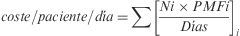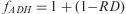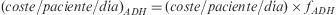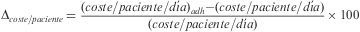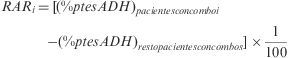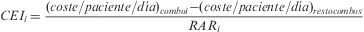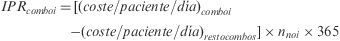Desarrollar una sistemática de manejo de datos que permita estimar comparativamente la eficiencia de los diferentes esquemas de tratamiento antirretroviral (TAR).
MétodoEstudio observacional retrospectivo en pacientes infectados por el VIH con TAR estable. Se determinó para cada paciente su adherencia y el coste unitario de su tratamiento. Se calculó el coste/paciente/día y, multiplicando por un factor de adherencia (fADH), el (coste/paciente/día)ADH. La comparación de ambos permitió obtener el Δcoste/paciente, que estima la desviación de costes originada por la falta de adherencia. Se calculó el coste-efectividad-incremental (CEI) agrupando los resultados en los diferentes fármacos coformulados («combos»). Se realizó un estudio de impacto presupuestario de dichos combos.
ResultadosSe evaluaron 468 pacientes (62% adherentes). La adherencia media fue de 88±18%. El valor medio del (coste/paciente/día)ADH fue significativamente superior al coste/paciente/día (27,3±9,8€ frente 24,3±7,6€, p<0,001). Al igual que para el fADH, no se encontraron diferencias en el Δcoste/paciente entre las diferentes combinaciones de TAR. El combo con menor desviación del coste/paciente/día debida a la falta de adherencia fue el constituido por abacavir/zidovudina/lamivudina (ABC/AZT/3TC,Δcoste/paciente=8,72±14,18%), y el de mayor desviación el AZT/3TC (Δcoste/paciente=13,52±17,68%). No se encontraron diferencias significativas en los CEI calculados para ningún combo. Los esquemas de TAR que incluyeron abacavir/lamivudina(ABC/3TC) obtuvieron el menor impacto presupuestario.
ConclusionesEl mayor coste y porcentaje de pacientes adherentes asociados a los combos compuestos por tenofovir/emtricitabina (TDF/FTC) y ABC/3TC, y el menor coste y efectividad de los compuestos por AZT/3TC y ABC/AZT/3TC, no permite identificar ninguna opción significativamente dominante. Los esquemas con ABC/3TC se muestran como los más favorables desde el punto de vista combinado del coste y la adherencia.
To develop a system of data management that allows us to estimate the comparative effectiveness of the various antiretroviral treatment (ART) regimens.
MethodRestrospective observational study in patients infected with HIV with stable ART. Adherence to treatment and unit cost for each patient's treatment was determined. The cost/patient/day was calculated and, multiplying by an adherence factor (fADH), the (cost/patient/day)ADH. The comparison of both allowed us to obtain the Δcost/patient, which estimates the additional costs caused by lack of adherence. The incremental cost-effectiveness (iCER), grouping the results by the various coformulated drugs (“combos”). A study of the budgetary impact of these combos was carried out.
Results468 patients were evaluated (62% adherent). Average adherence was 88±18%. The average value of (cost/patient/day) ADH was significantly higher than the cost/patient/day (27.3 ± 9.8€ compared to 24.3±7.6€. p < 0.001). Just as with the fADH, no differences were found in the Δcost/patient between the different ART combinations. The combo with the least deviation from the cost/patient/day due to lack of adherence was that composed of abacavir/zedovudine/lamivudine (ABC/AZT/3TC,Δcost/patient=8.72±14.18%), and that with the greatest deviation AZT/3TC (Δcost/patient=13.52±17.68%). No significant differences were found in the iCER calcluated for any combo. The ART that included abacavir/lamivudine (ABC/3TC) obtained the least budgetary impact.
ConclusionsThe greatest cost and percentage of adherent patients associated with the combos composed of Tenovovir/Emtricitabine(TDF/FTC) and ABC/3TC, and the least cost and effectiveness of those composed of AZT/#TC and ABC/AZT/3TC, does not allow us to identify any option as significantly dominant. The regimens with ABC/3TC were shown to be the most favourable from the combined point of view of cost and adherence.
Desde su aparición hace más de 20 años, la infección por el virus de la inmunodeficiencia humana (VIH) se ha convertido en una pandemia, superando en 2007 los 30 millones de personas infectadas por el VIH en el mundo. Con la aparición de los primeros antivirales y, sobre todo, con la introducción a mediados de los noventa, de los inhibidores de la proteasa (IP) se logró modificar drásticamente la evolución de la enfermedad reduciendo la morbi-mortalidad1,2. Los posteriores avances en el tratamiento antirretroviral (TAR) han contribuido a mantener y mejorar la supervivencia y el control clínico de la infección y, sobre todo, han conseguido incrementar la calidad de vida de los pacientes3. La aparición escalonada de los fármacos antirretrovirales (ARV) determinó que, en un momento dado y para un paciente concreto, las posibilidades de combinaciones de TAR fueran limitadas (debido fundamentalmente a la selección de resistencias y a la mala tolerancia) y, por tanto, la individualización estuvo plenamente justificada. Actualmente, en los países con acceso al TAR, la infección por el VIH es controlable clínicamente, con características de cronicidad, aunque sigue siendo importante desde el punto de vista de la salud pública por su epidemiología y mantiene un importante impacto social, económico y mediático4–6.
El Plan Nacional sobre el Sida (PNS) y el Grupo de Estudio del Sida (GESIDA), en su última actualización de las recomendaciones del TAR del adulto7, da preferencia a la combinación de tres fármacos que incluya dos inhibidores de la transcriptasa inversa análogos de nucleótido o nucleósido (ITIAN) y efavirenz (EFV: inhibidor de la transcriptasa inversa no análogo de nucleósido [ITINAN]), o bien dos ITIAN y un IP potenciado con ritonavir (IPr) como esquemas de inicio. En las combinaciones de dos ITIAN son recomendables las especialidades coformuladas, denominadas habitualmente «combos». Con independencia de los diferentes escenarios posibles de tratamiento, gracias a la reciente aparición de nuevos fármacos activos frente a cepas resistentes, se dispone en la actualidad, por primera vez desde la introducción de los fármacos ARV, de numerosas combinaciones capaces de conformar esquemas de TAR activos. Este cambio cuanti-cualitativo ha condicionado que en las recomendaciones generales se reconozca la «probabilidad de que haya diversas pautas de TAR similares en cuanto a potencia antirretroviral» y que, por tanto, la elección dependa, entre otros factores, del coste de los medicamentos7.
El control y tratamiento de la infección por VIH/SIDA supone un elevado coste económico, tanto en términos de costes directos (TAR, costes sanitarios) como de costes indirectos5,8–10. Se estima un coste anual superior a 10.000€ en pacientes VIH asintomáticos y a 15.000€ en pacientes sintomáticos9. El patrón de gasto sanitario ha ido cambiando durante estos quince años y actualmente el coste del tratamiento farmacológico es superior al derivado de los cuidados sanitarios del paciente10,11.
La adherencia al TAR, fundamentalmente por su papel en la respuesta virológica y en la selección de cepas resistentes, es uno de los principales condicionantes de éxito o fracaso terapéutico, y una falta de adherencia se correlaciona con un aumento de los ingresos hospitalarios, la evolución a SIDA y la mortalidad del paciente, conformándose como una causa de ineficiencia en la utilización de recursos sanitarios11–14. Dado el importante impacto económico del tratamiento y manejo de la infección por el VIH, es paradójico que pese a la existencia de numerosos grupos de investigación del SIDA, las numerosas publicaciones específicas y su abrumador impacto bibliográfico (se recuperaron 203.432 referencias bibliográficas tras definir unos criterios de búsqueda libre en PubMed: «hiv or antirretroviral therapy». Acceso el 5 de septiembre de 2009. www.ncbi.nlm.nih.gov/pubmed) exista una anormal escasez de estudios farmacoeconómicos (se recuperaron 93 referencias bibliográficas. Criterios de búsqueda libre: «pharmacoeconomics and antiretroviral therapy». Acceso el 5 de septiembre de 2009. www.ncbi.nlm.nih.gov/pubmed).
El objetivo de este trabajo es desarrollar y establecer una sistemática de manejo de datos e indicadores que permita estimar comparativamente la eficiencia de los diferentes esquemas de TAR. Para ello, dejando al margen los datos clínicos, se han combinado los datos económicos y de consumos con la adherencia.
MétodosEstudio observacional retrospectivo en el que se incluyeron pacientes adultos infectados por el VIH con tratamiento antirretroviral (TAR) estable durante, al menos, los seis últimos meses, que acudieron exclusivamente al Servicio de Farmacia de nuestro hospital durante el año 2008. Para cada paciente se estimó la adherencia mediante la versión española del cuestionario Simplified Medication Adherence Questionnaire (SMAQ)15 que clasifica los pacientes en adherentes y no adherentes, y los registros de dispensación (RD), que permiten estimar la adherencia como variable continua. Se consideró un paciente adherente cuando simultáneamente el SMAQ mostró adherencia y el RD≥90%.
Se calculó, igualmente para cada paciente, el coste diario de su esquema de TAR (€), a precio medio de factura (PMF) y fecha de diciembre de 2008, mediante la siguiente expresión:
donde Ni es el número de unidades dispensadas de un fármaco i, PMFi es el precio medio de factura unitario y Días son los días de tratamiento considerados según la cantidad dispensada y la pauta de administración. No se incluyeron cálculos por periodos de tiempo inferior a 180 días.Paralelamente, se estimó para cada paciente un factor de adherencia (fADH) mediante la siguiente expresión:
donde RD es el valor del registro de dispensación promedio de los fármacos que componen el esquema del paciente expresado en tanto por uno.A partir de ambas expresiones, se determinó para cada paciente su coste diario normalizado por la adherencia ([coste/paciente/día]ADH):
La variable Δcoste/paciente estima la desviación, originada por la falta de adherencia, respecto al coste basal de un esquema de tratamiento. Se ha calculado para cada paciente como la diferencia entre las variables coste/paciente/día y el (coste/paciente/día)ADH, expresada porcentualmente respecto al valor de la primera según la siguiente expresión:
Un mayor valor de Δcoste/paciente indica menor eficiencia del esquema de TAR respecto a su utilización en función de la adherencia calculada como RD.
Se analizaron de manera independiente los esquemas de TAR que incluyen principios activos coformulados en combinaciones fijas o «combos» considerados de primera línea de acuerdo con las recomendaciones vigentes hasta 2008 sobre TAR elaboradas por el Grupo Español de SIDA (GESIDA) y el Plan Nacional del SIDA (PNS)16: zidovudina 300mg+lamivudina 150mg (AZT/3TC), tenofovir 245mg+emtricitabina 200mg (TDF/FTC), abacavir 600mg+lamivudina 300mg (ABC/3TC). También se incluyó en el análisis de los combos, el formado por Abacavir 300mg+zidovudina 300mg+lamivudina 150mg (ABC/AZT/3TC). Para cada uno de los combos, se determinó el porcentaje de pacientes adherentes y su coste/paciente/día medio. Su comparación con los valores medios de los pacientes que no recibieron dicho combo permitió el cálculo de la reducción absoluta del riesgo (RAR), entendida como el «riesgo» de ser adherente con un combo determinado, y la determinación del coste efectividad incremental (CEI), que expresa el sobre-coste necesario para obtener un paciente adherente adicional con un combo determinado. El análisis de los costes permitió desarrollar un análisis de impacto presupuestario (IPR) que estimó el coste adicional derivado de mantener a la totalidad de los pacientes con un mismo combo durante un año. Solo se determinó el IPR de los combos dominantes en términos de efectividad considerada como porcentaje de pacientes adherentes, es decir, los que obtuvieron un RAR medio superior a cero.
donde IPRcomboi es el impacto presupuestario calculado para un combo i y nnoi es el número de pacientes que no toman el combo i.Las variables continuas se han expresado como su valor medio y desviación estándar (DE) y las categóricas como porcentaje (%), calculando los intervalos de confianza del 95% (IC95%) cuando fuera necesario. La distribución de frecuencias de las variables continuas se presenta como la mediana (percentil 50) y los percentiles 25 (p25) y 75 (p75). Las variables continuas se sometieron a la prueba de Kolmogorov-Smirnov para estimar su distribución. En caso de que la distribución no se ajustara a la normalidad, se utilizaron pruebas no paramétricas de contraste de hipótesis (Kruskall-Wallis). En caso de que los datos se ajustaran a una distribución normal, se emplearon pruebas paramétricas (t-student) para comparar la medias. Las posibles diferencias en las variables categóricas se compararon mediante la prueba ji-cuadrado (χ2). El estudio de las variables continuas en función de diferentes categorías se efectuó mediante un análisis de la varianza (ANOVA) de una vía.
ResultadosSe evaluaron un total de 468 pacientes, de 42±7 años de edad y mayoritariamente varones (72%). El 62% de los pacientes se estimaron como adherentes, combinando SMAQ y RD. Atendiendo exclusivamente al SMAQ, el 72% de los pacientes se consideró adherente, y atendiendo a un RD≥90% el 66% de los pacientes lo cumplieron. La adherencia medida como variable continua con los RD obtuvo un valor medio de 88±18%.
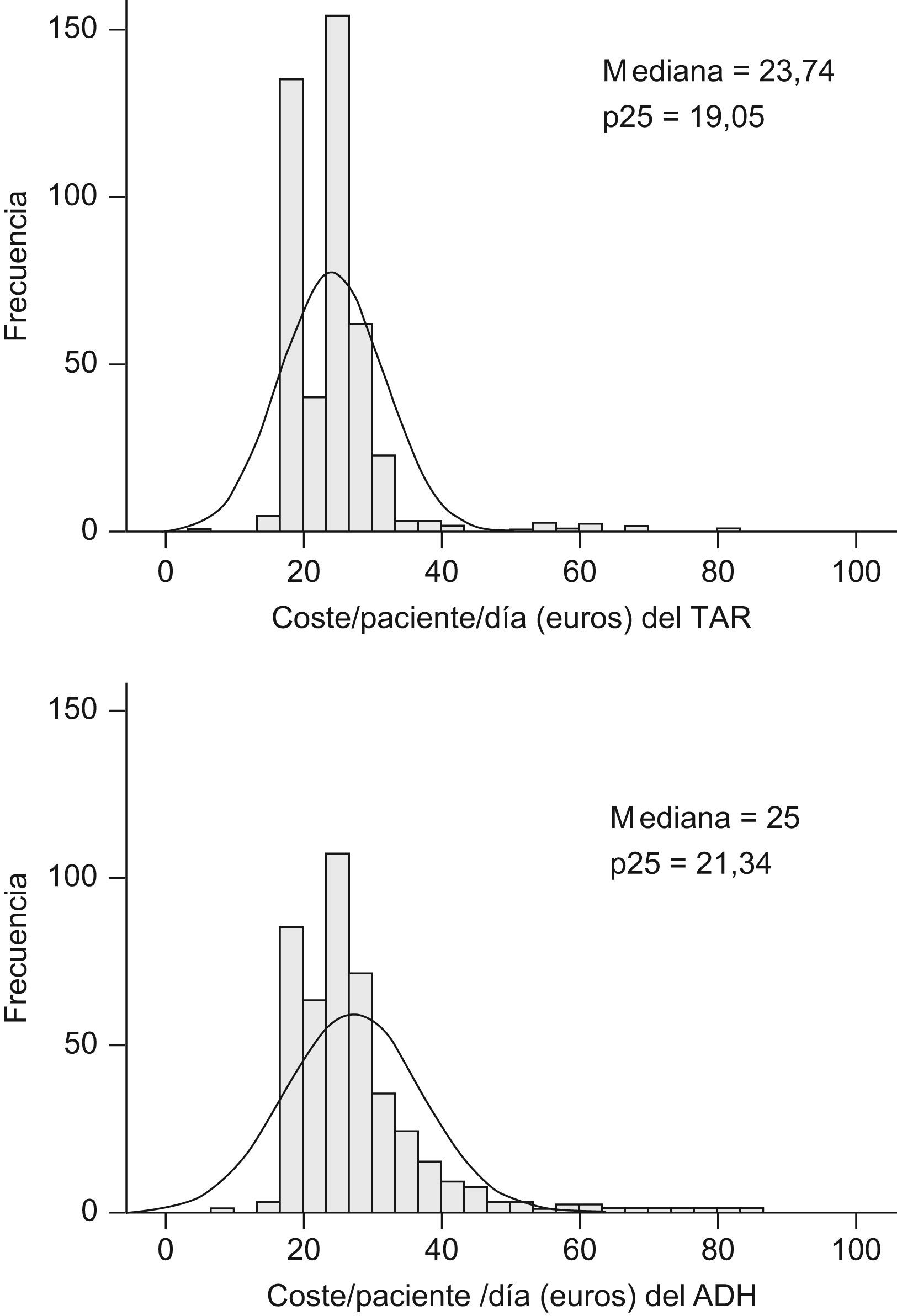
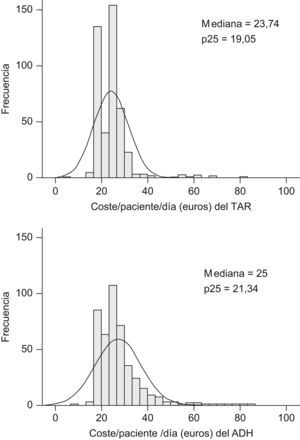
El valor medio del indicador (coste/paciente/día)ADH fue significativamente superior al coste/paciente/día (27,3±9,8€ frente 24,3±7,6€ respectivamente, p<0,001). La figura 1 muestra los histogramas de distribución de ambas variables incluyendo los valores de sus respectivas medianas, p25 y p75. El rango de ambos indicadores osciló entre 16,2 (zidovudina-didanosina-efavirenz;ATZ/ddI/EFV) y 80,3 (darunavir-ritonavir-raltegravir-maraviroc;DRVr/RGV/MRV) €/paciente/día y entre 16,2 (ATZ/ddI/EFV) y 80,3 (darunavir-ritonavir-raltegravir-tenofovir-emtricitabina;DRVr/RGV/TDF/FTC) (€/paciente/día)ADH.
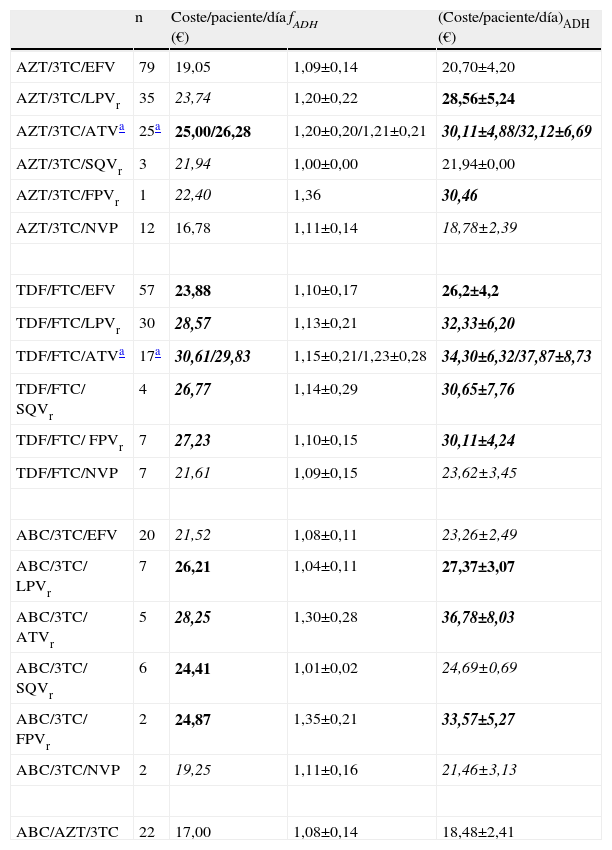
De los 468 pacientes, 341 (73%) basaron su esquema de TAR en un combo. La combinación mayoritaria fue AZT/3TC (155 pacientes, sin incluir la combinación AZT/3TC/TDF), seguida de TDF/FTC (122 pacientes), ABC/3TC (42 pacientes) y ABC/AZT/3TC (22 pacientes). La tabla 1 muestra los valores de las principales variables para cada una de los esquemas de TAR que incluyeron algún combo. La tabla 2 muestra los valores comparativos entre los diferentes combos. Ni para la edad ni para la adherencia, medida como RD, se encontraron diferencias significativas entre los diferentes combos agrupados. El coste/paciente/día fue significativamente diferente para todas las comparaciones posibles de combos (p<0,001). El (coste/paciente/día)ADH también se mostró diferente exceptuando la comparación entre AZT/3TC y ABC/3TC (p=0,250).
Coste por paciente y día, sin ajustar y ajustado por la adherencia, de cada uno de los esquemas de TAR que incluyen especialidades coformuladas (combos)¿.
| n | Coste/paciente/día (€) | fADH | (Coste/paciente/día)ADH (€) | |
| AZT/3TC/EFV | 79 | 19,05 | 1,09±0,14 | 20,70±4,20 |
| AZT/3TC/LPVr | 35 | 23,74 | 1,20±0,22 | 28,56±5,24 |
| AZT/3TC/ATVa | 25a | 25,00/26,28 | 1,20±0,20/1,21±0,21 | 30,11±4,88/32,12±6,69 |
| AZT/3TC/SQVr | 3 | 21,94 | 1,00±0,00 | 21,94±0,00 |
| AZT/3TC/FPVr | 1 | 22,40 | 1,36 | 30,46 |
| AZT/3TC/NVP | 12 | 16,78 | 1,11±0,14 | 18,78±2,39 |
| TDF/FTC/EFV | 57 | 23,88 | 1,10±0,17 | 26,2±4,2 |
| TDF/FTC/LPVr | 30 | 28,57 | 1,13±0,21 | 32,33±6,20 |
| TDF/FTC/ATVa | 17a | 30,61/29,83 | 1,15±0,21/1,23±0,28 | 34,30±6,32/37,87±8,73 |
| TDF/FTC/ SQVr | 4 | 26,77 | 1,14±0,29 | 30,65±7,76 |
| TDF/FTC/ FPVr | 7 | 27,23 | 1,10±0,15 | 30,11±4,24 |
| TDF/FTC/NVP | 7 | 21,61 | 1,09±0,15 | 23,62±3,45 |
| ABC/3TC/EFV | 20 | 21,52 | 1,08±0,11 | 23,26±2,49 |
| ABC/3TC/ LPVr | 7 | 26,21 | 1,04±0,11 | 27,37±3,07 |
| ABC/3TC/ ATVr | 5 | 28,25 | 1,30±0,28 | 36,78±8,03 |
| ABC/3TC/ SQVr | 6 | 24,41 | 1,01±0,02 | 24,69±0,69 |
| ABC/3TC/ FPVr | 2 | 24,87 | 1,35±0,21 | 33,57±5,27 |
| ABC/3TC/NVP | 2 | 19,25 | 1,11±0,16 | 21,46±3,13 |
| ABC/AZT/3TC | 22 | 17,00 | 1,08±0,14 | 18,48±2,41 |
AZT-Zidovudina, 3TC-Lamivudina, EFV-Efavirenz, LPV-Lopinavir, ATV-Atazanavir, SQV-Saquinavir, FPV-Fosamprenavir, NVP-Nevirapina, TDF-Tenofovir, FTC-Emtricitabina, ABC-Abacavir, fADH-Factor de adherencia, ADH-Adherencia.
El tipo de letra indica la posición del valor entre los percentiles mostrados en la figura 1; caracter normal: valor por debajo del p25, carácter en cursiva: valor entre el p25 y la mediana (p50), carácter en negrita: valor entre la mediana y el p75, carácter en negrita-cursiva: valor superior al p75.
Cinco de las seis combinaciones con AZT/3TC presentaron un coste/paciente/día inferior al valor de la mediana calculada para todos los esquemas de TAR posibles, y una, Zidovudina(Lamivudina/atazanavir-ritonavir (AZT/3TC/ATVr), superó el p75 (tabla 1). En referencia al (coste/paciente/día)ADH la distribución anterior se modificó sustancialmente: se mantuvo por debajo de la mediana en tres de las seis combinaciones aunque otras tres combinaciones superaron dicho valor, dos de ellas (AZT/3TC/ATV y zidovudina/lamivudina/fosamprenavir-ritonavir;AZT/3TC/FPVr), superaron incluso el p75. Cuatro de las seis combinaciones que incluyen TDF/FTC superaron al valor del p75 respecto al coste/paciente/día, una combinación (TDF/FTC/EFV) se mantuvo entre la mediana y el p75, y otra de ellas fue inferior a la mediana (tenofovir/emtricitabina/nevirapina;TDF/FTC/NVP). Respecto al (coste/paciente/día)ADH, se mantuvo la distribución anterior. De las seis combinaciones con ABC/3TC, dos no alcanzaron el valor de la mediana y dos superaron el p75 de la variable coste/paciente/día, y respecto al indicador (coste/paciente/día)ADH se mantuvo la distribución anterior salvo la combinación abacavir/lamivudina/saquinavir-ritonavir (ABC/3TC/SQVr), cuyo valor pasa a ser inferior a la mediana y la ABC/3TC/FPVr, cuyo valor, inicialmente comprendido entre la mediana y el p75, supera el p75 del (coste/paciente/día)ADH. Por último, la combinación ABC/AZT/3TC se mantuvo todos los casos por debajo del p25.
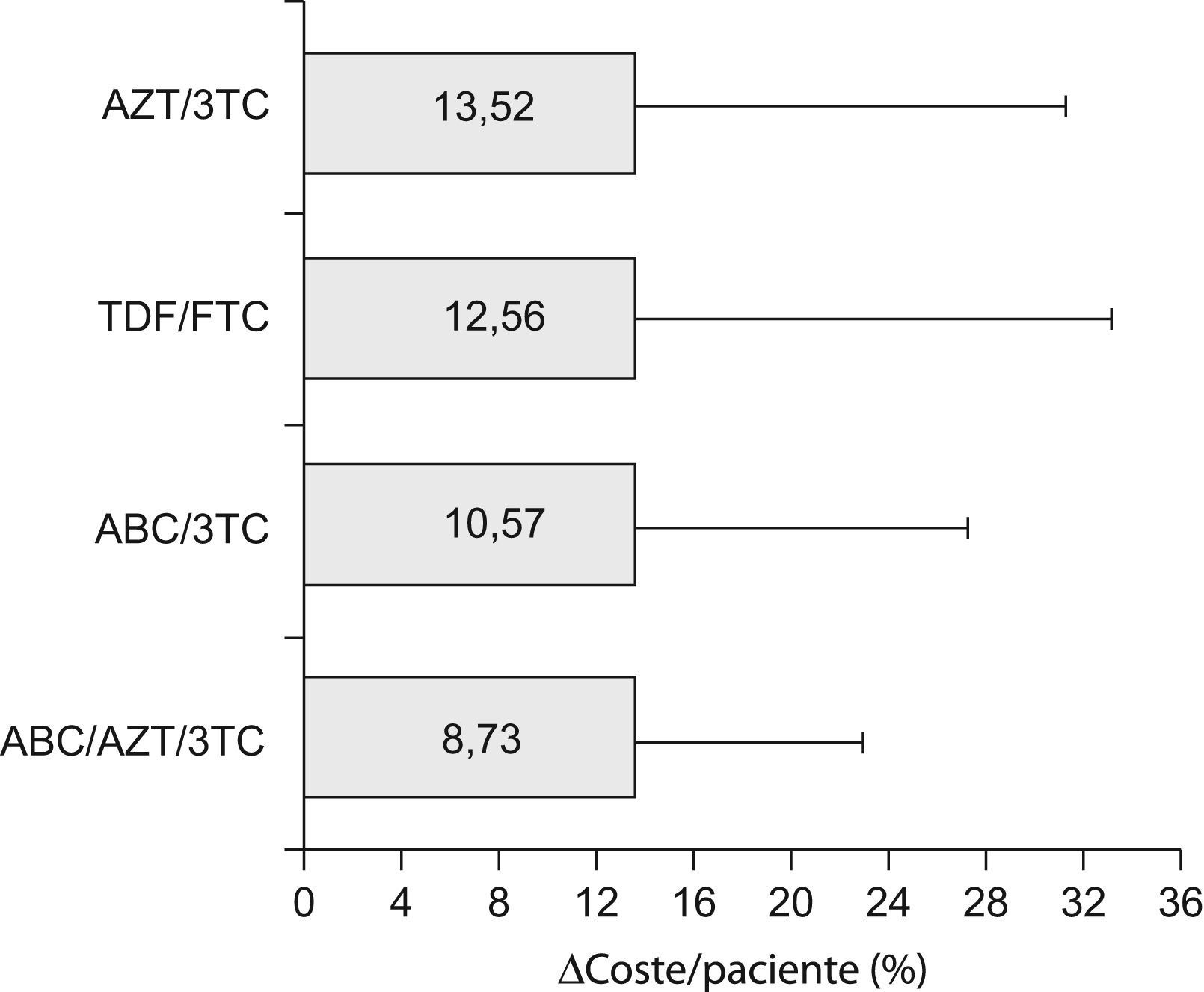
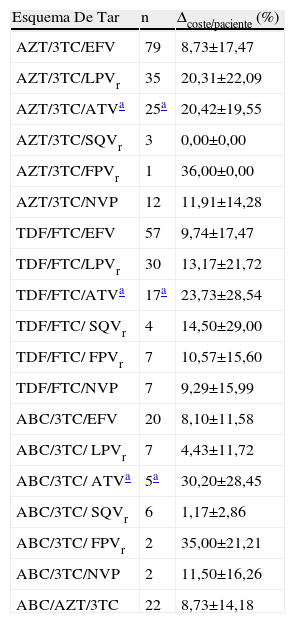
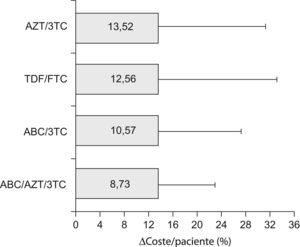
Al igual que para el fADH, no se encontraron diferencias significativas en la variable Δcoste/paciente entre las diferentes combinaciones de TAR, atendiendo tanto a cualquier esquema como a los basados en combos (tabla 3). Tampoco se encontraron diferencias al comparar conjuntamente todos los esquemas que incluyeron un mismo combo (fig. 2). El combo con menor desviación de su valor basal de coste/paciente/día debida a la falta de adherencia fue el constituido por ABC/AZT/3TC, con un Δcoste/paciente de 8,72±14,18%, y el de mayor desviación fue el formado por combinaciones de AZT/3TC (Δcoste/paciente=13,52±17,68%).
Δcoste/paciente para cada uno de los esquemas de TAR que incluyen algún combo
| Esquema De Tar | n | Δcoste/paciente (%) |
| AZT/3TC/EFV | 79 | 8,73±17,47 |
| AZT/3TC/LPVr | 35 | 20,31±22,09 |
| AZT/3TC/ATVa | 25a | 20,42±19,55 |
| AZT/3TC/SQVr | 3 | 0,00±0,00 |
| AZT/3TC/FPVr | 1 | 36,00±0,00 |
| AZT/3TC/NVP | 12 | 11,91±14,28 |
| TDF/FTC/EFV | 57 | 9,74±17,47 |
| TDF/FTC/LPVr | 30 | 13,17±21,72 |
| TDF/FTC/ATVa | 17a | 23,73±28,54 |
| TDF/FTC/ SQVr | 4 | 14,50±29,00 |
| TDF/FTC/ FPVr | 7 | 10,57±15,60 |
| TDF/FTC/NVP | 7 | 9,29±15,99 |
| ABC/3TC/EFV | 20 | 8,10±11,58 |
| ABC/3TC/ LPVr | 7 | 4,43±11,72 |
| ABC/3TC/ ATVa | 5a | 30,20±28,45 |
| ABC/3TC/ SQVr | 6 | 1,17±2,86 |
| ABC/3TC/ FPVr | 2 | 35,00±21,21 |
| ABC/3TC/NVP | 2 | 11,50±16,26 |
| ABC/AZT/3TC | 22 | 8,73±14,18 |
ABC: abacavir; AZT: zidovudina; ATV: atazanavir; EFV: efavirenz; FTC: emtricitabina; FPV: fosamprenavir; LPV: lopinavir; NVP: nevirapina; SQV: saquinavir; TDF: tenofovir; 3TC: lamivudina.
Δcoste/paciente medio agrupado (%) de los esquemas de TAR constituidos por cada uno de los fármacos coformulados (combos). Las barras representan el valor medio en magnitud y las líneas la desviación estándar en cada caso. No se apreciaron diferencias significativas entre ellos. AZT-zidovudina; 3TC-lamivudina; TDF-tenofovir; FTC-emtricitabina; ABC-abacavir.
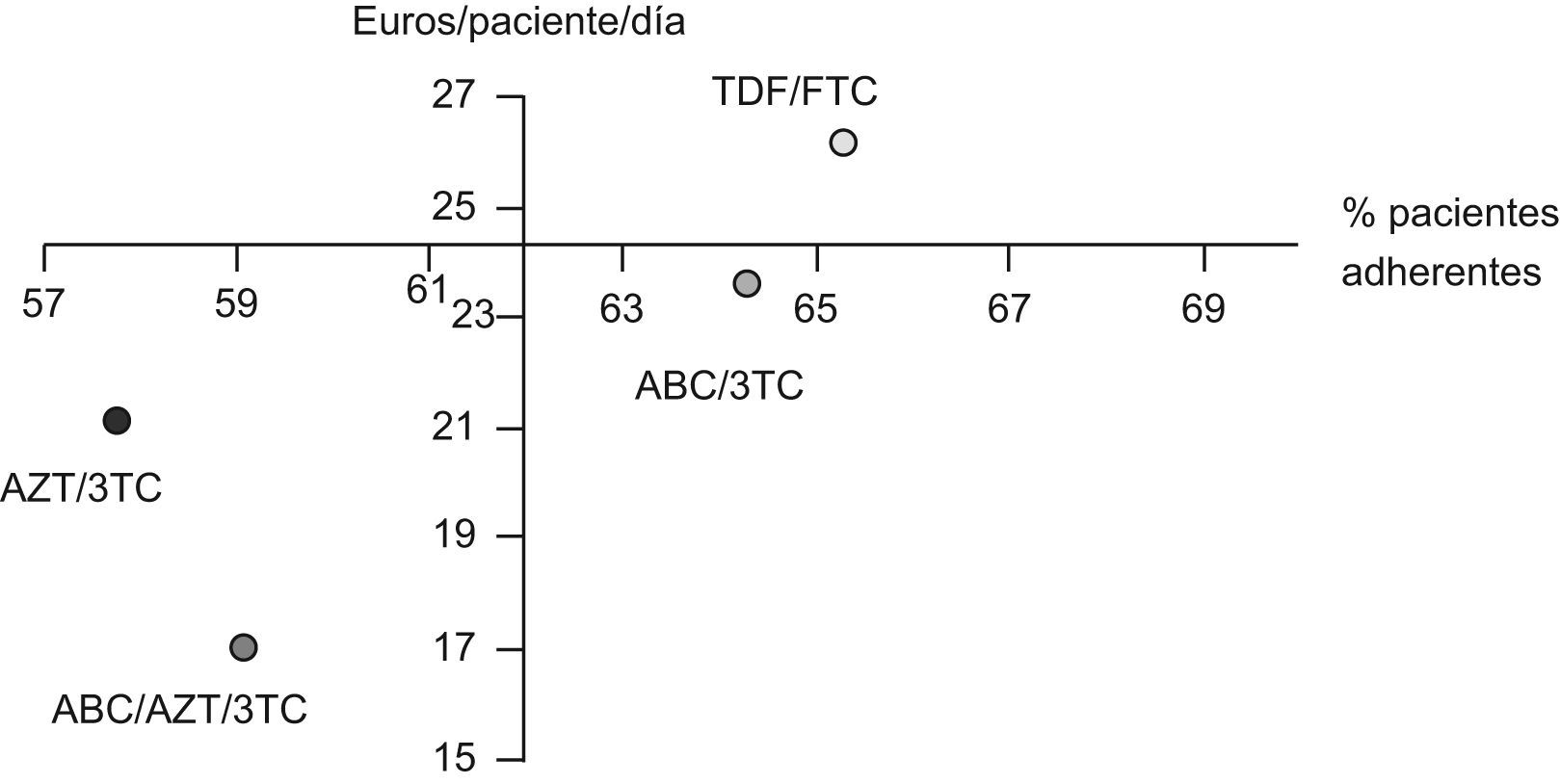
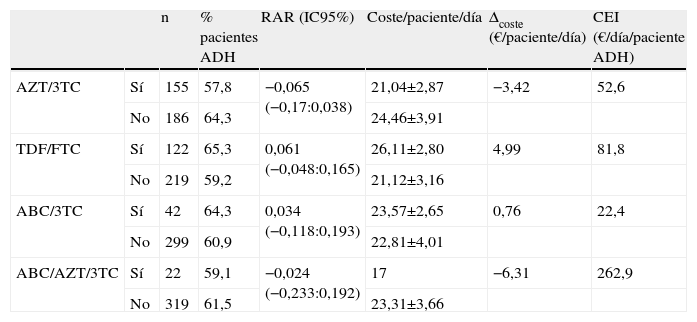
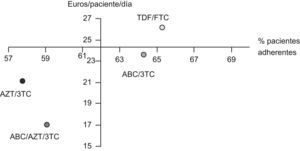
La tabla 4 muestra la estimación del CEI para cada uno de los combos estudiados incluyendo la RAR y su IC95%. En todos los casos, los IC95% de los RAR incluyen el valor cero y, por tanto, ninguna de las opciones se asocia significativamente con un incremento del número de pacientes adherentes respecto a las otras. En valor absoluto, los esquemas más favorables, por su mayor % de pacientes adherentes, son los compuestos por TDF/FTC y ABC/3TC, cuyo valor medio de RAR es mayor que cero. La figura 3 muestra la posición relativa de cada combo respecto a los valores medios, de forma que en el cuadrante inferior derecho se enmarca la combinación más favorable en valor absoluto (ABC/3TC) en términos de coste y porcentaje de pacientes adherentes y respecto a los valores medios de la cohorte de pacientes. El impacto derivado de tratar a los 341 pacientes que consumen algún combo con combinaciones de TDF/FTC o ABC/3TC supone un desembolso adicional de 398.875 y 82.943 €/año respectivamente.
Coste efectividad incremental (CEI: €/paciente/día para obtener un paciente adherente adicional) estimado para cada uno de los combos respecto al comparador determinado por los valores medios del coste/paciente/día y el % de pacientes adherentes obtenidos en los pacientes que no consumen el combo estudiado
| n | % pacientes ADH | RAR (IC95%) | Coste/paciente/día | Δcoste (€/paciente/día) | CEI (€/día/paciente ADH) | ||
| AZT/3TC | Sí | 155 | 57,8 | −0,065 (−0,17:0,038) | 21,04±2,87 | −3,42 | 52,6 |
| No | 186 | 64,3 | 24,46±3,91 | ||||
| TDF/FTC | Sí | 122 | 65,3 | 0,061 (−0,048:0,165) | 26,11±2,80 | 4,99 | 81,8 |
| No | 219 | 59,2 | 21,12±3,16 | ||||
| ABC/3TC | Sí | 42 | 64,3 | 0,034 (−0,118:0,193) | 23,57±2,65 | 0,76 | 22,4 |
| No | 299 | 60,9 | 22,81±4,01 | ||||
| ABC/AZT/3TC | Sí | 22 | 59,1 | −0,024 (−0,233:0,192) | 17 | −6,31 | 262,9 |
| No | 319 | 61,5 | 23,31±3,66 |
ABC: abacavir; ADH: adherencia; AZT: zidovudina; CEI: coste efectividad incremental; FTC: emtricitabina; RAR: reducción absoluta del riesgo; TDF: tenofovir 3TC:lamivudina.
Representación de los pares de valores medios de coste/paciente/día y adherencia de cada uno de los fármacos coformulados. El eje corresponde con los valores medios de referencia (62% de pacientes adherentes (SMAQ=ADH y RD>90%), coste/paciente/día=24,3€). AZT-Zidovudina; 3TC-Lamivudina; TDF-Tenofovir; FTC-Emtricitabina; ABC-Abacavir.
Tras veinte años de terapia antirretroviral, actualmente existe la posibilidad de conformar distintos esquemas de TAR equivalentes en cuanto a potencia7. Sin embargo, todavía no están suficientemente desarrolladas e implementadas estrategias de estudio sobre la utilización de los medicamentos ARV dentro del ámbito de la medicina basada en la eficiencia que, en resumen, trata de buscar la opción más eficiente para obtener los máximos beneficios posibles en la salud de la población y en los pacientes considerados individualmente. Necesariamente, muchos de los pacientes infectados por el VIH, debido a aspectos virológicos, de tolerancia, o de preferencias o conveniencia, van a tener limitadas las posibilidades de conformar un esquema de TAR activo. Sin embargo, existen otros escenarios en los cuales un paciente concreto (p.ej. algunos pacientes naïve, muchos de los pacientes con primer cambio de TAR…) pueda ser candidato a recibir diferentes esquemas de TAR a priori equivalentes en cuanto a potencia, tolerancia y conveniencia. Al igual que con otros fármacos y/o protocolos farmacoterapéuticos utilizados habitualmente en el hospital, se requiere la adecuada evaluación y selección, con el posterior posicionamiento terapéutico de cada fármaco o esquema para evitar su uso arbitrario y obtener el mayor beneficio para el paciente y la sociedad (utilización de la mejor alternativa posible).
El creciente incremento del coste global de ARV, motivado por la aparición de nuevos fármacos cada vez más activos pero también más caros, justifica reflexionar acerca de su utilización en un entorno de práctica asistencial. Limitar el estudio a un análisis de costes sin tener en cuenta aspectos relativos a la adecuada utilización de los medicamentos proporcionaría una visión parcial y no comparativa. La principal limitación de este trabajo deriva de su diseño; el marco más aconsejable para la evaluación y comparación de diferentes esquemas de TAR es probablemente una evaluación económica de coste-efectividad, incorporando las variables clínicas subrogadas como medida de la efectividad (linfocitos TCD4 y carga viral plasmática [CV]) aunque, debido precisamente a su carácter subrogado, dicho análisis también tendría limitaciones importantes en cuanto a la comparabilidad de los esquemas. Otra limitación, derivada del desarrollo en el ámbito asistencial de un hospital concreto con unos costes de adquisición concretos, es la dificultad de extrapolación de los resultados y las conclusiones obtenidas. Por otra parte, debido la población limitada, algunos de los subgrupos cuentan con un tamaño muestral insuficiente, que condiciona la gran variabilidad observada. Otro de los problemas metodológicos deriva de los sesgos de la propia medida de la adherencia como variable continua (RD) y su tendencia a la sobreestimación14,17,18. Además, utilizar los RD como variable relacionada con la «utilización» de los medicamentos también es una aproximación, dado que la dispensación no conlleva necesariamente el consumo del medicamento. Sin embargo, aunque la posible sobreestimación pueda condicionar los valores absolutos de los resultados, la comparación entre diferentes esquemas de TAR compensa el sesgo, dado que se ha aplicado a todos los pacientes y de la misma manera. Sin embargo, la adherencia, con todos sus sesgos, es una variable clínica subrogada de resultados finales, es decir, se asocia con la morbi-mortalidad de la infección por VIH12–14 y, por tanto, puede utilizarse en un análisis de coste-efectividad. Cabe considerar también la durabilidad del TAR dado que, con independencia de la efectividad estimada como linfocitos TCD4, CV o adherencia, es un dato objetivo para valorar la utilidad real de una combinación determinada y posibilita la comparación de diferentes TAR, con especial aplicación en la evaluación económica19,20. Nuestro estudio, con un diseño trasversal, no aporta información sobre los posibles cambios ni sus causas, asumiendo que todos los esquemas son equivalentes en cuanto a duración.
El estudio se divide en dos apartados fundamentales; por una parte la valoración, para cada uno de los pacientes, del coste/paciente/día y su modificación (absoluta y relativa) determinada por la adherencia como variable continua (RD). Por otra, la comparación del coste/paciente/día y el porcentaje de pacientes adherentes de cada uno de los esquemas basados en un combo concreto respecto a los esquemas que no contienen dicho combo. En el primer caso, se observa que la mayoría de los esquemas de TAR mantienen su distribución relativa tras aplicar el factor de adherencia (solo cuatro esquemas se ven penalizados por una mala adherencia, y un solo esquema mejora de categoría), prevaleciendo el coste del medicamento como principal factor para que un esquema concreto presente valores superiores o inferiores a la mediana o a un percentil determinado. En términos relativos, se observa que los esquemas que contienen el combo AZT/3TC presentan un mayor, aunque no significativo, Δcoste/paciente y, por tanto, se podría sugerir que la adherencia a estos es menor. Este hallazgo puede explicarse mediante la relación inversa existente entre la adherencia y el tiempo con TAR, dado que el AZT/3TC es la especialidad farmacéutica con mayor tiempo de comercialización entre las estudiadas14,21. Por el contrario, la combinación ABC/AZT/3TC, pese a ser más antigua que otros combos, muestra el Δcoste/paciente más favorable debido probablemente a que se utiliza en un número menor de pacientes con un buen control clínico y altamente fidelizados.
El CEI pretende determinar el coste que supone incrementar un paciente adherente cuando se emplea un esquema de TAR basado en un combo concreto respecto al resto de los esquemas. La principal limitación es la falta de validez externa, dado que la comparación no se lleva a cabo con un TAR estándar. El mayor porcentaje de pacientes adherentes se consigue con los esquemas basados en TDF/FTC y en ABC/3TC, aunque en ningún caso, la RAR se mostró significativamente superior a cero y, por tanto, no se puede concluir que un combo determinado permita obtener un mayor porcentaje de pacientes adherentes. Cabe destacar el mayor CEI del TDF/FTC respecto al ABC/3TC motivado fundamentalmente por el mayor incremento de coste que, a su vez, determina un impacto presupuestario muy superior (por encima de los 300.000€/año supone tratar a los 341 pacientes con TDF/FTC en lugar de con ABC/3TC). Estos hallazgos condicionan que, en valor absoluto, la opción más favorable sean los esquemas basados en ABC/3TC, con el menor CEI y enmarcados en un cuadrante dominante de coste-efectividad respecto a los valores medios (fig. 3), aunque no se identificaron diferencias significativas respecto al resto de combinaciones.
En conclusión, cabe destacar las diferencias encontradas en las dos vertientes del análisis. Atendiendo al impacto de la adherencia sobre el coste/paciente/día, se concluye que los esquemas basados en AZT/3TC son los menos favorecidos debido a la menor adherencia observada, aunque su coste favorable permite el cálculo de un CEI aceptable. Por el contrario, el esquema ABC/AZT/3TC, aunque su utilización terapéutica no es comparable con la del resto de combos, goza de buena adherencia en términos de RD y del coste más bajo, aunque su CEI no es favorable. En la comparación de los combos de elección en la actualidad, los esquemas basados en TDF/FTC son los que obtienen una relación coste-efectividad menos favorable debido principalmente a su mayor coste de adquisición respecto a ABC/3TC. Pese al interés implícito de los resultados expuestos, para dotarlos de validez es necesario consensuar esquemas de TAR que puedan considerarse como el comparador estándar, tanto en términos de costes como de adherencia y de efectividad clínica, de manera que, ante nuevas incorporaciones de ARV, se puedan desarrollar las estrategias de evaluación y selección que permitan su incorporación en el lugar más eficiente dentro de la farmacoterapia del VIH.