el objetivo principal fue comparar los efectos de 2 emulsiones de lípidos parenterales sobre la incidencia, la gravedad y la necesidad de tratamiento de la retinopatía del prematuro (ROP). El objetivo secundario fue comparar el efecto sobre el aumento de peso en las primeras 6 semanas de vida.
Métodosestudio retrospectivo, observacional, unicéntrico, que analizó recién nacidos prematuros con una edad gestacional menor de 31 semanas y un peso al nacer menor de 1.251 g, nacidos entre abril de 2015 y diciembre de 2018. Se revisaron las historias clínicas de los pacientes para recopilar los datos clínicos. Los datos de la nutrición parenteral se obtuvieron de la base de datos de farmacia del hospital.
Resultadosen total se incluyeron 180 pacientes: 90 recibieron ClinOleic® y 90 SMOFlipid®. No se observaron diferencias significativas en la incidencia de ROP (40% en el grupo ClinOleic® y 41% en el grupo SMOFlipid®, p=0,88) o de ROP que requería tratamiento (4 y 10% respectivamente, p=0,152). El aumento de peso semanal fue similar en los 2 grupos.
Conclusioneseste estudio no muestra diferencias entre los 2 grupos en cuanto a la ROP, la ROP que requiere tratamiento o aumento de peso semanal en las primeras 6 semanas de vida.
The main aim was to compare the effects of two parenteral lipid emulsions on retinopathy of prematurity (ROP) incidence, severity, and need for treatment. Secondary aim was to compare the effect on weight gain in the first 6 weeks of life.
MethodsSingle-center, observational, retrospective study analyzing preterm infants with a gestational age < 31 weeks and a birth weight < 1,251 g, born between April 2015 and December 2018. The infants’ medical records were reviewed to collect clinical data. Parenteral nutrition details were obtained from the hospital pharmacy database.
ResultsIn total, 180 patients were included: 90 received ClinOleic® and 90 received SMOFlipid®. No significant differences were observed for the incidence of ROP (40% in ClinOleic® group and 41% in SMOFlipid® group, p=0.88) or ROP requiring treatment (4% and 10% respectively, p=0.152). Weekly weight gain was similar in the two groups.
ConclusionsThis study showed no difference between the two groups regarding ROP, ROP requiring treatment or weekly weight gain in the first 6 weeks of life.
La retinopatía del prematuro (ROP) es una enfermedad multifactorial asociada al nacimiento prematuro. Su incidencia y gravedad son directamente proporcionales al grado de prematuridad1. La prevención de la ROP es de suma importancia para evitar el desprendimiento de la retina y la ceguera.
El ácido docosahexaenoico (DHA) es un ácido graso omega-3 esencial para el desarrollo del cerebro. Representa el 20% de todos los ácidos grasos en la retina. La síntesis endógena de DHA a partir del ácido α-linoleico es insuficiente para satisfacer las necesidades de neurodesarrollo de los recién nacidos prematuros, quienes además no tienen prácticamente reservas, ya que dicho ácido se acumula en el tejido adiposo durante el tercer trimestre del embarazo. La principal fuente de DHA para un recién nacido prematuro es la leche materna, pero es bien sabido que muchos de ellos deben ser alimentados en las primeras semanas de vida mediante nutrición parenteral.
Prevenir la progresión a una enfermedad más grave es la mejor forma de reducir la morbilidad asociada en pacientes con ROP. La suplementación nutricional con ácidos grasos omega-3 procedente del aceite de pescado puede modificar el curso de la enfermedad. No obstante, mientras que algunos estudios han demostrado que las emulsiones lipídicas intravenosas que contienen aceite de pescado tienen un efecto protector contra la incidencia y la gravedad de la ROP2, otros no han mostrado tales beneficios3–6.
El objetivo principal de este estudio es comparar los efectos de ClinOleic® y SMOFlipid® como parte de la nutrición parenteral (NP) a prematuros sobre la incidencia, gravedad y necesidad de tratamiento de la ROP. ClinOleic® es una emulsión lipídica que contiene un 20% de aceite de soja y un 80% de aceite de oliva, y SMOFlipid® contiene un 30% de aceite de soja, un 30% de triglicéridos de cadena media, un 25% de aceite de oliva y un 15% de aceite de pescado. La decisión de cambiar ClinOleic® por SMOFlipid® se basó en la composición de los productos. SMOFlipid® tiene una proporción óptima de omega-6/omega-3 y contiene la cantidad adecuada de alfa-tocoferol (200 mg/l), que actúa como antioxidante. Varios estudios han notificado tasas más rápidas de crecimiento y una menor incidencia de colestasis con soluciones que contienen SMOFlipid®7–9.
Los objetivos secundarios fueron comparar los efectos de las 2 emulsiones sobre el aumento de peso semanal en las primeras 6 semanas de vida y los desenlaces clínicos comunes.
MétodosDiseño del estudio y poblaciónDiseñamos un estudio observacional retrospectivo de prematuros nacidos en el Hospital Universitari Vall d'Hebron de Barcelona que ingresaron en la unidad de cuidados intensivos neonatales entre junio de 2015 y diciembre de 2018. Se estudiaron 2 periodos: de abril de 2015 a marzo de 2017, cuando las soluciones de NP contenían ClinOleic®, y de abril de 2017 a diciembre de 2018, cuando contenían SMOFlipid®. La dosificación de los lípidos se inició con 0,5 g por kg de peso corporal el día uno; se incrementó en 0,5 g/kg cada 24 h hasta un máximo de 3,5 g/kg/día. Los criterios de inclusión fueron una edad gestacional (EG) < 31 semanas en el momento del nacimiento, un peso al nacer menor de 1.251 g y el inicio de la NP según el protocolo de nutrición del hospital en las primeras 24 h de vida. Los pacientes incluidos se estratificaron en 3 subgrupos según la EG (menor de 27 semanas, 27-29 semanas y mayor de 29 semanas). Para ser incluidos, y como parte del protocolo de cribado de la ROP del hospital, los pacientes también debían haber recibido al menos un examen del fondo de ojo. La ROP se estadificó mediante los criterios de la Clasificación Internacional de la ROP10. La Clasificación Internacional de la ROP establece las bases para definir las características de la retinopatía. Cuando se diagnostica una retinopatía en un lactante prematuro, se debe indicar la gravedad (etapa), la extensión y la localización de la misma y definir las características de los vasos del polo posterior. Con todos estos datos, se establece si es necesario tratar o seguir realizando controles seriados del fondo de ojo y su frecuencia. La ROP suele afectar a ambos ojos, aunque a veces es asimétrica o incluso unilateral. La etapa se determinó teniendo en cuenta la etapa más grave en cualquiera de los 2 ojos. Se excluyó a pacientes con malformaciones congénitas.
Datos biodemográficos, obstétricos, de laboratorio y clínicosSe recopilaron los siguientes datos biodemográficos y obstétricos de las historias clínicas de los pacientes: la EG (en semanas), sexo, peso al nacer, edad de la madre, uso de corticosteroides prenatales, tipo de parto, estado de gestación múltiple, puntuaciones de Apgar a los 0, 5 y 10 min, puntuación en el índice CRIB (Clinical Risk Index for Babies), retraso del crecimiento intrauterino y muerte. Antes de iniciar la NP, se registraron los valores de hemoglobina, leucocitos y plaquetas. También se registró el peso semanalmente, hasta la sexta semana.
Otros datos clínicos recopilados fueron la duración de la NP, la necesidad de oxigenoterapia, la necesidad y número de transfusiones sanguíneas, hiperglucemia e hipoglucemia, sepsis confirmada y número de episodios, enterocolitis necrosante, colestasis, displasia broncopulmonar, hemorragia intraventricular de grado ≥ 2, enfermedad de las membranas hialinas y necesidad de terapia con un agente tensioactivo, conducto arterioso persistente y necesidad de tratamiento (farmacológico con ibuprofeno o quirúrgico) y la duración de la estancia hospitalaria.
Los criterios de valoración primarios fueron el desarrollo de ROP y la necesidad de tratamiento. En ambos grupos se analizaron como criterios de valoración secundarios el aumento de peso en las primeras 6 semanas de vida y variables clínicas.
Análisis estadísticoEl cálculo del tamaño de la muestra fue de 175 sujetos, con un nivel de confianza del 95%, una potencia de la prueba del 85%, valores de proporción esperados de ROP que requieran intervención entre el 5 y el 15% y una diferencia absoluta del 10% entre poblaciones. Con unas expectativas de casos no evaluables del 20%, se consideraron que se necesitaban identificar 210 casos. Finalmente, se incluyeron 180 casos.
Las variables continuas se expresaron como media y desviación estándar (DE) y las categóricas como frecuencias y porcentajes. Las medias y las proporciones se compararon mediante la prueba t y la prueba chi-cuadrado, respectivamente. Los análisis estadísticos se realizaron en el programa informático SPSS (versión 15.0, SPSS Inc. Chicago, Illinois, EE.UU.), y la significación se fijó en p≤0,05.
ResultadosDe los 214 lactantes identificados, se excluyeron 34: de ellos, 31 porque no se les había realizado un examen del fondo de ojo, 2 por malformaciones congénitas y uno por ausencia de historia clínica. Así pues, tras aplicar los criterios de inclusión y exclusión, el estudio contó con 180 lactantes: 90 en el grupo ClinOleic® y 90 en el grupo SMOFlipid®.
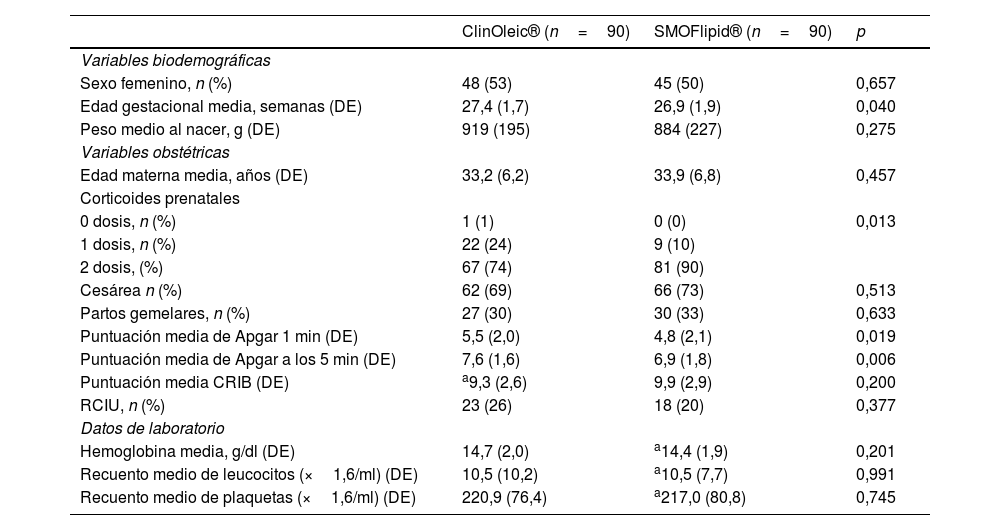
La EG media fue inferior en los lactantes que habían recibido SMOFlipid® en comparación con ClinOleic® (26,9 frente a 27,4 semanas, p=0,04). Las diferencias en la maduración pulmonar con corticosteroides prenatales también resultaron significativas, ya que el 74% de los pacientes del grupo de ClinOleic® alcanzaron maduración completa, frente al 90% del grupo de SMOFlipid® (p=0,013). Las puntuaciones de Apgar a 1 y 5 min fueron significativamente superiores para ClinOleic® (p=0,019 y p=0,006, respectivamente). Las diferencias observadas para el resto de variables biodemográficas y obstétricas no fueron significativas (tabla 1).
Variables biodemográficas, obstétricas y de laboratorio al inicio del estudio
| ClinOleic® (n=90) | SMOFlipid® (n=90) | p | |
|---|---|---|---|
| Variables biodemográficas | |||
| Sexo femenino, n (%) | 48 (53) | 45 (50) | 0,657 |
| Edad gestacional media, semanas (DE) | 27,4 (1,7) | 26,9 (1,9) | 0,040 |
| Peso medio al nacer, g (DE) | 919 (195) | 884 (227) | 0,275 |
| Variables obstétricas | |||
| Edad materna media, años (DE) | 33,2 (6,2) | 33,9 (6,8) | 0,457 |
| Corticoides prenatales | |||
| 0 dosis, n (%) | 1 (1) | 0 (0) | 0,013 |
| 1 dosis, n (%) | 22 (24) | 9 (10) | |
| 2 dosis, (%) | 67 (74) | 81 (90) | |
| Cesárea n (%) | 62 (69) | 66 (73) | 0,513 |
| Partos gemelares, n (%) | 27 (30) | 30 (33) | 0,633 |
| Puntuación media de Apgar 1 min (DE) | 5,5 (2,0) | 4,8 (2,1) | 0,019 |
| Puntuación media de Apgar a los 5 min (DE) | 7,6 (1,6) | 6,9 (1,8) | 0,006 |
| Puntuación media CRIB (DE) | a9,3 (2,6) | 9,9 (2,9) | 0,200 |
| RCIU, n (%) | 23 (26) | 18 (20) | 0,377 |
| Datos de laboratorio | |||
| Hemoglobina media, g/dl (DE) | 14,7 (2,0) | a14,4 (1,9) | 0,201 |
| Recuento medio de leucocitos (×1,6/ml) (DE) | 10,5 (10,2) | a10,5 (7,7) | 0,991 |
| Recuento medio de plaquetas (×1,6/ml) (DE) | 220,9 (76,4) | a217,0 (80,8) | 0,745 |
CRIB: Clinical Risk Index for Babies; RCIU: retraso del crecimiento intrauterino.
La duración media de la NP fue de 8,9 días en el grupo ClinOleic® y de 9,2 en el grupo SMOFlipid®. En el primero, se administró NP durante más de 7 días en 55 lactantes y durante más de 14 días en 4. Además, 4 lactantes de dicho grupo también precisaron NP en algún otro momento del ingreso. En el grupo SMOFlipid®, 46 y 7 lactantes recibieron NP durante más de 7 y 14 días, respectivamente. Doce lactantes de este grupo precisaron NP en otro momento de la hospitalización.
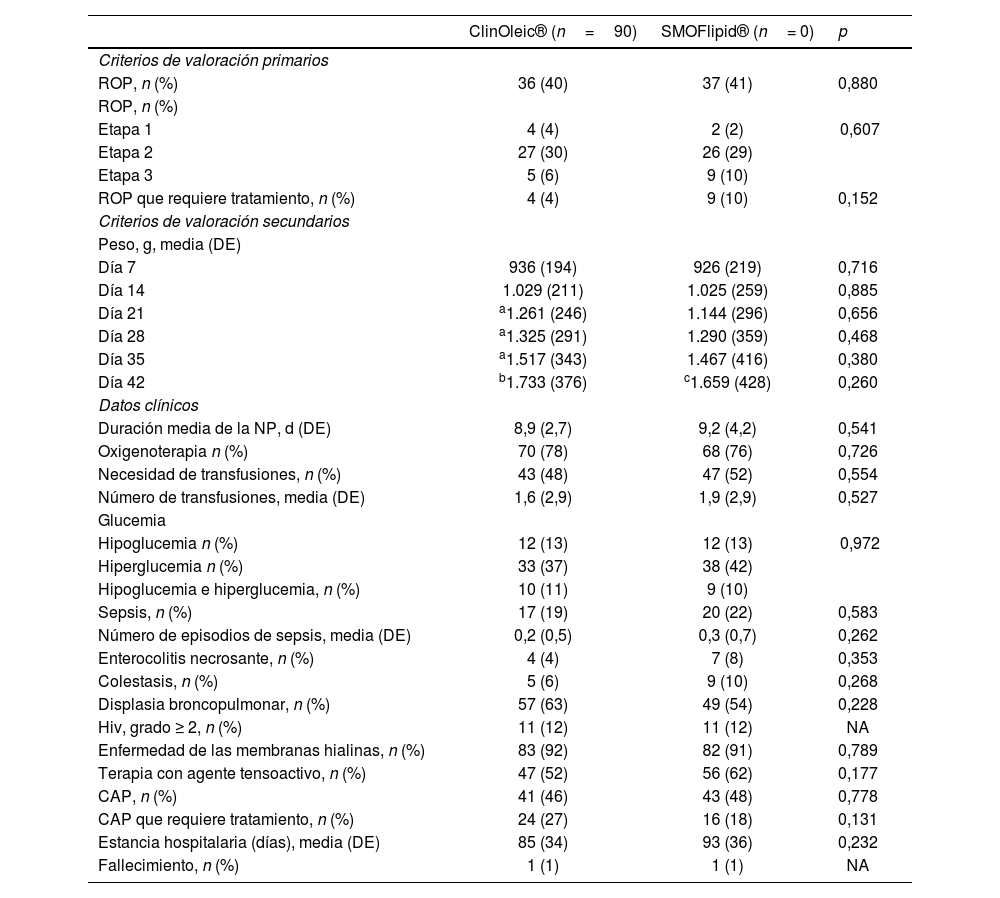
Criterios de valoración primariosNo se observaron diferencias en la incidencia de ROP (40% para ClinOleic® frente a 41% para SMOFlipid®, p=0,880), la gravedad o la necesidad de tratamiento (tabla 2). Las diferencias siguieron siendo no significativas en los análisis de subgrupos para la EG (menor de 27 semanas, 27-29 semanas y mayor de 29 semanas).
Resultados clínicos por grupo de estudio
| ClinOleic® (n=90) | SMOFlipid® (n= 0) | p | |
|---|---|---|---|
| Criterios de valoración primarios | |||
| ROP, n (%) | 36 (40) | 37 (41) | 0,880 |
| ROP, n (%) | |||
| Etapa 1 | 4 (4) | 2 (2) | 0,607 |
| Etapa 2 | 27 (30) | 26 (29) | |
| Etapa 3 | 5 (6) | 9 (10) | |
| ROP que requiere tratamiento, n (%) | 4 (4) | 9 (10) | 0,152 |
| Criterios de valoración secundarios | |||
| Peso, g, media (DE) | |||
| Día 7 | 936 (194) | 926 (219) | 0,716 |
| Día 14 | 1.029 (211) | 1.025 (259) | 0,885 |
| Día 21 | a1.261 (246) | 1.144 (296) | 0,656 |
| Día 28 | a1.325 (291) | 1.290 (359) | 0,468 |
| Día 35 | a1.517 (343) | 1.467 (416) | 0,380 |
| Día 42 | b1.733 (376) | c1.659 (428) | 0,260 |
| Datos clínicos | |||
| Duración media de la NP, d (DE) | 8,9 (2,7) | 9,2 (4,2) | 0,541 |
| Oxigenoterapia n (%) | 70 (78) | 68 (76) | 0,726 |
| Necesidad de transfusiones, n (%) | 43 (48) | 47 (52) | 0,554 |
| Número de transfusiones, media (DE) | 1,6 (2,9) | 1,9 (2,9) | 0,527 |
| Glucemia | |||
| Hipoglucemia n (%) | 12 (13) | 12 (13) | 0,972 |
| Hiperglucemia n (%) | 33 (37) | 38 (42) | |
| Hipoglucemia e hiperglucemia, n (%) | 10 (11) | 9 (10) | |
| Sepsis, n (%) | 17 (19) | 20 (22) | 0,583 |
| Número de episodios de sepsis, media (DE) | 0,2 (0,5) | 0,3 (0,7) | 0,262 |
| Enterocolitis necrosante, n (%) | 4 (4) | 7 (8) | 0,353 |
| Colestasis, n (%) | 5 (6) | 9 (10) | 0,268 |
| Displasia broncopulmonar, n (%) | 57 (63) | 49 (54) | 0,228 |
| Hiv, grado ≥ 2, n (%) | 11 (12) | 11 (12) | NA |
| Enfermedad de las membranas hialinas, n (%) | 83 (92) | 82 (91) | 0,789 |
| Terapia con agente tensoactivo, n (%) | 47 (52) | 56 (62) | 0,177 |
| CAP, n (%) | 41 (46) | 43 (48) | 0,778 |
| CAP que requiere tratamiento, n (%) | 24 (27) | 16 (18) | 0,131 |
| Estancia hospitalaria (días), media (DE) | 85 (34) | 93 (36) | 0,232 |
| Fallecimiento, n (%) | 1 (1) | 1 (1) | NA |
CAP = conducto arterioso persistente; Hiv = hemorragia intraventricular; NA = no aplicable; NP = nutrición parenteral; ROP = retinopatía del prematuro.
En el subgrupo de prematuros con una EG menor de 27 semanas, las gestaciones múltiples fueron más frecuentes entre las madres de los recién nacidos a los que se administró SMOFlipid® (33% frente a 10% para ClinOleic®, p=0,047) y la ROP fue más frecuente en los recién nacidos que habían recibido SMOFlipid® (81% frente a 60% para ClinOleic®, p=0,104). La ROP en una etapa 2 también fue más frecuente en el grupo de SMOFlipid® (52% frente a 40%). Todos los casos de ROP en etapa 3 y de ROP que requirió tratamiento se produjeron en lactantes con una EG menor de 27 semanas.
Criterios de valoración secundariosNo se observaron diferencias significativas entre los grupos en el aumento de peso semanal en las primeras 6 semanas ni en ninguna de las demás variables clínicas analizadas (tabla 2).
El aumento de peso medio diario tras 6 semanas fue de 19,0 g/d en general, 19,8 g/d en el grupo de ClinOleic® (n=86) y 18,5 g/d en el grupo de SMOFlipid® (n=84).
DiscusiónEste es el primer estudio realizado en España que compara los efectos de las emulsiones lipídicas ClinOleic® y SMOFlipid® sobre la incidencia, gravedad y necesidad de tratamiento de la ROP.
La incidencia de ROP fue prácticamente idéntica en los 2 grupos de tratamiento y la mayoría de los casos pertenecían a la etapa 2. La ROP en etapa 3 fue más frecuente en el grupo SMOFlipid® (9 casos frente a 5 en el grupo ClinOleic®), pero la diferencia no fue significativa. Trece lactantes precisaron tratamiento para la ROP: 4 en el grupo ClinOleic® y 9 en el grupo SMOFlipid®. Se observó una tendencia hacia una mayor proporción de lactantes con ROP en etapa 3 y con necesidad de tratamiento en los pacientes que recibieron SMOFlipid®.
El perfil clínico de los 2 grupos de tratamiento fue diferente. En comparación con los prematuros del grupo de ClinOleic®, aquellos con SMOFlipid® tenían una EG inferior, era más probable que hubieran recibido tratamiento prenatal con corticosteroides y presentaban peores puntuaciones CRIB y Apgar. El perfil nutricional sugiere que los pacientes del grupo SMOFlipid® presentaban un peor estado clínico y un mayor riesgo de mortalidad o enfermedad grave que los del grupo ClinOleic®. Los diferentes perfiles de pacientes podrían explicar la mayor incidencia de ROP en etapa 3 y la mayor necesidad de tratamiento en los pacientes que recibieron SMOFlipid®.
Dos estudios de Pawlik et al. atribuyeron los efectos beneficiosos del aceite de pescado sobre la ROP al DHA11,12. Se calcula que las necesidades fetales de DHA oscilan entre 40 y 60 mg/kg/d13,14. La emulsión SMOFlipid® 20% contiene un 2% de DHA. Por lo tanto, una dosis de 2,5 g/kg/d de lípidos proporcionaría 50 mg de DHA/kg/d, lo que cubriría prácticamente todas las necesidades de los prematuros. Sin embargo, la cantidad de DHA aportada por SMOFlipid® es inferior en los primeros días de vida, y se desconocen los posibles efectos de esta insuficiencia sobre la morbilidad15.
Solo 4 estudios han comparado los efectos de la NP que incluye SMOFlipid® y ClinOleic® sobre la ROP y la ROP con necesidad de tratamiento. Unal et al.3 notificaron en prematuros con SMOFlipid® una incidencia menor, pero no significativa, de ROP (29,5% frente a 32,5%) y de ROP en una etapa ≥2 (9,4% frente a 11,7%). Zübariouglu et al.6 observaron una incidencia mayor, pero tampoco significativa, de ROP en una etapa ≥2 en los lactantes a los que se administró ClinOleic® (34% frente a 20,5%, p=0,147). Dos estudios4,5 no hallaron diferencias en la incidencia y gravedad de la ROP en prematuros que recibían SMOFlipid® o ClinOleic®. Ninguno de estos 4 estudios encontró diferencias significativas en la incidencia de ROP, ROP en una etapa ≥2 o ROP con necesidad de tratamiento entre los lactantes a los que se administró ClinOleic® o SMOFlipid®. Nuestros resultados concuerdan con estos hallazgos.
Otros más estudios han analizado los efectos de SMOFlipid® y las emulsiones de aceite de soja sobre la ROP y la necesidad de su tratamiento, pero los resultados son contradictorios. Varios estudios han notificado una menor incidencia de ROP en los pacientes a los que se administró SMOFlipid®, pero no se observaron diferencias en la ROP que precisaba tratamiento o en una etapa ≥33–10,13–17. Otros 3 estudios18–20 encontraron una menor incidencia de ROP en el grupo de SMOFlipid®. Sin embargo, dicho resultado podría deberse a la mayor duración de la NP en el grupo con aceite de soja o a la edad gestacional superior del grupo SMOFlipid®.
En el ensayo clínico de Vlaardingerbroek et al.7, la ROP en etapa ≥3 fue más frecuente en los pacientes que recibieron Intralipid® (4% frente a 0% para SMOFlipid®, p=0,494). D'Ascenzo et al.21 compararon los ácidos grasos plasmáticos en lactantes prematuros que recibieron SMOFlipid® e Intralipid®. Los lactantes a los que se administró SMOFlipid® tenían mayores concentraciones plasmáticas de DHA y ácido eicosapentaenoico, pero no hubo casos de ROP en etapa ≥3 en ninguno de los grupos. Otros 2 estudios también encontraron diferencias no significativas en la incidencia de ROP en etapa ≥3 durante el uso de NP que incluía SMOFlipid® o Intralipid®13,22. Los resultados similares han sido similares para la ROP y la ROP que requiere tratamiento en varios ensayos clínicos2,23,24. Por otra parte, Gharehbaghi et al.25 notificaron una incidencia significactiva más baja de ROP en etapa 3 en los pacientes que recibieron SMOFlipid®.
Choudhary et al.26 también compararon 2 periodos, y hallaron una mayor incidencia de ROP en el grupo de SMOFlipid® respecto al grupo de intralipid® (54% frente a 39%, p=0,03). En el estudio de Qian et al.27 las tasas de ROP en el grupo de SMOFlipid® fue superior que en el grupo de Lipofundin® (60,1% frente a 47,4%, p=0,19)28 y de Jackson et al.29 Por último, Thanhaeuser et al.30 informaron de que los lactantes prematuros tratados con SMOFlipid® con un peso al nacer < 750 g a los 12 meses de EG corregida tenían una incidencia de ROP superior a la de los lactantes con el mismo perfil tratados con Intralipid® (85,7% frente a 70%). Sin embargo, la necesidad de tratamiento fue superior en el grupo de Intralipid® (20% frente al 17%).
Nuestro estudio compara los efectos de 2 tipos de emulsiones lipídicas utilizados en la NP sobre el aumento de peso semanal desde el nacimiento hasta las 6 semanas de vida. Los resultados coinciden con los observados en el ensayo clínico de Hsiao et al.24, en el que los lactantes tratados con SMOFlipid® ganaron una media de 18,42 g/día. Otros 2 estudios7,26 notificaron un aumento de peso superior con SMOFlipid® que con Intralipid®.
La principal limitación de nuestro estudio es su diseño retrospectivo, observacional y unicéntrico. Además, no se ha cuantificado el DHA aportado por la dieta enteral, lo que podría modificar los resultados obtenidos. Nuestros hallazgos también pueden haberse estado influidos por las mejoras realizadas en los cuidados neonatales en el transcurso del periodo de estudio.
En conclusión, este estudio retrospectivo .no demostró diferencias entre SMOFlipid® en comparación con ClinOleic® sobre la incidencia y la gravedad de la ROP. Son muchos los factores que influyen en los resultados clínicos de los recién nacidos prematuros y, por lo tanto, es muy difícil discernir el efecto de los distintos tipos de emulsiones lipídicas en NP mediante datos observacionales de cohortes retrospectivas. Según nuestros hallazgos, no pueden descartarse efectos beneficiosos de SMOFlipid® sobre otros desenlaces clínicos en lactantes prematuros.
Contribución a la literatura científicaAunque SMOFlipid® se asocia con tasas de crecimiento neonatal y una reducción del riesgo de colestasis, los informes sobre sus efectos en la retinopatía del prematuro (ROP) y la necesidad de tratamiento de la ROP son inconcluyentes.
No se ha observado que SMOFlipid® presente efectos beneficiosos sobre la incidencia de la ROP o la necesidad de tratarla, ni sobre el aumento de peso semanal desde el nacimiento hasta las 6 semanas de vida.
Sería aconsejable diseñar ensayos clínicos que investiguen nuevas estrategias capaces de prevenir la ROP o su progresión a una enfermedad más grave.
Responsabilidades éticasEl estudio fue aprobado por el comité de ética e investigación clínica del hospital y por la Agencia Española de Medicamentos y Productos Sanitarios (código: MJC-LIP-2017-01).
Los autores declaran que siguieron los protocolos establecidos por sus respectivas instituciones para acceder a los datos de pacientes y que se realizó con el único propósito de llevar a cabo investigación y comunicación científica.
FinanciaciónNo se recibió financiación específica para este estudio de organismos del sector público, comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración de contribución de autoría CRediTM. José Cabañas Poy: Writing – review & editing, Writing – original draft, Supervision, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. José Bruno Montoro Ronsano: Writing – original draft, Methodology, Formal analysis. Félix Castillo Salinas: Writing – original draft, Formal analysis, Data curation. Nieves Martín-Begué: Writing – original draft, Formal analysis, Data curation. Susana Clemente Bautista: Writing – original draft, Formal analysis, Conceptualization. M. Queralt Gorgas Torner: Writing – review & editing, Writing – original draft, Methodology.