adaptar el informe GHEMA de abemaciclib, un inhibidor de cinasas dependientes de ciclinas 4 y 6, con autorización de la Agencia Europea del Medicamento en abril de 2022 para el tratamiento adyuvante de los pacientes adultos con cáncer de mama precoz, receptor hormonal positivo, receptor del factor de crecimiento epidérmico negativo, con afectación ganglionar y riesgo elevado de recaída; en combinación con hormonoterapia.
Métodola eficacia y seguridad de abemaciclib se evaluaron en un estudio fase III multicéntrico, aleatorizado y abierto. Se incluyeron 5.637 pacientes diagnosticados de cáncer de mama precoz con ganglios positivos, receptor hormonal positivo, receptor del factor de crecimiento epidérmico negativo y alto riesgo de recaída. El criterio de alto riesgo se definió como la presencia de ≥ 4 ganglios positivos o de 1-3 ganglios y al menos una de las siguientes características: tamaño del tumor ≥ 5 cm, grado histológico 3 o Ki-67 ≥ 20%. Los pacientes fueron aleatorizados (1:1) a recibir durante 2 años abemaciclib + hormonoterapia (n = 2.808) u hormonoterapia sola (n = 2.829). En ambos brazos el tratamiento con hormonoterapia se mantuvo mínimo 5 años.
Resultadoscon una mediana de seguimiento de 15,5 meses, abemaciclib + hormonoterapia mostró beneficio significativo frente a la hormonoterapia sola (HR = 0,747 [IC95% 0,598-0,932], p = 0,0096), con una mejora absoluta del 3,5% en la tasa de supervivencia libre de enfermedad invasiva a 2 los años. Este beneficio se mantuvo con una mediana de seguimiento de 27,7 meses, logrando una mejora en la tasa de supervivencia libre de enfermedad invasiva del 2,7% y del 5,4% a los 2 y 3 años, respectivamente. La incidencia de efectos adversos grado 3-4 fue superior en el brazo de abemaciclib (45,9% vs. 12,9%); e incluía neutropenia (19,6% vs. 0,8%), leucopenia (11,4% vs. 0,4%) y diarrea (7,8% vs. 0,2%).
Conclusioneslos resultados del ensayo pivotal son suficientes para considerar abemaciclib como tratamiento adyuvante del cáncer de mama precoz con alto riesgo de recaída en pacientes muy seleccionados. Sin embargo, para que los resultados de eficacia presenten menos incertidumbre, debemos esperar a una evaluación posterior en la que podamos tener una determinación más madura a los 3 años (con más pacientes a riesgo).
To adapt the GHEMA report of abemaciclib, an inhibitor of cyclin-dependent kinases 4 and 6. European Medicines Agency authorisation (April 2022) includes, in combination with endocrine therapy, the adjuvant treatment of adult patients with hormone receptor positive, human epidermal growth factor receptor 2 negative, node-positive, early breast cancer at high risk of recurrence.
MethodThe efficacy and safety of abemaciclib were evaluated in a randomized, open-label and multicenter phase III study. A total of 5,637 patients diagnosed with early breast cancer with hormone receptor positive, human epidermal growth factor receptor 2 negative, node positive and high risk of recurrence were included. High risk was defined as patients with 4 or more positive axillary lymph nodes, or 1-3positive axillary lymph nodes and at least one of the following: tumor size ≥5 cm, histologic grade 3 or Ki-67 ≥ 20%. Patients were randomized (1:1) to receive adjuvant abemaciclib + endocrine therapy (n = 2,808) or endocrine therapy alone (n = 2,829) for 2 years, with endocrine therapy prescribed for at least 5 years.
ResultsWith a median follow-up of 15.5 months, abemaciclib + endocrine therapy demonstrated a statistically significant improvement in invasive disease-free survival versus endocrine therapy alone (HR = 0.747 [95% CI 0.598-0.932], p = 0.0096); achieving an absolute improvement of 3.5% invasive disease-free survival rate at 2-years. These results were maintained, with a median follow-up of 27.7 months: absolute improvement of 2.7% and 5.4% in invasive disease-free survival rate at 2 and 3-years, respectively. All-causality grade 3 or 4 adverse events were 45.9% for abemaciclib and 12.9% for endocrine therapy, and included neutropenia (19.6% vs. 0.8%), leukopenia (11.4% vs. 0.4%) and diarrhea (7.8% vs. 0.2%).
ConclusionsThe results of the pivotal trial are sufficient to consider abemaciclib as adjuvant treatment for high-risk early breast cancer in highly selected patients. However, in order to the efficacy results present less uncertainty, we must wait for a evaluation later, in which we can have a mature determination at 3 years (with more patients at risk).
El cáncer de mama se origina en los conductos (85%) o lobulillos (15%) del tejido glandular mamario y es un importante problema de salud debido a su elevada incidencia, prevalencia y mortalidad. En 2018 se diagnosticaron alrededor de 2,1 millones de nuevos casos de cáncer de mama en mujeres a nivel mundial. Este tipo de cáncer es poco frecuente en los varones, supone el 1% de los casos. Desde la introducción del cribado mamográfico la incidencia ha aumentado y sigue aumentando con el envejecimiento de la población (menos del 5% de los casos se producen antes de los 35 años). Los factores de riesgo más importantes son: predisposición genética, exposición a estrógenos, radiaciones ionizantes, paridad reducida, elevada densidad mamaria y antecedentes de hiperplasia atípica1.
El cáncer de mama es una enfermedad heterogénea con múltiples subtipos intrínsecos. El tipo luminal A (receptor hormonal positivo [RH+] y receptor del factor de crecimiento epidérmico humano 2 negativo [HER2−]) es el subtipo más común y tiene mejor pronóstico. El luminal B (RH+ y HER2 +/−) tiene un mayor índice proliferativo y es más agresivo que el subtipo A. Todos los tumores luminales deben tratarse con hormonoterapia (HT). El uso de quimioterapia (QT) en los pacientes con subtipos luminal A y luminal B HER2− depende de la carga de la enfermedad y del riesgo individual de recidiva, respectivamente. Por otra parte, el cáncer de mama luminal B HER2+ debe tratarse con QT, HT y terapia anti-HER21.
Muchas pacientes con cáncer de mama precoz (CMP) de tipo luminal A no experimentarán recidiva ni metástasis a distancia con los tratamientos estándar disponibles en la actualidad. Sin embargo, hasta un 30% de las pacientes con características clínicas y/o patológicas de alto riesgo pueden experimentar metástasis a distancia, muchas de ellas en los primeros 10 años. Este grupo de pacientes necesita otras opciones de tratamiento para prevenir la recidiva precoz o el desarrollo de metástasis2. Abemaciclib, un inhibidor oral de cinasas dependientes de ciclinas (CDK), ha sido recientemente aprobado en combinación con HT para el tratamiento adyuvante de pacientes adultos diagnosticados de CMP con RH+, HER2−, ganglios positivos y elevado riesgo de recidiva. Dicha combinación muestra una mejora absoluta en la tasa de supervivencia libre de enfermedad invasiva (SLEI)3. Este trabajo supone una adaptación del informe GHEMA de abemaciclib en la citada indicación. Se revisaron los resultados de abemaciclib más HT frente al uso de HT sola en un estudio fase III, ambos como tratamiento adyuvante de pacientes con CMP de tipo luminal A de alto riesgo.
EficaciaA continuación se presentan los resultados del estudio monarchE (NCT03155997). Se trata de un estudio fase III, abierto, aleatorizado y multicéntrico, que evalua la adicción de abemaciclib al tratamiento estándar adyuvante basado en HT en pacientes diagnosticados de CMP de alto riesgo con RH+, HER2− y ganglios positivos2. La cohorte 1 incluyó pacientes con 4 o más ganglios linfáticos axilares (GLA) positivos o 1-3 GLA positivos y grado histológico igual a 3 o tamaño del tumor ≥5 cm. La cohorte 2, de acuerdo con un criterio de la FDA (Food and Drug Administration), comenzó a seleccionarse un año después de la cohorte 1 e incluyó a pacientes con 1-3 GLA positivos y un índice de proliferación Ki-67 ≥ 20%. Los pacientes fueron aleatorizados (en una proporción 1:1) a recibir como tratamiento adyuvante abemaciclib más HT u HT sola durante 2 años, manteniéndose la HT durante al menos 5 años. La cohorte 1, planificada inicialmente en el protocolo y sin tener en cuenta el índice Ki-67, representó el 91% de la población total del estudio. Sin embargo, la cohorte 2, introducida más tarde y con una población reducida (9% de los pacientes)4, modificó el objetivo principal y planteó dudas sobre la validez externa y la aplicabilidad. Además, el análisis aislado de los resultados procedentes de la cohorte 2 no presentó un beneficio significativo. Por este motivo, solo se muestran los resultados de la cohorte 1.
Por otro lado, existe una ambigüedad en la ficha técnica que afecta a la indicación aprobada. La FDA es restrictiva y solo incluye a pacientes con un índice Ki-67 elevado. Sin embargo, la indicación aprobada por la Agencia Europea del Medicamento (EMA) podría aplicarse tanto a la cohorte 1 como a la 2 y a otros pacientes, incluyendo poblaciones que no están representadas en dicho estudio pivotal. Teniendo en cuenta la incertidumbre antes señalada en los resultados de la cohorte 2, la ambigüedad de la aprobación puede interpretarse en un sentido restrictivo, tomando los criterios de la cohorte 1, que es la única cuyos resultados aparecen en la sección de eficacia de la ficha técnica. La presentación exclusiva de los datos de la cohorte 1 se ajusta a la recomendación del Comité de Medicamentos de Uso Humano (CHMP) en el Informe Público Europeo de Evaluación (EPAR). Por lo tanto, se considera que el beneficio demostrado de abemaciclib como tratamiento adyuvante se aplicaría exclusivamente a los pacientes incluidos en la cohorte 1 con alto riesgo de recidiva.
Se incluyeron pacientes de ambos sexos de 18 años de edad o más diagnosticados de CMP de alto riesgo con RH+ y HER2−. Los criterios de alto riesgo fueron presentar 4 o más GLA positivos o 1-3 GLA positivos y al menos una de las siguientes características: tamaño tumoral ≥5 cm, grado histológico 3 o Ki-67 ≥ 20%. El número de pacientes incluidos fue 5.637, de los cuales 5.591 fueron aleatorizados a recibir tratamiento: 2.794 al brazo de abemaciclib más HT y 2.797 al brazo de HT sola. Los resultados se analizaron por intención de tratar, teniendo en cuenta todos los pacientes incluidos en el estudio2.
Abemaciclib se administró vía oral a una dosis de 150 mg 2 veces al día en combinación con HT (fármacos antiestrogénicos o inhibidores de la aromatasa), con o sin un agonista de la hormona liberadora de la gonadotropina4. Los pacientes fueron tratados durante 2 años (período de tratamiento) o hasta la interrupción por toxicidad inaceptable, abandono o muerte. Se estableció un periodo de tratamiento de 2 años por ser el intervalo de tiempo en el que existe mayor probabilidad de recurrencias en pacientes con CMP. Tras este período de tiempo, todos los pacientes continuaron con HT durante 5 a 10 años. No se permitió el cruce entre brazos en ningún momento. Las poblaciones incluidas en cada brazo de tratamiento se encontraban equilibradas, sin diferencias relevantes en la estratificación y las características basales2.
La variable principal fue la SLEI definida según los criterios STEEP (Definitions for Efficacy End Points in Adjuvant Breast Cancer Trials)5, como el intervalo de tiempo transcurrido entre la aleatorización y la primera documentación de progresión de la enfermedad (evaluada por el investigador) o muerte por cualquier causa. Las variables secundarias fueron la Supervivencia Libre de Enfermedad a Distancia (SLED), definida como el tiempo transcurrido desde la aleatorización hasta la aparición de metástasis a distancia o muerte por cualquier causa; la supervivencia global (SG) y la seguridad. Se realizaron evaluaciones rutinarias de seguridad así como de la gravedad de los efectos adversos2.
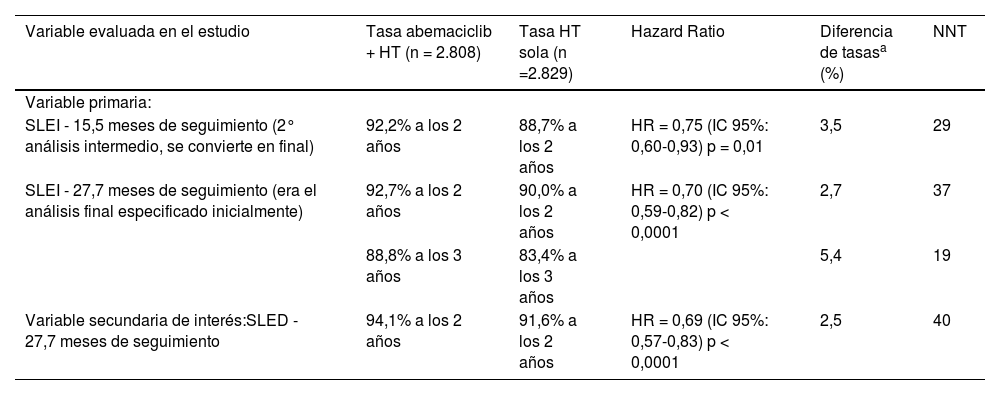
Los resultados de eficacia de la cohorte 1 se muestran en la tabla 1. En el segundo análisis intermedio (mediana de seguimiento de 15,5 meses), abemaciclib mostró un beneficio estadísticamente significativo en SLEI en la población por ITT frente a la HT sola (HR = 0,75 [IC 95%: 0,60-0,93], p = 0,01), con tasas de SLEI a los 2 años del 92,2% para el brazo de abemaciclib y del 88,7% para el brazo control2. El beneficio de adicionar abemaciclib a la HT se mantuvo de manera estadísticamente significativa (HR = 0,70 [IC 95%: 0,52-0,82], p < 0,0001), con una mediana de seguimiento de 27,7 meses. Las curvas de Kaplan-Meier mostraron el beneficio de abemaciclib más allá del periodo de tratamiento de 2 años del estudio. Con más pacientes en riesgo de recaída a los 3 años, los resultados muestran una mejora absoluta del 5,4% en la tasa de SLEI a los 3 años (abemaciclib más HT 88,8% frente a HT sola 83,4%)4.
Resultados de eficacia del estudio pivotal
| Variable evaluada en el estudio | Tasa abemaciclib + HT (n = 2.808) | Tasa HT sola (n =2.829) | Hazard Ratio | Diferencia de tasasa (%) | NNT |
|---|---|---|---|---|---|
| Variable primaria: | |||||
| SLEI - 15,5 meses de seguimiento (2° análisis intermedio, se convierte en final) | 92,2% a los 2 años | 88,7% a los 2 años | HR = 0,75 (IC 95%: 0,60-0,93) p = 0,01 | 3,5 | 29 |
| SLEI - 27,7 meses de seguimiento (era el análisis final especificado inicialmente) | 92,7% a los 2 años | 90,0% a los 2 años | HR = 0,70 (IC 95%: 0,59-0,82) p < 0,0001 | 2,7 | 37 |
| 88,8% a los 3 años | 83,4% a los 3 años | 5,4 | 19 | ||
| Variable secundaria de interés:SLED - 27,7 meses de seguimiento | 94,1% a los 2 años | 91,6% a los 2 años | HR = 0,69 (IC 95%: 0,57-0,83) p < 0,0001 | 2,5 | 40 |
HT: hormonoterapia; HR: hazard ratio; NNT: número necesario a tratar; SLEI: supervivencia libre de enfermedad invasiva; SLED: supervivencia libre de enfermedad a distancia.
El análisis de subgrupos mostró resultados consistentes en todos los subgrupos de pacientes. Se detectaron 2 subgrupos con interacción estadística: tamaño del tumor primario y estado funcional de los pacientes2. Sin embargo, la diferencia encontrada en ambos subgrupos fue poco fiable al valorar aspectos complementarios y no debería ser considerada en la práctica clínica.
Guías clínicasA continuación se presentan las últimas recomendaciones para el tratamiento del CMP incluidas en varias guías de práctica clínica :
- Guía ASCO 2022: Con base en un análisis secundario predefinido llevado a cabo por la FDA, se pueden administrar 2 años de abemaciclib (150 mg 2 veces al día) más HT a pacientes diagnosticados de CMP con RH+, HER2−, ganglios positivos, elevado riesgo de recaída y una puntuación Ki-67 ≥ 20%. El panel también recomienda, basándose en los resultados publicados por Harbeck et al.4, el uso de abemaciclib durante 2 años más HT durante ≥5 años en una población más amplia por intención de tratar de pacientes con CMP resecado, RH+, HER2−, ganglios positivos y alto riesgo de recaída6.
- Guía NCCN versión 4.2022: en pacientes diagnosticados de cáncer de mama de alto riesgo con RH+/HER2−, se pueden considerar 2 años de abemaciclib en combinación con HT como tratamiento adyuvante7.
- Guía CADTH 2022: abemaciclib está indicado en combinación con HT para el tratamiento adyuvante de pacientes adultos con CMP y RH+, HER2−, ganglios positivos, alto riesgo de recurrencia y una puntuación Ki-67 ≥ 20%8.
Estudios de seguridad y/o efectos adversosLa incidencia de efectos adversos (EA) de grado ≥3 fue del 45,9% en el brazo de abemaciclib y del 12,9% en el brazo control. Los EA de grado ≥3 más frecuentes descritos con abemaciclib fueron neutropenia (19,6%), leucopenia (11,3%), diarrea (7,8%) y linfopenia (5,4%); mientras que con HT sola fueron neutropenia (0,8%), aumento de la alanina aminotransferasa (0,7%) y linfopenia (0,5%)4. Se produjeron efectos adversos graves (EAG) en el 12,3% de los pacientes incluidos en el brazo de abemaciclib y en el 7,2% de los incluidos en el brazo control, siendo la neumonía el EAG notificado con mayor frecuencia en ambos brazos (0,8 y 0,5%, respectivamente). Un total de 1.901 pacientes (68,1%) tratados con abemaciclib experimentaron reducción de dosis. En cuanto a la interrupción del tratamiento por EA, el 16,6% de los pacientes en el brazo de abemaciclib tuvieron que abandonarlo frente al 0,8% en el brazo de HT sola. El 6,2% de los pacientes suspendieron ambos tratamientos2.
Análisis económicoLa estimación coste-efectividad de abemaciclib en comparación con el tratamiento estándar actual es incierta. A continuación se presenta un estudio somero de costes, puesto que sería necesario realizar una evaluación económica más completa, incluyendo también los costes del tratamiento tras la recaída y modelizando las curvas de SLEI para proyectarlas, considerando un horizonte temporal más prolongado.
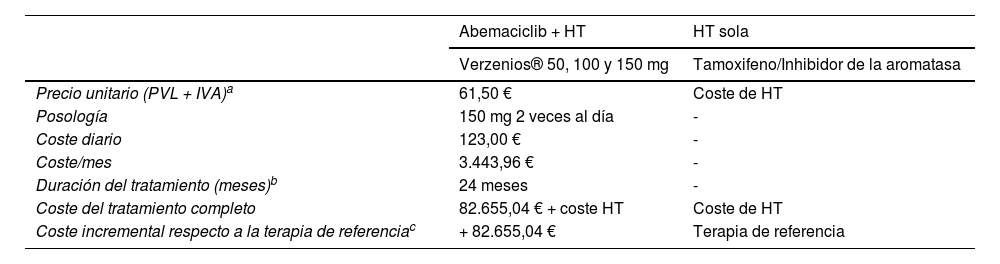
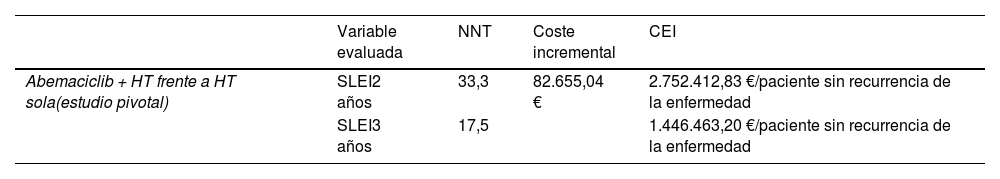
Las tablas 2 y 3 incluyen los resultados de evaluaciones económicas preliminares de abemaciclib en comparación con la terapia de referencia en España. Para calcular el coste, se ha utilizado la duración (2 años) del tratamiento adyuvante especificada en el protocolo del ensayo, obteniéndose un coste adicional estimado de 2.752.412,83 euros a los 2 años y de 1.446.463,20 euros a los 3 años, por cada paciente adicional en el que se evita la recurrencia de la enfermedad.
Costes de abemaciclib comparados frente a otras alternativas
| Abemaciclib + HT | HT sola | |
|---|---|---|
| Verzenios® 50, 100 y 150 mg | Tamoxifeno/Inhibidor de la aromatasa | |
| Precio unitario (PVL + IVA)a | 61,50 € | Coste de HT |
| Posología | 150 mg 2 veces al día | - |
| Coste diario | 123,00 € | - |
| Coste/mes | 3.443,96 € | - |
| Duración del tratamiento (meses)b | 24 meses | - |
| Coste del tratamiento completo | 82.655,04 € + coste HT | Coste de HT |
| Coste incremental respecto a la terapia de referenciac | + 82.655,04 € | Terapia de referencia |
HT: hormonoterapia; IVA: impuesto sobre el valor añadido; PVL: precio de venta laboratorio.
Coste eficacia incremental
| Variable evaluada | NNT | Coste incremental | CEI | |
|---|---|---|---|---|
| Abemaciclib + HT frente a HT sola(estudio pivotal) | SLEI2 años | 33,3 | 82.655,04 € | 2.752.412,83 €/paciente sin recurrencia de la enfermedad |
| SLEI3 años | 17,5 | 1.446.463,20 €/paciente sin recurrencia de la enfermedad |
HT: hormonoterapia; CEI: coste-eficacia incremental; NNT: número necesario a tratar; SLEI: supervivencia libre de enfermedad invasiva.
Abemaciclib en combinación con HT mostró beneficio estadísticamente significatico en la SLEI frente a la HT sola como tratamiento adyuvante en pacientes adultos diagnosticados de CMP con RH+, HER2−, ganglios positivos y alto riesgo de recaida, de acuerdo con los resultados de eficacia del ensayo pivotal. En cuanto a la relevancia clínica, los resultados fueron clínicamente relevantes tras aplicar el formulario 1 de la escala de beneficio clínico ESMO-MCBS v1.123 ya que se obtuvo una categoría B. Además, la variable primaria (SLEI), se considera una variable intermedia suficientemente válida para evaluar la eficacia del tratamiento adyuvante puesto que se tratan de pacientes con una SG muy prolongada y difícil de medir.
Sin embargo, el estudio presenta ciertas limitaciones. Los resultados de eficacia a los 3 años son prematuros (pocos pacientes a riesgo). Además, se trata de un estudio abierto sin un comité de evaluación independiente. Por este motivo, la SLEI, una variable subjetiva, debe ser interpretada con cautela ya que no se puede excluir el sesgo del investigador. De hecho, existen estudios ya publicados sobre el tratamiento adyuvante del cáncer de mama con la misma limitación: KATHERINE9 de trastuzumab-emtansina y HERA10 de trastuzumab. Por otro lado, la cohorte 2 se introdujo más tarde que la cohorte 1, modificando el protocolo inicial y planteando dudas acerca de la validez externa y la aplicabilidad: la cohorte 2 incluyó una población mucho más reducida (9% de la población total) y los resultados en SLEI (HR= 0,986; IC del 95%: 0,475-2,048) no pueden afirmarse sin una elevada incertidumbre.
Abemaciclib, administrado como tratamiento adyuvante reduce un tercio el número de pacientes que recaen, pero para los 2 tercios restantes que recaen de todos modos, haber administrado abemaciclib en adyuvancia probablemente implica la pérdida de una opción terapéutica en cáncer avanzado o metastásico. En cualquier caso, el balance positivo del beneficio clínico parece asegurado.
Se realizó una comparación indirecta (CI) ajustada para establecer si abemaciclib y palbociclib, ambos inhibidores de las CDK, podían ser considerados alternativas terapéuticas equivalentes (ATE). Se analizaron 2 ensayos: monarchE2 (abemaciclib) y Penelope-B11 (palbociclib). Ambos eran estudios en fase III, aleatorizados, que incluyeron pacientes con CMP de tipo luminal con HER2− y alto riesgo de recaida. Se encontraron diferencias en el diseño del estudio (abemaciclib abierto y palbociblib doble ciego), en el número de pacientes incluidas (abemaciclib, n = 5.637 frente a palbociclib, n = 1.250), en la duración del tratamiento (abemaciclib, 2 años frente a palbociclib, 1 año) y en el porcentaje de pacientes previamente tratadas con taxanos, antraciclinas o ambos (abemaciclib, 37% frente a palbociclib, 99%). Debido a estas diferencias, los ensayos clínicos no pudieron ser considerados similares. Abemaciclib demostró ser eficaz en el CMP de tipo luminal HER2 negativo de alto riesgo. Sin embargo, palbociclib no lo fue. La SLEI del grupo de abemaciclib fue estadísticamente significativa (HR = 0,70; IC del 95%: 0,59-0,82; p < 0,0001) con una mediana de seguimiento de 27 meses (el 90% de las pacientes completaron el tratamiento). Por el contrario, la SLEI del grupo de palbociclib no fue estadísticamente significativa (HR= 0,93; IC del 95%: 0,74-1,17; p = 0,525) con una mediana de seguimiento de 43 meses (el 92% de las pacientes completaron el tratamiento). En cuanto a la tasa de SLEI a los 2 años, también fue diferente: 93% para abemaciclib y 88% para palbociclib. En resumen, se detectaron limitaciones metodológicas importantes que impidieron realizar una CI ajustada.
Pese a que la mediana de seguimiento de 15 meses para el análisis intermedio y de 27 meses para el análisis final son cortas en el contexto de la adyuvancia en el CMP, los resultados de eficacia con abemaciclib más HT demostraron ser suficientes por obtener beneficio estadísticamente significativo a los 2 años en pacientes muy seleccionados de CMP con alto riesgo de recaída. No obstante, para apoyar su inclusión, se necesita un periodo de seguimiento mayor.
Los datos de seguridad fueron consistentes con el perfil de seguridad ya conocido previamente de abemaciclib. El 33% de las pacientes (diferencia entre ramas) presentaron EA de grado 3-4 asociados al uso de abemaciclib, y el 16% tuvo que suspender el tratamiento debido a EA. La diarrea, neutropenia y leucopenia fueron los EA de grado 3-4 más frecuentes asociados a abemaciclib.
En cuanto al coste del tratamiento, es necesario conocer el precio final tras la nueva indicación y la evaluación realizada por la Agencia Española de Medicamentos y Productos Sanitarios publicada en su Informe de Posicionamiento Terapéutico para poder emitir un posicionamiento terapéutico adecuado.
Contribución a la literatura científicaAbemaciclib puede ser considerado como tratamiento adyuvante del cáncer de mama precoz con alto riesgo de recaída en pacientes muy seleccionados con base en los resultados del estudio pivotal. Para que los resultados de eficacia presenten menos incertidumbre, debemos esperar a una evaluación futura más consolidada.
La selección de una alternativa farmacológica debe estar sustentada en criterios de evidencia científica y eficiencia. La evaluación y selección de los medicamentos, realizada de acuerdo con su valor terapéutico y el beneficio clínico incremental, permite su posicionamiento en las guías y protocolos terapéuticos asistenciales para que los pacientes reciban los tratamientos más adecuados teniendo en cuenta los recursos disponibles.
Responsabilidades éticasLos autores declaran que han seguido los protocolos establecidos por sus respectivos centros sanitarios para acceder a los datos de las historias clínicas necesarios para realizar este tipo de publicación con fines de investigación/divulgación para la comunidad científica.
FinanciaciónEstudio sin financiación.
Declaración de autoríaTodos los autores han contribuido al diseño del trabajo y al análisis de la información, a la redacción del borrador y revisión del artículo y a la posterior aprobación para su publicación. Asimismo, no se excluye a ninguna persona que haya participado en alguna de las tareas descritas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.