la obesidad constituye un problema de salud pública global y el conocimiento sobre la dosificación de fármacos en pacientes obesos es limitado. Los ensayos clínicos en pacientes críticos raramente incluyen individuos obesos, lo que resulta en la falta de información específica sobre la dosificación en las fichas técnicas de los productos. El objetivo de esta revisión bibliográfica es proporcionar a los clínicos pautas eficientes y seguras para este grupo de pacientes.
Métodose constituyó un grupo multidisciplinar compuesto por farmacéuticos especialistas en farmacia hospitalaria y médicos especialistas en medicina intensiva. Se identificaron y revisaron los grupos terapéuticos y, en profundidad, los principios activos más utilizados en la unidad de cuidados intensivos. La revisión bibliográfica se realizó utilizando términos como: «obese», «overweight», «critical illness», «drug dosification», y «therapeutic dose monitoring». Toda la información fue evaluada por el grupo de trabajo, que consensuó recomendaciones de dosificación para cada fármaco en pacientes obesos críticos.
Resultadosse identificaron 83 fármacos pertenecientes a los siguientes grupos terapéuticos: antivirales, antibacterianos, antifúngicos, inmunosupresores, antiepilépticos, vasopresores, anticoagulantes, bloqueadores neuromusculares y sedantes. Se elaboró una tabla con la recomendación consensuada de dosificación para cada uno de ellos tras su revisión.
Conclusionesla dosificación de medicamentos en pacientes obesos, tanto en entornos críticos como no críticos, sigue siendo un área con importantes incertidumbres. Esta revisión proporciona información actualizada y exhaustiva sobre la dosificación de los principales grupos terapéuticos en pacientes obesos críticos, siendo una herramienta útil tanto para médicos en unidades de cuidados críticos como para farmacéuticos clínicos en su práctica asistencial en dicho entorno.
The prevalence of obesity represents a significant global public health challenge, and the available evidence concerning the appropriate dosing of pharmaceutical in patients with obesity is limited. It is uncommon for clinical trials in critically ill patients to include obese individuals, which results in a lack of specific dosing information in product data sheets. The objective of this literature review is to provide clinicians with efficacious and secure guidelines for this cohort of patients.
MethodsA multidisciplinary team comprising pharmacists specialized in hospital pharmacy and physicians with expertise in intensive care medicine was established. The therapeutic groups and, in particular, the most commonly used active ingredients within the Intensive Care Unit were identified and subjected to detailed analysis. The following terms were included in the search: “obese”, “overweight”, “critical illness”, “drug dosification”, and “therapeutic dose monitoring”. All the information was then evaluated by the working group, which reached a consensus on the dosing recommendations for each drug in obese critically ill patients.
ResultsA total of 83 drugs belonging to the following therapeutic groups were identified: antivirals, antibacterials, antifungals, immunosuppressants, antiepileptics, vasopressors, anticoagulants, neuromuscular blocking agents and sedatives. A table was produced containing the consensus dosing recommendations for each of the aforementioned drugs following a review of the available evidence.
ConclusionsDrug dosing in obese patients, both in critical and noncritical settings, remains an area with significant uncertainty. This review provides comprehensive and up-to-date information on the dosing of the main therapeutic groups in obese critically ill patients, offering a valuable resource physicians in critical care units and clinical pharmacists in their practice in this setting.
La obesidad constituye un problema de salud pública a nivel mundial, con una prevalencia en aumento1. Este fenómeno ha llevado a un incremento en la proporción de pacientes obesos en las unidades de cuidados intensivos (UCI), estimándose que aproximadamente el 20–25% de los pacientes críticos presentan obesidad2. Este escenario plantea múltiples retos para su manejo, incluido el tratamiento farmacológico óptimo en esta población específica. No obstante, el conocimiento sobre la dosificación de fármacos en estos pacientes es muy limitado, debido a factores como la infrarrepresentación de los obesos en los ensayos clínicos y la comprensión aún insuficiente de las alteraciones en las variables farmacocinéticas (PK) y farmacodinámicas (PD).
Un aspecto crítico en el manejo farmacológico de pacientes obesos es la determinación del peso corporal a considerar: peso real, peso ideal o peso ajustado. La literatura presenta discrepancias respecto a este tema, lo que puede llevar a la sobredosificación y consecuente toxicidad si se utiliza el peso actual, o a la infradosificación y posible fracaso terapéutico si se aplican las recomendaciones estándar de las fichas técnicas de los medicamentos. En vista de estas consideraciones, se ha propuesto realizar una revisión bibliográfica de la literatura existente sobre las pautas de dosificación de los medicamentos comúnmente utilizados en las UCI. El objetivo de esta revisión es proporcionar a los clínicos una guía para la aplicación de las pautas más eficientes y seguras en este grupo de pacientes.
MétodosUn grupo de médicos intensivistas y farmacéuticos referentes de la UCI identificaron los grupos terapéuticos y, más detalladamente, los principios activos más utilizados en nuestro hospital. Para cada uno de ellos se recopilaron datos fisicoquímicos (logP, que indica el carácter hidrófilo o hidrófobo de una sustancia), datos farmacocinéticos (volumen de distribución, aclaramiento y unión a proteínas plasmáticas) y la existencia o no de información específica sobre su dosificación en obesidad y sobrepeso en la ficha técnica. Los datos fisicoquímicos y farmacocinéticos se obtuvieron de Uptodate, DrugBank y PubChem.
Simultáneamente, se realizó una revisión inicial en PubMed, Google Scholar y Cochrane Library. Se incluyeron revisiones sistemáticas, guías de práctica clínica, estudios científicos originales y casos clínicos publicados entre los años 1980 y 2023. La revisión bibliográfica se llevó a cabo utilizando los términos: «obese», «overweight», «critical illness», «drug dosification» y «therapeutic dose monitoring». Además, se cruzaron los nombres de los diferentes principios activos con los términos de búsqueda. Los idiomas aceptados en esta revisión fueron español e inglés. Se excluyeron los artículos que contuvieran datos de población infantil (menores de18 años) y aquellos escritos en idiomas distintos al inglés o español.
En la búsqueda de literatura, se incluyó todo artículo que hiciese mención al comportamiento del fármaco en pacientes obesos, en pacientes críticos o en pacientes obesos críticos. Para un mismo fármaco, podría existir discrepancias en la bibliografía respecto a la dosis a utilizar en pacientes obesos críticos, por lo que en el proceso de selección se tuvo en cuenta el año de publicación, el tipo de estudio y el número de pacientes incluidos. Las recomendaciones de dosis óptima en el paciente obeso crítico se basaron en estudios farmacocinéticos y clínicos. En ausencia de estos, en algunos casos se recurrió a reportes de casos para ayudar a definir la dosis en este tipo de pacientes. Se revisaron los abstracts y, de ser necesario, los artículos completos para determinar si la información contenida estaba relacionada con el objetivo. La información recopilada fue revisada por pares entre los farmacéuticos a posteriori. Se utilizó un código de colores (semáforo) para evaluar la coincidencia o discordancia de las recomendaciones sobre dosificación en pacientes obesos críticos encontradas en la bibliografía seleccionada. Posteriormente, se analizaron las discrepancias identificadas entre todo el grupo de trabajo.
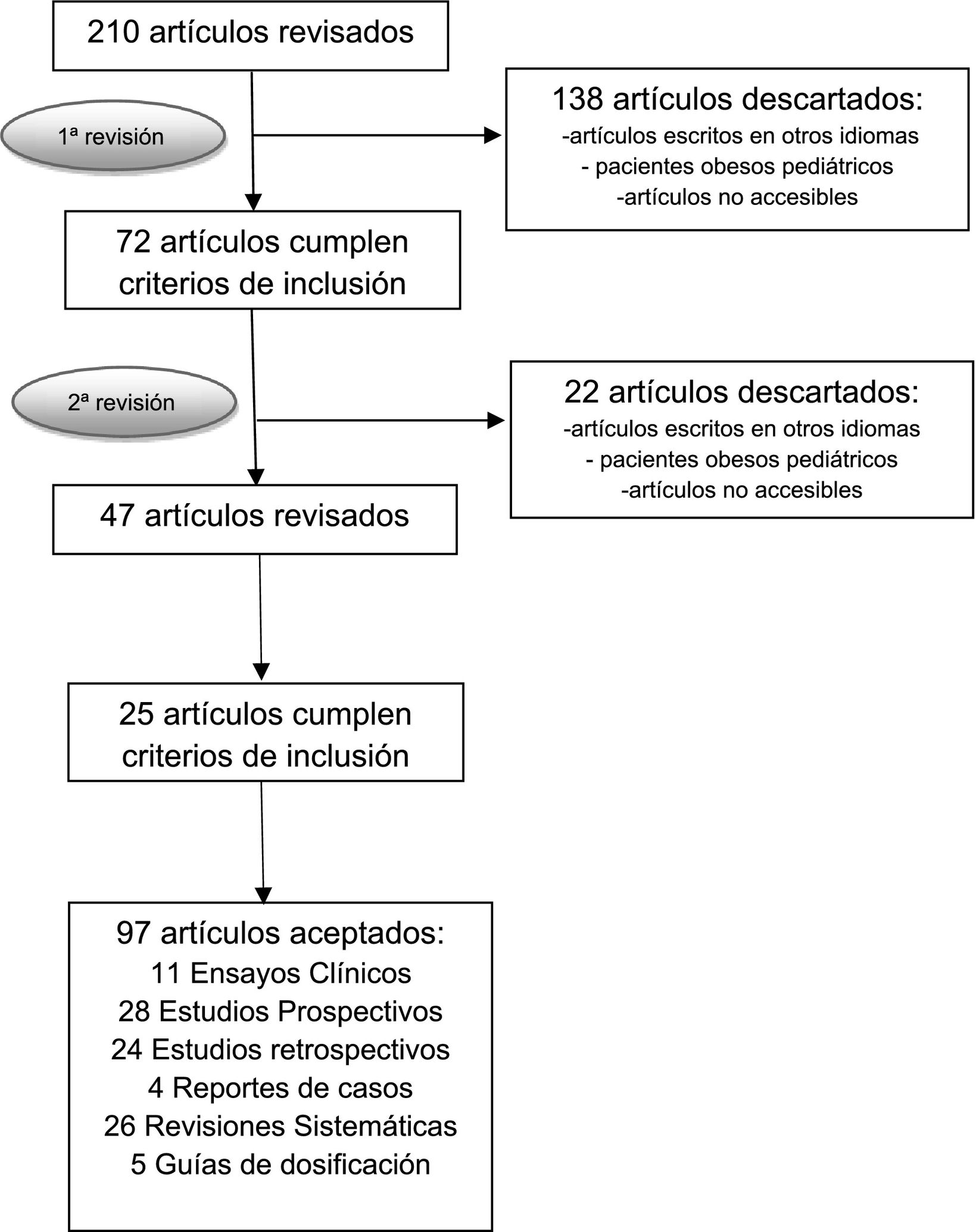
Se llevó a cabo una segunda búsqueda bibliográfica revisada por pares en PubMed y Google Scholar, de manera más específica para aquellos medicamentos en los que no se alcanzó un consenso inicial. Una vez recopilada esta información, el grupo de trabajo completo evaluó los hallazgos para cada medicamento y elaboró recomendaciones por consenso respaldadas por la bibliografía consultada. Finalmente, se recopilaron estas recomendaciones en forma de revisión bibliográfica. Se indica el flujograma en la figura 1.
El índice de masa corporal (IMC) se calcula en kg/m2 y proporciona una medida del grado de obesidad. A finales de la década de 1990, la Organización Mundial de la Salud (OMS)3 y un panel de expertos del Instituto Nacional de Salud (NIH) de Estados Unidos recomendaron categorizar el IMC en 3 clases. Posteriormente, debido al creciente número de pacientes con obesidad severa, la Sociedad Española para el Estudio de la Obesidad (SEEDO)4 en 2007 y la Asociación Americana del Corazón (AHA)5 en 2010 introdujeron las subcategorías 4 y 5 respectivamente:
- •
Obesidad clase I: 30–34,9 kg/m2
- •
Obesidad clase II: 35–39,9 kg/m2
- •
Obesidad clase III (obesidad mórbida): 40–49,9 kg/m2
- •
Obesidad clase IV (obesidad supermórbida): 50–59,9 kg/m2
- •
Obesidad clase V: igual o mayor a 60 kg/m2
Se consideraron diversas métricas de peso para recomendar la dosificación de los medicamentos:
- •
Peso total (PT): es el peso real del paciente, obtenido mediante la medición en la cama del paciente o el peso reportado por el paciente o cuidador en ausencia de una medición incorporada en la cama6.
- •
Peso ideal (PI): se calcula mediante fórmulas matemáticas que no tienen en cuenta las diferencias en la composición corporal7.
- •
Peso ajustado (PA): es un peso intermedio entre el peso real y el ideal, utilizado ampliamente para el cálculo de la dosificación de medicamentos8. Se calcula como PI + ([PT - PI] x C), donde la constante C varía según el fármaco y representa el porcentaje del exceso de peso estimado que distribuye el fármaco9.
Se identificaron un total de 83 fármacos distribuidos en los siguientes grupos terapéuticos: antivirales, antibacterianos, antifúngicos, inmunosupresores, antiepilépticos, vasopresores, anticoagulantes, bloqueadores neuromusculares y sedantes. De estos, en solo 13 de 83 medicamentos (15,6%) se proporcionaba información sobre la dosificación en población obesa en sus fichas técnicas. En la primera fase de revisión se evaluaron 210 artículos, de los cuales se incluyeron 72. Posteriormente, se realizó una segunda revisión para abordar discrepancias, ampliando así el número de artículos a 97. La literatura revisada incluye 11 ensayos clínicos, 28 estudios prospectivos, 24 estudios retrospectivos, 4 reportes de casos, 26 revisiones sistemáticas y 5 guías de dosificación. A continuación, se detalla la información específica de los medicamentos incluidos en esta revisión.
AntiviralesAciclovir: se recomienda ajustar la dosificación según el PA. Tradicionalmente, se ha preferido ajustar la dosis según el PI10. Sin embargo, un estudio PK/PD comparativo en pacientes con IMC mayor de 40 kg/m2 frente a pacientes de peso normal, mostró una menor exposición sistémica con la dosificación basada en PI en pacientes obesos mórbidos. Además, este estudio evaluó indirectamente la dosificación de aciclovir basada en PA en pacientes con obesidad mórbida, obteniendo resultados similares a los pacientes no obesos dosificados por PT, en cuanto a exposición sistémica. Por ello, sugieren la dosificación del fármaco según PA11. Además, una investigación reciente señala que no hay diferencias significativas en las tasas de daño renal agudo entre la dosificación según PA y PI12. A pesar de las recomendaciones, es importante evaluar cada caso en función de la situación clínica del paciente y la función renal.
Ganciclovir: se recomienda ajustar la dosificación según PA debido a su naturaleza hidrofílica y su potencial mielotoxicidad. Hasta 2023, no existían datos bibliográficos sobre la dosificación en pacientes obesos. Un estudio realizado en 2023 evaluó la eficacia y seguridad de ganciclovir en pacientes obesos y con sobrepeso, sin encontrar diferencias significativas entre los regímenes de dosificación basados en PA y PT13. Una revisión reciente14 sugiere que los pacientes obesos podrían beneficiarse de la monitorización de los niveles plasmáticos (TDM) de ganciclovir. Sin embargo, actualmente solo se puede recomendar la TDM de ganciclovir en el contexto de estudios de investigación, ya que no existe un intervalo terapéutico definido y la literatura existente no es suficiente para justificar su uso clínico15.
Foscarnet y cidofovir: se recomienda dosificar ambos medicamentos utilizando el PA debido a su naturaleza hidrofílica y su potencial nefrotoxicidad. Ambos fármacos son hidrofílicos, con un volumen de distribución en pacientes no obesos de 0,3–0,5 l/kg y 0,4–0,5 l/kg, respectivamente16. No se dispone de datos bibliográficos sobre la dosificación en pacientes obesos.
AntibacterianosAminoglucósidosSe recomienda dosificar los fármacos aminoglucósidos utilizando el PA con un factor (f) de 0,4. Existe consenso en la bibliografía consultada en la importancia de realizar TDM, el estado clínico y la función renal del paciente para ajustar la dosis adecuadamente17. En relación con la gentamicina, un estudio de 2020 sugiere dosificar según el filtrado glomerular calculado por CDK-EPI en pacientes obesos, proponiendo una reducción del 25% en la dosis en todos los casos de pacientes obesos críticos18.
BetalactámicosEn este grupo la dosificación no se basa en el peso, sino en dosis estándar. Existen numerosos estudios que respaldan la TDM de los betalactámicos en pacientes críticos19–22. Para pacientes obesos se recomienda preferentemente la administración por perfusión extendida o continua, ajustando la frecuencia a las dosis máximas dentro de los intervalos establecidos y considerando factores como el filtrado glomerular y el estado clínico del paciente. Las recomendaciones están condicionadas por la concentración mínima inhibitoria (CMI) del microorganismo tratado. Las dosis recomendadas se detallan en la tabla suplementaria 1 y se sugiere realizar TDM en algunos casos para asegurar niveles terapéuticos adecuados. Además, ciertos fármacos específicos requieren atención especial.
- •
Ceftriaxona: se recomienda usar la dosis de 2 g cada 12 horas, teniendo en cuenta la clínica del paciente y su función renal. En un estudio realizado con 101 pacientes (39 obesos y 62 no obesos), la mayoría de los participantes (94,1%) recibieron una dosis de 1 g cada 24 horas. Aunque no se encontraron diferencias estadísticamente significativas en los regímenes de dosificación entre ambos grupos, los pacientes obesos mostraron una tendencia numérica mayor a recibir 2 g de ceftriaxona (46,2% frente a 30,6%; p = 0,115). El fracaso clínico se presentó en el 61,5% de los pacientes obesos en comparación con el 40,3% de los no obesos (p = 0,038)23. Además, la alta unión a proteínas plasmáticas de la ceftriaxona puede afectar su farmacocinética en pacientes obesos críticos, especialmente en presencia de hipoalbuminemia, que es frecuente en este tipo de pacientes. Un estudio adicional incluyó a 137 pacientes, de los cuales 34 presentaban niveles de albúmina sérica menor a 2,5 g/dl. La hipoalbuminemia se asoció con una menor tasa de éxito clínico entre los pacientes obesos tratados con 2 g de ceftriaxona cada 12 horas. La mortalidad a los 30 días (13,7% frente a 0%, p < 0,001) y el reingreso hospitalario a los 30 días (31,6% frente a 12,0%, p = 0,008) fueron más frecuentes en el grupo con hipoalbuminemia24. Dado que este estudio se realizó en una población no crítica, se requieren ensayos clínicos adicionales que evalúen el fracaso clínico en pacientes críticos tratados con ceftriaxona 2 g/12 h para considerar una dosis superior, como 2 g/8 h.
- •
Cefiderocol: se recomienda dosificar según la pauta estándar. No existen estudios farmacocinéticos específicos sobre el efecto de la obesidad en pacientes críticos tratados con cefiderocol. Sin embargo, un estudio reciente25 en condiciones de vida real, con una representación del 28,6% de pacientes obesos entre 112 pacientes, no mostró resultados clínicos peores en comparación con el estudio pivotal CREDIBLE-CR26.
- •
Ertapenem: en pacientes obesos críticos infectados por microorganismos con CMI >0,25–0,50 μg/ml se recomienda una dosis de ertapenem de 2 g cada 24 horas. Siempre se puede recurrir a la TDM para evaluar la exposición adecuada del fármaco, sobre todo en situaciones de hipoalbuminemia27. Debido a su elevada lipofilia, ertapenem presenta una alta unión a proteínas plasmáticas (85–95%). En pacientes en UCI, la incidencia de hipoalbuminemia (menor de 2,5 g/dl) oscila entre un 40 y 50%, lo que produce un aumento en el Vd del fármaco y, consecuentemente, una reducción en su exposición sistémica, comprometiendo su eficacia terapéutica28. Por esta razón, algunos autores sugieren un régimen de dosis de carga de 2 g de ertapenem seguido de una dosis de mantenimiento de 1 g cada 12 horas en pacientes críticos con hipoalbuminemia. Estudios indican un mayor riesgo de mortalidad a los 30 días en pacientes con hipoalbuminemia tratados con dosis estándar de ertapenem, en comparación con otros carbapenémicos como meropenem o imipenem29. En este contexto, se recomienda el uso de meropenem en pacientes obesos críticos debido a su mejor perfil farmacocinético. Es crucial considerar que la dosis de ertapenem puede variar según el foco infeccioso, la CMI del patógeno, la hipoalbuminemia en pacientes críticos, o el aumento del aclaramiento renal en pacientes obesos críticos. En los primeros estudios PK/PD en pacientes obesos, una dosis de 1 g cada 24 horas no proporcionaba una exposición sanguínea suficiente para alcanzar un efecto bacteriostático en microorganismos con CMI superiores a 0,25–0,50 μg/ml30. Por ello, algunas guías recomiendan 2 g cada 24 horas en casos con CMI mayores a 0,25–0,50 μg/ml en pacientes obesos31,32. En un caso reportado se utilizó una dosis de 1,5 g/día guiada mediante TDM en un paciente con obesidad extrema, obteniendo una exposición adecuada a la CMI del patógeno33. Sin embargo, revisiones y estudios más recientes indican que no existen diferencias clínicamente significativas entre la población obesa y la estándar en escenarios como profilaxis quirúrgica34, infección intraabdominal35 o neumonía36. Para infecciones osteoarticulares, puede que la dosis de 1 g cada 24 horas no sea suficiente para tratar infecciones por organismos con CMI elevadas37.
- •
Ciprofloxacino: en general, se recomienda utilizar dosis mayores al estándar en pacientes obesos críticos, administrando 400 mg cada 8 horas por vía intravenosa y 750 mg cada 12 horas por vía oral. La evidencia sobre el uso de ciprofloxacino en pacientes obesos es limitada. No obstante, un estudio reciente en pacientes con obesidad mórbida no recomienda aumentar rutinariamente las dosis de ciprofloxacino, ya que no se observó una relación significativa entre la obesidad y los parámetros farmacocinéticos del fármaco. Sin embargo, para el tratamiento de infecciones en tejidos donde se anticipa una penetración deficiente del ciprofloxacino, como infecciones de piel y tejidos blandos, pueden ser necesarias dosis superiores38. Incluso en pacientes que reciben a terapia de reemplazo renal sustitutiva (TRRS), se han utilizado dosis de 400 mg cada 8 horas39 para bacterias con CMI mayores a 0,5 mg/l, como Pseudomonas aeruginosa o Acinetobacter baumannii40.
- •
Levofloxacino: se sugiere mantener una dosis de 750 mg cada 24 horas y, en casos donde el aclaramiento calculado supere los 110 ml/min (calculado por PI), aumentar la dosis a 1.000 mg cada 24 horas para infecciones causadas por bacterias gramnegativas41,42.
- •
Vancomicina: la dosificación recomendada se basa en el PT. Se sugiere una dosis de carga de 20–25 mg/kg, con un máximo de 2,5 g, y una dosis de mantenimiento de 15–20 mg/kg cada 8–12 horas, con un límite máximo de 4 g al día. En pacientes con un IMC mayores a 40 kg/m2, se aconseja una dosificación de 10–12,5 mg/kg cada 12 horas. Se recomienda ajustar dosis de mantenimiento en función de TDM.
- •
Teicoplanina: la dosificación recomendada se basa en el PT. La información bibliográfica sobre la dosificación de teicoplanina en pacientes obesos es limitada, pero recomienda basarse en el PT. Para la dosis de carga, se sugiere 12 mg/kg cada 12 horas para las primeras 3 dosis, seguido de una dosis de mantenimiento diaria de 6–12 mg/kg. Existen estudios que sugieren una dosis de 15 mg/kg en casos que requieran un aumento de la concentración mínima (Cmin)43. Se recomienda ajustar dosis de mantenimiento en función de TDM44.
Linezolid y tedizolid: en pacientes obesos con infecciones estafilocócicas coagulasa-negativas y con un CrCL (calculado mediante CKD-EPI) menor a 30 ml/min/1,73 m2, un estudio sugiere reducir la dosis a 450 mg cada 12 horas. Para aquellos con un CrCL (CDK-EPI) mayor a 60 ml/min/1,73 m2, se recomienda aumentar la dosis a 450 mg cada 8 horas. No obstante, si se dispone de TDM y la CMI del patógeno es mayor a 2 mg/l, se recomienda la posología de 600 mg/8 h, aunque se debe considerar el elevado riesgo de trombocitopenia45. Diversos estudios sugieren que la dosis estándar de linezolid (600 mg/12 h) no es suficiente para alcanzar las concentraciones plasmáticas adecuadas en pacientes obesos críticos46. Teniendo en cuenta el mayor volumen de distribución en estos pacientes, un estudio recomienda una dosis de carga de 600 mg o incluso 900 mg, seguida de una dosificación estándar de 600 mg cada 12 horas, comenzando la administración de la siguiente dosis después de 8 horas en lugar de 12 horas, preferiblemente como infusión prolongada47. En general, se sugiere realizar TDM en el paciente obeso crítico48,49. No existen datos sobre la dosificación de tedizolid en el paciente obeso crítico.
Clindamicina: en general, se recomienda una dosis de 900 mg cada 8 horas en pacientes obesos50. En situaciones de urgencia que amenazan la vida, según la ficha técnica del producto51, se han administrado dosis de hasta 4,8 g por día por vía intravenosa, aunque la dosis máxima recomendada es de 2,7 g por día. No se dispone de datos específicos sobre el uso de clindamicina en pacientes obesos críticos.
Daptomicina: se recomienda dosificar según el PA, ya que recientes estudios han demostrado que esta práctica reduce los efectos adversos en comparación con la dosificación basada en el PT, sin comprometer la eficacia clínica. En este estudio se evidenció una disminución de efectos adversos usando PA en lugar de PT52. Un consenso de expertos también respalda la dosificación según PA, dado que mantiene los parámetros de eficacia y mejora la seguridad al administrar dosis menores a pacientes obesos. A pesar de que una revisión reciente sugiere la dosificación en función del peso magro corporal, debido a la dificultad en su cálculo y su similitud con el peso ajustado, se mantiene la recomendación de dosificar según PA53. Tradicionalmente, la daptomicina se ha dosificado según el peso total, pero se ha observado que la exposición al fármaco tras una dosis de 4 mg/kg aumenta aproximadamente entre un 25 y un 60% en pacientes obesos en comparación con los no obesos54,55. En un estudio observacional retrospectivo con 326 pacientes se detectó una señal de toxicidad muscular independientemente del uso de estatinas (ROR, 6,82; IC 95% [4,56-10,22]; p < 0,001). En un análisis logístico múltiple en 250 pacientes se mostró una asociación significativa entre la toxicidad y un IMC mayor a 25 kg/m2 (OR, 3,57; IC 95% [1,58-8,09]; p = 0,002)56. Además, en otros estudios se sugieren tasas más elevadas de elevación de la CPK y de interrupción de la administración debido a eventos adversos cuando se dosifica daptomicina en función del peso total en pacientes obesos57,58.
AntifúngicosAzoles- •
Fluconazol: se recomienda ajustar la dosificación según PT, hasta una dosis máxima diaria de 1.600 mg. Algunos autores sugieren administrar dosis de carga de 12 mg/kg y continuar con 6 mg/kg cada 24 horas o 12 mg/kg cada 24 horas en función del objetivo PK/PD59. En un estudio60 que incluyó a 17 pacientes con obesidad mórbida que recibieron una cirugía laparoscópica gástrica, se demostró la implicación del factor sexo en el volumen de distribución del fármaco en la población obesa. Por tanto, concluyen que, para alcanzar una AUC 24h/CMI mayor de 100 para patógenos con CMI menor a 2 mg/l, las dosis de carga pueden ser las habituales (800 mg el primer día de tratamiento), excepto en pacientes varones con un peso mayor de 140 kg, en los que se debe administrar 600 mg cada 12 horas como dosis de carga el primer día de tratamiento. Para todos los pacientes, se alcanzaron las concentraciones deseadas con una dosis de mantenimiento de 400 mg cada 24 horas. Es importante destacar que este estudio se realizó en pacientes obesos no críticos.
- •
Voriconazol: se recomienda dosificar según peso ajustado PA, siguiendo la pauta estándar de 4 mg/kg cada 12 horas, con la posibilidad de administrar una dosis de carga el primer día de 6 mg/kg cada 12 horas. Algunos autores consideran que la presentación oral se podría ajustar a dosis estándar de 200–300 mg cada 12 horas en pacientes con un IMC mayor a 35 kg/m261. En cualquier caso, se recomienda el seguimiento estrecho con TDM.
- •
Posaconazol: se recomienda utilizar dosis estándar excepto en pacientes con un peso mayor a 140 kg en los que se requiere 400 mg cada 24 horas por vía intravenosa para el tratamiento de la infección fúngica62. Aunque hay estudios realizados con la formulación de comprimidos, donde se ha observado una menor exposición al fármaco a partir de 120 kg, no se recomienda realizar ningún ajuste, pero sí TDM63.
- •
Isavuconazol: no se recomienda realizar ningún ajuste. No obstante, en un estudio farmacocinético64 en 41 pacientes críticos se observó que el 51,4% de los pacientes con IMC mayor de 25 kg/m2 obtuvieron unas Cmin inferiores a 1 μg/ml. Aunque la mayor parte de la literatura no recomienda realizar TDM de isavuconazol de rutina, se podría plantear en pacientes obesos críticos. Todavía se necesitan más estudios para justificar la TDM de isavuconazol.
Estudios recientes han evidenciado el riesgo de baja exposición a equinocandinas en pacientes obesos críticos. Sin embargo, no se ha determinado si esto afecta los resultados clínicos. Debido a la discrepancia en las dosis recomendadas en los estudios existentes, se sugiere realizar TDM para establecer la posología adecuada en estos pacientes65. La International Association of Therapeutic Drug Monitoring and Clinical Toxicology considera valioso el uso de TDM para equinocandinas en pacientes obesos críticos66.
- •
Micafungina: en caso de infección por Candida albicans, se recomienda una dosis diaria de 150 mg cada 24 horas en pacientes con peso menor de 115 kg, y de 200 mg cada 24 horas en aquellos con peso mayor a 115 kg. Para infecciones por Candida glabrata, independientemente del peso, se recomienda administrar la dosis máxima de 200 mg cada 24 horas67.
- •
Anidulafungina: se recomienda aumentar la dosis en un 25% para pacientes con peso mayor de 140 kg y en un 50% para aquellos con peso mayor a 200 kg, es decir, a 125 mg cada 24 horas y 150 mg cada 24 horas respectivamente68. Estudios han demostrado que el aclaramiento de anidulafungina aumenta con el peso corporal, requiriendo un incremento en las dosis de carga y mantenimiento69.
Amfotericina B liposomal: se recomienda dosificar utilizando el PT hasta un máximo de 100 kg, es decir, hasta una dosis máxima de 500 mg, dependiendo de la indicación. Los datos bibliográficos disponibles sobre la dosificación de anfotericina B liposomal en pacientes obesos son limitados. Un estudio reciente evaluó los resultados clínicos en función de si la dosis se ajustaba según PA o PT. Los pacientes con la posología ajustada según PA mostraron una tasa significativamente menor de nefrotoxicidad y una tendencia (no significativa) a menor mortalidad. No obstante, estos resultados no se obtuvieron en pacientes críticos, por lo que en estos casos se recomienda la dosificación según PT70. Según un estudio realizado en 16 pacientes obesos, el tamaño corporal no influye en el aclaramiento de anfotericina B liposomal71.
InmunosupresoresEn general, en este grupo de fármacos, existe consenso en la bilbiografía sobre la necesidad de ajustar la dosis por peso para todos los tipos de pacientes (obesos y no obesos) y realizar TDM.
CorticoidesSe recomienda dosificar por PI, salvo en aquellos regímenes cortos de tratamiento en los que se podría usar el PA para evitar una posible infradosificación.
- •
Metilprednisolona: se sugiere el uso del PI o PA, especialmente en pacientes con formas más graves de obesidad (por ejemplo, IMC de 40 kg/m2 o superior)72.
- •
Hidrocortisona: la dosificación no está basada en el peso, por lo que la dosis intravenosa debe ser la misma que la utilizada en pacientes no obesos.
- •
Tacrolimus: se sugiere dosificar por PI o PA. La práctica estándar habitual para la dosificación inicial de tacrolimus en el postrasplante se basa en el peso total del paciente, siguiendo la recomendación de la ficha técnica. Sin embargo, estudios recientes sugieren que este enfoque puede no ser adecuado y proponen reducir la dosis en individuos con sobrepeso y obesidad73–75. Se ha identificado que un IMC más elevado es un factor de riesgo para ser un metabolizador lento, requiriendo estos pacientes una dosis menor de tacrolimus por kilogramo de PT76. Por el contrario, otros estudios han demostrado que no hay diferencias en las Cmin de tacrolimus entre pacientes obesos y no obesos tras una dosificación basada en el peso en la fase inmediatamente posterior al trasplante77.
- •
Micofenolato de mofetilo: un estudio realizado en pacientes trasplantados renales sugiere la necesidad de utilizar dosis más altas en pacientes con peso superior a 100 kg para evitar la infradosificación del fármaco78. Este estudio propone individualizar dosis según características del paciente o guiada por TDM.
Para los fármacos dosificados por peso, se recomienda generalmente administrar una dosis de carga utilizando el PT y continuar con la dosis de mantenimiento ajustada al peso ideal PI, monitorizando los niveles plasmáticos. Siempre se debe ajustar la dosis acorde al estado clínico del paciente, la función renal y/o hepática dependiendo de las características farmacocinéticas del fármaco. Para los fármacos administrados según dosis estándar, no existen estudios que avalen dosis superiores, por lo que se recomienda dosificar según indicación y, si es posible, utilizar TDM para ajustar las dosis de fármaco.
Fenitoína: la fenitoína se distribuye de manera no proporcional en el exceso de peso corporal. En un estudio reciente79 se sugiere que una dosis de carga de 20 mg/kg utilizando el PA, seguida de dosis de mantenimiento con las dosis diarias convencionales o el PI, podría alcanzar más fácilmente las concentraciones terapéuticas deseadas. La titulación posterior debe basarse en el control del fármaco mediante TDM y la eficacia clínica.
Levetiracetam: en general, se recomienda utilizar dosis máximas, entre 1.500 y 2.000 mg cada 12 horas. El levetiracetam exhibe una farmacocinética lineal con escasa variabilidad tanto intra como interpersonal, lo que sugiere que no sería necesaria la realización de TDM, a diferencia de otros agentes antiepilépticos. Sin embargo, existe controversia80 en este aspecto, debido a la exclusión de pacientes críticos y obesos, entre otros, en los ensayos clínicos. Investigaciones recientes han revelado un impacto significativo del aumento del aclaramiento renal en ciertos grupos de pacientes críticos, como los pacientes sépticos, neurocríticos y politraumatizados, en los niveles plasmáticos de levetiracetam, resultando en concentraciones inferiores a las esperadas81,82. Por ello, se recomienda la realización de TDM si es posible.
VasopresoresAl administrar vasopresores en pacientes obesos, es fundamental considerar cuidadosamente el enfoque de dosificación, ya sea basado en el peso o en parámetros clínicos. Se recomienda mantener la coherencia en el uso del PI o PA si se opta por un método de dosificación basado en el peso para la prescripción de diferentes medicamentos vasoactivos.
Noradrenalina: en general, se prefiere una estrategia de dosificación basada en objetivos clínicos. Un estudio retrospectivo evaluó el efecto del PT y el IMC en las necesidades de noradrenalina y otros vasopresores. Se observó que los pacientes obesos requerían menos dosis de vasopresores totales por kilogramo para alcanzar objetivos clínicos como la presión arterial media83. Utilizando una estrategia de dosificación basada en el peso, otro estudio demostró que la acumulación de noradrenalina en pacientes con obesidad mórbida se asoció con una menor mortalidad intrahospitalaria. Sin embargo, la mortalidad a un año fue mayor en los pacientes con obesidad mórbida84.
Vasopresina: se recomienda no modificar la dosis de vasopresina en función de la obesidad.
En el año 2016, en un estudio realizado en 40 pacientes con shock séptico se concluyó que el aumento de la dosis de vasopresina en función del peso no se correlacionaba con cambios en la presión arterial media cuando se utilizó junto con vasopresores catecolamínicos en el shock séptico. Sin embargo, la administración de vasopresina a dosis fijas podría no ser suficiente en pacientes obesos con shock séptico85. Posteriormente, en otro estudio se comparó regímenes de dosis estándar y elevadas de vasopresina en pacientes obesos con shock séptico. En este estudio se demostró que la administración de dosis altas de vasopresina no se asoció a diferencias en las necesidades de catecolaminas ni a una mejora de los resultados clínicos86.
AnticoagulantesHeparina no fraccionada: tradicionalmente se ha recomendado iniciar la terapia según PA hasta obtener el control del tiempo de tromboplastina parcial activado (TTPA). Esto es debido a que la dosificación de heparina en pacientes obesos debe considerar el aumento de la vasculatura y el volumen sanguíneo, omitiendo el peso del tejido adiposo, que está menos vascularizado. Un estudio realizado en una cohorte de pacientes obesos críticos, recomiendan dosificar según el PA en pacientes obesos con peso mayor a 165 kg y según PT para pacientes con peso menor a 165 kg87.
Heparina bajo peso molecular (HBPM): las HBPM son moléculas hidrófilas, lo que implica que la dosificación estándar basada en el peso en pacientes con obesidad puede incrementar el riesgo de complicaciones hemorrágicas debido a la supradosificación. Además, es crucial destacar que la obesidad es un factor de riesgo independiente para el tromboembolismo. Se estima que el riesgo tromboembólico en pacientes obesos es el doble que en pacientes no obesos, y puede llegar a ser 6 veces mayor en aquellos con un IMC superior a 35 kg/m2.
- •
Profilaxis tromboembólica: en pacientes con un IMC mayor o igual 40 kg/m2, diversos estudios recomiendan la administración de 40 mg de enoxaparina vía subcutánea 2 veces al día, 5.000 UI de dalteparina cada 12 horas, y 75 UI/kg/24 h de tinzaparina. Para pacientes con un IMC mayor o igual a 50 kg/m2, se sugiere la administración de 60 mg de enoxaparina cada 12 horas88. Otros estudios recomiendan una dosis de 0,5 mg/kg de PT de enoxaparina al día, sin evidencia de excesiva actividad anti-Xa89.
- •
Tratamiento anticoagulante: en pacientes con IMC mayor o igual a 40 kg/m2, se recomienda utilizar el peso PT y administrar enoxaparina a una dosis de 0,7–0,8 mg/kg subcutánea cada 12 horas, con una dosis máxima de 150 mg por toma, evitando el uso de una única dosis diaria90–92. Estos datos se confirman en una revisión sistemática reciente93, la cual también recomienda ajustar la pauta de la HBPM mediante la monitorización de los niveles de anti-Xa, especialmente en el contexto de tratamiento.
Aunque existe alguna evidencia que sugiere que la dosificación de atracurio y succinilcolina debe basarse en el PT, en pacientes obesos críticos se recomienda utilizar dosis de carga pequeñas y seriadas, tituladas según el efecto clínico. Otra opción es usar una única dosis de carga basada en el PI, reconociendo que pueden ser necesarias dosis suplementarias, seguida de infusiones iniciales de mantenimiento también basadas en el PI, y una titulación posterior según el efecto clínico y la estimulación de los nervios periféricos94.
Cisatracurio: se recomienda dosificar con base en el PA. No existen datos sobre la utilización de cisatracurio en pacientes críticos obesos; sin embargo, hay un estudio en pacientes obesos que recibieron una cirugía bariátrica. En comparación con la dosificación en función del PT, la infusión de cisatracurio basada en la dosificación del PA resulta en una situación postoperatoria más favorable, un menor consumo de cisatracurio y un tiempo de recuperación más corto. A diferencia del grupo de dosificación con PA, el grupo de dosificación con PI requirió dosis de rescate durante el mantenimiento de la anestesia con más frecuencia que el grupo de PT95.
Rocuronio: se recomienda dosificar con base en el PI. Recientemente se ha publicado un estudio que compara la dosificación de rocuronio para intubación basada en el PI y el PT. Los resultados sugieren una eficacia similar en condiciones óptimas de intubación entre el PI (73,8%) y el PT (68,5%, p = 0,12 [0,8-2,5]), así como una menor duración de la parálisis cuando la dosificación se basa en el PI (43 minutos frente a 71 minutos, p < 0,001)96.
Succinilcolina: se recomienda dosificar según el PT, debido a que en la obesidad mórbida la cantidad de seudocolinesterasa está aumentada, así como el volumen de líquido extracelular. Al comparar la dosificación de 1 mg/kg según PT con 1 mg/kg según PA, se comprobó que los primeros tuvieron mejores condiciones de intubación sin mialgias posoperatorias significativas97.
SedantesLa dosificación de la sedación debe ser guiada por objetivos clínicos específicos para optimizar el manejo del paciente y minimizar riesgos. Debido al exceso de grasa y la amplia distribución de estos fármacos en pacientes obesos, se sugiere iniciar con dosis de carga inicial basadas en el PT. Además, la estrategia de utilizar pequeñas dosis de carga seriadas hasta obtener el efecto clínico deseado, especialmente en pacientes con obesidad mórbida, puede ser una alternativa para evitar un exceso de sedación. Diversos estudios sugieren que las dosis de mantenimiento de los fármacos sedantes deben basarse en el PI o el PA98.
Midazolam: se recomienda administrar la dosis de carga en base a PA y la dosis de mantenimiento según PI. Midazolam es una benzodiacepina lipofílica con un volumen de distribución (Vd) de 2 l/kg que se incrementa en sujetos obesos comparado con no obesos (2,66 ± 0,16 vs. 1,74 ± 0,11 l/kg; p < 0,001), aunque su eliminación no se vea afectada por la obesidad. Esto resulta en una vida media prolongada en pacientes obesos, por lo que se recomienda utilizar el PI o el PA para las dosis iniciales, y administrar dosis suplementarias más pequeñas según sea necesario, debido al riesgo de acumulación y concentraciones supraterapéuticas con la dosificación basada en PT. Un estudio retrospectivo evaluó la cantidad de sedación y analgesia administrada en 2 grupos de pacientes obesos críticos (dosificación por PA y PT). Los grupos solo difirieron en la cantidad de midazolam administrado; no se encontraron diferencias en otros fármacos, ni en días de ventilación mecánica, estancia en UCI o autoextubación99.
Propofol: aunque a lo largo del tiempo se han sugerido diversas pautas para el propofol, recientemente se ha recomendado su prescripción por PA debido a sus efectos adversos sobre la hemodinamia100–103.
Dexmedetomidina: se recomienda dosificar la dexmedetomidina con base en el PA. En el último año, se han publicado 2 estudios comparando el objetivo de sedación con dexmedetomidina entre los grupos de pacientes cuya dosis se basaba en el PT o el PA. Tras la administración del fármaco, no se encontraron diferencias en la escala RASS104,105.
Se adjunta una tabla suplementaria en la que se desglosan los diferentes fármacos analizados, su valor de logP, información posológica en referencia a población obesa presente en la ficha técnica (AEMPS), nuestra recomendación respecto al peso de dosificación, recomendación posológica, la necesidad de seguimiento por TDM y un campo de observaciones.
DiscusiónEn España, se estima que la prevalencia de obesidad en la población adulta es del 18,7%106. Además, un estudio indicó que el 24,5% de los pacientes en UCI son obesos107. En otros países, como Francia y el Reino Unido la prevalencia de pacientes obesos en la UCI fue del 25,8108 y del 30,5%109, respectivamente, según estudios publicados.
Los factores propios de la obesidad, como el aumento del tejido adiposo, la alteración del flujo sanguíneo y los cambios en el tamaño de los órganos, pueden contribuir a variaciones farmacocinéticas en términos de distribución, unión a proteínas plasmáticas y eliminación de los fármacos110. Además, los pacientes críticos presentan condiciones adicionales que influyen en la farmacocinética, tales como la ventilación mecánica, el uso de circuitos extracorpóreos, estados inflamatorios severos, fallo renal, cardíaco y/o hepático, medicación asociada y el elevado volumen de administración recibido111. Estas alteraciones impactan en la dosificación de medicamentos en entornos de cuidados críticos, donde una dosificación precisa es esencial para la seguridad del paciente y la eficacia terapéutica.
Es crucial comprender las características de los fármacos y su relación con los cambios farmacocinéticos en pacientes obesos críticos. Los fármacos hidrófilos, con logP bajos, negativos o cercanos a 0, se distribuyen principalmente en zonas acuosas como el líquido intersticial, plasma y músculo. En pacientes obesos, el Vd de los fármacos hidrófilos se incrementa ligeramente debido al aumento del volumen plasmático y la masa magra muscular. Por lo tanto, al calcular la dosis por peso, se debe considerar el peso PI o PA, ya que el exceso de masa grasa no influye en la distribución del fármaco. Por otro lado, los fármacos lipófilos se distribuyen mayormente en el medio intracelular y el tejido adiposo, y en pacientes obesos, donde hay una mayor presencia de tejido adiposo, se observa un aumento significativo del Vd de estos fármacos. En estos casos, es preferible dosificar los fármacos según el PT.
En este contexto, la falta de datos y estudios específicos dificulta establecer recomendaciones claras para la dosificación de fármacos en pacientes obesos críticos. Además, los documentos aprobados por las agencias reguladoras rara vez incorporan esta información, a pesar del aumento en la incidencia de obesidad. Un estudio americano112 reveló que solo el 30% de las moléculas estudiadas incluían información sobre la dosificación en obesidad en el entorno de UCI, con solo un incremento del 3% en comparación con datos de 10 años previos113. En nuestro estudio, únicamente el 16,5% de los fármacos analizados contenían información específica sobre la dosificación en población obesa en su ficha técnica.
En esta revisión, hemos recopilado las características fisicoquímicas de los fármacos más utilizados en UCI, intentando resolver las discrepancias según las fuentes de información que proporcionan consejos posológicos en situaciones de obesidad y/o pacientes críticos. Se han establecido recomendaciones de dosificación para este grupo de pacientes, resumidas en una tabla. Otras revisiones han ofrecido recomendaciones posológicas enfocadas monográficamente en distintos grupos de fármacos, como antimicrobianos6,10,22,32, profilaxis tromboembólica y medicación de soporte72, bloqueadores neuromusculares94, analgésicos y sedantes98. Sin embargo, en esta guía proporcionamos una visión general de la terapéutica más habitual en una UCI de un hospital de tercer nivel.
Nuestro artículo presenta varias limitaciones debido a la alta heterogeneidad de los estudios revisados. Algunos estudios se realizaron en población obesa no crítica, lo que impide extrapolar los resultados a pacientes en UCI. Además, los estudios no son uniformes en cuanto a la inclusión de pacientes, con algunos utilizando IMC mayor a 30 kg/m2 o IMC mayor a 40 kg/m2, mientras que otros clasifican a los pacientes por rangos de peso sin mencionar el IMC. No se ha realizado una clasificación de los estudios según su diseño y grado de evidencia. En algunos casos, la evidencia es tan escasa y ambigua que ha limitado nuestra capacidad para escoger un peso de dosificación, ofreciendo más de una opción. Otra limitación es la selección de fármacos, restringida a los utilizados en nuestra UCI.
Los retos en este contexto incluyen establecer rangos de peso para la dosificación en la población obesa, utilizar parámetros de dosificación que consideren el fenotipo y la composición corporal (como la proporción de tejido magro), y explorar ensayos clínicos que informen sobre la dosificación de fármacos en obesidad. También se necesita más conocimiento para ajustar la dosis de fármacos orales en obesidad y reducir el riesgo de infradosificación.
El incremento global en la prevalencia de la obesidad se correlaciona con un aumento en el número de pacientes obesos en unidades de cuidados críticos, lo que presenta un desafío significativo en su manejo, incluyendo el tratamiento farmacológico más eficaz y seguro. La dosificación de medicamentos en pacientes obesos, tanto en entornos críticos como no críticos, sigue siendo un área con importantes incertidumbres debido a múltiples factores, como la infrarrepresentación de pacientes obesos en ensayos clínicos y la falta de conocimiento sobre cómo las variables PK y PD se ven afectadas en este grupo. En esta revisión, proporcionamos una visión actualizada y detallada sobre la dosificación de medicamentos pertenecientes a los principales grupos terapéuticos utilizados en el tratamiento farmacológico del paciente obeso crítico. Esta información será de utilidad tanto para médicos que trabajan en unidades de cuidados críticos como para farmacéuticos clínicos en su práctica asistencial en dicho entorno.
FinanciaciónNo se ha obtenido financiación para la realización del estudio.
Presentación en congresosCongreso 66 SEFH organizado por la Sociedad Española de Farmacia Hospitalaria y que se llevó a cabo en A Coruña (online) en fecha 18–21 octubre 2021.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosAgradecemos a Jose Manuel del Río Gutierrez, Carlota Varón Galcera y Marcos Pérez por su colaboración en la revisión de fármacos para la elaboración de esta guía.
Responsabilidad y cesión de derechosTodos los autores aceptamos la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (disponible en http://www.icmje.org/).
Los autores cedemos, en el supuesto de publicación, de forma exclusiva los derechos de reproducción, distribución, traducción y comunicación pública (por cualquier medio o soporte sonoro, audiovisual o electrónico) de nuestro trabajo a Farmacia Hospitalaria y por extensión a la SEFH. Para ello se firmará una carta de cesión de derechos en el momento del envío del trabajo a través del sistema online de gestión de manuscritos.
Declaración de contribución de autoría CRediTHector Carlos García-Díaz: Writing – review & editing, Writing – original draft, Investigation, Formal analysis, Data curation, Conceptualization. Pablo Sánchez-Sancho: Writing – original draft, Formal analysis, Data curation, Conceptualization. Pilar Lalueza-Broto: Writing – review & editing, Validation, Supervision, Conceptualization. Xavier Nuvials: Validation, Supervision, Investigation, Data curation. María Queralt Gorgas-Torner: Writing – review & editing, Validation, Supervision, Data curation. Laura Doménech-Moral: Writing – review & editing, Writing – original draft, Validation, Supervision, Project administration, Investigation, Formal analysis, Data curation, Conceptualization.