el sirólimus tópico es el tratamiento farmacológico de elección para los angiofibromas faciales asociados a la enfermedad rara de la esclerosis tuberosa. En nuestro servicio de farmacia se desarrolló una nueva fórmula más avanzada y compleja: sirólimus liposomal al 0,4%, con mejores características organolépticas y un perfil de liberación del principio activo más favorable.
El objetivo de este estudio es evaluar la efectividad y la seguridad del sirólimus tópico liposomal para el tratamiento de los angiofibromas en la esclerosis tuberosa.
Métodoestudio observacional, prospectivo y multicéntrico. La efectividad se evaluó principalmente a través de la escala FASI (Facial Angiofibroma Severity Index), la escala IGA (Investigator's Global Assessment) y el cuestionario de calidad de vida en dermatología (DLQI). Para evaluar el perfil de seguridad de la formulación se reportaron las reacciones adversas y se realizaron pruebas hematológicas y niveles sanguíneos de sirólimus durante el tratamiento.
Resultadosse incluyeron 11 pacientes, de los cuales 8 (73%) obtuvieron un tratamiento exitoso según las puntuaciones FASI e IGA después de 24 semanas de tratamiento. El análisis estadístico demostró una mejora significativa (p < 0,05) en las puntuaciones FASI e IGA, el eritema y el tamaño de los angiofibromas faciales después del tratamiento con la formulación liposomal de sirólimus (FASI antes del tratamiento, mediana [rango intercuartílico]: 6,0 [2,0], FASI después del tratamiento: 3,5 [2,0], p = 0,0063). Cinco pacientes también mejoraron su calidad de vida tras el tratamiento. En cuanto al perfil de seguridad, la reacción adversa más frecuente fue prurito leve y 2 pacientes refirieron eritema, por lo que suspendieron el tratamiento prematuramente. Todas las pruebas hematológicas fueron normales y los niveles sanguíneos de sirólimus fueron indetectables en todos los casos.
Conclusionestras la optimización galénica y la evaluación clínica, el sirólimus liposomal demostró ser efectivo y seguro para esta indicación. Esta nueva formulación fue incluida como fórmula magistral en nuestro servicio de farmacia, quedando disponible para su prescripción por parte de dermatología. La elaboración de medicamentos en los servicios de farmacia hospitalaria es, en muchas ocasiones, la única alternativa farmacológica posible para tratar los síntomas de las enfermedades raras, cuando las opciones de tratamiento son limitadas o inadecuadas.
Topical rapamycin is the pharmacological treatment of choice for facial angiofibromas in rare tuberous sclerosis disease. A new, more advanced, and complex formula was developed in our pharmacy service: rapamycin 0.4% liposomal formulation, with better organoleptic characteristics and a more favorable release profile of the active ingredient.
The purpose of this study is to evaluate the effectiveness and safety of liposomal topical rapamycin for the treatment of facial injuries in this rare disease.
MethodThis was an observational, prospective, and multicenter study. Effectiveness was evaluated mainly through Facial Angiofibroma Severity Index (FASI), Investigator's Global Assessment (IGA) scores and Dermatology Life Quality Index (DLQI) questionnaire. To assess the safety profile of rapamycin, adverse reactions were reported, and blood tests and blood rapamycin levels were performed during treatment.
ResultsEleven patients were included, of which 8/11 (73%) patients obtained successful treatment according to FASI and IGA scores after 24 weeks of treatment. Statistical analysis demonstrated a significant improvement (p < 0.05) in FASI and IGA scores, erythema, and FA size after treatment with rapamycin liposomal formulation (FASI before treatment, median [interquartile range]: 6.0 [2.0], FASI after treatment: 3.5 [2.0], p = 0.0063). Five patients also improved their quality of life after treatment. Regarding safety profile of rapamycin, the most common adverse reaction was mild pruritus and two patients reported erythema, who discontinued treatment prematurely. All hematological tests were normal, and blood rapamycin levels were undetectable.
ConclusionsAfter galenic improvements and clinical evaluations, the rapamycin liposomal formulation proved to be effective and safe for this therapeutic indication. This new formulation was included as a magistral formula in our hospital pharmacy service, now accessible for prescribing by dermatologists. Drug development in hospital pharmacy is often the only pharmacological alternative available to treat the symptoms of rare diseases, when treatment options are limited or inadequate.
La esclerosis tuberosa (ET) es una enfermedad rara, autosómica dominante, con una incidencia que oscila entre 1 de cada 6.000–10.000 individuos1 y que produce una serie de mutaciones en los genes supresores de tumores (TSC1 y TSC2). Esto conduce a la desregulación de la vía mTOR y a una proliferación celular descontrolada, que se traduce en la formación multisistémica de tumores benignos denominados hamartomas2. Estas tumoraciones pueden tener diferente gravedad y localización, si bien los riñones son una de las zonas más frecuentes. Además, los hamartomas pueden verse afectados por traumatismos leves que pueden llegar a provocar hemorragias incontroladas3.
Los angiofibromas faciales (AF) son la manifestación cutánea más frecuente de la ET. Constituyen un criterio diagnóstico fundamental de la enfermedad, ya que están presentes hasta en el 80% de los pacientes. Los AF aparecen a edades tempranas y tienden a estabilizarse en número y tamaño en la adolescencia, por lo que en ocasiones representan un problema estético y psicológico muy acusado para estos pacientes4,5.
Se han establecido múltiples tratamientos para esta afección cutánea. Los tratamientos físicos como la radiofrecuencia, la electrocoagulación, la crioterapia, la dermoabrasión y la terapia láser presentan problemas por su naturaleza invasiva y dolorosa y, además, requieren anestesia6,7. El interés por los inhibidores de mTOR en los AF se centra en el tratamiento farmacológico con everólimus y sirólimus, y publicaciones recientes sitúan al sirólimus tópico como la alternativa más adecuada para dicha afección. Esta molécula es un potente inhibidor de mTOR con características inmunosupresoras, antitumorales y antiangiogénicas8.
Existen numerosos estudios que respaldan la eficacia y seguridad de esta farmacoterapia, entre ellos series de casos y ensayos clínicos con un nivel de evidencia alto9–13. No obstante, la literatura disponible revela una variabilidad significativa en cuanto a las concentraciones, dosis y formulaciones utilizadas.
En nuestro servicio de farmacia hospitalaria, decidimos optimizar la formulación utilizada por los dermatólogos en su práctica clínica habitual: sirólimus al 0,4% en vaselina. El resultado de la investigación y desarrollo galénicos fue una fórmula más avanzada y compleja: una formulación liposomal de sirólimus al 0,4%3,14 preparada en una cabina de seguridad biológica. La composición exacta de la formulación liposomal fue sirólimus al 0,4%; 30% de Transcutol®, 25% de solución liposomal (Guinoxome®), colesterol al 0,1%, 10% de miristato de isopropilo, 10% de propilenglicol, carbopol al 2%, NaOH al 10% c.s.p. pH 7,5 y agua para inyección c.s.p. 20 g. En el ámbito cosmético y farmacéutico existen soluciones lipídicas comerciales, o previamente preparadas, que forman liposomas al incorporar la solución acuosa. Es el caso de la solución liposomal Guinoxome®, que permite la formación de liposomas de alta calidad de una forma sencilla. Los demás componentes de la formulación sirven como humectantes y estabilizantes, y merece especial atención el transcutol. Este disolvente funciona como un excelente promotor de la absorción mostrando el sirólimus una elevada solubilidad en este vehículo en comparación con la parafina líquida15. Los liposomas obtenidos fueron más ligeros, con una extensibilidad mejorada y, por sus características, compatibles con todotipo de pieles16. Además, estudios previos han notificado que las vesículas liposomales logran una liberación del principio activo más rápida que otras formulaciones, como los geles17. Esta nueva formulación liposomal se validó de acuerdo a su estabilidad química, física y microbiológica, con una eficiencia de encapsulación del sirólimus del 89%18. El periodo de validez fue de 3 meses a 3–8 °C19.
La administración de sirólimus tópico liposomal según práctica clínica habitual puede mejorar el aspecto de los AF, demostrando la efectividad y la seguridad del fármaco encapsulado en los sistemas liposomales.
El objetivo de este estudio es evaluar la efectividad y la seguridad del sirólimus tópico liposomal para el tratamiento de los AF en la enfermedad rara de la ET.
MétodoDiseño y desarrollo del estudioEstudio observacional, prospectivo, longitudinal y multicéntrico. El periodo de estudio durante el cual se seleccionaron pacientes fue entre diciembre de 2021 y octubre de 2023. Los centros participantes fueron el Hospital Universitario Doctor Peset y el Hospital Clínico Universitario de Valencia, España. Los servicios clínicos involucrados fueron el Servicio de Farmacia del Hospital Universitario Doctor Peset y los servicios de dermatología de ambos hospitales.
DescripciónEl estudio se dividió en 3 fases bien diferenciadas: selección, tratamiento y seguimiento. El Anexo 1 muestra de forma detallada las evaluaciones y los procedimientos realizados en cada fase.
Fase de selecciónSe evaluó la idoneidad de los participantes para su inclusión en el estudio. Se obtuvo el consentimiento informado y se recogieron los datos demográficos, la historia clínica y la medicación concomitante de los pacientes.
Fase de tratamientoLa fase de tratamiento consistió en una visita clínica al inicio del estudio (V0) y 3 visitas clínicas posteriores tras 2, 12 y 24 semanas de tratamiento con la formulación liposomal de sirólimus (P1, V2 y V3). Se instruyó a los pacientes sobre cómo administrar la formulación: aplicar 3 veces por semana por la tarde, utilizando un guante de nitrilo. La cantidad de formulación necesaria para crear una capa confluente fina sobre la piel fue de 6 mg/cm2 y se basó en el tamaño de la zona afectada. La textura tipo gel permite una excelente aplicación y absorción en las afecciones cutáneas de las mejillas, la nariz y la barbilla. Transcurridas 2 o 3 h de exposición, los pacientes retiraron completamente la formulación mediante un lavado de la zona con agua y jabón neutro. Se recomendó mantener la zona bien hidratada, evitar la exposición al sol y utilizar cremas de protección solar con FPS 50. Los pacientes que interrumpieron el tratamiento prematuramente realizaron una visita (Vx) en la que se evaluó la efectividad y la seguridad (eventos adversos).
SeguimientoSe realizó una visita de seguimiento (P4) 4 semanas después de la visita V3 o Vx.
Criterios de inclusión- •
Pacientes varones y mujeres con edades comprendidas entre 10 y 65 años en el momento en que se obtuvo el consentimiento informado.
- •
Pacientes diagnosticados con ET que presentaran lesiones cutáneas visibles compatibles con AF.
- •
Una puntuación en la escala FASI20 de al menos 3 y no superior a 8 (Anexo 2).
- •
Una puntuación en la escala IGA13 de al menos 2 y no superior a 4 (Anexo 2).
- •
Pacientes que hayan estado en tratamiento con algún inhibidor de mTOR en los 3 meses previos a la selección por cualquier vía de administración.
- •
Pacientes que hayan recibido terapia láser o quirúrgica en los 6 meses previos a la selección.
- •
Pacientes con lesiones cutáneas graves como erosiones o úlceras.
- •
Pacientes con hipersensibilidad conocida a cualquier componente o excipiente.
- •
Pacientes con disfunción inmune o que recibieran cualquier terapia inmunosupresora.
- •
Mujeres embarazadas o en periodo de lactancia.
Para evitar posibles interferencias con la evaluación de la efectividad y la seguridad, el uso de los siguientes medicamentos estuvieron prohibidos durante el estudio: láser y tratamiento quirúrgico en la zona de tratamiento, aplicación de esteroides u otros agentes inmunosupresores en la zona designada, administración de inhibidores de mTOR (sirólimus, everólimus, temsirólimus, etc.) por cualquier vía de administración y uso de inhibidores potentes de CYP3A4 o de Gp-P (como ketoconazol, voriconazol, itraconazol, eritromicina, telitromicina o claritromicina) o inductores potentes de CYP3A4 y Gp-P (como rifampicina) por cualquier vía de administración.
Evaluación de la efectividadEvaluación objetiva del investigador (EOI)Criterios de valoración primarios- •
Porcentaje de pacientes con éxito de tratamiento, establecido como una reducción de 2 puntos o más en la escala FASI después del tratamiento.
- •
Porcentaje de pacientes con éxito de tratamiento, establecido como una reducción de 1 punto o más en la escala IGA después del tratamiento.
- •
Mediana de los valores de la escala FASI y de sus subcategorías (eritema, tamaño y extensión), antes y después del tratamiento.
- •
Mediana de la escala IGA antes y después del tratamiento.
- •
Porcentaje de pacientes con éxito de tratamiento, establecido como una reducción de 2 puntos o más en la escala FASI tras 12 semanas de tratamiento.
- •
Porcentaje de pacientes con éxito de tratamiento, establecido como una reducción de 1 punto o más en la escala IGA después de 12 semanas de tratamiento.
- •
Tiempo hasta lograr el éxito de tratamiento (semanas de tratamiento) según las puntuaciones de las escalas FASI e IGA.
- •
Escala de mejora subjetiva (EMS): mejora mínima, moderada, buena o excelente según las fotografías de los AF después del tratamiento.
- •
EMS: mejora mínima, moderada, buena o excelente según las fotografías de los AF tras 12 semanas de tratamiento.
- •
Porcentaje de pacientes con una mejora en la calidad de vida, establecido por la reducción en la puntuación de índice de calidad de vida en dermatología (DLQI, por sus siglas en inglés) después del tratamiento (Anexo 3).
- •
Mediana de los valores del cuestionario DLQI antes y después del tratamiento.
- •
Porcentaje de pacientes con una mejora en la calidad de vida establecida como una reducción en la puntuación DLQI tras 12 semanas de tratamiento.
Notificación de reacciones adversas durante las visitas P1, V2, V3 y P4.
HematologíaAnálisis de sangre con hemograma completo mediante citometría de flujo (recuento de leucocitos, eritrocitos y plaquetas) durante las visitas V0, V2 y V3. (Sysmex®, Roche Diagnostics S.L.).
FarmacocinéticaConcentración de sirólimus en sangre en las visitas V2 y V3. Se utilizó un inmunoanálisis quimioluminiscente de micropartículas (CMIA) para la determinación cuantitativa de sirólimus en sangre humana completa (Abbott Architect®, Abbott Park, IL, EE. UU.). Antes de iniciar la secuencia Architect automatizada, se realizó un paso de pretratamiento manual. Este consistió en extraer la muestra de sangre completa (150 μl) con un reactivo de precipitación (300 μl), seguido de calentamiento (10 min a 42 °C) y centrifugación (5 min a 10.900 rpm). Posteriormente, se decantó el sobrenadante en un tubo de pretratamiento de trasplante, que se introdujo en el sistema Architect para su posterior procesamiento. El límite de detección del análisis Architect para sirólimus es de 0,3 ng/ml.
Métodos estadísticosSe realizó un análisis descriptivo estándar de todas las variables incluidas; las variables continuas se expresaron como media y desviación estándar, y las variables cualitativas como frecuencias absolutas, porcentajes y proporciones. El análisis estadístico se realizó mediante el enfoque AIT (análisis por intención de tratar). Se incluyó en el análisis a todos los participantes del estudio, independientemente de su cumplimiento terapéutico o de la desviación del protocolo. Para evaluar la normalidad de los datos, se empleó la prueba de Shapiro–Wilk, adecuada para muestras pequeñas (n < 30). Debido a una distribución no normal de las variables, se aplicó una transformación logarítmica, pero no resultó del todo eficaz para normalizar los datos. Posteriormente, se realizaron pruebas no paramétricas, concretamente la prueba de Wilcoxon para muestras pareadas, con las variables expresadas como medianas y rangos intercuartílicos (IQR). Las desviaciones se consideraron estadísticamente significativas cuando p < 0,05. Para el procesamiento de los datos estadísticos se utilizó el aplicativo Stata® 13.1.
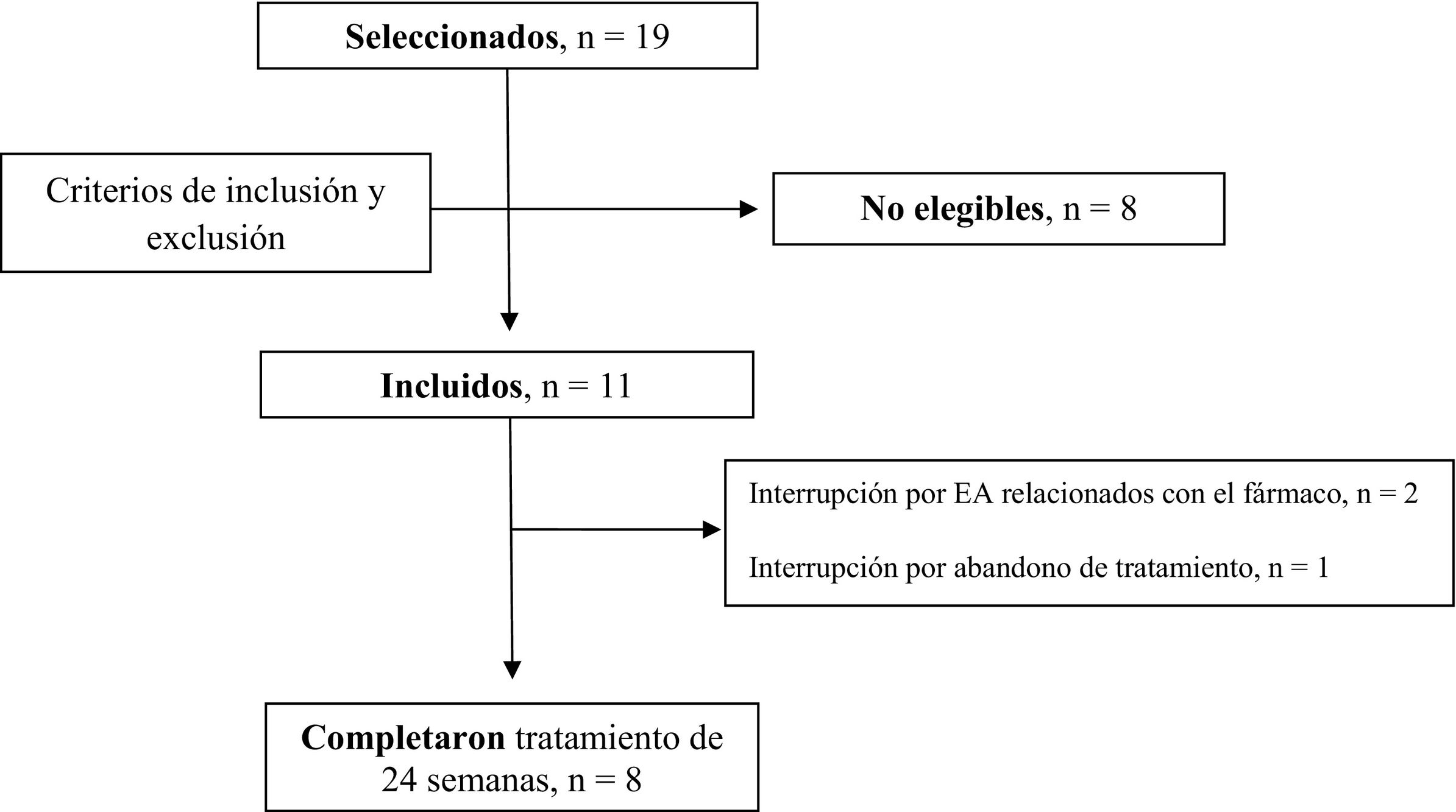
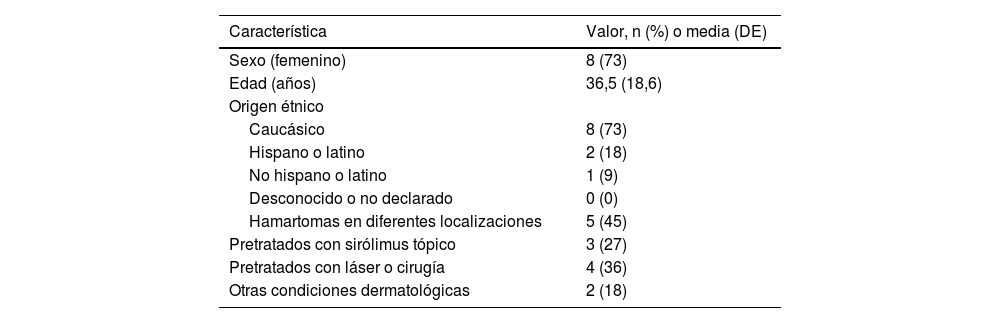
ResultadosOnce pacientes fueron seleccionados. Tras la exclusión de 8 pacientes no elegibles, se incluyeron 11 pacientes (fig. 1), de los cuales 8 eran mujeres. La mediana de edad fue de 36 años (11–64) en el momento de la selección. La mayoría de los pacientes eran de etnia caucásica, predominante en España. Cinco pacientes presentaban hamartomas en diferentes localizaciones, como los riñones o los pulmones. Tres pacientes habían recibido tratamiento previo con sirólimus tópico, mientras que 4 habían recibido previamente tratamiento con láser o cirugía. No obstante, en todo momento, los pacientes cumplieron todos los criterios de inclusión/exclusión. Además, 2 pacientes presentaban como afección dermatológica piel atópica (tabla 1). Las puntuaciones basales FASI e IGA pueden consultarse en la tabla 2.
Características de los pacientes al inicio del tratamiento (n = 11)
| Característica | Valor, n (%) o media (DE) |
|---|---|
| Sexo (femenino) | 8 (73) |
| Edad (años) | 36,5 (18,6) |
| Origen étnico | |
| Caucásico | 8 (73) |
| Hispano o latino | 2 (18) |
| No hispano o latino | 1 (9) |
| Desconocido o no declarado | 0 (0) |
| Hamartomas en diferentes localizaciones | 5 (45) |
| Pretratados con sirólimus tópico | 3 (27) |
| Pretratados con láser o cirugía | 4 (36) |
| Otras condiciones dermatológicas | 2 (18) |
DE: desviación estándar.
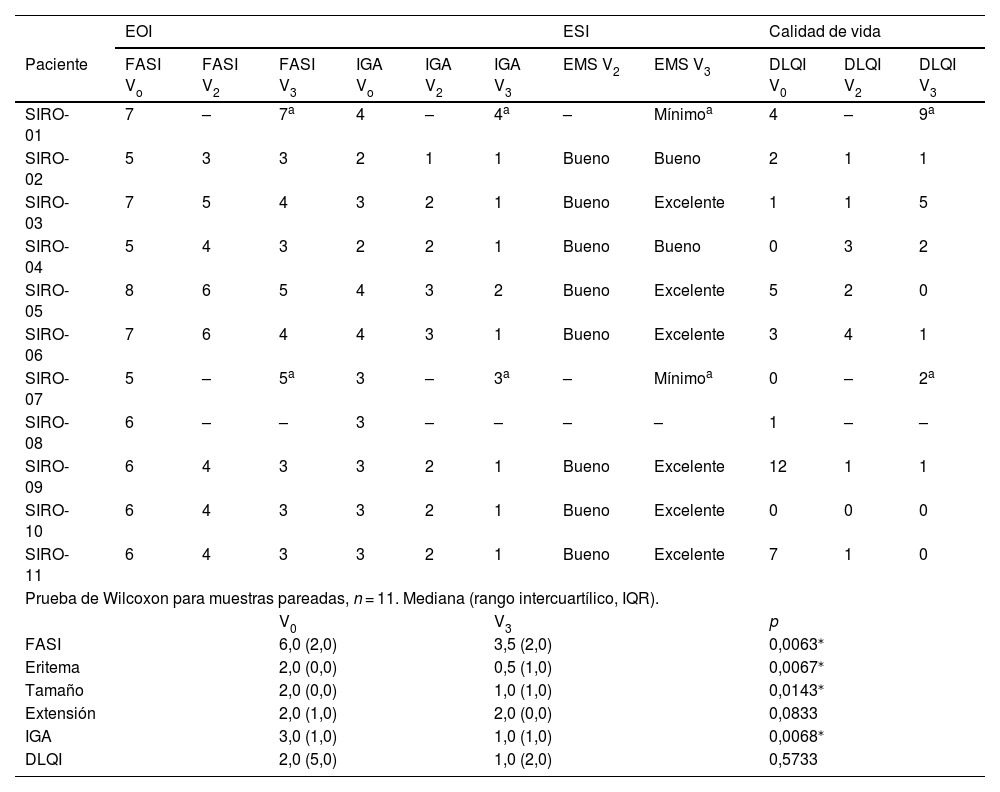
Evaluación de la eficacia
| EOI | ESI | Calidad de vida | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Paciente | FASI Vo | FASI V2 | FASI V3 | IGA Vo | IGA V2 | IGA V3 | EMS V2 | EMS V3 | DLQI V0 | DLQI V2 | DLQI V3 |
| SIRO-01 | 7 | – | 7a | 4 | – | 4a | – | Mínimoa | 4 | – | 9a |
| SIRO-02 | 5 | 3 | 3 | 2 | 1 | 1 | Bueno | Bueno | 2 | 1 | 1 |
| SIRO-03 | 7 | 5 | 4 | 3 | 2 | 1 | Bueno | Excelente | 1 | 1 | 5 |
| SIRO-04 | 5 | 4 | 3 | 2 | 2 | 1 | Bueno | Bueno | 0 | 3 | 2 |
| SIRO-05 | 8 | 6 | 5 | 4 | 3 | 2 | Bueno | Excelente | 5 | 2 | 0 |
| SIRO-06 | 7 | 6 | 4 | 4 | 3 | 1 | Bueno | Excelente | 3 | 4 | 1 |
| SIRO-07 | 5 | – | 5a | 3 | – | 3a | – | Mínimoa | 0 | – | 2a |
| SIRO-08 | 6 | – | – | 3 | – | – | – | – | 1 | – | – |
| SIRO-09 | 6 | 4 | 3 | 3 | 2 | 1 | Bueno | Excelente | 12 | 1 | 1 |
| SIRO-10 | 6 | 4 | 3 | 3 | 2 | 1 | Bueno | Excelente | 0 | 0 | 0 |
| SIRO-11 | 6 | 4 | 3 | 3 | 2 | 1 | Bueno | Excelente | 7 | 1 | 0 |
| Prueba de Wilcoxon para muestras pareadas, n = 11. Mediana (rango intercuartílico, IQR). | |||||||||||
| V0 | V3 | p | |||||||||
| FASI | 6,0 (2,0) | 3,5 (2,0) | 0,0063⁎ | ||||||||
| Eritema | 2,0 (0,0) | 0,5 (1,0) | 0,0067⁎ | ||||||||
| Tamaño | 2,0 (0,0) | 1,0 (1,0) | 0,0143⁎ | ||||||||
| Extensión | 2,0 (1,0) | 2,0 (0,0) | 0,0833 | ||||||||
| IGA | 3,0 (1,0) | 1,0 (1,0) | 0,0068⁎ | ||||||||
| DLQI | 2,0 (5,0) | 1,0 (2,0) | 0,5733 | ||||||||
DLQI: índice de calidad de vida en dermatología; EOI: evaluación objetiva del investigador; FASI: Facial Angiofibroma Severity Index; IGA: evaluación global del investigador; ESI: evaluación subjetiva del investigador; EMS: Escala de mejora subjetiva.
Ocho pacientes finalizaron las 24 semanas de tratamiento y 3 no lo hicieron, 2 debido a EA relacionados con el tratamiento (paciente 01 y paciente 07) y uno debido al abandono del tratamiento (paciente 08). En consecuencia, se evaluó la eficacia y la seguridad en todos los pacientes excepto del paciente 08.
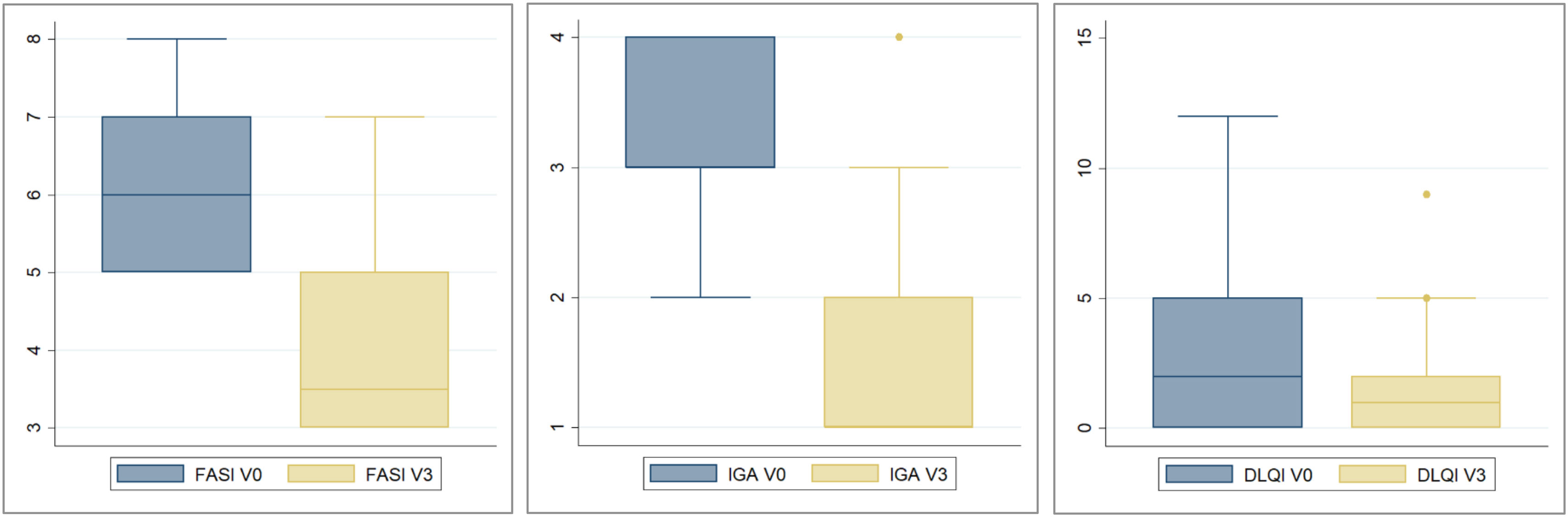
Evaluación de la efectividadEvaluación objetiva del investigador (EOI)Ocho de 11 (73%) pacientes obtuvieron un tratamiento exitoso de acuerdo con las puntuaciones FASI e IGA tras 24 semanas de tratamiento (tabla 2). Todos los pacientes lograron que las puntuaciones FASI e IGA se redujesen o mantuviesen después del tratamiento. La evaluación final de la efectividad para los pacientes 01 y 07 tuvo lugar en la visita Vx (antes de la semana 24 de tratamiento). La tabla 2 muestra los valores de la mediana y el IQR para la puntuación FASI y sus subcategorías de eritema, tamaño y extensión, así como para la puntuación IGA antes y después del tratamiento. La figura 2 corresponde a los diagramas BoxPlot que muestran la distribución de las puntuaciones FASI e IGA antes y después del tratamiento. La línea central representa la mediana, la caja corresponde al IQR y los valores atípicos se representan como puntos de datos individuales.
Tras 12 semanas de tratamiento, 6 de 11 pacientes (55%) lograron un tratamiento satisfactorio, según la escala FASI. Por otra parte, según la escala IGA, el éxito del tratamiento se observó en 7 pacientes (64%) (tabla 2).
El tiempo transcurrido hasta el éxito del tratamiento, medido en semanas de tratamiento según la escala FASI, fue de 12 semanas en 6 pacientes y de 24 semanas en 2 pacientes. Asimismo, según la escala IGA, el éxito del tratamiento se produjo a las 12 semanas en 7 pacientes y a las 24 semanas en un paciente (tabla 2).
Evaluación subjetiva del investigador (ESI)La EMS de los AF tras el tratamiento fue mínima en 2 de 11 (18%) pacientes, buena en otros 2 pacientes y excelente en 6 de 11 (55%) pacientes (tabla 2).
La EMS de los AF tras 12 semanas de tratamiento fue buena en 8 de 11 (73%) pacientes (tabla 2). En el Anexo 4 se muestran fotografías representativas de 2 pacientes, con una EMS excelente tras el tratamiento.
Calidad de vidaCinco de 11 (45%) pacientes mejoraron su calidad de vida objetivada por una disminución de la puntuación en el cuestionario DLQI después del tratamiento.
La tabla 2 muestra los valores de la mediana y el IQR para el cuestionario DLQI, antes y después del tratamiento. La figura 2 corresponde al diagrama BoxPlot que muestra la distribución de las puntuaciones del DLQI antes y después del tratamiento.
Cuatro de 11 (36%) pacientes mejoraron su calidad de vida, documentada por una disminución de la puntuación en el cuestionario DLQI tras 12 semanas de tratamiento.
Evaluación de la seguridadEventos adversos (EA)No se notificaron eventos adversos graves durante el tratamiento ni durante el período de seguimiento. Cinco de 11 (45%) pacientes notificaron algún acontecimiento adverso durante la fase de tratamiento. La reacción adversa más frecuente fue prurito leve (5 de 11, 45%) en la zona de administración, que en todos los casos cesó tras 5–10 min de exposición a la formulación. Dos de 11 (18%) pacientes comunicaron sequedad cutánea y otros 2 pacientes reportaron sensación de tirantez. Cabe destacar que 2 pacientes notificaron eritema, lo que llevó a la interrupción prematura del tratamiento antes de V2. Todas las reacciones adversas desaparecieron al interrumpir el tratamiento, como se confirmó en la visita P4.
HematologíaEn todos los pacientes, las pruebas hematológicas fueron normales. No hubo cambios significativos en los recuentos de glóbulos blancos, glóbulos rojos o plaquetas. Todos los valores analíticos estuvieron dentro del intervalo normal.
FarmacocinéticaLas concentraciones sanguíneas de sirólimus fueron indetectables en todos los pacientes, con valores por debajo del límite de detección de la técnica (menor de 0,3 ng/ml).
DiscusiónTodos los pacientes que completaron las 24 semanas de tratamiento lograron un tratamiento exitoso según las escalas FASI e IGA (8 de 11, 73%). La escala FASI es una herramienta sencilla, reproducible y validada para evaluar la severidad de los AF y la respuesta al tratamiento farmacológico. Como se ha demostrado, esta escala proporciona una evaluación más objetiva del eritema, el tamaño y la extensión de los AF20. El análisis estadístico demostró una diferencia significativa (p < 0,05) entre la puntuación FASI, el eritema, el tamaño y la puntuación IGA antes y después del tratamiento con la formulación liposomal. Las pruebas no paramétricas no mostraron diferencias significativas para la subcategoría de extensión de los AF (tabla 2).
Según la evaluación subjetiva, el aspecto de los AF en los pacientes que completaron las 24 semanas de tratamiento mejoró considerablemente. Así, 6 de 11 (55%) pacientes obtuvieron una excelente mejoría de las lesiones. Como puede observarse en el Anexo 4, el eritema, el tamaño y la extensión de los AF disminuyó en ambos pacientes, con un aplanamiento considerable de las lesiones.
La satisfacción de los pacientes también representó un aspecto relevante en nuestro estudio, con una mejoría de la calidad de vida en 5 de 11 (45%) pacientes tras el tratamiento. No obstante, no se observaron diferencias significativas respecto a las puntuaciones DLQI en las pruebas no paramétricas (tabla 2). Los AF aparecen entre los 2 y 5 años de edad y crecen en número y tamaño hasta estabilizarse en la adolescencia21. El impacto visual de las lesiones faciales supone un problema de autoimagen4,5, especialmente en pacientes jóvenes y, en ocasiones, no se prioriza el tratamiento dermatológico por existir otras complicaciones más graves asociadas a esta enfermedad rara. Se ha observado que existe un mayor componente angiogénico en edades muy tempranas, mientras que en los pacientes de edad avanzada tienden a predominar las lesiones fibromatosas. Los criterios de exclusión relacionados con la edad se basan en estas observaciones y coinciden con los criterios establecidos por otros estudios clínicos similares, incluidos ensayos clínicos aleatorizados.
En general, la nueva formulación fue bien tolerada y se notificaron acontecimientos adversos leves que se resolvieron al finalizar el tratamiento. Dos pacientes experimentaron eritema moderado, lo que motivó la interrupción prematura del tratamiento. Cabe destacar que ambos pacientes tenían antecedentes de piel atópica. Las pruebas hematológicas y farmacocinéticas confirmaron la ausencia de absorción sistémica de sirólimus con la administración tópica, lo que refuerza aún más el perfil de seguridad del fármaco.
Debido a la gran variabilidad en la evaluación de la eficacia, resulta difícil comparar nuestros resultados con otros estudios publicados. Los métodos de evaluación comprenden desde escalas validadas a las opiniones subjetivas de los investigadores. De los 5 ensayos clínicos aleatorizados identificados en la literatura, solo 2 de ellos evalúan la eficacia mediante escalas objetivas estandarizadas12,13. Todos los pacientes tratados con sirólimus mostraron una mejoría significativa según las escalas FASI e IGA en comparación con placebo. En nuestro estudio, todos los pacientes que completaron el periodo de tratamiento de 24 semanas obtuvieron resultados de efectividad favorables y estas experiencias coinciden con los hallazgos de estudios publicados anteriormente. Las reacciones adversas fueron coherentes con la bibliografía, sin que se notificaran acontecimientos adversos graves.
Para asegurar la efectividad y la seguridad, sería aconsejable realizar un seguimiento del tratamiento con sirólimus liposomal a más largo plazo. Sin embargo, debe considerarse que los pacientes no reciben el tratamiento de manera continua, sino que descansan durante la época estival para minimizar o prevenir los EA derivados de la fototoxicidad del sirólimus.
En cualquier caso, los liposomas aportan varios beneficios que permiten una mejora sustancial en el tratamiento de los AF. Esta innovadora fórmula presenta mejores características organolépticas, de aspecto y extensibilidad. Además, la sensación tras su aplicación es más agradable en comparación con formulaciones elaboradas con vaselina16,18. Asimismo, se puede retirar con más facilidad con agua y jabón neutro que otras formulaciones debido a su naturaleza ligera, evitando así que se irrite la piel facial del paciente durante el proceso de lavado. Todas estas ventajas contribuyen a mejorar el cumplimiento terapéutico y la satisfacción del paciente con el tratamiento tópico.
Por otra parte, se ha demostrado que los liposomas sirven como portadores de moléculas en tratamientos quimioterapéuticos e inmunosupresores22,23. En concreto, el sirólimus encapsulado en liposomas puede llegar más rápidamente al lugar de acción y presenta un perfil de liberación mejorado, lo que proporciona una mayor biodisponibilidad e incrementa la penetración del principio activo a través del estrato córneo17. Estos aspectos subrayan la importancia de centrarse en la optimización de las formulaciones y la incorporación de nuevos sistemas de liberación de fármacos para la preparación de medicamentos en los servicios de farmacia hospitalaria. Nuestro trabajo es un ejemplo de este enfoque. Cuando las opciones de tratamiento son limitadas o inadecuadas, el desarrollo de fármacos y la optimización galénica en los servicios de farmacia hospitalaria es, en muchas ocasiones, la única alternativa disponible para tratar los síntomas de las enfermedades raras.
En dichas enfermedades, los servicios de farmacia desempeñan una función clave durante el proceso farmacoterapéutico. En colaboración con los dermatólogos, los farmacéuticos hospitalarios pueden realizar un seguimiento clínico de pacientes, lo que contribuye a mejorar la efectividad y minimizar las posibles reacciones adversas3. La atención farmacéutica tiene una relevancia especial en los procesos de formulación, dispensación, administración y seguimiento con una mayor supervisión de estos pacientes y una integración más efectiva de los farmacéuticos hospitalarios en los equipos multidisciplinares.
Tras las mejoras galénicas y las evaluaciones clínicas realizadas, el sirólimus tópico liposomal demostró ser efectivo y seguro para el tratamiento de los AF en la ET. Esta formulación innovadora se incluyó como fórmula magistral en el Servicio de Farmacia del Hospital Universitario Doctor Peset, quedando disponible para su prescripción por parte de los especialistas en dermatología.
El número limitado de participantes en este estudio observacional podría afectar a la fiabilidad y aplicabilidad de los resultados. No se calculó el tamaño muestral inicial por tratarse de una enfermedad rara, y la selección de pacientes se realizó mediante muestreo casual o accidental, a medida que se producían los casos y eran remitidos por los dermatólogos. La metodología empleada y las pruebas estadísticas aplicadas han tenido en cuenta el tamaño muestral (n < 30). Sin embargo, debemos considerar que la ET es una enfermedad rara que afecta a una minoría de la población (menos de 1 de cada 2.000 personas) y, por tanto, la inclusión de pacientes es una tarea más ardua y difícil.
Contribución a la literatura- •
Este estudio observacional demuestra la efectividad y la seguridad de una nueva formulación liposomal de sirólimus para el tratamiento de angiofibromas faciales en la enfermedad rara de la esclerosis tuberosa.
- •
La fórmula innovadora aporta un beneficio sustancial para los pacientes. Sus características organolépticas contribuyen a mejorar el cumplimiento terapéutico y la satisfacción de los pacientes con la aplicación tópica de sirólimus.
- •
El sirólimus encapsulado en liposomas es capaz de llegar más rápidamente al lugar de acción con un perfil de liberación mejorado y una mayor penetración del principio activo a través del estrato córneo.
- •
Esta investigación aporta nuevos datos clínicos que apoyan las decisiones terapéuticas de otros autores, farmacéuticos y dermatólogos.
Este estudio fue evaluado y aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario Doctor Peset (Número de registro: 16.102 el 6 de mayo de 2021, en Valencia, España).
Todas las pruebas y procedimientos del estudio se realizaron de acuerdo con la Declaración de Helsinki para la investigación médica en seres humanos, incluida la investigación sobre datos humanos identificables (Helsinki, 1964).
FinanciaciónLos autores declaran que no han recibido fondos, subvenciones ni otras ayudas durante la preparación de este manuscrito.
Conflicto de interesesLos autores no tienen intereses financieros o no financieros relevantes que declarar.
AgradecimientosEste estudio ha sido posible gracias a la colaboración e implicación de los siguientes servicios clínicos de Valencia, España: el Servicio de Farmacia del Hospital Universitario Doctor Peset, el Servicio de Dermatología del Hospital Universitario Doctor Peset y el Servicio de Dermatología del Hospital Clínico Universitario.
Asimismo, las autoras desean expresar su especial agradecimiento a todos los pacientes que participaron en el estudio.
Declaración de contribución de autoría CRediTClara Cortell-Fuster: Writing – review & editing, Writing – original draft, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. María Amparo Martínez-Gómez: Validation, Supervision, Investigation. Ana Cristina Cercós-Lleti: Validation, Supervision, Methodology, Conceptualization. Mónica Climente-Martí: Validation, Supervision, Resources, Methodology, Conceptualization. Tania Díaz-Corpas: Validation, Supervision, Resources, Investigation. Almudena Mateu-Puchades: Validation, Supervision, Resources, Methodology, Investigation, Conceptualization. Ángeles Revert-Fernández: Validation, Supervision, Resources, Investigation.