adalimumab biosimilar MSB11022 (Idacio®) ha sido aprobado para las mismas indicaciones que el fármaco original (Humira®), basado en los resultados de los ensayos clínicos en psoriasis en placas. Los resultados de eficacia y seguridad en la enfermedad inflamatoria intestinal son escasos.
Material y métodosse realizó un estudio observacional retrospectivo incluyendo 44 pacientes con enfermedad inflamatoria intestinal: 30 fueron tratados con adalimumab original, 5 pacientes empezaron directamente con MSB11022 y 9 se cambiaron del adalimumab original al biosimilar. Para la evaluación de la eficacia del uso de adalimumab en la enfermedad inflamatoria intestinal se han empleado tanto marcadores de laboratorio (calprotectina fecal y proteína C reactiva) como escalas que miden la actividad de la enfermedad inflamatoria intestinal, empleando escalas específicas (Harvey-Bradshaw Index [HBI] para enfermedad de Crohn y Mayo Score para colitis ulcerosa). La eficacia se evaluó registrando los efectos adversos que se pudiesen presentar la administración de adalimumab (original o biosimilar). El éxito del cambio se determinó comparando diferencias relevantes en criterios de eficacia y seguridad. Así mismo, se analizó la medicación concomitante y la necesidad de intensificaciones de dosis. El objetivo del presente estudio fue evaluar la efectividad y seguridad del biosimilar de adalimumab en pacientes naive y en pacientes que había realizado el cambio desde el adalimumab original.
Resultadosno se detectaron diferencias significativas en los criterios de progresión clínica (p = 0,317) o en los parámetros bioquímicos (calprotectina fecal [p = 0,445] y proteína C reactiva [p = 0,661]) después de realizar el cambio del adalimumab original al MSB11022. Se apreció una reducción no significativa en el uso de corticoides y tiopurinas (p = 0,157). Durante el periodo de estudio, no se registraron visitas al servicio de urgencias ni hospitalizaciones de los pacientes analizados, ningún paciente presento ningún efecto adverso grave.
Conclusionesno se presentaron diferencias entre los grupos que recibieron adalimumab original y los que empezaron con el biosimilar, tampoco se apreciaron diferencias entre los que recibieron adalimumab original y los que realizaron el cambio al biosimilar y en el análisis pre- y pos- de los pacientes que cambiaron a adalimumab biosimilar, se registraron 2 pacientes que presentaron efectos adversos después del cambio.
El biosimilar ha demostrado un perfil favorable (solo un paciente presentó un exantema cutáneo que implicó la interrupción de su tratamiento) no apreciándose cambios en los parámetros clínicos o biológicos tras cambiar de adalimumab original a adalimumab biosimilar.
Adalimumab biosimilar MSB11022 (Idacio®) has been approved for the same indications as its originator (Humira®), based on findings from clinical trials in plaque psoriasis. Data on its efficacy and safety in inflammatory bowel disease, however, are scarce.
MethodsRetrospective, observational study of 44 patients with inflammatory bowel disease: 30 were treated with originator adalimumab, five were directly started on MSB11022, and nine switched from originator to biosimilar adalimumab. To evaluate the effectiveness of the use of adalimumab in inflammatory bowel disease, both laboratory markers (fecal calprotectin and C-reactive protein) and scales that measure the activity of inflammatory bowel disease using specific scales (Harvey-Bradshaw Index [HBI] have been used for Crohn's disease and Mayo Score for ulcerative colitis). Efficacy was evaluated by recording the adverse effects that could occur with the administration of adalimumab (original or biosimilar). The success of the switch was determined by analyzing meaningful differences in effectiveness and safety criteria. Concomitant therapy and the need for dose intensification were also analyzed. Objective of this study was to assess the effectiveness and safety of biosimilar adalimumab in adalimumab-naïve patients and patients switched from originator adalimumab.
ResultsNo significant differences were observed in clinical disease activity (p = 0.317) or biochemical parameters (fecal calprotectin [p = 0.445] and C-reactive protein [p = 0.661]) after the switch from the originator adalimumab to MSB11022. There was not a significant reduction in the concomitant use of corticosteroids and thiopurines (p = 0.157). No emergency room visits or hospitalizations were observed during the study period and none of the patients experienced serious adverse effects.
ConclusionsBetween originator adalimumab and biosimilar-start cohorts no differences were observed, between originator adalimumab and switch cohorts no significant differences were found either, and with the pre- and post-switch to biosimilar comparison two of the nine patients experienced adverse effects after the switch.
The biosimilar showed a favorable safety profile (one patient with a serious adverse effect [rash] with biosimilar discontinued treatment) and no significant changes to clinical or biochemical parameters were observed after the switch.
La enfermedad inflamatoria intestinal (EII) incluye diferentes enfermedades inmunomediadas y autoinmunes que causan inflamación dentro o fuera del intestino (manifestaciones extraintestinales). Los 2 tipos principales de EII son la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), ambas son enfermedades crónicas y progresivas con periodos irregulares de remisión y de recaída1.
El diagnóstico y tratamiento precoces de la EII son esenciales para mejorar la calidad de vida del paciente, prevenir complicaciones y garantizar una respuesta eficaz. Las estrategias terapéuticas actuales se basan en distintos factores, tales como la severidad de la enfermedad, su localización y comportamiento, y la respuesta al tratamiento2,3. Los fármacos más utilizados en la EII son los corticosteroides, los inmunosupresores (tiopurinas [azatioprina, mercaptopurina] o metotrexato) y los biológicos4.
Los fármacos biológicos son estructuras tridimensionales grandes y complejas producidas mediante organismos vivos que son muy sensibles a los cambios ambientales y a las condiciones externas. Dado que su producción es un proceso complejo y en varias etapas, no existen 2 medicamentos idénticos. De ahí que los biosimilares sean productos biológicos similares pero no idénticos a un medicamento biológico ya aprobado denominado «originario»5,6.
El pronóstico de la EII ha mejorado mucho con la introducción de los biológicos, especialmente los anticuerpos monoclonales contra el factor de necrosis tumoral alfa (anti-TNF-α)2. El adalimumab originario, Humira®, es un anticuerpo IgG1 completamente humano, que fue aprobado para uso médico en 2002 y se convirtió rápidamente en el tratamiento principal de la EII de moderada a grave. El tratamiento biológico de la EII supone una importante carga financiera para los sistemas sanitarios y limita el acceso de pacientes a una terapia adecuada3. Dado que muchos productos derivados de la biotecnología están llegando al final de su patente primaria, en los últimos años se han aprobado opciones terapéuticas más asequibles que son biosimilares del adalimumab (ADA)7,8.
Los biosimilares aprobados por la agencia del medicamento estadounidense (FDA) y por la Agencia europea (EMA) se consideran equivalentes a los correspondientes productos biológicos originarios de referencia. Por lo tanto, las agencias del medicamento permiten el cambio de fármacos originarios a biosimilares. Una vez demostrada la biosimilitud en una indicación, se considera aceptable la extrapolación del biosimilar a otras indicaciones del originario9. Sin embargo, la intercambiabilidad entre el originario y los biosimilares en el contexto de la EII no está exenta de controversia5,10.
La FDA y la EMA han aprobado varios biosimilares de ADA para su uso en la EII, pero los estudios de eficacia o seguridad son escasos. El ADA biosimilar (Idacio®) se aprobó sobre la base de los resultados obtenidos en el estudio en fase III AURIEL-PsO, que demostraron su equivalencia con el ADA originario (Humira®) en la psoriasis crónica con placas de moderadas a graves11.
No se dispone de ensayos controlados aleatorizados que comparen los biosimilares con el fármaco originario, y pocos estudios del mundo real han analizado el desenlace clínico en pacientes con EII a los que se les ha cambiado a un biosimilar12. Hasta la fecha, ningún estudio ha analizado los resultados de eficacia y seguridad en pacientes con EII nunca tratados con biológicos previamente, a los que se les administró el ADA biosimilar MSB11022, o en pacientes con EII a los que se les sustituyó el ADA originario por el ADA MSB11022.
El objetivo primario de este estudio fue analizar la eficacia y la seguridad tras el cambio del ADA originario (Humira®) al ADA biosimilar MSB11022 (Idacio®) en pacientes con EII. El objetivo secundario fue comparar los resultados clínicos de pacientes iniciados directamente con el tratamiento biosimilar y aquellos tratados con el ADA originario.
Material y métodosSe realizó un estudio observacional, retrospectivo, en una cohorte de pacientes adultos con EII en un contexto del mundo real. Los criterios de inclusión fueron: EII diagnosticada según los criterios de la ECCO (siglas en inglés de la Organización Europea de Crohn y Colitis)8,9; con edad mayor de 18 años; tratamiento en curso con el ADA originario o el biosimilar durante al menos 3 meses en las cohortes sin cambio, y un mínimo de 6 meses en la cohorte de cambio. Los criterios de exclusión fueron: pacientes que no cumplían los criterios anteriores, pacientes tratados con un ADA biosimilar distinto de Idacio® y pacientes embarazadas.
Para calcular el tamaño de la muestra se seleccionaron todos los pacientes que habían comenzado directamente con el ADA biosimilar, y todos aquellos que realizaron el cambio del originario al biosimilar; la comparación con los grupos anteriores se estableció mediante un grupo de control con todos los pacientes que estaban recibiendo el ADA originario.
Para analizar la eficacia y la seguridad del ADA biosimilar MSB11022 tras cambiar del originario al biosimilar, se comprobó que no hubiera diferencias basales significativas entre los pacientes (fig. 1):
- a)
Cohorte del ADA originario frente a la cohorte de pacientes que iniciaron directamente el tratamiento con el ADA biosimilar MSB11022.
- b)
Pacientes que cambiaron del ADA originario al ADA biosimilar MSB11022 frente a los pacientes de la cohorte del ADA originario.
- c)
Cohortes de cambio, antes y después del cambio de ADA originario a ADA biosimilar MSB11022.
Los datos se recopilaron de las historias clínicas electrónicas en la plataforma Cerner Millennium. El acceso a la historia clínica con fines legales, epidemiológicos, de salud pública, investigación o docencia se rige por lo dispuesto en la legislación vigente en materia de protección de datos de carácter personal, y por la Ley 14/1986, de 25 de abril, General de Sanidad13. El comité de investigación de nuestro hospital aprobó este estudio y el análisis de los datos de todos los pacientes tratados con ADA y su posterior correlación con los datos clínicos.
El estudio se consideró una revisión de la práctica clínica sin intervención del paciente. Por lo tanto, no se obtuvo consentimiento escrito ni aprobación ética formal. Se tomaron las medidas oportunas para garantizar la plena confidencialidad de los pacientes analizados de acuerdo con la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y Garantía de los Derechos Digitales14. Todos los datos fueron debidamente anonimizados para proteger la identidad de los pacientes.
Se recogió la siguiente información:
- •
Información demográfica: sexo, edad en el momento del diagnóstico de EII y antecedentes de tabaquismo.
- •
Información clínica: diagnóstico, antecedentes de cirugía relacionada con la EII antes del tratamiento con ADA (sí/no, tipo), manifestaciones extraintestinales, uso de otro biológico antes del ADA, cambio a un biológico diferente de ADA (sí/no, motivo).
- •
Estado de la clasificación de Montreal. Para la EC: edad en el momento del diagnóstico, localización, comportamiento y antecedentes de enfermedad perianal. Para la CU: extensión de la enfermedad y puntuación de Mayo (índice de actividad).
- •
Tratamiento: fechas de inicio y finalización; duración total (meses); intensificación de la dosis; visitas a urgencias relacionadas con la EII durante el tratamiento en el periodo de estudio (sí/no, número de visitas); hospitalización relacionada con la EII durante el tratamiento en el periodo de estudio (sí/no, número de días); cirugía relacionada con la EII durante el tratamiento en el periodo de estudio (sí/no, tipo).
- •
Uso concomitante o esporádico de inmunosupresores (tiopurinas) o corticosteroides.
- •
Biomarcadores de laboratorio. Calprotectina fecal (CF) (mg/kg) y proteína C reactiva (PCR) (mg/l). La CF es un marcador inflamatorio fecal que se correlaciona con los infiltrados de neutrófilos en el intestino y se utiliza para detectar la inflamación intestinal. La PCR es un reactante en la fase aguda dependiente de la interleucina 6 que se correlaciona con la carga inflamatoria. Aunque no es muy específica, se utiliza para estratificar la severidad de la EII. Se han observado correlaciones entre los niveles de PCR y FC y los hallazgos endoscópicos sobre la actividad de la enfermedad.
- •
Actividad de la EII. Índice de Harvey-Bradshaw (HBI) para la EC y escala de Mayo parcial para la CU. El HBI clasifica la enfermedad en función de 5 criterios, mientras que la escala de Mayo parcial tiene en cuenta 3 parámetros clínicos. En ambos casos, las puntuaciones finales se obtienen sumando las puntuaciones de los ítems individuales15.
No existe un método de referencia establecido para evaluar la respuesta clínica a los agentes anti-TNF en la EII16,17. Además, las manifestaciones clínicas no siempre se correlacionan con las evaluaciones objetivas de la actividad de la enfermedad, tales como la actividad según endoscopia o las concentraciones de biomarcadores. Por lo tanto, la eficacia del tratamiento se evalúa mediante una combinación de datos clínicos (por ejemplo, puntuaciones de actividad) y bioquímicos (por ejemplo, niveles de biomarcadores).
La remisión bioquímica se ha definido como un nivel de FC menor a 250 mg/kg y un nivel de PCR menor a 5 mg/l18. Según la literatura, la remisión en la EC se define como un HBI de 5 o inferior. Las puntuaciones de 5–7 indican actividad leve; 8–16, actividad moderada y mayor de 16, actividad grave. En el caso de la CU, puntuaciones parciales de Mayo menores que 2 indican remisión; 2–4, actividad leve; 5–7, actividad moderada; y mayor que 7, actividad grave15,17,19.
La eficacia del ADA biosimilar MSB11022 se analizó comparando los marcadores bioquímicos basales (FC y PCR) (niveles previos al cambio registrados durante el periodo de estudio) y después del cambio (últimos niveles registrados durante el periodo de estudio). Ambos parámetros se analizaron como variables continuas. La remisión clínica se estableció como un HBI menor que 4 para la EC y una puntuación parcial de Mayo menor o igual a 1 para la CU. Estas puntuaciones se analizaron como variables categóricas18,20,21. El fracaso del tratamiento se definió como una diferencia clínica y bioquímica significativa en comparación con el ADA originario, necesidad de intensificar la dosis, necesidad de tratamiento concomitante con corticosteroides o tiopurinas, cambio a otro biológico, y hospitalización, cirugía10,21,22 o visitas a urgencias relacionadas con la EII. La seguridad se evaluó analizando las interrupciones del tratamiento y los acontecimientos adversos (AA)10,20,21. Se analizaron todos los AA notificados durante el seguimiento, independientemente de su posible relación con el ADA biosimilar MSB1102219.
Se utilizaron estadísticas descriptivas para describir las características demográficas y clínicas. Las variables categóricas se expresan como números y porcentajes. Se utilizó la prueba de D'Agostino-Pearson para evaluar la distribución de las variables continuas, que se expresaron como media ± desviación estándar cuando se distribuyeron normalmente y mediana e intervalo intercuartílico (IIC) en caso contrario.
Las variables categóricas se compararon mediante la prueba exacta de Fisher o la prueba de chi-cuadrado, según procediera. Los datos independientes con distribución normal y no normal se compararon mediante la prueba t de Student y la prueba de U de Mann–Whitney, respectivamente. Se utilizó la prueba no paramétrica de McNemar para comparar variables continuas antes y después del cambio, comprobando si había diferencias significativas entre las variables categóricas binarias emparejadas.
No fue necesario realizar un cálculo de potencia, ya que se trataba de un estudio observacional de cohortes de todos los pacientes de nuestro hospital que cumplían los criterios de inclusión. El análisis estadístico se realizó con Intercooled Stata 9.1 y Epidat 3.1. La significación estadística se estableció en un valor p inferior a 0,05. Se consideró que un valor de 0,05–0,10 indicaba tendencia hacia la significación.
ResultadosSe incluyeron 44 pacientes con EC o CU tratados en nuestro hospital con ADA originario o el biosimilar MSB11022 entre el 1 de enero de 2019 y el 28 de febrero de 2022. Treinta fueron asignados a la cohorte de ADA originario, 5 a la cohorte de inicio con ADA biosimilar MSB11022 y 9 a la cohorte de cambio.
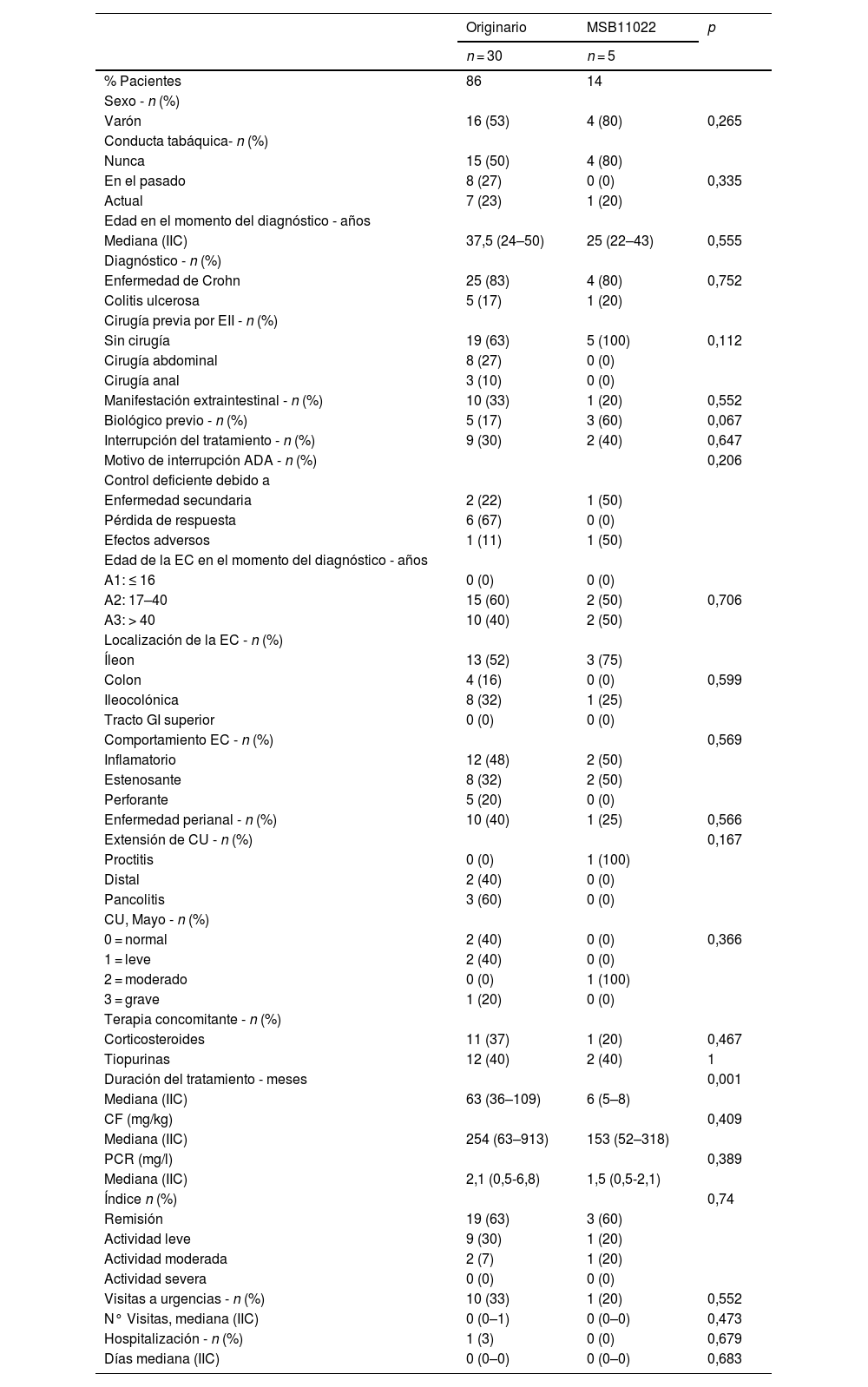
Comparación basal de las cohortes de inicio con biosimilares del adalimumab originario (n = 30) y con biosimilares del adalimumab MSB11022 (n = 5)La comparación basal de las cohortes de inicio con ADA originario y con ADA biosimilar MSB11022 incluyó a 35 pacientes: 30 personas en la cohorte ADA originario y 5 de la cohorte ADA biosimilar. En la tabla 1 se muestran sus características demográficas y clínicas basales. No se observaron diferencias estadísticamente significativas entre los 2 grupos de inicio en cuanto a la edad, sexo, duración de la enfermedad, comportamiento de la enfermedad, tabaquismo, tratamiento concomitante y características clínicas. La única diferencia significativa observada fue una mayor duración del tratamiento en la cohorte de ADA originario (63 meses frente a 6 meses, p = 0,001). Hubo una tendencia hacia la significación (p = 0,067) para el uso de otro biológico antes del tratamiento con ADA, con una mayor proporción de pacientes previos en la cohorte de inicio con ADA biosimilar MSB11022. No se observaron diferencias en cuanto a la interrupción del tratamiento (p = 0,647). Un paciente de la cohorte con ADA originario requirió hospitalización.
Datos demográficos basales y características clínicas de la comparación: pacientes tratados con fármaco originario frente a pacientes que comenzaron con MSB11022
| Originario | MSB11022 | p | |
|---|---|---|---|
| n = 30 | n = 5 | ||
| % Pacientes | 86 | 14 | |
| Sexo - n (%) | |||
| Varón | 16 (53) | 4 (80) | 0,265 |
| Conducta tabáquica- n (%) | |||
| Nunca | 15 (50) | 4 (80) | |
| En el pasado | 8 (27) | 0 (0) | 0,335 |
| Actual | 7 (23) | 1 (20) | |
| Edad en el momento del diagnóstico - años | |||
| Mediana (IIC) | 37,5 (24–50) | 25 (22–43) | 0,555 |
| Diagnóstico - n (%) | |||
| Enfermedad de Crohn | 25 (83) | 4 (80) | 0,752 |
| Colitis ulcerosa | 5 (17) | 1 (20) | |
| Cirugía previa por EII - n (%) | |||
| Sin cirugía | 19 (63) | 5 (100) | 0,112 |
| Cirugía abdominal | 8 (27) | 0 (0) | |
| Cirugía anal | 3 (10) | 0 (0) | |
| Manifestación extraintestinal - n (%) | 10 (33) | 1 (20) | 0,552 |
| Biológico previo - n (%) | 5 (17) | 3 (60) | 0,067 |
| Interrupción del tratamiento - n (%) | 9 (30) | 2 (40) | 0,647 |
| Motivo de interrupción ADA - n (%) | 0,206 | ||
| Control deficiente debido a | |||
| Enfermedad secundaria | 2 (22) | 1 (50) | |
| Pérdida de respuesta | 6 (67) | 0 (0) | |
| Efectos adversos | 1 (11) | 1 (50) | |
| Edad de la EC en el momento del diagnóstico - años | |||
| A1: ≤ 16 | 0 (0) | 0 (0) | |
| A2: 17–40 | 15 (60) | 2 (50) | 0,706 |
| A3: > 40 | 10 (40) | 2 (50) | |
| Localización de la EC - n (%) | |||
| Íleon | 13 (52) | 3 (75) | |
| Colon | 4 (16) | 0 (0) | 0,599 |
| Ileocolónica | 8 (32) | 1 (25) | |
| Tracto GI superior | 0 (0) | 0 (0) | |
| Comportamiento EC - n (%) | 0,569 | ||
| Inflamatorio | 12 (48) | 2 (50) | |
| Estenosante | 8 (32) | 2 (50) | |
| Perforante | 5 (20) | 0 (0) | |
| Enfermedad perianal - n (%) | 10 (40) | 1 (25) | 0,566 |
| Extensión de CU - n (%) | 0,167 | ||
| Proctitis | 0 (0) | 1 (100) | |
| Distal | 2 (40) | 0 (0) | |
| Pancolitis | 3 (60) | 0 (0) | |
| CU, Mayo - n (%) | |||
| 0 = normal | 2 (40) | 0 (0) | 0,366 |
| 1 = leve | 2 (40) | 0 (0) | |
| 2 = moderado | 0 (0) | 1 (100) | |
| 3 = grave | 1 (20) | 0 (0) | |
| Terapia concomitante - n (%) | |||
| Corticosteroides | 11 (37) | 1 (20) | 0,467 |
| Tiopurinas | 12 (40) | 2 (40) | 1 |
| Duración del tratamiento - meses | 0,001 | ||
| Mediana (IIC) | 63 (36–109) | 6 (5–8) | |
| CF (mg/kg) | 0,409 | ||
| Mediana (IIC) | 254 (63–913) | 153 (52–318) | |
| PCR (mg/l) | 0,389 | ||
| Mediana (IIC) | 2,1 (0,5-6,8) | 1,5 (0,5-2,1) | |
| Índice n (%) | 0,74 | ||
| Remisión | 19 (63) | 3 (60) | |
| Actividad leve | 9 (30) | 1 (20) | |
| Actividad moderada | 2 (7) | 1 (20) | |
| Actividad severa | 0 (0) | 0 (0) | |
| Visitas a urgencias - n (%) | 10 (33) | 1 (20) | 0,552 |
| N° Visitas, mediana (IIC) | 0 (0–1) | 0 (0–0) | 0,473 |
| Hospitalización - n (%) | 1 (3) | 0 (0) | 0,679 |
| Días mediana (IIC) | 0 (0–0) | 0 (0–0) | 0,683 |
ADA: adalimumab; CF: calprotectina fecal; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; GI: gastrointestinal; PCR: proteína C reactiva.
Tres de los 5 pacientes de la cohorte de inicio con ADA biosimilar MSB11022 experimentaron AA (2 casos de dolor musculoesquelético y un caso de caída del cabello y erupción cutánea). El paciente que experimentó caída del cabello y erupción cutánea interrumpió el tratamiento.
Ocho de los 30 pacientes del grupo de ADA originario presentaron AA (3 casos de hipertransaminasemia y un caso de erupción periocular, fractura ósea, dolor osteomuscular, herpes zóster, visión borrosa, cefalea, formación de cataratas y temblores corporales). Un paciente interrumpió el tratamiento debido a la formación de cataratas.
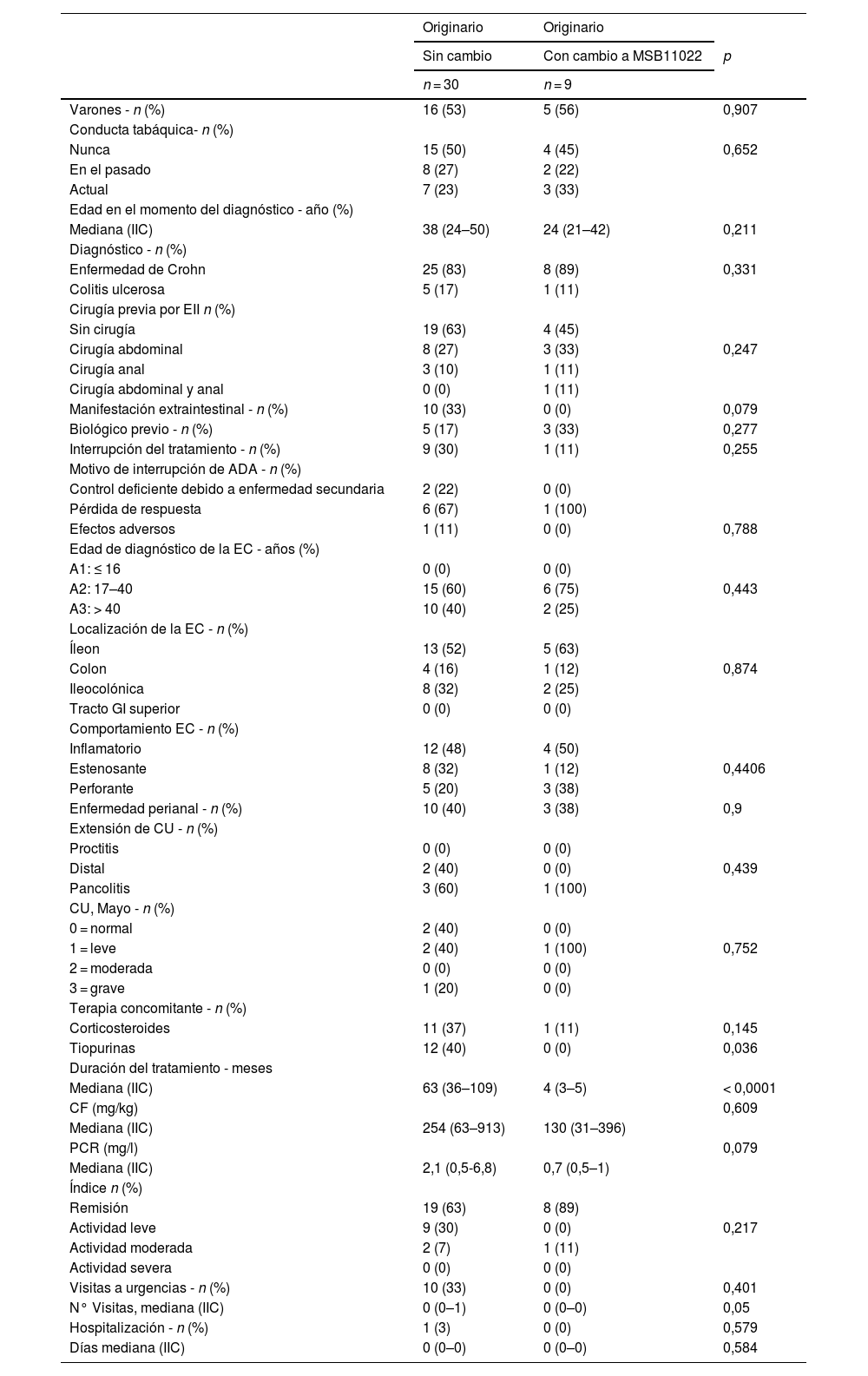
Comparación basal de la cohorte de biosimilares del adalimumab originario y la cohorte de cambioSe incluyeron 39 pacientes en la comparación basal de los pacientes tratados solo con el ADA originario (n = 30) y los que cambiaron del ADA originario al ADA biosimilar MSB11022 (n = 9). Sus características demográficas y clínicas se resumen en la tabla 2.
Resultados de las características demográficas y clínicas basales de la comparación: pacientes tratados con el fármaco originario frente a pacientes que cambiaron a MSB11022
| Originario | Originario | ||
|---|---|---|---|
| Sin cambio | Con cambio a MSB11022 | p | |
| n = 30 | n = 9 | ||
| Varones - n (%) | 16 (53) | 5 (56) | 0,907 |
| Conducta tabáquica- n (%) | |||
| Nunca | 15 (50) | 4 (45) | 0,652 |
| En el pasado | 8 (27) | 2 (22) | |
| Actual | 7 (23) | 3 (33) | |
| Edad en el momento del diagnóstico - año (%) | |||
| Mediana (IIC) | 38 (24–50) | 24 (21–42) | 0,211 |
| Diagnóstico - n (%) | |||
| Enfermedad de Crohn | 25 (83) | 8 (89) | 0,331 |
| Colitis ulcerosa | 5 (17) | 1 (11) | |
| Cirugía previa por EII n (%) | |||
| Sin cirugía | 19 (63) | 4 (45) | |
| Cirugía abdominal | 8 (27) | 3 (33) | 0,247 |
| Cirugía anal | 3 (10) | 1 (11) | |
| Cirugía abdominal y anal | 0 (0) | 1 (11) | |
| Manifestación extraintestinal - n (%) | 10 (33) | 0 (0) | 0,079 |
| Biológico previo - n (%) | 5 (17) | 3 (33) | 0,277 |
| Interrupción del tratamiento - n (%) | 9 (30) | 1 (11) | 0,255 |
| Motivo de interrupción de ADA - n (%) | |||
| Control deficiente debido a enfermedad secundaria | 2 (22) | 0 (0) | |
| Pérdida de respuesta | 6 (67) | 1 (100) | |
| Efectos adversos | 1 (11) | 0 (0) | 0,788 |
| Edad de diagnóstico de la EC - años (%) | |||
| A1: ≤ 16 | 0 (0) | 0 (0) | |
| A2: 17–40 | 15 (60) | 6 (75) | 0,443 |
| A3: > 40 | 10 (40) | 2 (25) | |
| Localización de la EC - n (%) | |||
| Íleon | 13 (52) | 5 (63) | |
| Colon | 4 (16) | 1 (12) | 0,874 |
| Ileocolónica | 8 (32) | 2 (25) | |
| Tracto GI superior | 0 (0) | 0 (0) | |
| Comportamiento EC - n (%) | |||
| Inflamatorio | 12 (48) | 4 (50) | |
| Estenosante | 8 (32) | 1 (12) | 0,4406 |
| Perforante | 5 (20) | 3 (38) | |
| Enfermedad perianal - n (%) | 10 (40) | 3 (38) | 0,9 |
| Extensión de CU - n (%) | |||
| Proctitis | 0 (0) | 0 (0) | |
| Distal | 2 (40) | 0 (0) | 0,439 |
| Pancolitis | 3 (60) | 1 (100) | |
| CU, Mayo - n (%) | |||
| 0 = normal | 2 (40) | 0 (0) | |
| 1 = leve | 2 (40) | 1 (100) | 0,752 |
| 2 = moderada | 0 (0) | 0 (0) | |
| 3 = grave | 1 (20) | 0 (0) | |
| Terapia concomitante - n (%) | |||
| Corticosteroides | 11 (37) | 1 (11) | 0,145 |
| Tiopurinas | 12 (40) | 0 (0) | 0,036 |
| Duración del tratamiento - meses | |||
| Mediana (IIC) | 63 (36–109) | 4 (3–5) | < 0,0001 |
| CF (mg/kg) | 0,609 | ||
| Mediana (IIC) | 254 (63–913) | 130 (31–396) | |
| PCR (mg/l) | 0,079 | ||
| Mediana (IIC) | 2,1 (0,5-6,8) | 0,7 (0,5–1) | |
| Índice n (%) | |||
| Remisión | 19 (63) | 8 (89) | |
| Actividad leve | 9 (30) | 0 (0) | 0,217 |
| Actividad moderada | 2 (7) | 1 (11) | |
| Actividad severa | 0 (0) | 0 (0) | |
| Visitas a urgencias - n (%) | 10 (33) | 0 (0) | 0,401 |
| N° Visitas, mediana (IIC) | 0 (0–1) | 0 (0–0) | 0,05 |
| Hospitalización - n (%) | 1 (3) | 0 (0) | 0,579 |
| Días mediana (IIC) | 0 (0–0) | 0 (0–0) | 0,584 |
ADA: adalimumab; CF: calprotectina fecal; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; GI: gastrointestinal; PCR: proteína C reactiva.
No se observaron diferencias estadísticamente significativas entre los 2 grupos (cohorte de ADA originario y cohorte de cambio) en cuanto a la edad, el sexo, la duración de la enfermedad, el comportamiento de la enfermedad, el tabaquismo y los hallazgos clínicos con respecto a la CF, la PCR y el índice de enfermedad. Se observaron diferencias significativas entre la cohorte de ADA originaria y la cohorte de cambio en cuanto al uso de tiopurinas (12 frente a 0, p = 0,036, respectivamente) y la duración del tratamiento (63 meses frente a 4 meses, p < 0,001, respectivamente). Hubo una tendencia hacia niveles más altos de PCR (2,1 frente a 0,7; p = 0,079) y más visitas a urgencias relacionadas con la EII en el grupo de ADA originario (p = 0,050). Los pacientes de la cohorte de cambio presentaban una mediana de edad más baja en el momento del diagnóstico de EII, pero la diferencia no fue significativa (p = 0,211).
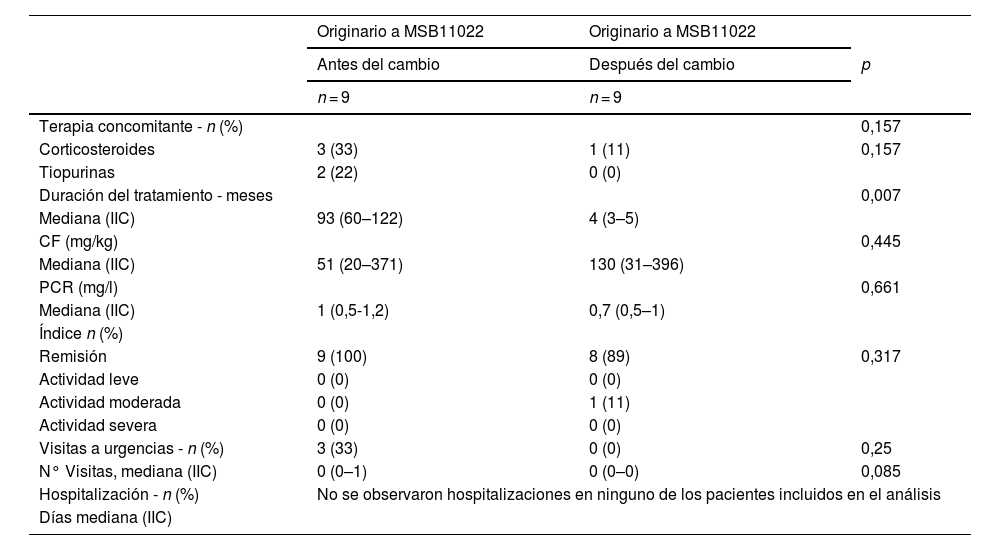
Comparación antes y después del cambio (n = 9)Los 9 pacientes de la cohorte de cambio fueron incluidos en la comparación de los datos de antes y después del cambio de la cohorte del ADA originario al ADA biosimilar MSB11022. Sus características clínicas y bioquímicas se muestran en la tabla 3.
Características clínicas y bioquímicas de los análisis antes y después del cambio
| Originario a MSB11022 | Originario a MSB11022 | ||
|---|---|---|---|
| Antes del cambio | Después del cambio | p | |
| n = 9 | n = 9 | ||
| Terapia concomitante - n (%) | 0,157 | ||
| Corticosteroides | 3 (33) | 1 (11) | 0,157 |
| Tiopurinas | 2 (22) | 0 (0) | |
| Duración del tratamiento - meses | 0,007 | ||
| Mediana (IIC) | 93 (60–122) | 4 (3–5) | |
| CF (mg/kg) | 0,445 | ||
| Mediana (IIC) | 51 (20–371) | 130 (31–396) | |
| PCR (mg/l) | 0,661 | ||
| Mediana (IIC) | 1 (0,5-1,2) | 0,7 (0,5–1) | |
| Índice n (%) | |||
| Remisión | 9 (100) | 8 (89) | 0,317 |
| Actividad leve | 0 (0) | 0 (0) | |
| Actividad moderada | 0 (0) | 1 (11) | |
| Actividad severa | 0 (0) | 0 (0) | |
| Visitas a urgencias - n (%) | 3 (33) | 0 (0) | 0,25 |
| N° Visitas, mediana (IIC) | 0 (0–1) | 0 (0–0) | 0,085 |
| Hospitalización - n (%) | No se observaron hospitalizaciones en ninguno de los pacientes incluidos en el análisis | ||
| Días mediana (IIC) | |||
FC: calprotectina fecal; PCR: proteína C reactiva.
Se encontraron diferencias significativas en la duración del tratamiento, que fue más largo en el periodo previo al cambio (93 meses frente a 4 meses, p = 0,008). El uso concomitante y esporádico de corticosteroides y tiopurinas disminuyó significativamente tras el cambio, pero no fue significativo (p = 0,157). Se observó una tendencia hacia la significación en el número de visitas a urgencias (p = 0,085), con un menor número de visitas después del cambio.
Dos de los 9 pacientes experimentaron AA tras el cambio (hipertransaminasemia en un caso y dolor musculoesquelético en el otro). Ninguno de ellos interrumpió el tratamiento. Ninguno de los pacientes precisó hospitalización ni intervención quirúrgica.
Solo un paciente interrumpió el tratamiento con ADA debido a una pérdida de respuesta tras el cambio. El paciente tenía una actividad moderada de la enfermedad en el momento del cambio y había recibido tratamiento previo con varios fármacos biológicos, incluidos otros agentes anti-TNF-α.
DiscusiónAunque la aparición de los biosimilares cambió la práctica clínica, la extrapolación de los datos de eficacia y seguridad a otras indicaciones del fármaco originario ha suscitado cierta controversia en relación con los posibles aumentos de inmunogenicidad (presencia de anticuerpos antifármaco)23 ligados al uso de lotes con posibles variaciones en los epítopos. Sin embargo, este efecto no se ha detectado en estudios clínicos24. Ni Barbier et al.25 ni McKinnon26, en sus revisiones sistemáticas de más de 170 estudios, encontraron que el cambio de un originario a un biosimilar produjera diferencias significativas en la eficacia, seguridad o la inmunogenicidad.
Este es el primer estudio español que analiza la eficacia y la seguridad del ADA biosimilar MSB11022 (Idacio®) en pacientes con EII a los que se inicia tratamiento con este biosimilar como nueva estrategia terapéutica, o se les cambia el ADA originario por dicho biosimilar.
No se observaron cambios significativos en los marcadores clínicos ni bioquímicos respecto a la actividad de la enfermedad tras el cambio del fármaco originario al biosimilar. Además, el análisis de eficacia no mostró diferencias significativas entre la cohorte del ADA originario y la cohorte de inicio con el ADA biosimilar MSB11022. Cabe destacar que hubo una tendencia hacia niveles más altos de PCR en la cohorte del originario que en la cohorte del cambio (2,1 frente a 0,7; p = 0,079).
Los pacientes en las cohortes del ADA biosimilar MSB11022 (Idacio®) desde el inicio y por cambio eran más jóvenes que los de la cohorte de ADA originario, lo que indica un diagnóstico más temprano de la EII y una introducción más temprana del tratamiento biológico, tal vez relacionada con el uso de biosimilares. En esta población adulta, no se observaron diferencias en la distribución de la EII dependientes del sexo.
Nueve pacientes de la cohorte ADA originario, 2 de la cohorte de inicio con ADA biosimilar MSB11022 y uno de la cohorte de cambio interrumpieron el tratamiento con ADA (tabla 2). Los motivos de la interrupción fueron:
- a)
AA no graves (un paciente de la cohorte de ADA originario).
- b)
Control deficiente de una enfermedad secundaria (2 pacientes de la cohorte con ADA originario).
- c)
Pérdida de respuesta (6 pacientes de la cohorte con ADA originario y uno de la cohorte de cambio).
Las tasas de pérdida de respuesta concuerdan con notificaciones anteriores que describen tasas del orden del 10 al 20% y del 13 al 30%, según el estudio. Las tasas de AA también coinciden con notificaciones previas22. Ninguno de los pacientes incluidos en este estudio necesitó una intensificación de la dosis de ADA ni cirugía durante el tratamiento en el periodo de estudio.
Nuestros hallazgos no muestran cambios en los parámetros clínicos o bioquímicos en los pacientes que cambiaron de ADA originario a ADA biosimilar MSB11022 (Idacio®). También muestran que el ADA biosimilar MSB11022 es seguro y eficaz en pacientes con EII que no han recibido ADA. Se ha observado una actividad farmacocinética y bioquímica de la enfermedad estables en una cohorte importante de pacientes que cambiaron de ADA originario a ADA biosimilar como parte de un programa de cambio en el mundo real27. El beneficio clínico del ADA originario se mantuvo tras el cambio a un ADA biosimilar MSB11022, sin que hubiese riesgos de recaída, visitas a urgencias o ingreso hospitalario observado en este estudio. Este estudio canadiense estableció la seguridad y eficacia del cambio a un agente biosimilar de adalimumab28.
Nuestro estudio tiene varios puntos fuertes, como el doble análisis de los pacientes con EII que comenzaron directamente con el biosimilar MSB11022 y los pacientes que cambiaron a este fármaco después del tratamiento con el ADA originario. El sesgo de selección se minimizó mediante el uso de un procedimiento de recopilación basado en protocolos para reunir parámetros clínicos, bioquímicos y de severidad de la enfermedad a partir de la plataforma integrada de historias clínicas electrónicas del hospital.
En consonancia, este estudio también tiene limitaciones, entre ellas la diferencia de tamaño entre las cohortes del estudio, ya que, el ADA biosimilar MSB11022 (Idacio®) se introdujo en nuestro hospital en 2021, mientras que el ADA originario (Humira®) se utiliza desde 2008. Esta situación refleja la práctica clínica habitual, ya que cuanto más tiempo lleve una persona con tratamiento biológico, más probable es que pierda respuesta22. Otra limitación que puede afectar a nuestros hallazgos sobre la eficacia del biosimilar MSB11022 es la ausencia de control endoscópico, ya que solo algunos de los pacientes en tratamiento de mantenimiento con ADA se hicieron un examen endoscópico durante el seguimiento. Otra limitación del presente estudio son los pocos pacientes tratados con el ADA biosimilar MSB11022. Por último, faltaron datos relativos a la monitorización terapéutica de los fármacos, como los niveles de anticuerpos antifármaco y de ADA, ya que, en nuestro hospital, dichos parámetros solo se recogieron en pacientes con sospecha de fracaso del tratamiento.
A pesar de las limitaciones mencionadas, este estudio aporta datos valiosos sobre la respuesta a corto plazo y refleja la práctica real respecto al tratamiento con el ADA biosimilar MSB11022, lo que permite la extrapolación directa de los resultados a la práctica clínica habitual en nuestro hospital.
Aunque los biosimilares ofrecen varias ventajas socioeconómicas con respecto a los productos originarios, la eficacia y la seguridad deben seguir siendo esenciales en cualquier tratamiento. No obstante, el ahorro potencial de costes asociado a los biosimilares representa una excelente oportunidad para ampliar el acceso a los tratamientos biológicos y para mejorar la eficiencia de los sistemas sanitarios.
ConclusionesNo se observaron diferencias entre las cohortes de inicio con ADA originario y con ADA biosimilar MSB11022. Tampoco se encontraron diferencias significativas entre la cohorte del ADA originario y la cohorte de cambio, ni en la comparación previa y posterior al cambio al ADA biosimilar MSB11022; 2 de los 9 pacientes experimentaron AA después del cambio.
El ADA biosimilar MSB11022 (Idacio®) mostró un perfil de seguridad favorable (un paciente con un efecto adverso severo [erupción cutánea] con el biosimilar interrumpió el tratamiento) y no se observaron cambios significativos en los parámetros clínicos o bioquímicos después del cambio.
Aportaciones a la literatura científicaLos biosimilares aprobados por la Agencia del medicamento estadounidense (FDA) y la Agencia europea (EMA) se consideran equivalentes a los correspondientes productos biológicos de referencia, u originarios. Por lo tanto, se permite el cambio de fármacos originarios a biosimilares. Una vez demostrada la biosimilitud en una indicación, se acepta la extrapolación del originario a otras indicaciones. La terapia biológica en la EII, supone una importante carga financiera para los sistemas sanitarios (el ADA originario [Humira®] se ha situado entre los medicamentos más vendidos del mundo en la última década), lo que limita el acceso de los pacientes a una terapia adecuada.
El ADA biosimilar MSB11022 (marca comercial Idacio®) fue aprobado para las mismas indicaciones que su originario. Esta es la primera comparación entre el ADA MSB11022 y el ADA originario en el contexto de la EII, y no se observaron diferencias significativas en la eficacia o la seguridad de los pacientes que empezaron a tomar MSB11022 o que cambiaron del originario al biosimilar.
En nuestra opinión, esta investigación ha aportado resultados que pueden mejorar significativamente la atención sanitaria de nuestros pacientes. El menor coste de los biosimilares representa una excelente oportunidad para ampliar el acceso de pacientes a las terapias biológicas y mejorar la eficiencia del sistema sanitario.
Consideraciones éticasLa planificación, realización y comunicación de esta investigación se ha realizado de acuerdo con la Declaración de Helsinki, revisada en 2013. Se trata de una investigación retrospectiva sin intervención en los pacientes, por lo que el Comité de Investigación de nuestro hospital consideró que estaba exonerada de obtener el consentimiento de los pacientes. Todos los autores confirman que evitaron cualquier material que pudiera ser potencialmente identificable.
FinanciaciónLos autores declaran no tener ninguna fuente de financiación.
AutoríaLos siguientes autores (Inés Ibáñez-Sala, Jaime E Poquet-Jornet, Adrián Munilla-Das, Antonio Valdivia-Pérez, Francisco Javier Carrera-Hueso) han seguido las recomendaciones del ICMJE, por lo que todos ellos realizaron contribuciones sustanciales a la concepción o diseño del trabajo y a la adquisición, análisis o interpretación de los datos para el trabajo; todos los autores revisaron críticamente el borrador respecto a contenido intelectual importante y participaron en la redacción de la versión final que se va a publicar. Todos ellos se aseguraron de que las cuestiones relacionadas con la exactitud o integridad de todas las partes del trabajo se investigaran y resolvieran adecuadamente. Teresa Garrigues-Pelufo falleció el 6 de febrero de 2023, pero cumple los criterios de inclusión como coautora, por lo que debe ser incluida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Utilización de inteligencia artificialEn ningún momento hemos utilizado tecnologías asistidas por inteligencia artificial (IA) para la producción del trabajo presentado.
Publicaciones previasEl manuscrito presentado y titulado: Eficacia y seguridad de un adalimumab biosimilar en pacientes con enfermedad inflamatoria intestinal es una contribución original que no se ha publicado con anterioridad ni se ha enviado para que se considere su publicación en ningún otro lugar.
Declaración de contribución de autoría CRediTJaime E. Poquet-Jornet: Writing – review & editing, Writing – original draft, Validation, Supervision, Methodology, Formal analysis, Data curation, Conceptualization. Inés Ibáñez-Sala: Writing – review & editing, Writing – original draft, Visualization, Methodology, Investigation, Formal analysis, Data curation. Teresa Garrigues-Pelufo: Conceptualization. Adrián Munilla-Das: Writing – review & editing, Writing – original draft, Validation, Supervision, Formal analysis, Data curation. Antonio Valdivia-Pérez: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Methodology, Formal analysis, Data curation. Francisco Javier Carrera-Hueso: Writing – review & editing, Writing – original draft, Validation, Methodology, Formal analysis, Data curation.