en 2016 se publicaron las guías de la MASCC/ESMO que incorporaron los esquemas de antraciclinas como quimioterapia altamente emetógena (QAE) proponiendo la triple terapia antiemética, así como para los esquemas de carboplatino.
Los objetivos fueron analizar el nivel de concordancia entre las guías y la profilaxis antiemética utilizada en el hospital de día de hematooncología, evaluar su efectividad y determinar el ahorro de la inclusión de netupitant/palonosetrón (NEPA) oral con dexametasona intravenosa (NEPAd) respecto a fosaprepitant con ondansetrón y dexametasona (FOD intravenosa).
Métodoestudio observacional prospectivo registrando variables demográficas, esquema de quimioterapia recibido, localización tumoral, riesgo emetógeno del paciente, pauta antiemética prescrita, concordancia con guía MASCC/ESMO y su efectividad, utilización de medicación de rescate y registro de visitas a urgencias o ingresos por emesis.
Se llevó a cabo un estudio farmacoeconómico de minimización de costes.
Resultadosse incluyeron 61 pacientes, 70% mujeres, mediana edad 60,5.
Los esquemas de platino fueron más frecuentes en el periodo 1, siendo el 87,5% respecto al 67,6% en el periodo 2. Los esquemas con antraciclinas fueron del 21,6 y 10% respectivamente en cada periodo.
Un 21,1% de las pautas antieméticas no coincidían con las recomendaciones MASCC/ESMO, siendo en su totalidad en el periodo 1. La puntuación de los cuestionarios de efectividad fue de protección total en el 90,9% en las náuseas agudas, del 100% en los vómitos agudos y en las náuseas retardadas, y del 72,7% en los vómitos retardados.
La frecuencia de uso de medicación de rescate fue del 18,7% en el periodo 1 y no fue necesaria en el periodo 2.
No se detectaron visitas a urgencias ni ingresos en ninguno de los periodos.
El uso de NEPAd comportó una reducción del 28% de los costes con respecto al empleo de FOD.
Conclusionesse obtuvo un alto nivel de concordancia en ambos periodos entre la última guía publicada y la práctica asistencial de nuestro ámbito. Las encuestas llevadas a cabo en los pacientes parecen mostrar que ambas terapias antieméticas presentan una efectividad similar en la práctica clínica. La inclusión de NEPAd ha comportado una disminución de costes, posicionándose como una opción eficiente.
Latest MASCC/ESMO guidelines of the recommendations for the prophylaxis of acute and delayed emesis induced by moderately emetogenic chemotherapy was published in 2016 incorporating anthracycline schemes as highly emetogenic chemotherapy (HEC), proposing triple antiemetic therapy to control nausea and vomiting. Likewise, they recommend triple therapy for carboplatin.
The objectives of this study were to analyze the degree of concordance between guidelines and antiemetic prophylaxis used in the Chemotherapy Outpatient Unit in patients undergoing treatment with HEC and carboplatin, to evaluate its effectiveness and to determine the savings due to the use of netupitant/palonosetron (NEPA) oral (or) with intravenous (iv) dexamethasone (NEPAd) compared to iv Fosaprepitant with ondansetron and dexamethasone (FOD iv).
MethodsProspective observational study recording demographic variables, chemotherapy protocol, tumor location, patient emetogenic risk, antiemetic regimen prescribed, concordance with the MASCC/ESMO guideline, and effectiveness, evaluated by MASCC survey, use of rescue medication and visits to the Emergency Department or hospitalization due to emesis.
A cost minimization pharmacoeconomic study was carried out.
Results61 patients were included; 70% women; median age 60.5.
Platinum schemes were more frequent in period 1, being 87.5% compared to 67.6% in period 2. Anthracycline schemes were 21.6% and 10% respectively in each period.
A 21.1% of the antiemetic regimens did not coincide with the MASCC/ESMO recommendations, being entirely in period 1. The score of the effectiveness questionnaires was total protection in 90.9% in acute nausea, from 100% in acute vomiting and delayed nausea, and 72.7% in delayed vomiting.
The frequency of use of rescue medication was 18.7% in period 1 and was not necessary in period 2.
No visits to the emergency room or admissions were detected in any of the periods.
ConclusionsUse of NEPAd led to a 28% reduction in costs with respect to the use of FOD.
A high level of concordance was obtained in both periods between the latest published guideline and healthcare practice in our field. Surveys carried out on patients seem to suggest that both antiemetic therapies have similar effectiveness in clinical practice. The inclusion of NEPAd has led to a reduction in costs, positioning itself as an efficient option.
La prevención y el control de las náuseas y los vómitos (NV) son de suma importancia en el tratamiento de los pacientes con cáncer. Las NV inducidas por la quimioterapia (NVIQ) son uno de los efectos secundarios más relevantes del tratamiento del cáncer; se presentan hasta en un 80% de los pacientes y pueden tener un efecto importante en la calidad de vida1. Se definen las náuseas como la experiencia subjetiva de malestar epigástrico que se asocia con la necesidad de vomitar, y el vómito como la expulsión oral del contenido gastrointestinal mediante un arco reflejo emético coordinado por el sistema nervioso central1.
Las NVIQ se clasifican en agudas si se presentan en las primeras 24 h tras el tratamiento o tardías a partir de las 24 h del tratamiento de quimioterapia. Las NVIQ agudas están mediadas predominantemente por la unión de la serotonina a los receptores 5-HT3 en las aferencias vagales periféricas del intestino, mientras que la activación de los receptores de neuroquinina-1 (NK1) por la sustancia P se produce en localizaciones centrales, principalmente en el área postrema y núcleo del tracto solitario (NTS), y es el mecanismo principal subyacente a las NVIQ tardías. Las diferencias en la fisiopatología de las NVIQ agudas y tardías justifican los distintos enfoques farmacológicos2.
La emetogenicidad depende del tratamiento, de las características del paciente (edad, sexo o consumo de alcohol) y del tumor. La capacidad emetógena del tratamiento se clasifica según su riesgo en alto, intermedio, bajo y mínimo3–8.
Existen distintas herramientas para valorar el riesgo emético de manera individualizada como el algoritmo de Junker y Wiedemann de los años 909 o el sistema online CINV Risk Assessment mucho más reciente10. Este último consiste en una plataforma ágil de 10 ítems que solicita información referente a los citostáticos que van a utilizarse y datos de los factores de riesgo del paciente para ofrecer una recomendación individualizada de profilaxis antiemética a cada sujeto. En la figura 1 puede observarse, a modo de ejemplo, la primera pantalla del aplicativo.
Aplicativo MASCC para establecer el riesgo emetógeno en los pacientes (primera pantalla)10.
Los antagonistas de los receptores de dopamina como la metoclopramida se emplearon como tratamiento en la profilaxis de la quimioterapia altamente emetógena (QAE), pero su principal inconveniente era que presentaban una menor eficacia a las dosis habituales, precisando dosis altas y presentando mayores efectos secundarios.
Posteriormente surgieron los antagonistas de los receptores de serotonina (ondansetrón, granisetrón), solos o en combinación con corticoides. Después de ondansetrón y granisetrón aparecieron nuevos fármacos con este mecanismo de acción como dolasetrón y palonosetrón1,3,8. Palonosetrón presenta una mayor afinidad por los receptores de serotonina y un tiempo de eliminación más elevado, aumentando su potencial antiemético sobretodo en la fase tardía como lo demuestran varios estudios que comparan palonosetrón con el resto de antiserotoninérgicos11,12.
Los fármacos más recientes son los antagonistas selectivos de los receptores NK1 de las neurocininas (aprepitant, fosaprepitant, netupitant). Estos medicamentos, asociados a una terapia estándar de corticoides y antagonistas de los receptores de serotonina, son capaces de incrementar la respuesta antiemética en los pacientes que reciben QAE, sobre todo las combinaciones que contienen palonosetrón2.
El último fármaco comercializado es una combinación de netupitant y palonosetrón (NEPA). Con base en los ensayos clínicos, los pacientes con NEPA mostraron tasas no inferiores de respuesta completa, es decir sin emesis y sin necesidad de fármacos de rescate, en comparación con palonosetrón en tratamientos con quimioterapia altamente y moderadamente emetógena2,13,14. Estas tasas se observaron tanto en emesis aguda como tardía.
Disponer de distintos grupos de fármacos y vías de administración permiten ir escalando el tratamiento antiemético procurando una buena profilaxis, dado que un mal control previo de la emesis es el principal factor de riesgo para no lograr un buen control en los ciclos sucesivos1–3,5,7,8.
En 2017 se publicaron las nuevas guías de la National Comprehensive Cancer Network (NCCN)15 y American Society of Clinical Oncology (ASCO)16 y en 2016, las de la Multinational Association of Supportive Care in Cancer (MASCC), en asociación con la European Society for Medical Oncology (ESMO)4. La principal novedad de estas guías es la incorporación del esquema AC (antraciclinas-ciclofosfamida) como QAE y de la triple terapia para la profilaxis antiemética para el carboplatino. Así pues, actualmente, el tratamiento más recomendado en todas las guías para la prevención de NV en QAE y en carboplatino es la triple terapia antiemética con antagonistas de los receptores de serotonina, antagonistas selectivos de los receptores NK1 y corticoides4,15,16. En los pacientes con mal control de la emesis se puede emplear la cuádruple terapia añadiendo una pauta de 5 días con olanzapina4,15,16. La adherencia a las guías clínicas antieméticas comporta un buen control de las NV y mejora la calidad de vida de los pacientes17.
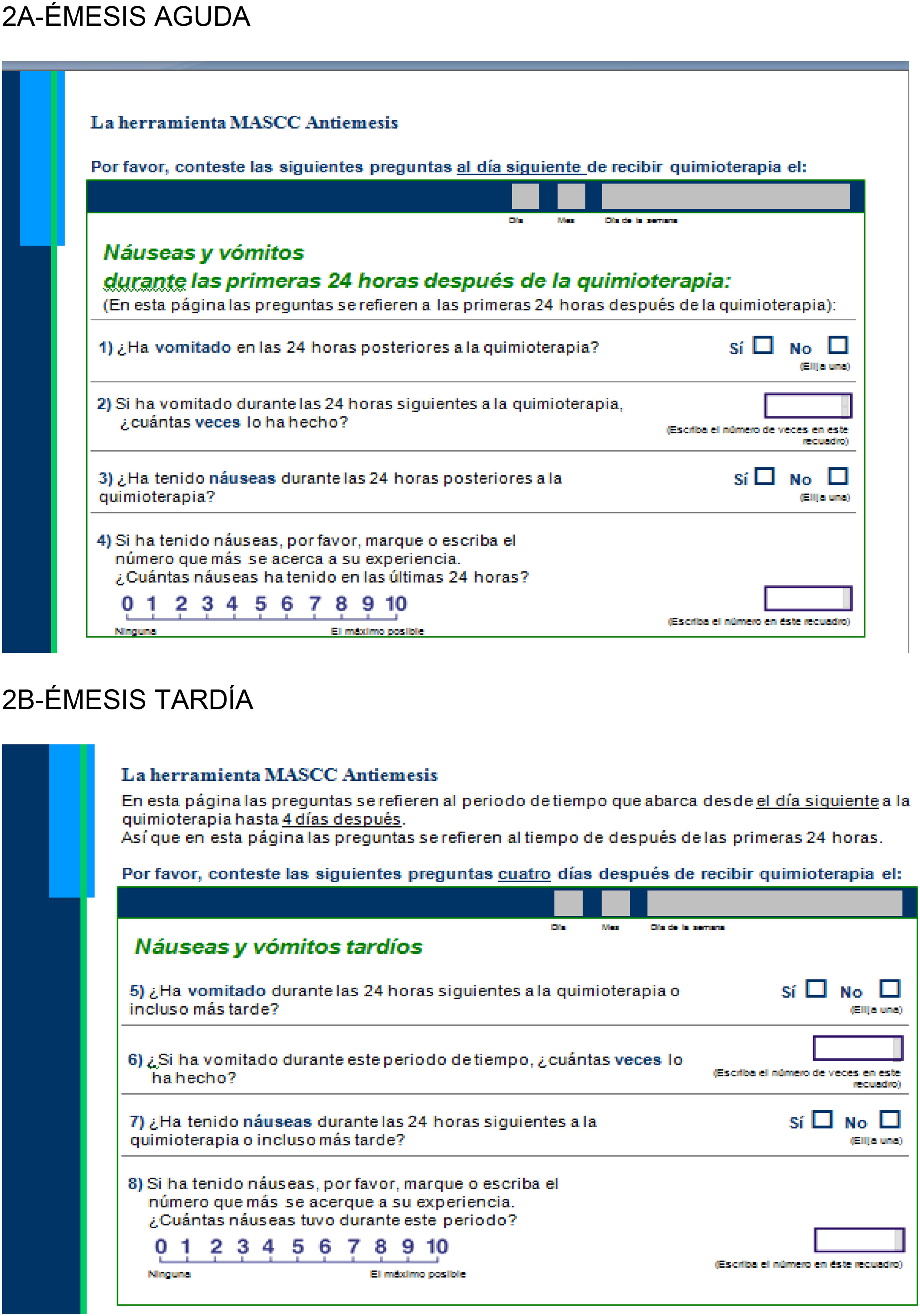
Existen distintos cuestionarios para medir la efectividad de las terapias antieméticas, como por ejemplo el MASCC Antiemesis Tool18 que hace referencia tanto a la emesis aguda (fig. 2A) como a la tardía (fig. 2B).
Como puede observarse en las figuras 2A y 2B, los cuestionarios consisten en 4 preguntas para cada tipo de emesis que deben ser contestadas por el paciente.
Debido a la inclusión del NEPA en la Guía Farmacoterapéutica del hospital, se realizó la modificación de las pautas antieméticas asistenciales así como una formación específica y actualización sobre antiemesis a los médicos prescriptores.
Los objetivos del presente trabajo fueron:
- -
Evaluar la adherencia a la guía de la MASCC/ESMO en el uso de las pautas antieméticas en la profilaxis de QAE, incluyendo los esquemas con AC y la triple terapia para carboplatino en nuestro entorno, de forma previa a la introducción del NEPA en la Guía Farmacoterapéutica del hospital y posteriormente a dicha introducción y formación a los prescriptores.
- -
Analizar la efectividad de dichas pautas antieméticas.
- -
Determinar el ahorro económico que conllevó la inclusión de NEPA vía oral (vo) y dexametasona intravenosa (iv) (NEPAd) respecto a la pauta previa que consistía en fosaprepitant (F) junto a ondansetrón (O) y dexametasona (DXM) (FOD iv).
Se llevó a cabo un estudio observacional prospectivo durante 4 meses incluyendo los pacientes mayores de 18 años que iniciaron QAE y aceptaron voluntariamente participar en el estudio.
Previamente a la incorporación del NEPA vo y para poder realizar posteriormente un estudio comparativo se incluyeron durante 2 meses los pacientes con QAE que recibieron antiemesis con FOD iv, y posteriormente, tras la incorporación del NEPA a la práctica asistencial, se llevó a cabo otro periodo de inclusión de 2 meses de los pacientes con QAE tratados con NEPAd.
La guía antiemética MASCC/ESMO4 se utilizó para la clasificación del riesgo emetógeno de la quimioterapia. Los esquemas con carboplatino y AC fueron incluidos en el análisis, según lo establecido por la guía4.
La adherencia a las pautas se definió de acuerdo con las recomendaciones de tratamiento antiemético de la guía MASCC/ESMO de 20164, que era la última versión actualizada en el momento en que se realizó la revisión de las pautas antieméticas.
La efectividad de las pautas antieméticas previa y posteriormente a la introducción del NEPA en el hospital fue evaluada mediante la encuesta validada de la MASCC en español18, cuya puntuación, que va de 0 a 10, se basa en la aparición de NV en las primeras 24 horas después del tratamiento y en las 96 horas siguientes, el registro tras la revisión de la historia clínica del paciente para la comprobación de si este había requerido medicación de rescate y si había acudido a urgencias o había estado ingresado por causa de episodios de NV. Se diseñó una hoja de información para el paciente y consentimiento informado para la obtención de las encuestas MASCC.
Se registraron las variables demográficas, quimioterapia (QT) prescrita, localización tumoral, riesgo emetógeno de cada paciente según la herramienta CINV Risk Assessment10, pauta antiemética prescrita, concordancia con la guía MASCC4 y su efectividad.
El estudio farmacoeconómico se realizó mediante un análisis de minimización de costes, basándose en los costes directos de adquisición. El resultado de dicho análisis se ha expresado en porcentaje de disminución de coste de un fármaco respecto al otro.
El estudio fue autorizado por el CEIm del centro.
Análisis estadístico: se llevó a cabo estadística descriptiva de las variables cuantitativas con medias y desviación estándar. Se determinó la mediana, el rango y la distancia intercuartil 25–75 (IQR 25–75) para las variables sin distribución normal. Las variables cualitativas se expresaron en números absolutos y porcentajes.
Tras verificar el comportamiento no paramétrico de las variables mediante la prueba de Kolmogorov–Smirnov, la eficacia de ambas alternativas se analizó mediante la prueba de U de Mann–Whitney para variables independientes, considerando efectividad parecida e igualdad de variancias por el test de Leven. Se consideró significación estadística p < 0,05.
El análisis estadístico se realizó con el programa estadístico Minitab-18.1.
ResultadosSe incluyeron 61 pacientes, de las que un 62% fueron mujeres, con una mediana de edad de 60,16 (rango ±11,3).
En el periodo 1 se analizaron 24 pacientes con una mediana de edad de 61 (±10,62) de las cuales el 50% fueron mujeres. En el periodo 2 se analizaron 37 pacientes con una mediana de edad de 59 (±13,54) de las cuales el 70,3% fueron mujeres.
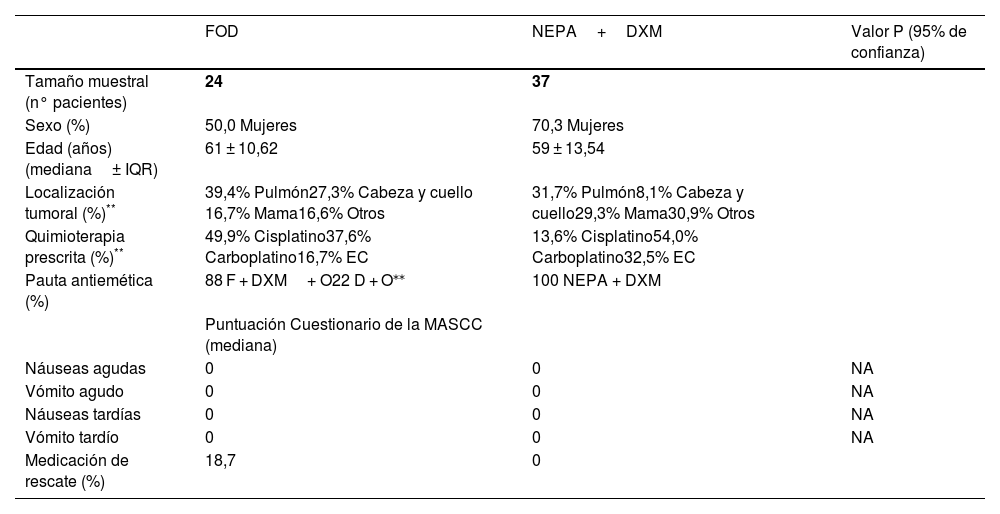
Los datos de las principales variables estudiadas estratificadas en los 2 periodos de estudio pueden observarse en la tabla 1.
Comparativa de los datos demográficos y la puntuación obtenida de los cuestionarios de la MASCC de F + O + DXM con NEPA + DXM
| FOD | NEPA+DXM | Valor P (95% de confianza) | |
|---|---|---|---|
| Tamaño muestral (n° pacientes) | 24 | 37 | |
| Sexo (%) | 50,0 Mujeres | 70,3 Mujeres | |
| Edad (años) (mediana± IQR) | 61 ± 10,62 | 59 ± 13,54 | |
| Localización tumoral (%)** | 39,4% Pulmón27,3% Cabeza y cuello 16,7% Mama16,6% Otros | 31,7% Pulmón8,1% Cabeza y cuello29,3% Mama30,9% Otros | |
| Quimioterapia prescrita (%)** | 49,9% Cisplatino37,6% Carboplatino16,7% EC | 13,6% Cisplatino54,0% Carboplatino32,5% EC | |
| Pauta antiemética (%) | 88 F + DXM+ O22 D + O⁎⁎ | 100 NEPA + DXM | |
| Puntuación Cuestionario de la MASCC (mediana) | |||
| Náuseas agudas | 0 | 0 | NA |
| Vómito agudo | 0 | 0 | NA |
| Náuseas tardías | 0 | 0 | NA |
| Vómito tardío | 0 | 0 | NA |
| Medicación de rescate (%) | 18,7 | 0 |
Los esquemas más frecuentemente prescritos coinciden en los 2 periodos de recogida de datos, siendo con un 78,4% en el primer periodo y un 90% en el segundo periodo los esquemas basados en platinos, aunque los esquemas difieren en sus porcentajes entre periodos (tabla 1).
Según la CINV Risk Assessment10, el 54,1 y el 60,6% de los pacientes presentaban un perfil de riesgo emetógeno alto en el periodo 1 y 2, respectivamente.
En el primer periodo un 22% de las pautas antieméticas no coincidían con las recomendaciones MASCC. En 2 pacientes la QT implicada era carboplatino y en 6 se trataba de esquemas de AC, concretamente epirubicina-ciclofosfamida.
En el segundo periodo el 100% de las pautas fueron coincidentes.
En el periodo 1, la puntuación de los cuestionarios de efectividad fue de protección total en el 90,9% en las náuseas agudas. El 9,1% que no reportó protección total corresponde a 3 pacientes cuya puntuación fue de 5,2 y 1, respectivamente. En referencia a los vómitos agudos y las náuseas tardías la protección fue del 100%, y del 72,7% en los vómitos tardíos.
En el periodo 2 los datos fueron de protección total en el 94,6% en las náuseas agudas. El 5,4% que no reportó protección total corresponde a 2 pacientes cuya puntuación fue de 4 y 3, respectivamente. En referencia a los vómitos agudos, las náuseas y vómitos tardíos la protección fue también del 100%.
La frecuencia de uso de medicación de rescate fue del 18,7% en el periodo 1 y del 0% en el periodo 2.
No se observó en ningún caso la ausencia de profilaxis antiemética.
No se detectó ninguna visita a urgencias ni ingreso causado por NVIQ en ninguno de los periodos.
Considerando la triple terapia FOD como el 100% de los costes, el uso de NEPAd comportó una reducción del 28%.
DiscusiónEn la actualidad, existen distintas terapias antieméticas disponibles y recomendadas en las guías antieméticas internacionales. Sin embargo, está descrito que el 61% de los pacientes que reciben terapia antiemética presenta NVIQ, lo que sugiere un control deficiente de estas19.
En este estudio, se ha recogido la concordancia del uso de esquemas antieméticos en la QAE en nuestro ámbito respecto a con la guía antiemética MASCC/ASCO 2016.
Las directrices internacionales sobre antieméticos coinciden en que la profilaxis de las NVIQ debe ser el objetivo principal de la terapia antiemética y debe determinarse sobre la base de la emetogenicidad de la quimioterapia, los antecedentes de las NVIQ y los factores de riesgo individuales. Por lo tanto, la profilaxis debe implementarse en pacientes con un riesgo de NVIQ del 10% o más y cubrir todo el período de riesgo19.
Los protocolos antieméticos empleados en nuestro centro reflejaron una elevada adhesión a las últimas recomendaciones de la guía de antiemesis de la MASCC/ESMO en el primer periodo, aumentando hasta el 100% en el segundo periodo estudiado.
Las discrepancias detectadas en el primer periodo se debieron a esquemas con carboplatino y en especial a esquemas AC, aunque en ninguna de ellas se observó un peor control de las NV. Este hallazgo resulta llamativo puesto que podría evidenciar que no es necesaria la triple terapia en algunos pacientes a pesar de las últimas recomendaciones y nos conduce a pensar que es necesario un tratamiento personalizado en función de los riesgos individuales, independientemente del riesgo inicial que presente la QT a administrar. También se podría plantear una monitorización estrecha durante las primeras infusiones de QT para ajustar la medicación antiemética en función de las necesidades individuales.
El uso de medicación de rescate fue anecdótico y no comportó ingresos en ninguno de los periodos estudiados.
Este resultado se contrapone a una reciente publicación llevada a cabo en nuestro país que también revisaba el uso de pautas antieméticas en QAE y que objetivó que el porcentaje de pacientes que recibían profilaxis antiemética basada en antagonistas NK1 era bajo, y que solo se prescribía en el 29% de los casos, comprobando que el uso de la triple terapia recomendada según las guías MASC/ESMO4 se obtuvo únicamente en un 8% de los pacientes analizados19. También detectó que en un 8,46% de tratamientos de QAE no se administró profilaxis antiemética para la prevención de las NVIQ.
Los autores comentan que estos resultados son notables, especialmente si se tiene en cuenta que desde 2004, los antagonistas de NK1 en asociación con antagonistas de los receptores de 5-HT3 y corticoesteroides están incluidos en las guías MASCC/ESMO4 para el manejo de NVIQ en pacientes que reciben QAE.
El bajo porcentaje de concordancia en el estudio español pudo ser debido según sus autores al corto período entre la inclusión de las recomendaciones en las guías de 2016 y 2017 y el tiempo de realización de su análisis, consideran que pudo haber sido insuficiente para permitir la total integración e implementación de estas recomendaciones en la práctica clínica.
Así mismo en otros estudios realizados en España también se ha informado sistemáticamente de una baja adherencia a las directrices de 2004 y sus posteriores actualizaciones20,21.
Este hallazgo se detectó también en otros estudios observacionales realizados en Europa y Estados Unidos22,23.
El presente trabajo se ha llevado a cabo tras varios años desde la publicación de las nuevas recomendaciones y tras formación expresa al equipo médico de oncólogos, así como al de farmacia oncológica en una sesión conjunta. Este hecho puede haber condicionado la obtención de una mayor concordancia la cual también mejoró con el paso de los meses al consolidarse las nuevas recomendaciones.
Algunos estudios destacan que son muchos los médicos que tendrían una percepción inadecuada del riesgo emetógeno asociado a la quimioterapia y que este motivo es una de las principales causas de la baja adherencia a las guías19,24.
Por otra parte, una publicación europea concluyó que los pacientes que habían recibido profilaxis antiemética de acuerdo a las guías presentaban un control significativamente mejor de las NVIQ que aquéllos que no lo recibieron17. Se observaron resultados similares en 2 estudios llevado a cabo en Estados Unidos24 y Reino Unido25 respectivamente.
Dichos estudios mostraron nuevamente la baja adherencia a las recomendaciones en profilaxis antiemética. En el estudio inglés, la adherencia a las guías fue solo del 29%, mientras que en el estudio estadounidense fue del 29% para los pacientes que recibieron QAE y del 73% para los pacientes que recibieron QT moderadamente emetógena. Tras la formación que acompañó a la introducción del NEPA, sorprende que la adherencia a las guías no se modificó, con ambas estrategias antieméticas estuvo alrededor del 70%.
En cuanto a la localización más frecuente del cáncer tratado se observó que en el trabajo español destacan la mama y el cáncer colorrectal mientras que en nuestro ámbito fueron el pulmón y la mama, sin haber considerado en ningún caso el oxaliplatino como QAE. Destaca en este punto que la guía MASCC no recoge oxaliplatino como fármaco altamente emetógeno ni recomienda el empleo de la triple terapia antiemética en estos esquemas.
No obstante, ambos trabajos coinciden en que la mayoría de QAE analizadas correspondían mayoritariamente a QAE basadas en cisplatino.
El cisplatino solo o en combinación con gemcitabina fue el tratamiento que se administró con mayor frecuencia a los pacientes en el estudio que analizaba la práctica clínica nacional, lo que coincide también con nuestro entorno en que la quimioterapia más prescrita fue la basada en platinos.
La herramienta CINV Risk Assessment no resultó de gran utilidad para conocer el riesgo individual del paciente, dado que el riesgo asignado a carboplatino y AC no ha sido actualizado en base a las nuevas guías. El 39,4% de pacientes no se clasificaban como pacientes en riesgo emetógeno alto, básicamente debido a la QT, ya fuera carboplatino o EC y no por causa de los factores de riesgo individuales de los pacientes.
Las encuestas cumplimentadas por los pacientes sugieren que las 2 triples terapias antieméticas podrían presentar una efectividad similar en la práctica clínica.
Esto coincide con los resultados de un ensayo clínico aleatorizado fase III conducido en Asia, que comparaba NEPA vo más DXM con aprepitant-granisetrón vo más DXM en pacientes que recibieron QAE26. Es importante destacar que este estudio publicado en 2018 fue la primera comparación directa de 2 regímenes que presentaban la combinación de la triple terapia antiemética y demostró la no inferioridad de una dosis única de NEPA vo más DXM, en comparación con el régimen de aprepitant-granisetrón-DXM vo de 3 días, en términos de protección antiemética completa aguda y tardía.
Aun no siendo exactamente los fármacos analizados y ante la ausencia de ensayos que los comparen, se podrían extrapolar estos resultados y consolidarlos con los resultados obtenidos en nuestra muestra.
NEPA presenta la ventaja de proporcionar en una única formulación 2 fármacos dirigidos a 2 vías emetógenas diferentes y además presenta una vida media larga que permite dosificarlo en dosis única previo al tratamiento de quimioterapia y su efecto se mantiene durante 5 días, lo que facilitaría la adherencia al tratamiento antiemético2. Es necesario asociarlo a la toma de corticoides para que el tratamiento sea eficaz. Es un fármaco bien tolerado con un perfil de seguridad favorable. En la bibliografía revisada no se observaron efectos adversos inesperados con un perfil similar al de los regímenes basados en palonosetrón y aprepitant2.
Por otro lado, si se tiene en cuenta el hecho de que algunos pacientes son reacios a tomar medicación, NEPA es la única combinación fija de un antagonista de receptores de NK1 y un antagonista de los receptores de 5-HT3 aportando un esquema de administración más simple, con menor número de comprimidos y pudiendo resultar más conveniente para algún perfil de paciente.
En el caso de pacientes que no toleren la vía oral sería necesario recurrir a la formulación intravenosa de fosaprepitant, anti5HT3 y corticoides, pero no se dió el caso durante el segundo periodo del estudio.
La inclusión de NEPA en la Guía Farmacoterapéutica ha comportado una disminución de costes en el control de NV sin disminuir la eficacia, por tanto, su uso es una opción eficiente.
Hay que destacar que las medidas restrictivas implementadas durante el período de pandemia COVID-19 ocasionaron que el tamaño muestral haya sido excepcionalmente menor a lo previsto, especialmente en el primer periodo estudiado.
A modo de conclusión podemos afirmar que aunque hemos obtenido buenos resultados en cuanto a la concordancia con las últimas recomendaciones de la guía MASCC/ESMO, no hemos incorporado en su totalidad los cambios referentes a la incorporación de carboplatino y AC. Por ello, es necesario un estrecho seguimiento de las actualizaciones de las recomendaciones en antiemesis, una constante formación de todos los profesionales implicados y un seguimiento estrecho de los pacientes en el que el servicio de farmacia podría tener un destacado papel.
Las pautas antieméticas basadas en FOD iv y NEPAd han mostrado una efectividad similar en nuestro entorno, posicionándose NEPAd como la opción más eficiente.
Aportación a la literatura científicaA pesar de los avances en el manejo de los síntomas, las náuseas y los vómitos inducidos por la quimioterapia siguen siendo uno de los efectos secundarios con más impacto en la calidad de vida entre los pacientes que se someten a quimioterapia sistémica1.
Algunos estudios que analizan la práctica clínica evidencian que las pautas no se siguen de manera uniforme2,3. Tanto el personal médico como la enfermería reconocen que la prescripción de antieméticos no es consistente con las recomendaciones de las últimas guías, especialmente en el entorno de la quimioterapia altamente emetógena2,3.
El siguiente estudio se llevó a cabo en un hospital universitario de 800 camas para analizar la práctica clínica relacionada con la profilaxis antiemética con esquemas altamente emetógenos en nuestro entorno.
AutoríaSusana Redondo Capafons: concepción y diseño del trabajo, recogida de datos, análisis, interpretación de los datos, escritura del artículo y aprobación de la versión final para su publicación.
Laura Soriano Gutierrez: concepción y diseño del trabajo, recogida de datos, análisis, interpretación de los datos, escritura del artículo y aprobación de la versión final para su publicación.
Elsa Dalmau Portulas: concepción y diseño del trabajo y aprobación de la versión final para su publicación.
Àlex Barragán Muñoz: recogida de datos, análisis e interpretación de datos y aprobación de la versión final para su publicación.
Sergio Martínez Robles: recogida de datos y aprobación de la versión final para su publicación.
Mònica Gómez-Valent: aprobación de la versión final para su publicación.