el uso off-label de medicamentos requiere respaldo científico para equilibrar el balance riesgo/beneficio, limitándose a casos excepcionales en los que no existen alternativas terapéuticas.
Métodosestudio descriptivo retrospectivo de los informes de la Comisión de Farmacia y Terapéutica, entre 2018 y 2022, en un hospital de tercer nivel. Se analizaron las solicitudes, los medicamentos, el dictamen final y los motivos, el nivel de evidencia y el impacto económico.
Resultadosse analizaron 124 informes, destacando enfermedades oncohematológicas (41,9%) y autoinmunes (27,4%) como principales indicaciones. Oncología (37,1%) y Pediatría (18,5%) fueron los principales solicitantes, con un 87,9% de medicamentos antineoplásicos e inmunomoduladores. El 74,2% de las solicitudes fueron aprobadas por falta de alternativas y evidencia sólida (ensayos fase II-III), mientras que el 25,8% fueron denegadas por disponibilidad de opciones terapéuticas o evidencia insuficiente. En cuanto al coste, el 53% de los fármacos oncohematológicos tenían un precio comprendido entre 10.000 y 50.000 €/tratamiento, y el 62,1% de los no oncohematológicos entre 1.000 y 10.000 €/año. La aprobación de los tratamientos rechazados habría generado un gasto adicional de 2.272.603 €.
Conclusiónse evidenció un aumento de hasta 4 veces en la evaluación de medicamentos de uso off-label, con una alta tasa de aprobación.
The off-label use of drugs requires scientific support to balance risk/benefit, being limited to exceptional cases in which there are no therapeutic alternatives.
MethodsRetrospective descriptive study of the reports of the Pharmacy and Therapeutics Committee between 2018 and 2022 in a third level hospital; analyzing the requests, drugs, final opinion, reasons, level of evidence and economic impact.
ResultsA total of 124 reports were analyzed, highlighting oncohematological (41.9%) and autoimmune (27.4%) diseases as main indications. Oncology (37.1%) and Pediatrics (18.5%) were the main applicants, with 87.9% for antineoplastic and immunomodulatory drugs. A total of 74.2% of the applications were approved due to lack of alternatives and solid evidence (phase II-III trials), while 25.8% were denied due to the availability of therapeutic options or insufficient evidence. In terms of cost, 53% of oncohematological drugs cost between €10,000–50,000/treatment and 62.1% of non-oncohematological drugs cost between €1,000–10,000/year. Approval of the rejected treatments would have generated an additional expenditure of €2,272,603.
ConclusionAn increase of up to four times in the evaluation of off-label use drugs was evidenced, with a high approval rate.
Los medicamentos de uso off-label hacen referencia al uso en población, posología o indicación diferentes a la aprobada en la ficha técnica, siendo esta última la más común1,2. Se trata de una práctica clínica considerada una alternativa terapéutica que debe estar respaldada por evidencia científica que demuestre una relación beneficio/riesgo favorable3,4. Entre las causas se encuentra la baja representatividad o exclusión de ciertas minorías en ensayos clínicos (EECC), como es el caso de los pacientes pediátricos, geriátricos o embarazadas5. Por otro lado, la demora en la publicación de los resultados de los EECC o en la autorización por las agencias reguladoras1. Otro motivo es el desinterés de los laboratorios para solicitar la autorización de nuevas indicaciones, debido al bajo coste de fármacos ya comercializados para dichas indicaciones, o el reducido target de pacientes1,3. Por último, las situaciones terminales pueden motivar la prescripción de un fármaco de uso off-label5.
En consecuencia, las áreas más prevalentes son pediatría, psiquiatría y oncohematología6. La población pediátrica se encuentra infrarepresentada en EECC, debido al alto coste, el bajo rendimiento y las implicaciones éticas7. Los pacientes psiquiátricos también arrastran cuestiones éticas, lo que disminuye su inclusión en EECC6,8. Mientras que los pacientes oncohematológicos suelen agotar las líneas de tratamiento estándar y, debido a la gravedad de la enfermedad, se facilita el acceso a fármacos con beneficio clínico, aunque no estén aprobados4.
En España, el Real Decreto 1015/2009 regula los medicamentos en situaciones especiales, donde se recoge que el uso de medicamentos en condiciones diferentes a las autorizadas tiene carácter excepcional y se restringe a situaciones con ausencia de alternativas autorizadas2,6. El médico debe justificar su uso, e informar al paciente de la relación riesgo/beneficio, obteniendo su consentimiento según la Ley 41/20029, y la Comisión de Farmacia y Terapéutica (CFT) es quien asume la evaluación de cada solicitud2. Los farmacéuticos miembros elaboran un informe con propuesta de resolución, según la situación clínica del paciente, la evidencia científica, la disponibilidad de alternativas (autorizadas o no), el coste y la conveniencia. La decisión final se toma mediante votación del resto de vocales de la CFT.
El objetivo de este estudio es analizar los casos de uso off-label solicitados a la CFT entre 2018 y 2022, así como sus resoluciones y el grado de evidencia en el que se sustentaron las decisiones finales.
MétodosSe realizó un estudio descriptivo retrospectivo de los informes realizados por la CFT, en relación a las características de las solicitudes, los medicamentos y el dictamen final. Respecto a las solicitudes, se recogió: número total de peticiones, año de solicitud, sexo y edad del paciente, tipo de indicación terapéutica y servicio peticionario. Respecto al medicamento solicitado, se registró: clasificación ATC, tipo de dispensación, condición de seguimiento adicional y medicamento huérfano, y año de autorización. También se calculó el coste del tratamiento, de forma anual para medicamentos no oncohematológicos, y el del tratamiento completo para fármacos oncohematológicos. En referencia al dictamen, se recogió la decisión final y el motivo. En el caso de solicitudes aprobadas se categorizaron en: a) por ausencia de terapias autorizadas, y b) por ausencia de terapias autorizadas y no autorizadas; y en el caso de solicitudes denegadas: a) disponibilidad de alternativa en el arsenal terapéutico (autorizadas u off-label), b) falta de evidencia que avale un beneficio/riesgo favorable, c) relación coste/beneficio desfavorable. Por último, se analizó el nivel de evidencia que sustentó la decisión.
ResultadosSe localizaron 124 informes correspondientes a 50 fármacos en 74 indicaciones distintas. La distribución en los diferentes años fue la siguiente: 13 informes en 2018, 12 en 2019, 16 en 2020, 32 en 2021 y 51 en 2022.
Las características de las solicitudes, y de los medicamentos solicitados, están recogidas en la tabla 1. Las indicaciones más comunes fueron enfermedades oncohematológicas (41,9%), autoinmunes (27,4%) y hematológicas (10,5%). Los principales servicios solicitantes fueron oncología (37,1%) y pediatría (18,5%). La mayoría de los medicamentos (87,9%) pertenecían al grupo L (antineoplásicos e inmunomoduladores).
Características de las solicitudes de medicamentos de uso off-label evaluados (2018–2022)
| Solicitados | Aprobados | |
|---|---|---|
| n (%) | n (%) | |
| Total | 124 (100) | 92 (74,2) |
| Año de solicitud | ||
| 2018 | 13 (10,5) | 6 (46,2) |
| 2019 | 12 (9,7) | 10 (83,3) |
| 2020 | 16 (12,9) | 13 (81,3) |
| 2021 | 32 (25,8) | 23 (71,9) |
| 2022 | 51 (41,1) | 40 (78,4) |
| Sexo del paciente | ||
| Mujer | 114 (91,9) | 83 (72,8) |
| Hombre | 10 (8,1) | 9 (90,0) |
| Edad del paciente | ||
| Media | 40 | 37 |
| 0–18 años | 31 (25,0) | 26 (83,9) |
| 19–30 años | 13 (10,5) | 10 (76,9) |
| 31–50 años | 31 (25,0) | 24 (77,4) |
| 51–65 años | 31 (25,0) | 19 (61,3) |
| 66–80 años | 16 (12,9) | 13 (81,3) |
| >80 años | 2 (1,6) | 0 (0) |
| Indicación terapéutica | ||
| Oncológica | 52 (41,9) | 35 (67,3) |
| Autoinmune | 34 (27,4) | 29 (85,3) |
| Hematológica | 13 (10,5) | 9 (69,2) |
| Dermatológica | 9 (7,3) | 5 (55,6) |
| Infecciosa | 7 (5,6) | 7 (100) |
| Neurológica | 5 (4,0) | 3 (60,0) |
| Cardiovascular | 4 (3,2) | 4 (100) |
| Servicio peticionario | ||
| Oncología médica | 46 (37,1) | 31 (67,4) |
| Pediatría | 23 (18,5) | 19 (82,6) |
| Dermatología | 18 (14,5) | 12 (66,7) |
| Hematología | 15 (12,1) | 12 (80,0) |
| Nefrología | 11 (8,9) | 10 (90,9) |
| Digestivo | 2 (1,6) | 0 (0) |
| Enfermedades infecciosas | 2 (1,6) | 2 (100) |
| Neurología | 2 (1,6) | 2 (100) |
| Salud mental | 2 (1,6) | 1 (50,0) |
| Traumatología | 1 (0,8) | 1 (100) |
| Urología | 1 (0,8) | 1 (100) |
| Medicina interna | 1 (0,8) | 1 (100) |
| Características del medicamento solicitado | ||
| Clasificación ATC | ||
| L: Antineoplásicos e inmunomoduladores | 109 (87,9) | 78 (71,6) |
| J: Antiinfecciosos para uso sistémico | 4 (3,2) | 4 (100) |
| N: Sistema nervioso | 3 (2,4) | 2 (66,7) |
| V: Varios | 3 (2,4) | 3 (100) |
| B: Sangres y órganos hematopoyéticos | 2 (1,6) | 2 (100) |
| M: Sistema musculoesquelético | 2 (1,6) | 2 (100) |
| R: Sistema respiratorio | 1 (0,8) | 1 (100) |
| Tipo de dispensación | ||
| DH | 64 (51,6) | 43 (67,2) |
| H | 60 (48,4) | 49 (81,7) |
| Seguimiento adicional | 40 (32,3) | 24 (60,0) |
| Medicamento huérfano | 16 (12,9) | 14 (87,5) |
| Año de autorización del medicamento | ||
| 1995–1999 | 9 (7,3) | 9 (100) |
| 2000–2004 | 13 (10,5) | 12 (92,3) |
| 2005–2009 | 23 (18,5) | 19 (82,6) |
| 2010–2014 | 21 (16,9) | 16 (76,2) |
| 2014–2020 | 56 (45,2) | 35 (62,5) |
| 2020–2022 | 2 (1,6) | 1 (50,0) |
H: uso hospitalario. DH: diagnóstico hospitalario.
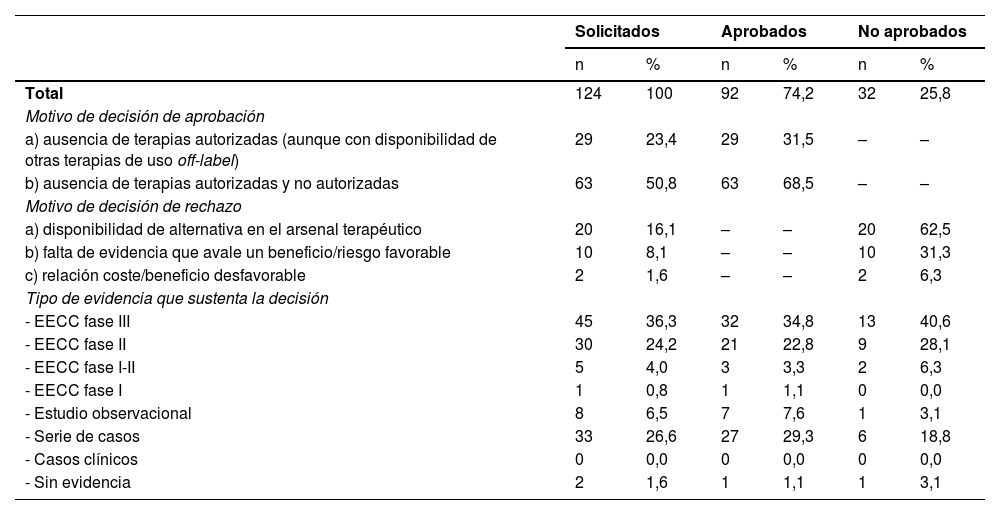
De los 124 informes de evaluación, 92 (74,2%) obtuvieron un dictamen favorable (tabla 2). De estos, el 68,5% fueron aprobados por falta de alternativas autorizadas, mientras que el 31,5% restantes fueron aprobados a pesar de la disponibilidad de otras terapias off-label. El 34,8% de las aprobaciones se basaron en EECC fase III, seguidas de series de casos (29,3%) y EECC fase II (22,8%).
Resoluciones de las solicitudes tras la evaluación por Comisión de Farmacia, motivos y base de evidencia
| Solicitados | Aprobados | No aprobados | ||||
|---|---|---|---|---|---|---|
| n | % | n | % | n | % | |
| Total | 124 | 100 | 92 | 74,2 | 32 | 25,8 |
| Motivo de decisión de aprobación | ||||||
| a) ausencia de terapias autorizadas (aunque con disponibilidad de otras terapias de uso off-label) | 29 | 23,4 | 29 | 31,5 | – | – |
| b) ausencia de terapias autorizadas y no autorizadas | 63 | 50,8 | 63 | 68,5 | – | – |
| Motivo de decisión de rechazo | ||||||
| a) disponibilidad de alternativa en el arsenal terapéutico | 20 | 16,1 | – | – | 20 | 62,5 |
| b) falta de evidencia que avale un beneficio/riesgo favorable | 10 | 8,1 | – | – | 10 | 31,3 |
| c) relación coste/beneficio desfavorable | 2 | 1,6 | – | – | 2 | 6,3 |
| Tipo de evidencia que sustenta la decisión | ||||||
| - EECC fase III | 45 | 36,3 | 32 | 34,8 | 13 | 40,6 |
| - EECC fase II | 30 | 24,2 | 21 | 22,8 | 9 | 28,1 |
| - EECC fase I-II | 5 | 4,0 | 3 | 3,3 | 2 | 6,3 |
| - EECC fase I | 1 | 0,8 | 1 | 1,1 | 0 | 0,0 |
| - Estudio observacional | 8 | 6,5 | 7 | 7,6 | 1 | 3,1 |
| - Serie de casos | 33 | 26,6 | 27 | 29,3 | 6 | 18,8 |
| - Casos clínicos | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| - Sin evidencia | 2 | 1,6 | 1 | 1,1 | 1 | 3,1 |
EECC: ensayos clínicos.
De las 32 (25,8%) solicitudes no aprobadas, 20 (62,5%) fueron rechazadas por alternativas terapéuticas disponibles, 10 (31,3%) por falta de evidencia que avale el beneficio/riesgo favorable, y 2 (6,3%) por una relación coste/beneficio desfavorable. El 40,6% de las solicitudes no aprobadas se sustentaban en EECC fase III, el 28,1% en EECC fase II y el 18,8% en series de casos.
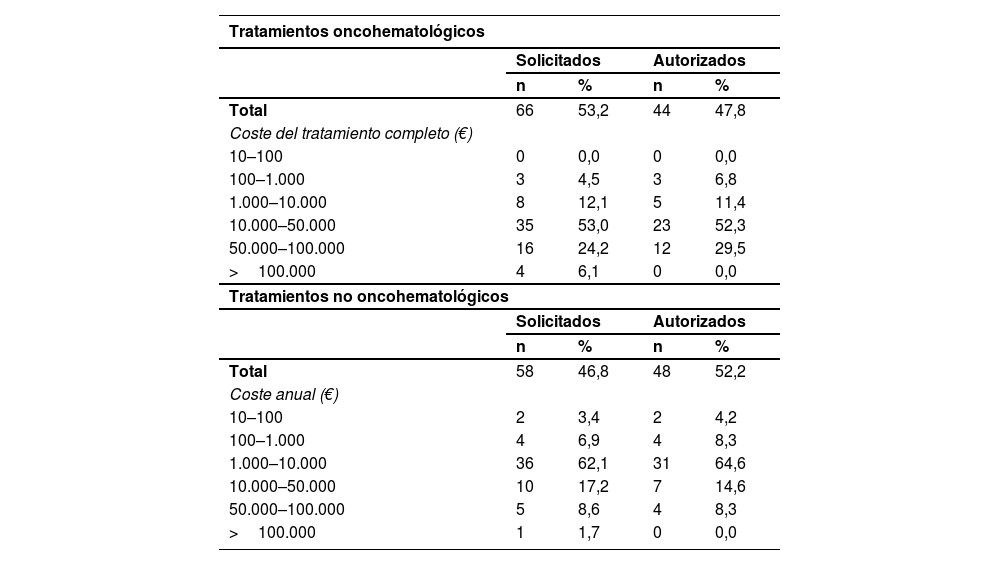
Sobre el impacto económico de la aprobación vía off-label (tabla 3), en el caso de los fármacos oncohematológicos, la mayoría de peticiones (53%) se sitúan entre los 10.000 y 50.000 €/tratamiento completo. Respecto a la tasa de aprobación, de las 66 solicitudes, se aprobaron 44. En el caso de los tratamientos no oncohematológicos, se registraron 58 solicitudes, de las cuales se aprobaron 48, situándose la mayoría entre los 1.000 y 10.000 €/año (62,1%). Se presentaron 5 solicitudes de alto impacto económico, superiores a 100.000 €, 4 de ellos de tratamientos oncohematológicos. Ninguna fue autorizada. El cálculo total del impacto presupuestario de los medicamentos aprobados asciende a 2.265.670 €. Se estimó que los tratamientos rechazados, de haber sido aprobados, habrían supuesto un gasto adicional de 2.272.603 €, incrementando el gasto total hasta los 4.538.274 €.
Impacto económico de las solicitudes de medicamentos de uso off-label y tasa de aprobación
| Tratamientos oncohematológicos | ||||
|---|---|---|---|---|
| Solicitados | Autorizados | |||
| n | % | n | % | |
| Total | 66 | 53,2 | 44 | 47,8 |
| Coste del tratamiento completo (€) | ||||
| 10–100 | 0 | 0,0 | 0 | 0,0 |
| 100–1.000 | 3 | 4,5 | 3 | 6,8 |
| 1.000–10.000 | 8 | 12,1 | 5 | 11,4 |
| 10.000–50.000 | 35 | 53,0 | 23 | 52,3 |
| 50.000–100.000 | 16 | 24,2 | 12 | 29,5 |
| >100.000 | 4 | 6,1 | 0 | 0,0 |
| Tratamientos no oncohematológicos | ||||
| Solicitados | Autorizados | |||
| n | % | n | % | |
| Total | 58 | 46,8 | 48 | 52,2 |
| Coste anual (€) | ||||
| 10–100 | 2 | 3,4 | 2 | 4,2 |
| 100–1.000 | 4 | 6,9 | 4 | 8,3 |
| 1.000–10.000 | 36 | 62,1 | 31 | 64,6 |
| 10.000–50.000 | 10 | 17,2 | 7 | 14,6 |
| 50.000–100.000 | 5 | 8,6 | 4 | 8,3 |
| >100.000 | 1 | 1,7 | 0 | 0,0 |
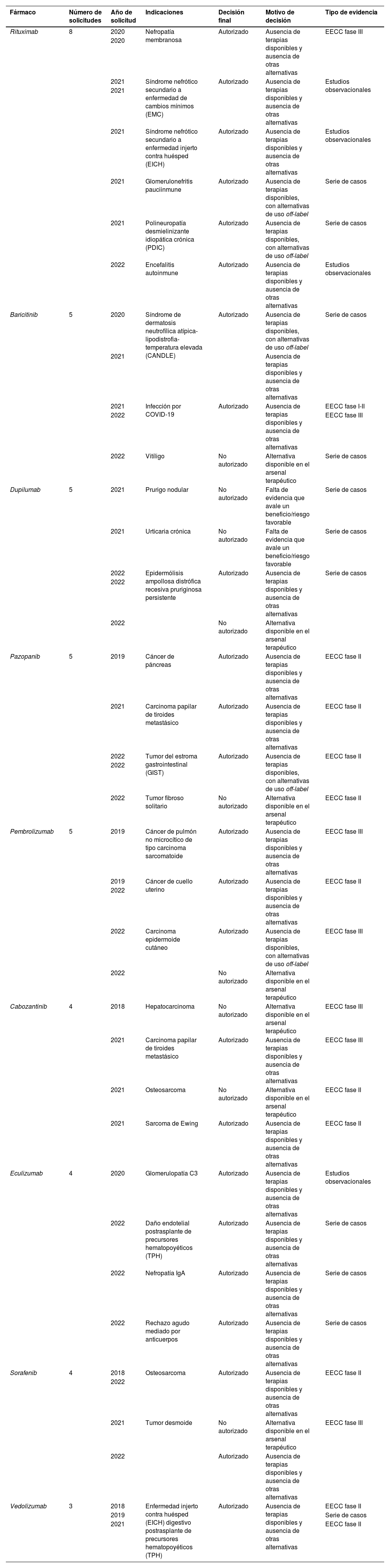
En la tabla 4 se resumen los fármacos solicitados con más frecuencia, su indicación y la resolución. Según el orden decreciente, se encuentran: rituximab, baricitinib, dupilumab, pazopanib, pembrolizumab, cabozantinib, eculizumab, sorafenib y vedolizumab.
Medicamentos más solicitados: indicaciones, decisión final, justificación y evidencia
| Fármaco | Número de solicitudes | Año de solicitud | Indicaciones | Decisión final | Motivo de decisión | Tipo de evidencia |
|---|---|---|---|---|---|---|
| Rituximab | 8 | 2020 | Nefropatía membranosa | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase III |
| 2020 | ||||||
| 2021 | Síndrome nefrótico secundario a enfermedad de cambios mínimos (EMC) | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | Estudios observacionales | ||
| 2021 | ||||||
| 2021 | Síndrome nefrótico secundario a enfermedad injerto contra huésped (EICH) | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | Estudios observacionales | ||
| 2021 | Glomerulonefritis pauciinmune | Autorizado | Ausencia de terapias disponibles, con alternativas de uso off-label | Serie de casos | ||
| 2021 | Polineuropatía desmielinizante idiopática crónica (PDIC) | Autorizado | Ausencia de terapias disponibles, con alternativas de uso off-label | Serie de casos | ||
| 2022 | Encefalitis autoinmune | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | Estudios observacionales | ||
| Baricitinib | 5 | 2020 | Síndrome de dermatosis neutrofílica atípica-lipodistrofia-temperatura elevada (CANDLE) | Autorizado | Ausencia de terapias disponibles, con alternativas de uso off-label | Serie de casos |
| 2021 | Ausencia de terapias disponibles y ausencia de otras alternativas | |||||
| 2021 | Infección por COVID-19 | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase I-II | ||
| 2022 | EECC fase III | |||||
| 2022 | Vitíligo | No autorizado | Alternativa disponible en el arsenal terapéutico | Serie de casos | ||
| Dupilumab | 5 | 2021 | Prurigo nodular | No autorizado | Falta de evidencia que avale un beneficio/riesgo favorable | Serie de casos |
| 2021 | Urticaria crónica | No autorizado | Falta de evidencia que avale un beneficio/riesgo favorable | Serie de casos | ||
| 2022 | Epidermólisis ampollosa distrófica recesiva pruriginosa persistente | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | Serie de casos | ||
| 2022 | ||||||
| 2022 | No autorizado | Alternativa disponible en el arsenal terapéutico | ||||
| Pazopanib | 5 | 2019 | Cáncer de páncreas | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase II |
| 2021 | Carcinoma papilar de tiroides metastásico | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase II | ||
| 2022 | Tumor del estroma gastrointestinal (GIST) | Autorizado | Ausencia de terapias disponibles, con alternativas de uso off-label | EECC fase II | ||
| 2022 | ||||||
| 2022 | Tumor fibroso solitario | No autorizado | Alternativa disponible en el arsenal terapéutico | EECC fase II | ||
| Pembrolizumab | 5 | 2019 | Cáncer de pulmón no microcítico de tipo carcinoma sarcomatoide | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase III |
| 2019 | Cáncer de cuello uterino | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase II | ||
| 2022 | ||||||
| 2022 | Carcinoma epidermoide cutáneo | Autorizado | Ausencia de terapias disponibles, con alternativas de uso off-label | EECC fase III | ||
| 2022 | No autorizado | Alternativa disponible en el arsenal terapéutico | ||||
| Cabozantinib | 4 | 2018 | Hepatocarcinoma | No autorizado | Alternativa disponible en el arsenal terapéutico | EECC fase III |
| 2021 | Carcinoma papilar de tiroides metastásico | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase III | ||
| 2021 | Osteosarcoma | No autorizado | Alternativa disponible en el arsenal terapéutico | EECC fase II | ||
| 2021 | Sarcoma de Ewing | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase II | ||
| Eculizumab | 4 | 2020 | Glomerulopatía C3 | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | Estudios observacionales |
| 2022 | Daño endotelial postrasplante de precursores hematopoyéticos (TPH) | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | Serie de casos | ||
| 2022 | Nefropatía IgA | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | Serie de casos | ||
| 2022 | Rechazo agudo mediado por anticuerpos | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | Serie de casos | ||
| Sorafenib | 4 | 2018 | Osteosarcoma | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase II |
| 2022 | ||||||
| 2021 | Tumor desmoide | No autorizado | Alternativa disponible en el arsenal terapéutico | EECC fase III | ||
| 2022 | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | ||||
| Vedolizumab | 3 | 2018 | Enfermedad injerto contra huésped (EICH) digestivo postrasplante de precursores hematopoyéticos (TPH) | Autorizado | Ausencia de terapias disponibles y ausencia de otras alternativas | EECC fase II |
| 2019 | Serie de casos | |||||
| 2021 | EECC fase II |
EECC: ensayos clínicos.
En este estudio, se observa un notable aumento de la actividad evaluadora, llegando a cuadruplicar el número de solicitudes, debido posiblemente a la incorporación de nuevos fármacos10 y a la aparición de nuevas enfermedades, donde destacamos la pandemia por COVID-19 en 202011. De los medicamentos solicitados, la mayoría pertenecían al grupo L de la clasificación ATC, con indicaciones en enfermedades oncohematológicas y autoinmunes y pertenecientes a los servicios de oncología médica y pediatría, datos alineados con el estudio de Pérez-Moreno et al.1, realizado en el mismo hospital en 2009–2011. La mayor parte de los fármacos solicitados para enfermedades autoinmunes pertenecían al servicio de pediatría, justificado por tratarse de un centro referente en enfermedades autoinmunes pediátricas.
Los resultados muestran una alta tasa de autorización, cerca del 75%, lo que evidencia que la vía de solicitud de medicamentos de uso off-label continúa siendo una herramienta clave una década después de la publicación del RD 1015/20092. El estudio de Pérez-Moreno et al.1 muestra resultados similares, lo que podría explicarse por la complejidad de pacientes en un hospital de tercer nivel. En las decisiones de aprobación se observa una tendencia a autorizar fármacos para indicaciones sin opciones de tratamiento o con alternativas limitadas. Por el contrario, las solicitudes con alternativas disponibles o con una relación coste-beneficio desfavorable tienden a ser rechazadas. Por otro lado, destaca que incluso con evidencia científica de bajo nivel, la tasa de aprobación es elevada, probablemente debido a la ausencia de alternativas en pacientes que han agotado todas las opciones terapéuticas. Si analizamos la evidencia dentro del grupo de peticiones denegadas, se basa principalmente en EECC fase II-III. Este grupo se corresponde con aquellas peticiones que son denegadas, a pesar de estar respaldadas con evidencia científica, por disponer de alternativas terapéuticas que aún no se habían probado en el paciente con una adecuada relación coste-beneficio.
Otro aspecto a destacar es el coste de los fármacos. Los tratamientos con menor coste tienen mayor tasa de aprobación, mientras que los de mayor impacto económico, superior a 100.000 €, ninguna fue aprobada. Como cabría esperar, en estos casos se prioriza aún más el nivel de evidencia y la disponibilidad de alternativas. En el ámbito de los medicamentos oncohematológicos, la mayoría de los fármacos autorizados presentan un coste promedio de 10.000–50.000 €/tratamiento. Este rango se alinea con el estudio publicado por González-Morcillo et al.12, quienes analizaron la relación coste-efectividad de fármacos de uso off-label, principalmente del área de oncohematología, identificando un coste promedio por solicitud de 16.288 €/solicitud. Por el contrario, los fármacos no oncohematológicos tienen costes promedio significativamente más bajos, entre 1.000 y 10.000 €/año.
Aunque las peticiones de fármacos oncohematológicos superaron en número a las de los no oncohematológicos, la tasa de autorización fue significativamente mayor para los medicamentos no oncohematológicos (66% vs. 82%, respectivamente). Esta diferencia podría estar vinculada al mayor coste asociado a los tratamientos oncohematológicos, donde su uso requiere mayor respaldo científico.
En términos de impacto presupuestario, la aprobación de 92 de las 124 peticiones supuso un ahorro de 2,2 millones de euros. Por lo que las políticas de evaluación y selección de medicamentos en la gestión hospitalaria no solo minimizan la exposición de los pacientes a tratamientos con respaldo científico limitado, sino que también optimizan los recursos disponibles al priorizar opciones más eficientes.
Responsabilidades éticasEste caso se apela a lo señalado por el Comité Internacional de Editores de Revistas Médicas (ICMJE).
FinanciaciónLos autores declaran no haber recibido financiación para la elaboración de este trabajo.
Declaración de autoríaLupe Rodríguez-de Francisco realizó la redacción del manuscrito; Ángela María Villalba-Moreno y Eva Rocío Alfaro-Lara revisaron críticamente el contenido intelectual del manuscrito y aprobaron la versión final que se presentará; Lupe Rodríguez-de Francisco presentó el manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración de contribución de autoría CRediTLupe Rodríguez-de Francisco: Writing – review & editing, Writing – original draft, Formal analysis, Data curation. Ángela María Villalba-Moreno: Validation, Supervision, Conceptualization. Eva Rocío Alfaro-Lara: Validation, Supervision, Conceptualization.