describir los resultados obtenidos en la efectividad y la seguridad del tiosulfato sódico intravenoso en pacientes diagnosticados de calcifilaxis no urémica, identificar y analizar los posibles factores etiológicos de la enfermedad y determinar la morbimortalidad asociada.
Métodoestudio retrospectivo y multicéntrico con pacientes diagnosticados de calcifilaxis no urémica que recibieron tiosulfato sódico intravenoso entre 2013 y 2023. Se evaluó la efectividad según el estado de las úlceras al finalizar el tratamiento y la seguridad según los efectos adversos reportados y la necesidad de ajuste posológico.
Resultadosse evaluaron 33 pacientes de 3 centros hospitalarios (93,9% caucásicos, 78,8% mujeres, edad media 80 [DE 8,1] años) diagnosticados de calcifilaxis no urémica confirmada por biopsia cutánea. El patrón de localización fue 90,9% distal. Se realizaron las siguientes medidas terapéuticas complementarias: curas tópicas, retirada de factores precipitantes (principalmente suplementos con vitamina D y antagonistas de la vitamina K), fármacos para reducir la calcificación (bifosfonatos, cinacalcet) y técnicas para favorecer la curación de las úlceras. Las principales características asociadas a desarrollar la calcifilaxis fueron: enfermedad renal crónica no urémica (81,8%), suplementación con vitamina D (72,7%) e hipoalbuminemia (66,7%). La posología del tiosulfato sódico más utilizada fue 25 g (n = 26) 3 veces por semana (n = 28) por vía intravenosa con una mediana de duración de 11,4 (RIC 5,7-18) semanas. Se obtuvo resolución completa o mejoría de las úlceras en el 78,8% de los casos. El 96,7% de los pacientes presentó efectos adversos, destacando la acidosis metabólica (n = 19) y las náuseas y vómitos (n = 18). El 9% precisó ajuste posológico por toxicidad. La tasa de morbilidad significativa fue del 69,7% (n = 23). Las principales complicaciones fueron: 57,6% sobreinfección de las úlceras y 24,3% mal control del dolor. La tasa de mortalidad global fue del 66,7%; 42,4% durante los primeros 6 meses desde el diagnóstico y 39,4% secundaria a calcifilaxis no urémica.
Conclusionesel tiosulfato sódico muestra un posible beneficio en el tratamiento de las úlceras por calcifilaxis no urémica, con un perfil de seguridad similar al reportado para la calcifilaxis urémica, considerando la elevada morbimortalidad asociada a la enfermedad. Son necesarios estudios adicionales para determinar su eficacia y evaluar la contribución específica de los distintos tratamientos utilizados.
To describe the results obtained in terms of effectiveness and safety of intravenous sodium thiosulfate in patients diagnosed with non-uremic calciphylaxis, to identify and analyse possible etiological factors of the disease, and to determine the associated morbidity and mortality.
MethodA multicenter and retrospective study was conducted with patients diagnosed with non-uremic calciphylaxis who received intravenous sodium thiosulfate between 2013 and 2023. Effectiveness was evaluated based on the status of the ulcers at the end of treatment, and safety was assessed according to the main reported adverse effects and the need for dosage adjustment.
ResultsA total of 33 patients from three university hospitals were evaluated (93.9% Caucasian, 78.8% women, mean age 80 [SD 8.1] years) with non-uremic calciphylaxis confirmed by skin biopsy. The localization pattern was 90.9% distal. The following complementary therapeutic measures were undertaken: topical wound care, removal of precipitating factors (mainly vitamin D supplements and vitamin K antagonists), medications to reduce calcification (bisphosphonates, cinacalcet), and techniques to promote ulcer healing. The main associated factors for developing calciphylaxis were: non-uremic chronic kidney disease (81.8%), vitamin D supplementation (72.7%), and hypoalbuminemia (66.7%). The most commonly used sodium thiosulfate dosage was 25 g (n = 26) three times per week (n = 28) intravenously, with a median treatment duration of 11.4 (IQR 5.7-18) weeks. A complete resolution or improvement of the ulcers was achieved in 78.8% of the cases. Adverse effects were observed in 96.7% of patients, with the most common being metabolic acidosis (n = 19) and nausea and/or vomiting (n = 18). Dosage adjustments due to toxicity were necessary in 9% of cases. The significant morbidity rate was 69.7% (n = 23). The main complications were: 57.6% ulcer superinfection and 24,3% poor pain control. The overall mortality rate was 66.7%; 42.4% within the first 6 months after diagnosis and 39.4% secondary to non-uremic calciphylaxis.
ConclusionsSodium thiosulfate shows a potential benefit in the treatment of ulcers due to non-uremic calciphylaxis, with a similar safety profile to that reported for uremic calciphylaxis, considering the high morbidity and mortality associated with the condition. Further studies are needed to determine its efficacy and assess the specific contribution of the different treatments used.
La calcifilaxis es una enfermedad rara y multifactorial, caracterizada por la presencia de lesiones cutáneas dolorosas, secundarias a la calcificación e hiperplasia de la capa media de arteriolas y arterias pequeñas, que conducen a isquemia, necrosis y ulceración tisular1,2. Se desarrolla mayormente en pacientes con enfermedad renal crónica (ERC) avanzada (estadio 4 o superior, trasplantados renales, diálisis o prediálisis), definida como calcifilaxis urémica (CU). Sin embargo, también se ha documentado en pacientes con función renal normal o en estadios precoces de la ERC, conocida como calcifilaxis no urémica (CNU)3–5.
La patogenia, la etiología y el tratamiento de la CNU no están bien establecidos4. Se ha observado un mejor pronóstico respecto a aquellos pacientes con CU, con una mortalidad anual de entre 25 y 45%, siendo la sepsis la principal causa6,7. El abordaje terapéutico óptimo engloba el manejo del dolor, la cura de las úlceras, la eliminación de posibles factores precipitantes y el tratamiento farmacológico específico2,3,7. El tiosulfato sódico (TS) se utiliza frecuentemente para el tratamiento de la calcifilaxis en condiciones off-label, con base en los datos obtenidos en estudios retrospectivos en pacientes con CU8–12. El mecanismo de acción del TS es desconocido, aunque se han propuesto diferentes vías que podrían explicar su efecto: formación de complejos solubles con el calcio, restauración de la función endotelial, inhibición directa de la calcificación, además de un posible efecto vasodilatador y antioxidante13. Los efectos secundarios descritos son náuseas y vómitos, cefalea, acidosis metabólica, hipernatremia, sobrecarga de volumen, hipotensión, rinorrea, cefalea, efectos neurológicos (sabor metálico, hormigueo periorbitario, disminución de la audición), debilidad, hipocalcemia con prolongación del intervalo QT8–10. No existen presentaciones comercializadas de TS intravenoso en España, solo está disponible como formulación magistral. Aunque no existe una dosis estandarizada de TS intravenoso para la calcifilaxis, las pautas posológicas más comúnmente reportadas en la literatura abarcan un rango de dosis que oscila entre 5 y 25 gramos con una frecuencia de administración de 2 a 5 veces por semana8–11,13.
El objetivo principal del estudio es describir los resultados obtenidos en efectividad y seguridad del TS al 25% administrado por vía intravenosa en pacientes diagnosticados de CNU. Los objetivos secundarios son identificar y analizar posibles factores predisponentes de la enfermedad, así como determinar las tasas de morbimortalidad asociadas a la CNU.
MétodosDiseñoSe realizó un estudio retrospectivo y multicéntrico, en el que participaron 3 centros hospitalarios universitarios de Cataluña. Se incluyeron pacientes diagnosticados de CNU, confirmada por biopsia cutánea, tratados con TS intravenoso entre 2013 y 2023, a cargo de los servicios de medicina interna, nefrología, infecciosas, geriatría o dermatología, tanto en régimen de hospitalización como de hospital de día. Se excluyeron aquellos pacientes con pérdida de seguimiento por traslado a otro centro hospitalario.
Se incluyeron datos demográficos, antecedentes patológicos, patrón de localización de la calcifilaxis y parámetros analíticos previos al inicio del TS, así como variables relacionadas con el tratamiento, incluyendo posología, frecuencia, duración, efectos adversos y tratamientos concomitantes. El patrón de localización de la calcifilaxis se clasificó en 2 grupos: distal (extremidades inferiores, dedos y manos) y proximal (tronco, interior de los muslos, nalgas). Se documentaron las medidas terapéuticas complementarias categorizadas en 3 ejes principales: cuidado de las úlceras, tratamiento dirigido a reducir la calcificación y eliminación de factores precipitantes. La recogida de datos se realizó a partir de la revisión de la historia clínica y de la prescripción electrónica del paciente.
La efectividad del tratamiento con TS se evaluó mediante la valoración clínica del médico tratante documentada en la historia clínica. Para el análisis de datos, se estratificó el estado de las úlceras después del tratamiento en 4 niveles: resolución completa (desaparición de la úlcera y sintomatología asociada), mejoría (reducción significativa del tamaño de la lesión, formación de tejido de granulación, ausencia de signos de infección o disminución del exudado o del dolor), estabilidad (sin cambios significativos) y deterioro (aumento del tamaño, del exudado, del dolor o presencia de signos de infección). Se consideró tratamiento efectivo según la valoración clínica cuando hubo resolución completa o mejoría.
La seguridad se analizó según los principales efectos adversos documentados en la historia clínica y la necesidad de ajustar la posología de tratamiento.
La identificación y el análisis de posibles factores predisponentes de la enfermedad se realizó con base en la recogida de las características basales de los pacientes, parámetros analíticos y tratamientos concomitantes, descritos previamente en la literatura como posibles factores de riesgo para el desarrollo de la enfermedad3,4,6,7,14.
Se determinaron 3 tipos de tasas de morbimortalidad asociadas a la CNU: morbilidad significativa, manifestada por la aparición de complicaciones relevantes durante el transcurso de la enfermedad; mortalidad precoz, definida como muerte del paciente dentro de los 6 meses posteriores al diagnóstico inicial de CNU; y mortalidad secundaria a CNU, caracterizada por la muerte debida a complicaciones vinculadas a la progresión de la enfermedad.
El uso off-label del TS se realizó conforme a un protocolo institucional aprobado por la comisión de farmacia y terapéutica y la dirección médica de cada hospital. Además, se documentó la justificación clínica en la historia clínica del paciente y se obtuvo su consentimiento.
Este estudio se autorizó como estudio observacional con medicamentos (retrospectivo) por el Comité Ético de Investigación con Medicamentos de la Fundació Privada Hospital Asil de Granollers. Dado el carácter observacional del estudio sin intervenciones se aprobó la exención del consentimiento informado. En todo momento se cumplió la Ley Orgánica 3/2018 de 5 de diciembre de Protección de Datos Personales y Garantía de los Derechos Digitales, así como los principios básicos de la Declaración de Helsinki y las Normas de Buena Práctica Clínica.
Análisis estadísticoSe realizó un análisis de estadística descriptiva para todas las variables. Las variables continuas se describieron mediante el número de casos (n), media, desviación estándar (DE), mediana y rango intercuartílico (RIC). Dado las limitaciones inherentes por falta de tamaño muestral, no se realizaron pruebas formales de normalidad para evaluar la distribución de datos. La descripción de los datos se basó en la comparación entre la media y la mediana. En los casos en los que se observaron discrepancias notables, se optó por utilizar medidas como la mediana y el RIC para describir los datos. Las variables categóricas se describieron mediante frecuencias absolutas y relativas de cada categoría. Dado las limitaciones inherentes por falta de tamaño muestral, no se realizaron pruebas para realizar estudios comparativos. En caso de valores ausentes, se han indicado sobre cada variable y se han eliminado aquellas variables con valores ausentes mayores al 10%. El análisis estadístico se realizó siguiendo los principios especificados en las Guidelines ICH E9, así como todas las normas de buenas prácticas clínicas. El análisis estadístico se realizó usando el programa SAS (Statistical Analysis System) v9.4.
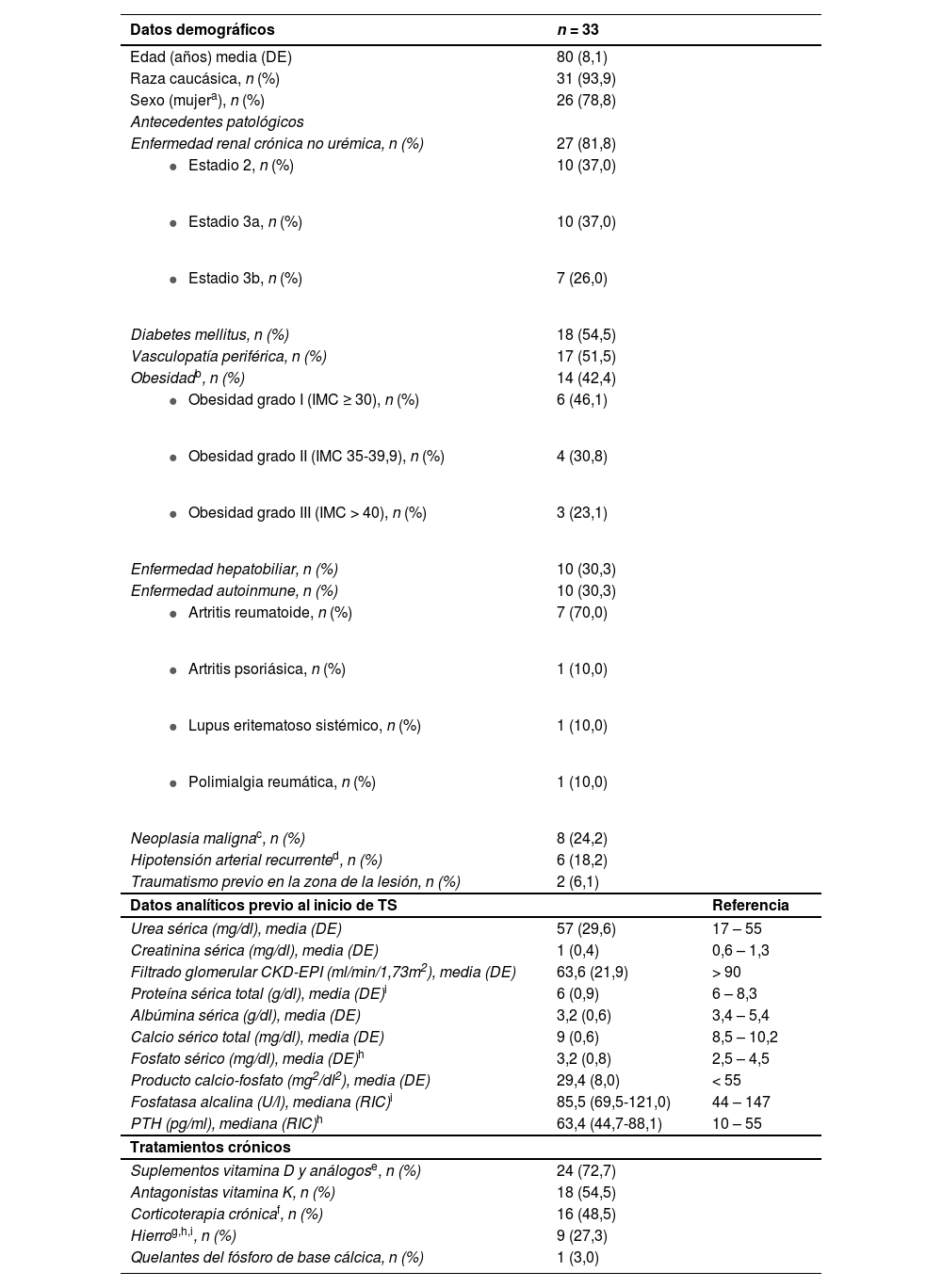
ResultadosSe incluyeron un total de 33 pacientes. En la tabla 1 se recogen los datos demográficos y características basales de los pacientes. El patrón de localización de las lesiones fue 90,9% (n = 30) distal y 9,1% (n = 3) proximal. En todos los casos el diagnóstico se confirmó mediante biopsia cutánea.
Datos demográficos y características basales de los pacientes en el momento del diagnóstico de la calcifilaxis no urémica
| Datos demográficos | n = 33 | |
|---|---|---|
| Edad (años) media (DE) | 80 (8,1) | |
| Raza caucásica, n (%) | 31 (93,9) | |
| Sexo (mujera), n (%) | 26 (78,8) | |
| Antecedentes patológicos | ||
| Enfermedad renal crónica no urémica, n (%) | 27 (81,8) | |
| 10 (37,0) | |
| 10 (37,0) | |
| 7 (26,0) | |
| Diabetes mellitus, n (%) | 18 (54,5) | |
| Vasculopatía periférica, n (%) | 17 (51,5) | |
| Obesidadb, n (%) | 14 (42,4) | |
| 6 (46,1) | |
| 4 (30,8) | |
| 3 (23,1) | |
| Enfermedad hepatobiliar, n (%) | 10 (30,3) | |
| Enfermedad autoinmune, n (%) | 10 (30,3) | |
| 7 (70,0) | |
| 1 (10,0) | |
| 1 (10,0) | |
| 1 (10,0) | |
| Neoplasia malignac, n (%) | 8 (24,2) | |
| Hipotensión arterial recurrented, n (%) | 6 (18,2) | |
| Traumatismo previo en la zona de la lesión, n (%) | 2 (6,1) | |
| Datos analíticos previo al inicio de TS | Referencia | |
| Urea sérica (mg/dl), media (DE) | 57 (29,6) | 17 – 55 |
| Creatinina sérica (mg/dl), media (DE) | 1 (0,4) | 0,6 – 1,3 |
| Filtrado glomerular CKD-EPI (ml/min/1,73m2), media (DE) | 63,6 (21,9) | > 90 |
| Proteína sérica total (g/dl), media (DE)i | 6 (0,9) | 6 – 8,3 |
| Albúmina sérica (g/dl), media (DE) | 3,2 (0,6) | 3,4 – 5,4 |
| Calcio sérico total (mg/dl), media (DE) | 9 (0,6) | 8,5 – 10,2 |
| Fosfato sérico (mg/dl), media (DE)h | 3,2 (0,8) | 2,5 – 4,5 |
| Producto calcio-fosfato (mg2/dl2), media (DE) | 29,4 (8,0) | < 55 |
| Fosfatasa alcalina (U/l), mediana (RIC)i | 85,5 (69,5-121,0) | 44 – 147 |
| PTH (pg/ml), mediana (RIC)h | 63,4 (44,7-88,1) | 10 – 55 |
| Tratamientos crónicos | ||
| Suplementos vitamina D y análogose, n (%) | 24 (72,7) | |
| Antagonistas vitamina K, n (%) | 18 (54,5) | |
| Corticoterapia crónicaf, n (%) | 16 (48,5) | |
| Hierrog,h,i, n (%) | 9 (27,3) | |
| Quelantes del fósforo de base cálcica, n (%) | 1 (3,0) | |
DE: desviación estándar; IMC: índice de masa corporal; PTH, hormona paratiroidea; RIC: rango intercuartílico; TS: tiosulfato sódico; TTPa: tiempo de tromboplastina activado.
Se definió obesidad si IMC ≥30 y en caso de falta de datos, se consideraron aquellos que tenían la obesidad como antecedente patológico documentado en curso clínico. Los datos de IMC para definir los grados de obesidad son sobre 13 pacientes.
Presencia de neoplasia maligna sólida o hematológica en el momento del diagnóstico de la calcifilaxis o antecedentes previos.
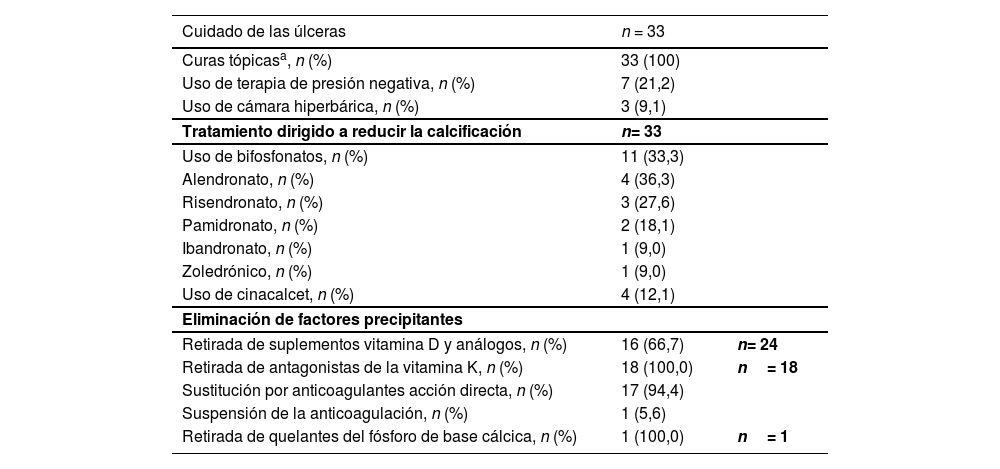
La dosis más utilizada de TS al 25% intravenoso fue de 25 g (n = 26), seguida de 12,5 g (n = 5) y de 20 g (n = 2) por sesión. El 84,8% (n = 28) de los pacientes lo recibió 3 veces por semana, el 9,1% (n = 3) una vez por semana y el 6,1% (n = 2) 2 veces por semana. La mediana de duración fue de 11,4 (RIC 5,7-18) semanas. En 11 pacientes se combinó la terapia intravenosa con la administración de TS intralesional. Las medidas terapéuticas complementarias realizadas para la resolución de las lesiones se resumen en la tabla 2.
Medidas complementarias realizadas para la resolución de las lesiones
| Cuidado de las úlceras | n = 33 | |
|---|---|---|
| Curas tópicasa, n (%) | 33 (100) | |
| Uso de terapia de presión negativa, n (%) | 7 (21,2) | |
| Uso de cámara hiperbárica, n (%) | 3 (9,1) | |
| Tratamiento dirigido a reducir la calcificación | n= 33 | |
| Uso de bifosfonatos, n (%) | 11 (33,3) | |
| Alendronato, n (%) | 4 (36,3) | |
| Risendronato, n (%) | 3 (27,6) | |
| Pamidronato, n (%) | 2 (18,1) | |
| Ibandronato, n (%) | 1 (9,0) | |
| Zoledrónico, n (%) | 1 (9,0) | |
| Uso de cinacalcet, n (%) | 4 (12,1) | |
| Eliminación de factores precipitantes | ||
| Retirada de suplementos vitamina D y análogos, n (%) | 16 (66,7) | n= 24 |
| Retirada de antagonistas de la vitamina K, n (%) | 18 (100,0) | n= 18 |
| Sustitución por anticoagulantes acción directa, n (%) | 17 (94,4) | |
| Suspensión de la anticoagulación, n (%) | 1 (5,6) | |
| Retirada de quelantes del fósforo de base cálcica, n (%) | 1 (100,0) | n= 1 |
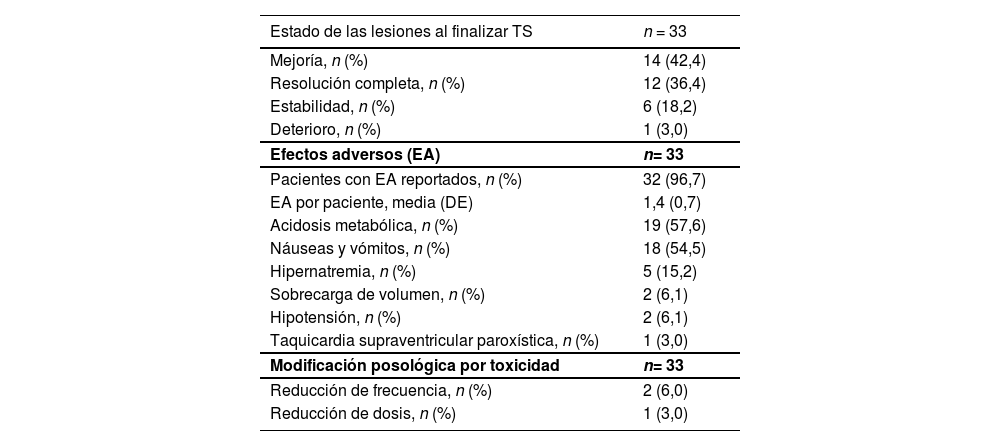
Los resultados de efectividad y seguridad del tratamiento con TS se muestran en la tabla 3. Se consideró tratamiento efectivo según valoración clínica en el 78,8% (n = 26) de los pacientes. Sin embargo, en 9 de estos pacientes el TS se discontinuó antes de alcanzar la resolución completa de las úlceras debido a diferentes circunstancias: 15,4% (n = 4) muerte, 11,5% (n = 3) eventos adversos y 7,7% (n = 2) incidencias relacionadas con el acceso venoso. Todos los pacientes, a excepción de uno, presentaron efectos adversos relacionados con el TS. Las causas de finalización del TS fueron: 51,5% (n = 17) resolución de las lesiones, 27,3% (n = 9) muerte, 15,2% (n = 5) efectos adversos y 6,1% (n = 2) incidencias relacionadas con la vía de administración (mal acceso venoso y endocarditis secundaria a bacteriemia por catéter). El 9% (n = 3) precisó ajuste posológico del TS por toxicidad, de los cuales uno acabó con la suspensión definitiva por toxicidad y los otros 2 alcanzaron la resolución completa.
Efectividad y seguridad del tratamiento con tiosulfato sódico
| Estado de las lesiones al finalizar TS | n = 33 |
|---|---|
| Mejoría, n (%) | 14 (42,4) |
| Resolución completa, n (%) | 12 (36,4) |
| Estabilidad, n (%) | 6 (18,2) |
| Deterioro, n (%) | 1 (3,0) |
| Efectos adversos (EA) | n= 33 |
| Pacientes con EA reportados, n (%) | 32 (96,7) |
| EA por paciente, media (DE) | 1,4 (0,7) |
| Acidosis metabólica, n (%) | 19 (57,6) |
| Náuseas y vómitos, n (%) | 18 (54,5) |
| Hipernatremia, n (%) | 5 (15,2) |
| Sobrecarga de volumen, n (%) | 2 (6,1) |
| Hipotensión, n (%) | 2 (6,1) |
| Taquicardia supraventricular paroxística, n (%) | 1 (3,0) |
| Modificación posológica por toxicidad | n= 33 |
| Reducción de frecuencia, n (%) | 2 (6,0) |
| Reducción de dosis, n (%) | 1 (3,0) |
DE: desviación estándar; TS: tiosulfato sódico.
Los posibles factores predisponentes más destacados en estos pacientes fueron: enfermedad renal crónica no urémica (81,8%), suplementación con vitamina D o análogos (72,7%), hipoalbuminemia (66,7%), hiperparatiroidismo (57%), diabetes mellitus (54,5%), uso de antagonistas de la vitamina K (54,5%), vasculopatía periférica (51,5%), corticoterapia crónica (48,5%) y obesidad (42,4%). Todos los pacientes presentaron más de un factor concomitante.
La tasa de morbilidad significativa fue del 69,7% (n = 23), 6 pacientes presentaron más de una complicación durante el transcurso de la enfermedad. Las complicaciones más relevantes fueron: 57,6% (n = 19) sobreinfección de las úlceras, 24,3% (n = 8) mal control del dolor, 9% (n = 3) sepsis, 6,1% (n = 2) sangrado de las úlceras y 3% (n = 1) bacteriemia por catéter de larga duración.
Durante el periodo de estudio, se registró una mortalidad total del 66,7% (n = 22). La tasa de mortalidad precoz fue del 42,4% (n = 14). La tasa de mortalidad secundaria a CNU fue del 39,4% (n = 13). Esta se subclasificó en 2 categorías: tasa directamente atribuible a la CNU (9,1%, n = 3), causada principalmente por sepsis de origen cutáneo y tasa potencialmente atribuible a la CNU (30,3%, n = 10), correspondiente a fallecimientos ocurridos durante el ingreso hospitalario asociados a múltiples factores, incluyendo la descompensación de enfermedades crónicas preexistentes.
DiscusiónEn el presente estudio, el uso de TS junto con el resto de las medidas complementarias aplicadas, se consideró efectivo según la valoración clínica en la mayoría de los pacientes (78,8%), mostrando una resolución completa o mejoría de las úlceras. Sin embargo, no existen ensayos clínicos aleatorizados que evalúen la eficacia del TS en pacientes con CNU. Los ensayos disponibles se han realizado exclusivamente en pacientes con CU y sus resultados aún no han sido publicados (NCT03150420, NCT03146793, NCT03319914, NCT05018221). En una revisión sistemática de Peng et al., que incluyó 358 casos de CU tratados con TS, se reportó una tasa de efectividad del 70,1%, definida como mejoría en la cicatrización o control del dolor sin mortalidad asociada15. Nigwekar et al. analizaron 172 pacientes con CU, de los cuales el 85% completaron el tratamiento con TS. En este estudio, la respuesta al tratamiento fue evaluada en 53 pacientes mediante un cuestionario dirigido al médico tratante; se observó una respuesta favorable en el 73,6% de los casos, desglosada como resolución completa (26,4%), mejoría significativa (18,9%) y mejoría parcial (28,3%)10.
No obstante, estos resultados se limitan al uso de TS en pacientes con CU. La evidencia disponible sobre el uso del TS en CNU se restringe a casos aislados, series de casos o revisiones sistemáticas que describen su uso empírico4,5,12,16,17. En una revisión realizada por Bajaj et al., que incluyó 107 pacientes con calcifilaxis y función renal normal, no se encontró asociación significativa entre el uso de TS intravenoso y la mejoría de las lesiones cutáneas (HR 1,1; IC 95%: 0,6–2,02), ni con la supervivencia global (HR 1,01; IC 95%: 0,6-1,7)4. Sin embargo, Altman et al. describieron una tasa de supervivencia del 75% en un análisis retrospectivo de 16 pacientes con CNU. Los pacientes sobrevivieron entre uno y 14 años después del diagnóstico; los autores atribuyen esta elevada supervivencia al uso frecuente de TS en el 63% de los casos (n = 10)14.
En términos de seguridad, el TS presentó un perfil similar a los EA descritos en la literatura tanto para CU como CNU9. La acidosis metabólica y las náuseas y vómitos fueron los EA predominantes, por lo que es importante realizar seguimiento analítico periódico durante el tratamiento y valorar la profilaxis antiemética adecuada. El ajuste posológico del TS reduciendo la dosis o espaciando la frecuencia podría ser una opción para disminuir la toxicidad, aunque en nuestro estudio no se pudo determinar qué estrategia podría resultar óptima para conseguir un adecuado balance beneficio-riesgo.
A pesar de la evidencia limitada que existe actualmente en el tratamiento de la CNU, se ha observado que la utilización de diversas estrategias puede mejorar la evolución de la enfermedad2,18. Las medidas complementarias fundamentalmente realizadas fueron las curas tópicas de las úlceras y la retirada de los factores precipitantes. Adicionalmente, se utilizaron tratamientos para reducir la calcificación (bifosfonatos y cinacalcet) y técnicas para favorecer la curación de las úlceras (terapia de presión negativa y cámara hiperbárica). En el presente trabajo, no se pudo llevar a cabo un análisis para analizar el impacto de cada una de ellas debido al tamaño muestral. En el análisis realizado por Bajaj et al., ninguna combinación de las intervenciones médicas ni quirúrgicas (tratamiento multimodal) se asoció con mejoría de las lesiones o supervivencia4. En cambio, en el estudio de McCarthy et al., el desbridamiento quirúrgico mostró un beneficio estadísticamente significativo en la mortalidad global12. A pesar de no poder establecer la magnitud del efecto de las distintas estrategias, y tratándose de una entidad multifactorial, el manejo terapéutico de estos pacientes se debe basar en la aplicación de todas las intervenciones posibles en la medida de lo posible.
La CNU fue más frecuente en mujeres de raza caucásica y edad avanzada. En la muestra de pacientes analizada, las características observadas de forma predominante coinciden con factores de riesgo relacionados con la calcifilaxis descritos en otros estudios7 y en concreto, para CNU3,4,6,14, aunque las conclusiones no pueden extrapolarse debido al diseño no poblacional del estudio. Destacó el metabolismo fósforo-calcio normal, por lo que sugiere que, en la CNU, las alteraciones minerales no serían el mecanismo etiopatogénico principal. También es importante recalcar los factores etiológicos modificables, como serían los fármacos (por ejemplo, los suplementos de vitamina D o los antagonistas de vitamina K), por lo que es relevante tener en cuenta el historial farmacoterapéutico de los pacientes en el momento del diagnóstico para valorar posibles alternativas.
La morbilidad de la CNU se asoció principalmente con sobreinfección de las úlceras, dolor mal controlado y sangrado, siendo la sepsis la complicación más grave. La mortalidad global relacionada con la CNU observada (39,4%) fue inferior a la reportada por Nigwekar et al. (52%) en una revisión sistemática de 36 casos de CNU6. La tasa de mortalidad precoz (41,4%) también fue inferior a la descrita en la revisión de McCarthy et al. (57,3%), teniendo en cuenta que también incluye pacientes con CU12. Tal y como sugieren los autores, parece haber una tendencia a la mayor supervivencia en los pacientes con CNU, atribuyendo una mayor mortalidad a los pacientes con CU por el riesgo añadido de la propia enfermedad renal crónica y, posiblemente, a la existencia de factores de riesgo diferentes entre la CU y la CNU12.
Las limitaciones de este estudio son el diseño retrospectivo y la heterogeneidad en el manejo clínico de estos pacientes, que dificultan la extrapolación de los resultados. Sin embargo, según nuestro conocimiento, esta es una de las series más largas publicadas hasta la fecha en pacientes con CNU.
En conclusión, los resultados obtenidos en nuestro estudio sugieren un posible beneficio del tratamiento con TS para la curación de las úlceras en pacientes con CNU, con un perfil de seguridad similar al reportado en la CU, considerando la elevada morbimortalidad asociada a la enfermedad. El tratamiento multimodal parece ser una estrategia razonable para la CNU. No obstante, son necesarios estudios adicionales para comprender mejor la etiopatogenia de la enfermedad y así determinar la eficacia de las distintas medidas terapéuticas utilizadas.
Aportación a la literatura científicaLa CNU es una enfermedad rara de la que aún se desconocen bastantes aspectos, y con evidencia científica disponible escasa. Este estudio proporciona datos en vida real sobre el uso off-label del TS en el tratamiento de la CNU tanto a nivel de efectividad como de seguridad.
Los resultados obtenidos en nuestro estudio multicéntrico muestran la utilidad del uso de tiosulfato intravenoso en este tipo de pacientes, y permiten obtener información relevante sobre el manejo de esta enfermedad contribuyendo a optimizar su abordaje en la práctica clínica.
FinanciaciónLos autores declaran que no recibieron financiación.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.
Declaración de contribución de autoría CRediTLaura Cardona-Roca: Writing – review & editing, Writing – original draft, Project administration, Methodology, Formal analysis, Data curation, Conceptualization. Laura Borràs Trias: Writing – review & editing, Validation, Supervision, Methodology, Formal analysis, Conceptualization. Rosario Bueno Uceda: Writing – review & editing, Validation, Data curation. Adrià Siles: Writing – review & editing, Validation, Data curation. Adrián Vilariño Seijas: Writing – review & editing, Validation, Data curation. Nuria Rudi Sola: Writing – review & editing, Validation, Supervision, Methodology, Data curation, Conceptualization. Carlos Seguí-Solanes: Writing – review & editing, Writing – original draft, Validation, Supervision, Methodology, Formal analysis, Conceptualization.