La artritis reumatoide (AR) es la enfermedad reumática inflamatoria crónica más común, y su manejo y morbilidad suponen una gran carga para los sistemas de salud. El desarrollo y uso de fármacos antirreumáticos modificadores de la enfermedad han contribuido a mejoras para los pacientes, sin embargo, los altos costes han impedido su uso generalizado. La aparición de los biosimilares está cambiando este paradigma al ofrecer el mismo perfil de beneficio-riesgo a un menor coste. El objetivo es analizar el coste-efectividad de tocilizumab biosimilar (bsTCZ) subcutáneo en pacientes con AR moderada-severa en España desde la perspectiva del sistema de salud.
MétodosSe desarrolló un modelo de Markov con un horizonte temporal de toda la vida incluyendo cinco estados de salud: remisión de la enfermedad; actividad baja, moderada o alta; y muerte. Mediante una búsqueda PICO-S-T se identificó la eficacia de los tratamientos en metanálisis y metanálisis en red, y se complementó con evidencia de ensayos clínicos publicados. Los costes farmacológicos se obtuvieron de la base de datos BotPlus, y los de recursos de las tarifas regionales. Se realizaron análisis de sensibilidad determinísticos y probabilísticos para validar la robustez de los resultados. Se calculó la ratio coste-efectividad incremental (RCEI) para el coste/porcentaje de remisión y el coste/años de vida ganados ajustados por calidad (AVAC).
ResultadosEl coste durante toda la vida de bsTCZ fue 183.741€ (más bajo) frente a los comparativos que oscilaban entre 184.317€ para infliximab y 201.972€ (más alto) para certolizumab. Los AVAC fueron 13,74 para upadacitinib y 13,73 para sarilumab y tocilizumab, con valores entre 13,53 y 13,72 para los comparadores. El RCEI en €/remisión y €/AVAC mostraron que bsTCZ fue dominante o la alternativa más coste-efectiva en la mayoría de las comparaciones. Los análisis de sensibilidad mostraron que el coste a largo plazo de bsTCZ y la transición de baja a moderada fueron los factores más influyentes. Además, bsTCZ fue dominante o coste-efectivo en todas las comparaciones.
ConclusionesbsTCZ demostró ser una alternativa coste-efectiva y que genera ahorros en el tratamiento de pacientes con AR en España en comparación con las alternativas terapéuticas disponibles.
Rheumatoid arthritis (RA) is the most common chronic inflammatory rheumatic disease, its management and morbidity impose a great burden to healthcare systems. Development and rollout of biological disease modifying anti-rheumatic drugs has contributed to improvements for patients, however, high costs have prevented them to be widely used. This is being addressed with biosimilars, with equal benefit–risk profile and reduced costs. The objective is to analyze the cost-effectiveness of subcutaneous biosimilar tocilizumab (bsTCZ) for patients with moderate–severe RA in Spain from a healthcare system perspective.
MethodsA Markov model was developed with a lifetime horizon including 5 health states: remission of the disease; low, moderate, or high activity; and death. A PICO-S-T search retrieved efficacy of treatments in meta-analysis and network meta-analysis, and was further complemented with published clinical trials. Pharmacological costs were obtained from the BotPlus database, and medical resources costs from regional tariffs. Deterministic and probabilistic sensitivity analysis were performed to validate the robustness of results. Incremental cost-effectiveness ratio (ICER) for cost/percentage of remission and cost/quality-adjusted life year (QALY) gain were calculated.
ResultsLifetime cost of bsTCZ was 183 741€ (lowest) versus comparative costs ranging from 184 317€ for infliximab to 201 972€ (highest) for certolizumab. QALYs were 13.74 for upadacitinib and 13.73 for sarilumab and tocilizumab with values between 13.53 and 13.72 for the comparators. ICERs as €/remission and €/QALY showed that bsTCZ was either dominant in most of the comparisons or the most cost-effective alternative. The sensitivity analysis showed that bsTCZ long term cost, and transition from low to moderate disease activity health status were the most influential factors. Moreover, bsTCZ was either dominant or cost-effective in all the comparisons.
ConclusionsbsTCZ demonstrated to be a cost-effective and cost-saving alternative for the treatment of patients with RA in Spain when compared to all the available therapeutic alternatives.
La artritis reumatoide (AR) es una enfermedad inflamatoria inmunomediada (IMID por sus siglas en inglés), cuyas manifestaciones clínicas suponen una carga humanística1,2 y un gran impacto económico para los sistemas sanitarios a nivel mundial, debido al elevado consumo de recursos que se genera en el adecuado manejo de los pacientes afectados, tanto derivados de la propia enfermedad como de la morbilidad asociada3. En España, esta carga es mucho más elevada que en Europa y otras partes del mundo, y además tiene una mayor afectación en mujeres4. La AR representa el 5% de la carga total de las enfermedades reumáticas en España (4,4% de la carga total en Europa Occidental y 4% a nivel mundial)4. La prevalencia de la AR y la multimorbilidad están aumentando exponencialmente, así como las tasas de hospitalización (oscilan entre 31,6/100.000 habitantes en 2002 y 56,3/100.000 habitantes en 2017)5 motivadas en parte por una reducción de la mortalidad por AR. Esta reducción fue del 43,8% en los países con rentas más altas, debido a una mejor gestión de los pacientes mediante el control de la enfermedad y los tratamientos basados en objetivos terapéuticos2.
La AR es la enfermedad reumática inflamatoria crónica más frecuente y se ha descrito que su prevalencia estimada en España es del 0,82% (IC 95% 0,59–1,15) afectando predominantemente a mujeres6. En el estudio llevado a cabo por Silva-Fernández et al., también estiman que hay entre 220.000 y 430.000 pacientes con AR mayores de 20 años en España. La mayoría de los pacientes tenían entre 40 y 59 años, una edad en la que estos se encuentran en activo laboralmente1,6, lo que, unido a su efecto debilitante en los pacientes que padecen la enfermedad, conlleva una elevada carga humanística y económica3.
El enfoque terapéutico para estos pacientes cambió radicalmente hace 20 años con el desarrollo de los fármacos antirreumáticos modificadores de la enfermedad biológicos (FAMEb), que han supuesto una gran mejora de las condiciones de vida de los pacientes al permitir un mejor control de la enfermedad, un menor consumo de corticoides7, y una mejor calidad de vida global8. Los FAMEb tienen un impacto significativo sobre el efecto de la enfermedad y su progresión9. Sin embargo, los costes asociados a estas terapias han supuesto una limitación para su uso generalizado, un obstáculo que se ha solventado con la aparición de los biosimilares, que mantienen el perfil beneficio-riesgo a un menor coste9,10.
En la actualidad, existen numerosas alternativas terapéuticas de FAMEb, fármacos sintéticos dirigidos y biosimilares para el tratamiento de la AR, como abatacept, adalimumab, baricitinib, certolizumab, etanercept, golimumab, infliximab, rituximab, sarilumab, tocilizumab, tofacitinib y upadacitinib11,12. Entre ellos, el tocilizumab (TCZ) ha sido aprobado para la AR en la UE desde 2009 para el tratamiento de pacientes naïve a metotrexato, así como para aquellos pacientes con AR moderada a grave que no responden o tienen intolerancia a los fármacos antirreumáticos modificadores de la enfermedad (FAME) o a los fármacos antifactor de necrosis tumoral alfa (anti-TNF-α)13. En los últimos años, se ha señalado la enorme importancia de seguir de cerca la actividad de la enfermedad tras el diagnóstico, para alcanzar la guía «Treat to Target», que propone que el objetivo terapéutico en la AR debe ser un estado de remisión, o alternativamente una baja actividad de la enfermedad14. En España, el índice más utilizado para la evaluación de la actividad de la enfermedad es el Índice de actividad de la enfermedad 28 (DAS28), que examina 28 articulaciones y utiliza la velocidad de sedimentación de eritrocitos (VSG) o la proteína C reactiva (PCR), y clasifica los resultados en 4 categorías15–17.
Para tomar decisiones bien informadas tanto para el paciente como para el sistema sanitario en función del perfil de eficacia-seguridad, así como de los costes asociados a cada tratamiento, es obligatorio generar evidencia que permita un adecuado proceso de toma de decisiones. El último biosimilar aprobado y actualmente disponible en el mercado en España para el tratamiento de la AR es el MSB-11456, un biosimilar de tocilizumab (bsTCZ), que ha impulsado una búsqueda renovada y la generación de evidencia actualizada al integrarse en la dinámica del mercado actual. Así, el objetivo de este estudio es desarrollar un análisis de costo-efectividad del bsTCZ subcutáneo (SC) para el tratamiento de la AR comparándolo con las alternativas más habituales en España desde la perspectiva del sistema de salud.
MétodosPara contrastar el bsTCZ administrado de forma subcutánea con sus comparadores (abatacept SC, adalimumab biosimilar SC, baricitinib oral -O-, certolizumab SC, etanercept SC, filgotinib O, golimumab SC, infliximab biosimilar intravenoso -IV-, rituximab IV, sarilumab SC, tocilizumab biológico SC -refTCZ-, tofacitinib O y upadacitinib O), se construyó un modelo de costo-efectividad desde la perspectiva del sistema de salud español. Los estudios que incluyeron pacientes tratados con cualquiera de los comparadores fueron incluidos en el modelo.
Revisión bibliográficaSiguiendo las directrices Cochrane, se realizó una revisión sistemática de la literatura en: MEDLINE; Database of Abstracts of Reviews of Effects, National Health Service Economic Evaluation Database y Health Technology Assessment. La búsqueda se diseñó y realizó siguiendo una estructura PICO-S-T (tabla suplementaria 1) para obtener datos de eficacia.
- –
P (Paciente): Artritis reumatoide.
- –
I (Intervención): Tocilizumab.
- –
C (Comparador): Etanercept, infliximab, certolizumab, golimumab, adalimumab, tofacitinib, upadacitinib, baricitinib, abatacept, sarilumab, rituximab, filgotinib.
- –
O (Resultado): Índice de actividad de la enfermedad (DAS28); coste por respondedor; coste por respuesta; número necesario para tratar, NNT; respondedor.
- –
S (Tipo de estudio): Meta-análisis (MA), meta-análisis en red (NMA).
- –
T (Plazo de tiempo): Desde 2011 hasta agosto de 2023.
Las búsquedas se limitaron a artículos publicados en inglés y español. Los títulos y resúmenes fueron revisados de forma independiente por dos investigadores (tablas suplementarias 2-4), y la calidad de los artículos seleccionados se evaluó utilizando la lista de comprobación de las directrices de la Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA) mediante su extensión para meta-análisis en red, como el porcentaje de concordancia18.
Para aquellos comparadores que no estaban representados en los MA o NMA obtenidos, o los datos recogidos eran insuficientes, se realizaron búsquedas ad hoc para encontrar aquellos ensayos clínicos (EC) que permitieran incluirlos en el modelo. Además, los comparadores (tal y como se definieron en la búsqueda PICO-S-T) incluidos en los brazos de estos EC también se incorporaron al análisis.
De los estudios finalmente incluidos se extrajo la información relativa a los comparadores (como monoterapia o adyuvante al metotrexato), la población de pacientes (naïve o con tratamiento previo), el seguimiento, el resultado y el método de metaanálisis utilizado.
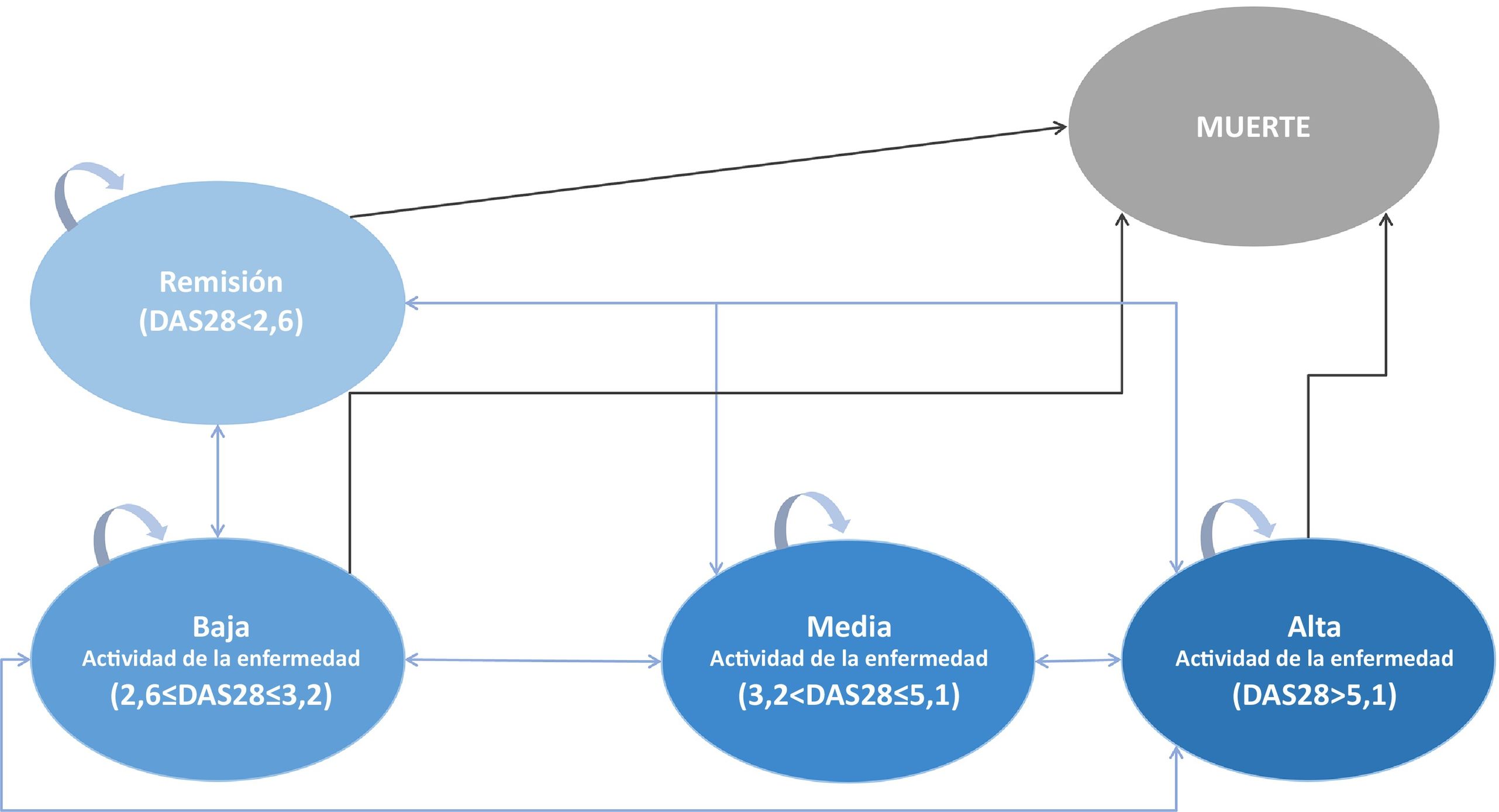
Análisis de coste-efectividadSe construyó un modelo de Markov con ciclos de 3 meses considerando la práctica clínica española en el manejo de pacientes con AR, utilizando 5 estados de salud basados en el DAS28, el parámetro clínico más utilizado en España19: alta actividad de la enfermedad, actividad moderada de la enfermedad, baja actividad de la enfermedad, remisión de la enfermedad y muerte como estado absorbente (fig. 1); y se simuló un horizonte de vida para comparar el bsTCZ con todas las alternativas terapéuticas disponibles. Inicialmente, los pacientes se encuentran en un estado de moderado a grave, con la posibilidad de transitar a otros estados o mantenerse en el mismo (alto, moderado, bajo, en remisión o muerte) según las proporciones específicas de eficacia de cada tratamiento (tabla 1). Estas estimaciones de eficacia provienen de la literatura consultada y, en casos donde los datos eran insuficientes, se realizaron aproximaciones basadas en el producto más comparable dentro de la misma generación. Los datos del primer año se tomaron como punto de inicio y, cada 52 semanas, se evaluaba el cambio de tratamiento según el estado de salud del paciente, si este había cambiado o se había mantenido igual, y el tratamiento y el estado de salud del paciente (mejorado/empeorado). Los pacientes que cambiaban de tratamiento después de 52 semanas se encontraban en el estado de alta actividad de la enfermedad y pasaban a un grupo hipotético de alternativas terapéuticas con una eficacia estimada basada en los ensayos clínicos correspondientes y la participación en el mercado de cada tratamiento, según los expertos clínicos. Para estas estimaciones, los tratamientos en los que el paciente alcanzó el estado de alta actividad de la enfermedad fueron descartados del grupo. Después de la semana 52, las probabilidades de transición fueron iguales para todos los tratamientos (tabla suplementaria 5)20. Se aplicó un descuento del 3% tanto a los costes como a los efectos. (See Tabla 2.)
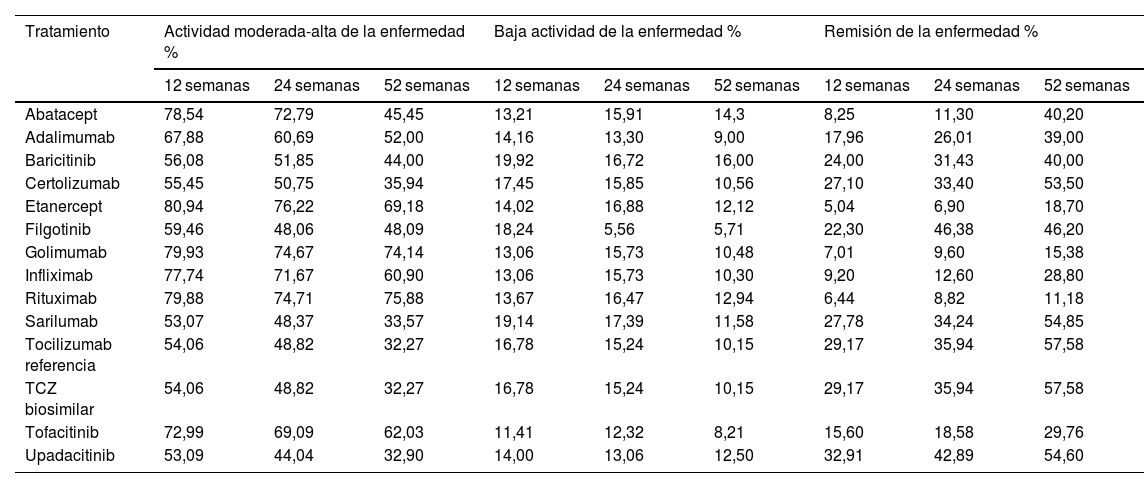
Probabilidades de transición estimadas de un paciente para los distintos tratamientos y estados de salud
| Tratamiento | Actividad moderada-alta de la enfermedad % | Baja actividad de la enfermedad % | Remisión de la enfermedad % | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 12 semanas | 24 semanas | 52 semanas | 12 semanas | 24 semanas | 52 semanas | 12 semanas | 24 semanas | 52 semanas | |
| Abatacept | 78,54 | 72,79 | 45,45 | 13,21 | 15,91 | 14,3 | 8,25 | 11,30 | 40,20 |
| Adalimumab | 67,88 | 60,69 | 52,00 | 14,16 | 13,30 | 9,00 | 17,96 | 26,01 | 39,00 |
| Baricitinib | 56,08 | 51,85 | 44,00 | 19,92 | 16,72 | 16,00 | 24,00 | 31,43 | 40,00 |
| Certolizumab | 55,45 | 50,75 | 35,94 | 17,45 | 15,85 | 10,56 | 27,10 | 33,40 | 53,50 |
| Etanercept | 80,94 | 76,22 | 69,18 | 14,02 | 16,88 | 12,12 | 5,04 | 6,90 | 18,70 |
| Filgotinib | 59,46 | 48,06 | 48,09 | 18,24 | 5,56 | 5,71 | 22,30 | 46,38 | 46,20 |
| Golimumab | 79,93 | 74,67 | 74,14 | 13,06 | 15,73 | 10,48 | 7,01 | 9,60 | 15,38 |
| Infliximab | 77,74 | 71,67 | 60,90 | 13,06 | 15,73 | 10,30 | 9,20 | 12,60 | 28,80 |
| Rituximab | 79,88 | 74,71 | 75,88 | 13,67 | 16,47 | 12,94 | 6,44 | 8,82 | 11,18 |
| Sarilumab | 53,07 | 48,37 | 33,57 | 19,14 | 17,39 | 11,58 | 27,78 | 34,24 | 54,85 |
| Tocilizumab referencia | 54,06 | 48,82 | 32,27 | 16,78 | 15,24 | 10,15 | 29,17 | 35,94 | 57,58 |
| TCZ biosimilar | 54,06 | 48,82 | 32,27 | 16,78 | 15,24 | 10,15 | 29,17 | 35,94 | 57,58 |
| Tofacitinib | 72,99 | 69,09 | 62,03 | 11,41 | 12,32 | 8,21 | 15,60 | 18,58 | 29,76 |
| Upadacitinib | 53,09 | 44,04 | 32,90 | 14,00 | 13,06 | 12,50 | 32,91 | 42,89 | 54,60 |
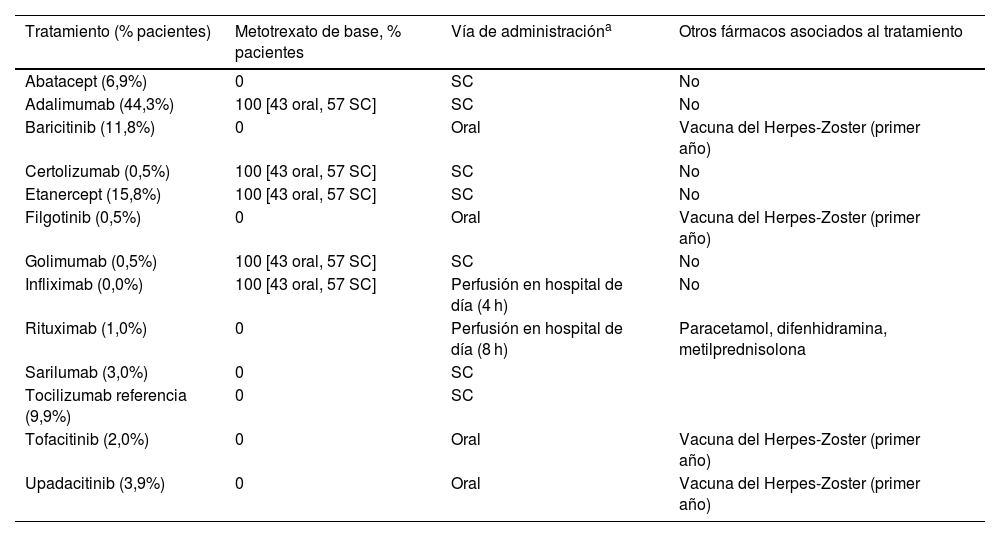
Uso de recursos en función del tratamiento
| Tratamiento (% pacientes) | Metotrexato de base, % pacientes | Vía de administracióna | Otros fármacos asociados al tratamiento |
|---|---|---|---|
| Abatacept (6,9%) | 0 | SC | No |
| Adalimumab (44,3%) | 100 [43 oral, 57 SC] | SC | No |
| Baricitinib (11,8%) | 0 | Oral | Vacuna del Herpes-Zoster (primer año) |
| Certolizumab (0,5%) | 100 [43 oral, 57 SC] | SC | No |
| Etanercept (15,8%) | 100 [43 oral, 57 SC] | SC | No |
| Filgotinib (0,5%) | 0 | Oral | Vacuna del Herpes-Zoster (primer año) |
| Golimumab (0,5%) | 100 [43 oral, 57 SC] | SC | No |
| Infliximab (0,0%) | 100 [43 oral, 57 SC] | Perfusión en hospital de día (4 h) | No |
| Rituximab (1,0%) | 0 | Perfusión en hospital de día (8 h) | Paracetamol, difenhidramina, metilprednisolona |
| Sarilumab (3,0%) | 0 | SC | |
| Tocilizumab referencia (9,9%) | 0 | SC | |
| Tofacitinib (2,0%) | 0 | Oral | Vacuna del Herpes-Zoster (primer año) |
| Upadacitinib (3,9%) | 0 | Oral | Vacuna del Herpes-Zoster (primer año) |
SC: subcutáneo.
La población para el modelo se obtuvo de Leil et al. 202121 y se definió como la formada por pacientes que padecían AR con actividad de la enfermedad de moderada a alta (media DAS28 5,7 [EE 0,52], 80,6% mujeres, edad media 52,7 [EE 1,0]) y duración media de la enfermedad 7,45 años (EE 2,72). La evaluación de la calidad de vida para este caso de base varía en función de la progresión de la enfermedad utilizando los valores 0,839, 0,8, 0,679 y 0,492 para los estados de remisión, baja, moderada y alta actividad de la enfermedad, respectivamente, adaptados de Chiou et al., (2004)22. Estas utilidades se emplearon para estimar años de vida ajustados por calidad (AVAC) para los resultados en salud. De acuerdo con una investigación reciente, la mortalidad se consideró igual a la de la población general durante los 10 primeros años de la enfermedad23 y, a partir de entonces, se aplicó un incremento sobre la mortalidad (tasa de mortalidad estandarizada 1,49 [IC 95% 1,30–1,71])24. Se calcularon los índices de relación costo-efectividad incremental (ICER), esto es, el costo por porcentaje de remisión (€/remisión) y el costo por AVAC (€/AVAC).
Manejo del paciente y uso de recursosLos datos sobre el manejo de los pacientes en España se contabilizaron en términos de uso de recursos y costes en función del tratamiento conforme a la opinión de los expertos (tabla 2). Como manejo común para todos los fármacos, se consideró la visita al especialista en reumatología cada 3 meses para aquellos pacientes en el estado de salud de alta actividad de la enfermedad, cada 6 meses para aquellos en el estado de salud de actividad moderada de la enfermedad, y una vez al año para el estado de salud de baja actividad de la enfermedad y remisión. Las pruebas anuales incluían una radiografía de tórax, 3 análisis de sangre (incluidas pruebas de función hepática y renal, VSG, proteína C reactiva y hemograma). Además, en la primera visita también se consideró una prueba cutánea de tuberculina de Mantoux (tabla suplementaria 6). Cuando fue necesario, los costes se actualizaron a EUR2023.
Costes farmacológicosPara estimar el costo farmacológico de los tratamientos, se utilizó la base de datos “BOT PLUS” del Consejo General de Colegios Oficiales de Farmacéuticos de España a precio de venta del laboratorio en 2023. A partir de este precio, se aplicó el descuento reflejado en el Real Decreto-Ley 08/201025 y se estimó el precio del tratamiento anual utilizando la dosis adecuada o la combinación necesaria de tratamientos (como en el caso de los anti-TNF-α, FAMEb y la adición de MTX en una distribución de 57% SC–47% PO con sus respectivos precios) para cada comparador. En cuanto al precio del bsTCZ, se asume que, basándose en las tendencias de precios de los biosimilares en España, se lanzará a un precio que refleje un descuento del 30% en comparación con el refTCZ.
Análisis de sensibilidadSe realizó un análisis de sensibilidad univariado para cada variable, modificando su valor en el modelo según su rango de probabilidad, con el fin de evaluar la influencia de cada una de ellas en los resultados finales y detectar la forma en que se aseguraba la credibilidad de los resultados. El análisis de sensibilidad univariado se representó en un diagrama de tornado basado en el Beneficio Monetario Neto (Net Monetary Benefit). Además, se realizó un análisis de escenarios en el que se modificó la probabilidad de cambio de tratamiento en pacientes con alta actividad de la enfermedad (0–100%) o actividad moderada de la enfermedad (0–100%), se añadió un rango de descuento a los comparadores (0–10%) y se utilizaron diferentes distribuciones de probabilidad (normal, gamma, log-normal y Poisson) para asignar inicialmente a los pacientes según la gravedad de la enfermedad. La robustez se evaluó mediante un análisis de sensibilidad probabilístico con una simulación de Monte Carlo de segundo orden. Se utilizaron distribuciones Dirichlet/Beta para las probabilidades, distribución Gamma para las utilidades y distribuciones log-normales para los costes y las razones de riesgo.
ResultadosRevisión bibliográficaLa búsqueda PICO-S-T dio como resultado 31 estudios, que fueron revisados por pares para su inclusión. Se excluyeron 18 por el título o el resumen y 13 de ellos se revisaron en texto completo. Las razones de la exclusión incluyeron falta de comparadores, otros resultados, diferente tipo de estudio o texto completo no disponible. No se encontraron NMA que incluyeran upadacitinib, baricitinib, sarilumab y filgotinib, por lo que se realizaron búsquedas ad hoc de ensayos clínicos apropiados para incluir estos comparadores en el modelo.
Finalmente, en cuanto a la eficacia, se incluyeron metaanálisis y una serie de ensayos clínicos para los diferentes tratamientos: abatacept, Guyot et al. (2011)26; adalimumab, Burmester et al. (2016); baricitinib, Dougados et al. (2016) and Genovese et al. (2016); certolizumab, Guyot et al. (2011); etanercept, Guyot et al. (2011); filgotinib, Westhovens et al. (2020) y Genovese et al. (2019); golimumab, Guyot et al. (2011); infliximab, Guyot et al. (2011); rituximab, Guyot et al. (2011); sarilumab, Burmester et al. (2016); refTCZ y bsTCZ, Leil et al. (2021)27; tofacitinib, Kremer et al. (2013) y Vollenhoven et al. (2020); y, upadacitinib, Genovese et al. (2018) y Vollenhoven et al. (2020).
EfectividadLos umbrales de DAS28 considerados para cada estado de salud fueron los siguientes: DAS28 < 2,6, remisión; 2,6 ≤ DAS28 ≤ 3,2, baja actividad de la enfermedad; 3,2 < DAS28 ≤ 5,1, actividad moderada de la actividad, y DAS28 > 5,1, alta actividad de la enfermedad. Las probabilidades estimadas de transición de un paciente para los distintos tratamientos se reflejan en la tabla 1, con cifras entre el 11% para rituximab y el 57% para tocilizumab (refTCZ o bsTCZ) en el primer año. A largo plazo (52 semanas), los tratamientos con mejores resultados (mayor porcentaje de pacientes en estado de remisión) fueron tocilizumab, upadacitinib, certolizumab y filgotinib. En cuanto a aquellos en los que los pacientes se encontraban mayoritariamente en el estado de actividad de la enfermedad moderada-alta a las 52 semanas, se encuentran rituximab, golimumab y etanercept. En el estado de baja actividad de la enfermedad, todos los tratamientos mostraron un rendimiento similar.
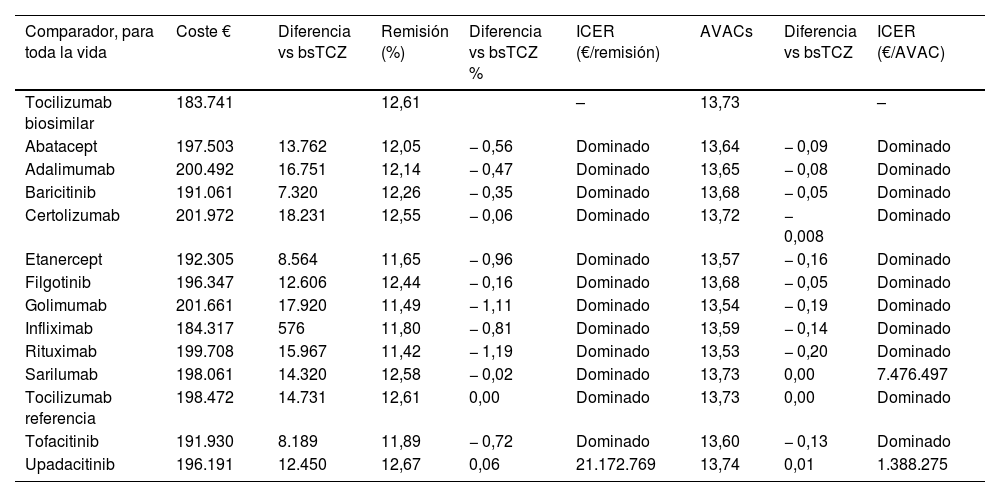
Caso baseEn el horizonte de vida útil, los tratamientos con un mayor porcentaje de pacientes en estado de remisión fueron upadacitinib (12,67%), tocilizumab (12,61%) y sarilumab (12,58%) (tabla 3). En cuanto a los AVAC, se obtuvieron valores de 13,74 para upadacitinib y de 13,73 para sarilumab y tocilizumab. El bsTCZ mostró el menor costo total por paciente, con una cifra de 183.741€, seguido de infliximab (184.317€), en comparación con certolizumab, que presentó el costo más alto por paciente (201.972€).
Los costes y la efectividad de cada tratamiento se evaluaron en un horizonte temporal de toda la vida
| Comparador, para toda la vida | Coste € | Diferencia vs bsTCZ | Remisión (%) | Diferencia vs bsTCZ % | ICER (€/remisión) | AVACs | Diferencia vs bsTCZ | ICER (€/AVAC) |
|---|---|---|---|---|---|---|---|---|
| Tocilizumab biosimilar | 183.741 | 12,61 | – | 13,73 | – | |||
| Abatacept | 197.503 | 13.762 | 12,05 | − 0,56 | Dominado | 13,64 | − 0,09 | Dominado |
| Adalimumab | 200.492 | 16.751 | 12,14 | − 0,47 | Dominado | 13,65 | − 0,08 | Dominado |
| Baricitinib | 191.061 | 7.320 | 12,26 | − 0,35 | Dominado | 13,68 | − 0,05 | Dominado |
| Certolizumab | 201.972 | 18.231 | 12,55 | − 0,06 | Dominado | 13,72 | − 0,008 | Dominado |
| Etanercept | 192.305 | 8.564 | 11,65 | − 0,96 | Dominado | 13,57 | − 0,16 | Dominado |
| Filgotinib | 196.347 | 12.606 | 12,44 | − 0,16 | Dominado | 13,68 | − 0,05 | Dominado |
| Golimumab | 201.661 | 17.920 | 11,49 | − 1,11 | Dominado | 13,54 | − 0,19 | Dominado |
| Infliximab | 184.317 | 576 | 11,80 | − 0,81 | Dominado | 13,59 | − 0,14 | Dominado |
| Rituximab | 199.708 | 15.967 | 11,42 | − 1,19 | Dominado | 13,53 | − 0,20 | Dominado |
| Sarilumab | 198.061 | 14.320 | 12,58 | − 0,02 | Dominado | 13,73 | 0,00 | 7.476.497 |
| Tocilizumab referencia | 198.472 | 14.731 | 12,61 | 0,00 | Dominado | 13,73 | 0,00 | Dominado |
| Tofacitinib | 191.930 | 8.189 | 11,89 | − 0,72 | Dominado | 13,60 | − 0,13 | Dominado |
| Upadacitinib | 196.191 | 12.450 | 12,67 | 0,06 | 21.172.769 | 13,74 | 0,01 | 1.388.275 |
bsTCZ: tocilizumab biosimilar; ICER: razón de costo-efectividad incremental; AVAC: año de vida ajustado por calidad; TCZ Biosimilar: tocilizumab biosimilar.
Nota: Un tratamiento se considera dominado cuando el tocilizumab biosimilar es menos costoso y más efectivo que la alternativa.
El ICER tanto para el porcentaje de pacientes en estado de remisión como para los AVAC mostró que bsTCZ fue dominante o costo-efectivo en comparación con todos los tratamientos evaluados. Además del caso base, se simularon análisis de escenarios adicionales. En el primero, el 100% de los pacientes con actividad moderada o alta de la enfermedad cambiaron de tratamiento; en el segundo, se aplicó un descuento del 10% sobre el precio de venta del laboratorio a todos los comparadores y del 0% a bsTCZ; y, por último, se evaluó una distribución diferente de los pacientes por gravedad de la enfermedad al inicio, basada en distintas distribuciones de probabilidad. Los resultados en todos estos escenarios se mantuvieron, mostrando que bsTCZ fue dominante o costo-efectivo en todas las comparaciones.
Análisis de sensibilidadEl análisis de sensibilidad determinístico univariado mostró que los factores con mayor influencia en la variabilidad de los resultados fueron: la probabilidad de transición de remisión a un estado de baja actividad de la enfermedad, el coste a largo plazo de bsTCZ y la probabilidad de transición de un estado de baja a moderada actividad de la enfermedad (figs. suplementarias 1–13). Aunque estos factores influyeron en la variabilidad del análisis univariado, bsTCZ se mantuvo como la opción de tratamiento más costo-efectiva en todos los escenarios.
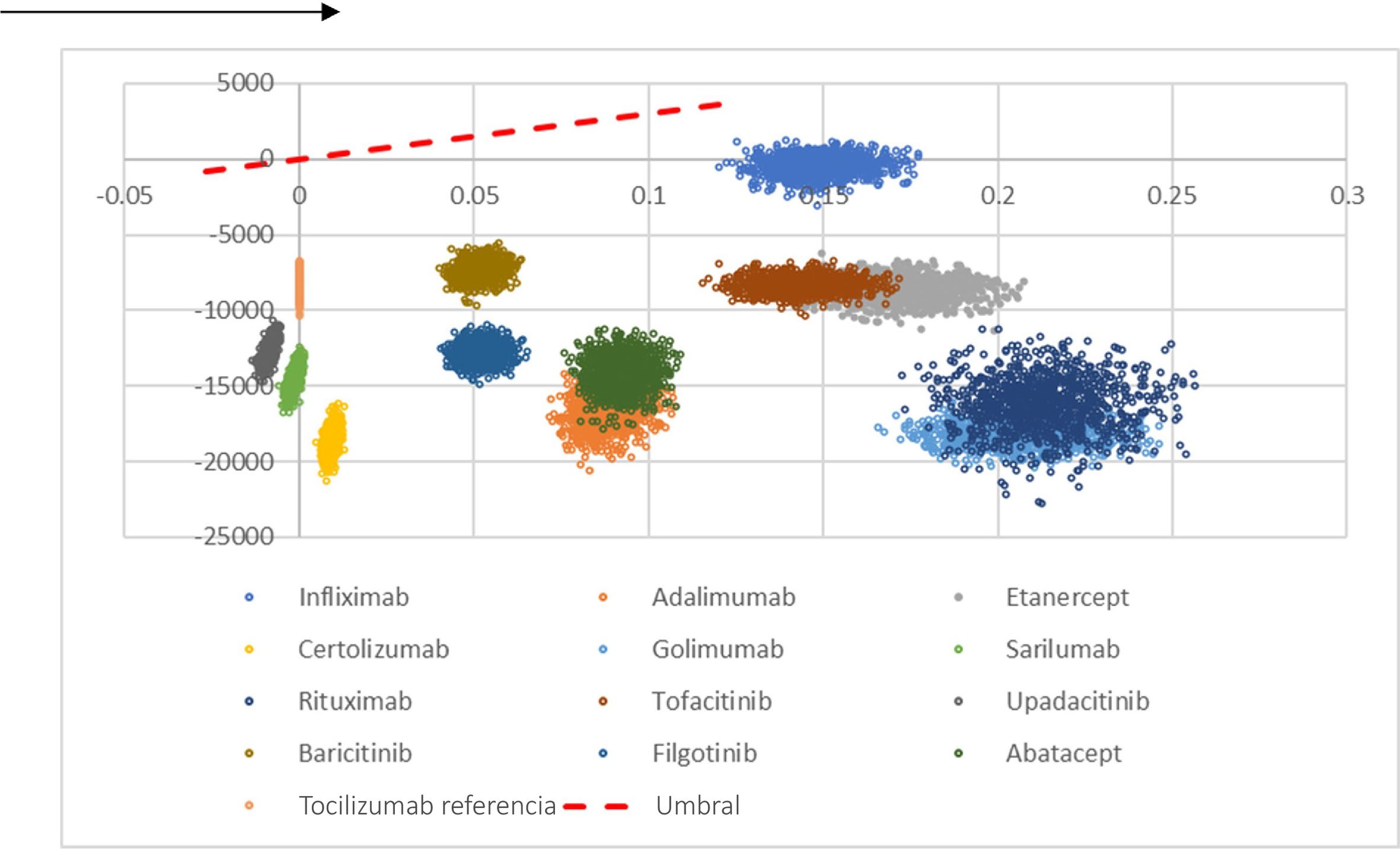
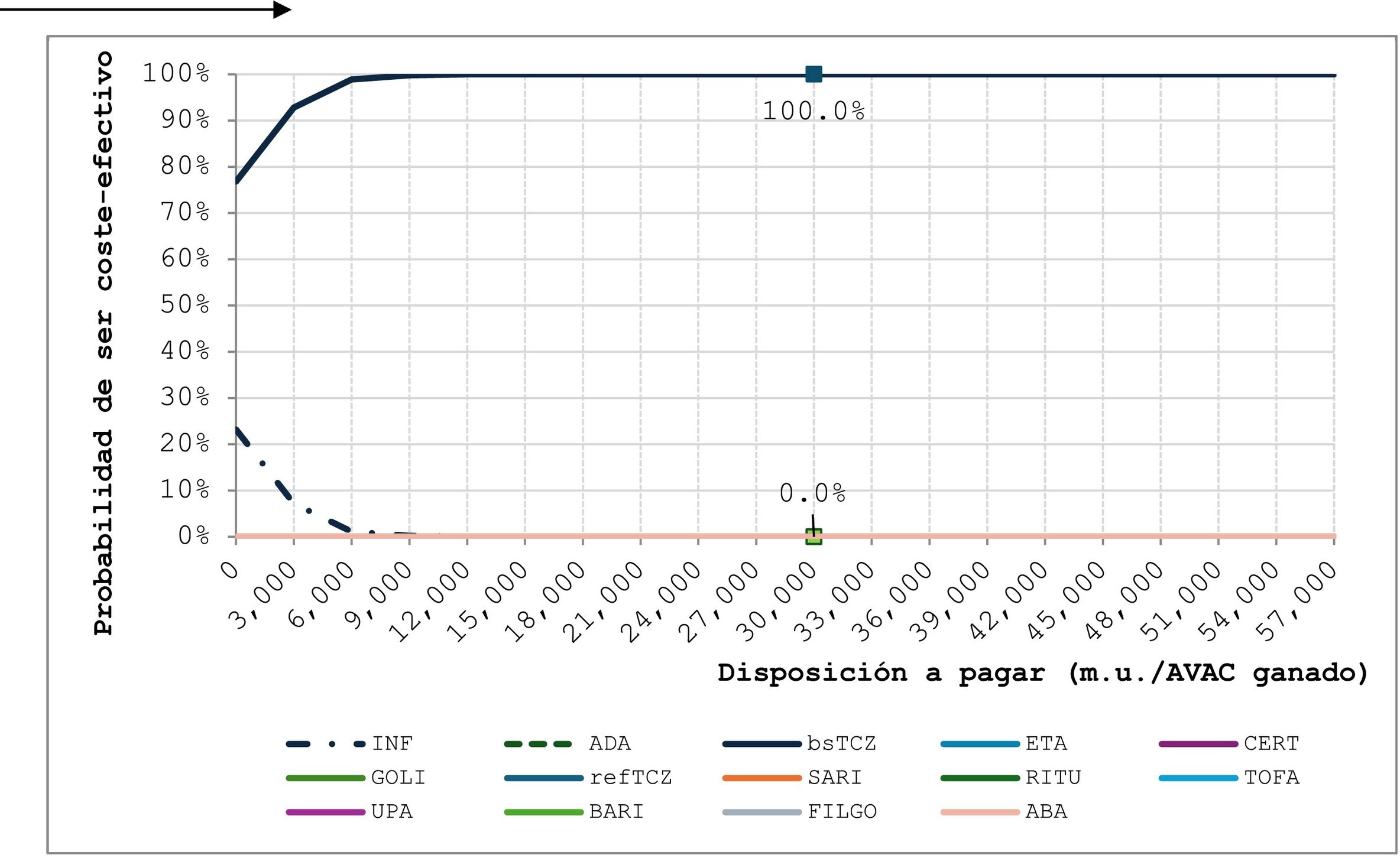
El análisis de sensibilidad probabilístico (n = 1000 simulaciones) mostró que bsTCZ fue dominante o costo-efectivo en todas las comparaciones (fig. 2). Cuando se analizó la probabilidad de ser costo-efectivo, bsTCZ tuvo un 100% de probabilidad de serlo en comparación con los demás tratamientos para ambos umbrales de 30.000€ y 22.000€, los más utilizados en España (fig. 3)28.
Plano coste-efectividad del biosimilar tocilizumab vs. todos los comparadores. Representa las 1000 simulaciones realizadas por el modelo. Las comparaciones situadas en el eje x positivo representan mejores AVAC para bsTCZ, las situadas en 0 representan los mismos AVAC, y las situadas en el eje x negativo representan peores AVAC; las comparaciones en costes se representan en el eje y, y todas ellas se sitúan en el eje y negativo, lo que significa que bsTCZ representa mayoritariamente un coste menor (excepto las simulaciones en la comparación vs infliximab).
Para este modelo, fue necesario realizar algunas suposiciones. Por ejemplo, la distribución basal de los pacientes entre los diferentes estados de salud (baja, moderada y alta actividad de la enfermedad) se calculó a partir de la distribución basal media del DAS28 en Leil et al. (2021)21 asumiendo una distribución normal. Cuando no había datos sobre la distribución de los pacientes entre moderado-alto, se calculó que el 15,3% pertenecían al estado de salud con actividad moderada de la enfermedad. Se observó que, en los CTs más antiguos, se utilizaba principalmente DAS28-VGS, pero que progresivamente se había cambiado a DAS28-CRP en los ensayos más recientes como punto final. Según Leil et al. (2021)21, los valores de ambos marcadores son muy similares y, además, no era posible estimar el estado de salud, por lo que se asumió que los datos eran equivalentes. En cuanto al horizonte de vida, se hicieron 2 suposiciones: se asumió que la efectividad de los estudios pivotales es válida hasta la semana 52 y, a partir de ese momento, se aplicaron las mismas probabilidades de transición para todos los tratamientos a partir de un estudio para pacientes en tratamiento con anti-TNF-α20. Después de la semana 52, los pacientes en estado de alta actividad de la enfermedad cambiaron a un grupo de tratamientos definido de acuerdo con la cuota de mercado en España. Todas las suposiciones se hicieron de manera conservadora, siempre en detrimento de los resultados de bsTCZ, para que los resultados obtenidos y las conclusiones extraídas de este análisis no sobreestimaran a bsTCZ ni subestimaran a sus comparadores. Aunque se realizó un análisis de sensibilidad utilizando diferentes rangos de descuento para los comparadores, se debe considerar que en este análisis se utilizaron los precios ex fábrica, ya que los precios finales reembolsados no están disponibles públicamente, lo que podría afectar a los resultados finales. Creemos que será útil para todos los profesionales y partes interesadas involucrados en el tratamiento de la AR contar con un ejercicio farmacoeconómico actualizado, dada la creciente disponibilidad de opciones terapéuticas para esta enfermedad.
Aunque no existen estudios específicos de coste-efectividad de bsTCZ para el tratamiento de la AR en otros países, los estudios de otros biosimilares en AR29,30 o de bsTCZ en el tratamiento de otras patologías han mostrado que los biosimilares son una alternativa coste-efectiva y que ahorran costes31,32, por lo que deben posicionarse de inmediato en el esquema de tratamiento para aprovechar sus beneficios. La introducción de los biosimilares permite ahorrar costes y, en el caso de España, se ha informado de que una mayor adopción de biosimilares permitiría tratar a más pacientes, redirigiendo esos ahorros32, y mejorando la asignación de recursos sanitarios y la atención al paciente.
En conclusión, este estudio demuestra, a través del modelo propuesto, que el bsTCZ es dominante o, al menos, coste-efectivo frente a todas las alternativas terapéuticas para el tratamiento de la AR desde la perspectiva del sistema de salud español.
Responsabilidades éticasTodos los autores aceptan las responsabilidades definidas por el Comité Internacional de Editores de Revistas Médicas (ICMJE). El estudio se realizó utilizando datos administrativos y públicos. No se utilizó información de pacientes.
FinanciaciónEste trabajo ha sido financiado por Kabi Spain S.A.U.
Conflicto de interesesFernando Pérez Ruíz ha recibido honorarios por asesoramiento de protalix, horizon, arthrosis y LG Pharma; honorarios como ponente de Menarini y Bioepis; y becas de investigación de la Asociación de Reumatólogos de Cruces. Carlos Crespo Diz ha recibido honorarios de: Abbvie, Almirall, Amgen, Biogen, Bristol Myers Squibb, Fresenius Kabi, Janssen-Cilag, Kern Pharma, Merck Sharp Done, Pfizer, Roche, UCB Pharma. Joan Antoni Schoenenberger-Arnaiz ha recibido honorarios de Fresenius Kabi y IQVIA. Mónica Cerezales y Carlos Crespo son empleados de Axentiva, una consultora que trabaja para varias empresas farmacéuticas y de productos sanitarios. Marcelo Alejandro Guigini y José Ignacio Peinado-Fabregat F son empleados de Fresenius Kabi Spain. Mónica Climente-Martí ha percibido honorarios de Abbvie, Fresenius Kabi, Janssen-Cilag, Kern Pharma, Leo-Pharma, Pfizer y Roche.
Presentaciones en congresosOrganización 1: the European Alliance of Associations for Rheumatology.
Lugar de celebración: Messe Wien Congress Center, Vienna, Austria.
Fecha: 12–15 de junio de 2024.
Organización 2: Sociedad Española de Reumatología.
Lugar de celebración: Palacio de Congresos Expomeloneras, Gran Canaria, España.
Fecha: 7–10 de mayo de 2024.
Declaración de transparenciaEl autor de correspondencia, en nombre del resto de los firmantes, declara que los datos e información contenidos en el estudio son precisos, transparentes y íntegros; que no se ha omitido ninguna información relevante; y que todas las discrepancias entre los autores han sido adecuadamente resueltas y descritas.
Responsabilidad y cesión de derechosLos coautores aceptan las responsabilidades definidas por el Comité Internacional de Editores de Revistas Médicas (disponible en http://www.icmje.org/).
En caso de publicación, los autores ceden en exclusiva a la revista y, por extensión, a la SEFH, sus derechos de reproducción, distribución, traducción y comunicación pública de su trabajo por cualquier medio o formato sonoro, audiovisual o electrónico. A tal efecto, se adjuntará una carta de cesión de dichos derechos al artículo cuando se envíe a través del sistema de gestión de manuscritos en línea.
Aportación a la literatura científicaEl estudio compara la coste-eficacia del tocilizumab biosimilar frente a otras alternativas terapéuticas para el tratamiento de la artritis reumatoide moderada a grave en España.
El análisis proporciona una visión sobre el coste-efectividad de las diferentes alternativas de tratamiento, brindando así a clínicos, farmacéuticos hospitalarios y responsables de la toma de decisiones, una evidencia para elegir la opción más apropiada para el manejo de estos pacientes, desde una perspectiva tanto clínica como económica.
Declaración de disponibilidad de los datosTodos los datos incluidos en este análisis se obtuvieron de fuentes públicas y están disponibles para el acceso a ellos.
ABA: abatacept; ADA: adalimumab; BARI; baricitinib; CERT: certolizumab; ETA; etanercept; FILGO: filgotinib; GOLI: golimumab; INF: infliximab; RITU: rituximab; SARI: sarilumab; bsTCZ: tocilizumab biosimilar; TOCI: tocilizumab; TOFA: tofacitinib; UPA: upadacitinib.