La telangiectasia hemorrágica hereditaria (HHT) o también conocida como síndrome Rendu-Osler-Weber, es una displasia vascular de carácter autosómico dominante que se caracteriza por presentar una serie de malformaciones arteriovenosas (AMVs) y telangiectasias mucocútaneas.
Los pacientes con HHT suelen presentar un alto grado de epistaxis y sangrado gastrointestinal, dando lugar a la aparición de anemia y en la mayoría de los casos, el requerimiento de tratamiento con hierro y trasfusiones sanguíneas.
El mecanismo por el que se produce este desarrollo anormal de las paredes de los vasos sanguíneos no está totalmente definido, se cree que probablemente se deba a una incorrecta señalización en la cascada del factor transformante de crecimiento beta (TGF-β) durante el desarrollo vas- cular1.
Muchos genes se han asociado con la aparición de HHT incluyendo Endoglina (ENG) y el gen del receptor de activina tipo kinasa 1 (ALK1)2. La importancia reside en que la mayoría de estos genes forman parte de la cascada de TGF-β y VEGF, jugando un papel fundamental en la regulación de la proliferación celular y la angiogénesis.
De hecho, numerosos estudios muestran que las concentraciones de TGF-β y del factor de crecimiento endotelial vascular (VEGF) están significativamente aumentados en estos pacientes.
El TGF-β estimula la producción de VEGF, cuya implicación es clave en el proceso de desarrollo de la angiogénesis.
Por este motivo, se introduce el uso de bevacizumab, un anticuerpo monoclonal humanizado IgG1 cuyo mecanismo de acción es el bloqueo de los niveles circulantes de VEGF, como terapia en la epistaxis asociada a HHT.
Nuestro objetivo es describir un caso de una paciente con epistaxis asociada a HHT en el cual el uso de bevacizumab permite reducir la aparición éstas, además de disminuir las telangiectasias y la necesidad de trasfusiones sanguíneas con una adecuada tolerancia al tratamiento.
Descripción del caso clínicoSe trata de una mujer de 79 años, con antecedentes personales de diabetes mellitus tipo 2, hipertensión arterial, cardiopatía isquémica crónica, portadora de 4 stent coronarios, que además presenta una insuficiencia tricúspide ligera asociada a hipertensión pulmonar leve-moderada. Diagnosticada de asma bronquial y osteoartrosis generalizada.
Es ingresada en mayo de 2012 en la Unidad de Cuidados Intensivos (UCI) por epistaxis recurrentes (Hb: 8.8 mg/dl), desde este servicio se realiza una interconsulta al servicio de otorrinolaringología (ORL) al comprobar que el sangrado no cesaba. Tras realizar dicha consulta, el médico decide pautar Ialumar® (solución isotónica de agua de mar y sal sódica del ácido hialurónico), medumed spray y Mycostatin® (nistatina) y la cita en 2 meses para control.
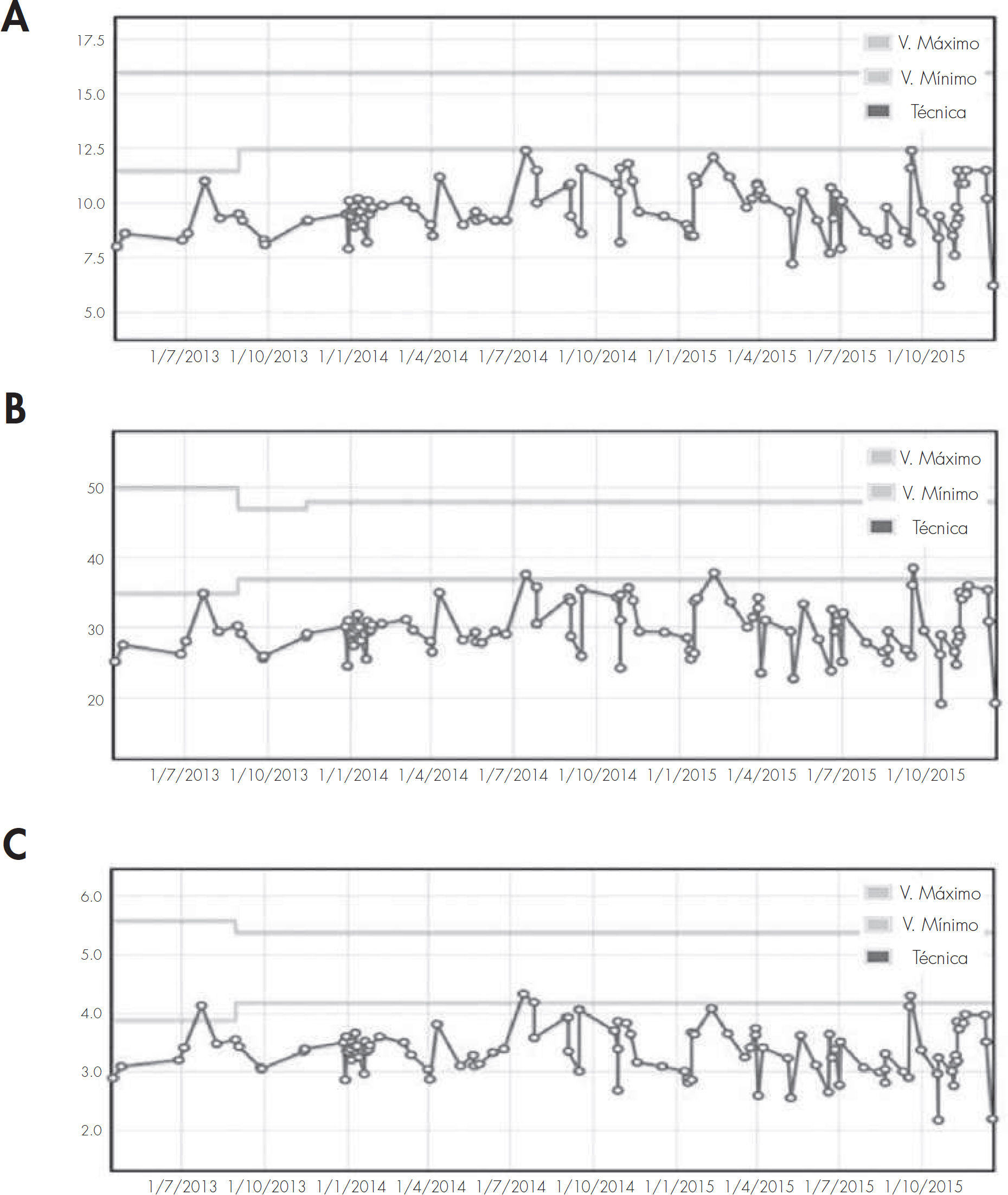
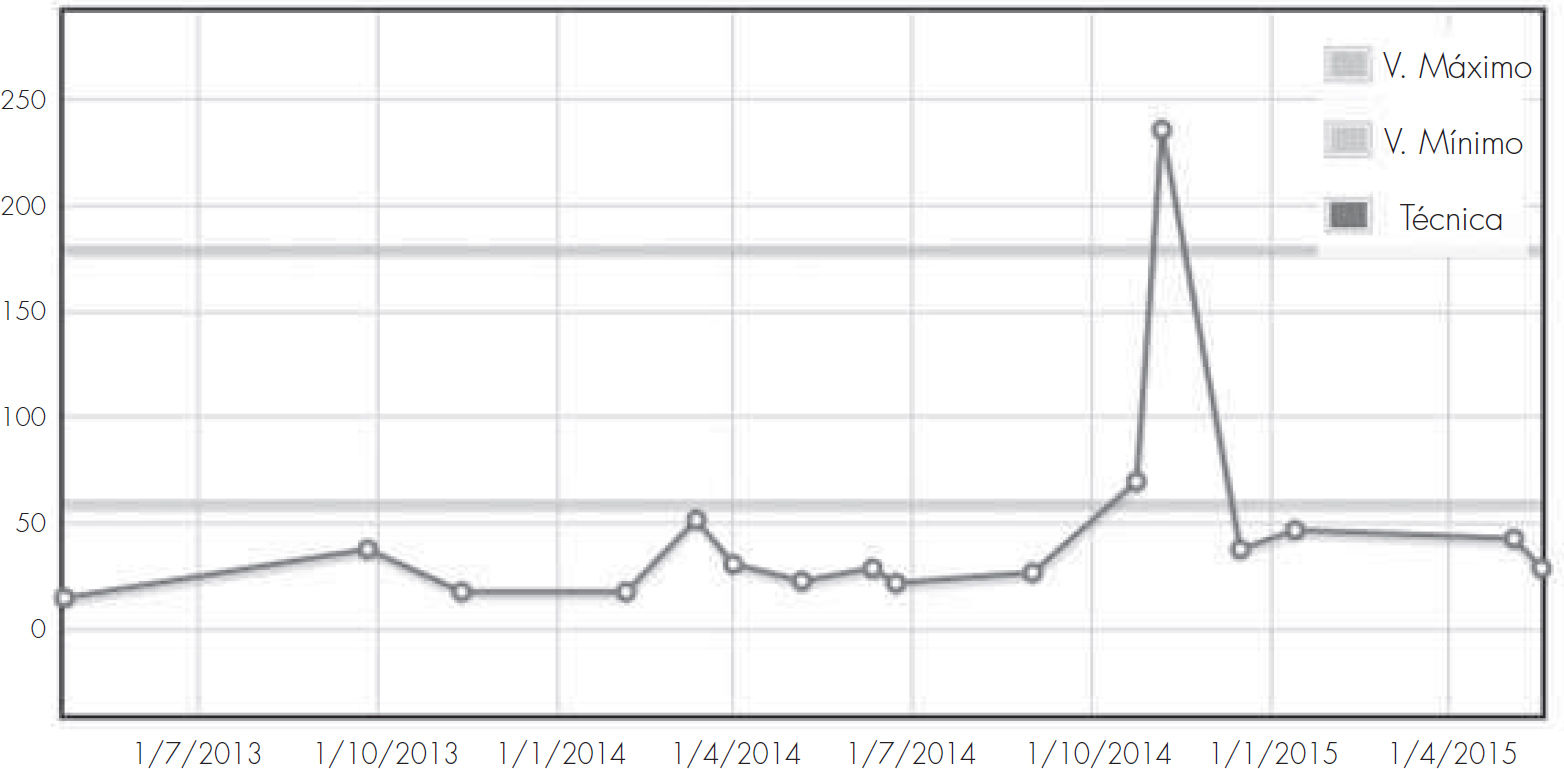
Tras este tratamiento la paciente persiste con sangrado, acudiendo de manera continua al servicio de urgencias. Las analíticas realizadas en estas consultas evidencian los bajos niveles de hemoglobina, hematocrito y hematíes de la paciente, requiriendo trasfusiones sanguíneas (Fig. 1).
Tras varias consultas, el servicio de ORL decide realizar una embolización de la esfelopalatina derecha e izquierda; pero la paciente continúa con diversos sangrados asociados a episodios de hipotensión. En diferentes ocasiones se realizaron taponamiento con hemostáticos absorbibles de celulosa (Surgicel®) y de colágeno (Lyostypt®) sin éxito en el control de la epistaxis a largo plazo.
Ante la imposibilidad de parar los sangrados y ante la amplia historia familiar de sangrado nasal, se remite a la paciente al servicio de neumo- logía en base al juicio clínico de un posible Rendu-Osler atípico. Tras el estudio genético se confirma el diagnóstico.
Desde el servicio de ORL se sigue realizando taponamientos cada 2 meses, y se realizan cauterizaciones de las telangiectasias de la mucosa en el quirófano para evitar el empeoramiento del sangrado. Se remite a la paciente al servicio de hematología para un seguimiento de su hemograma y de la anemia severa que presenta (Fig. 2). Durante este tiempo la paciente presenta una necesidad de trasfusiones cada 15 días y su estado físico y cansancio emporan.
El servicio de ORL plantea a la paciente la posibilidad de tratamiento con bevacizumab de forma sistémica, el cual es desestimado por la paciente por miedo a los posibles efectos adversos. Ante esto, deciden consultar con el servicio de farmacia la posibilidad de realizar el tratamiento por vía intranasal mediante de infiltración local o nebulizado con spray nasal.
Aportación farmacéutica
Desde el servicio de farmacia se estudia el caso, se revisa toda la bibliografía relacionada3-5 y se tramita la solicitud de tratamiento como un uso off-label. Una vez obtenida la autorización de la dirección del hospital, se evalúa el procedimiento de elaboración, la estabilidad de las preparaciones y el material de acondicionamiento adecuado a la vía de administración elegida: jeringa precargada y aguja 27G con fiador para realizar las infiltraciones y para la nebulización se opta por acoplar el dispositivo MAD TM Nasal a la jeringa precargada de bevacizumab.
Finalmente se decide preparar las infiltraciones de bevacizumab con la misma concentración que el medicamento de partida Avastin® 25 mg/mL, La dosis total administrada de 100 mg, 50 mg por fosa nasal, a su vez repartidos en cuatro inyecciones submucosa de 12,5 mg (0,5 ml) correspondientes a cada uno de los puntos de entrada de las arterias principales que irrigan las fosas nasales4,5.
Se desaconsejó el uso de bevacizumab en forma de spray nasal para esta paciente debido a que presenta un alto grado de epistaxis, y por tanto el tiempo de contacto del fármaco con la mucosa sería demasiado corto para que pudiera ejercer el efecto deseado; sin embargo, si sería adecuado como tratamiento de mantenimiento post- inyección3,5.
En las consultas sucesivas tras la infiltración, la paciente refiere haber cesado el sangrado durante los dos meses posteriores, mejorando su calidad de vida. Desde el servicio de ORL evidencian también una disminución en el tamaño de las telangiectasias en la mucosa nasal, concluyendo que si la paciente muestra nuevos sangrados se realizarán las infiltraciones de nuevo viendo el éxito del tratamiento.
DiscusiónAunque el mecanismo de esta patología no está totalmente definido, bevacizumab, un anticuerpo monoclonal inhibidor de VEGF, es el primer tratamiento cuya diana terapéutica está enfocada a la elevación de VEGF que presentan estos pacientes.
Los diferentes autores demuestran que el grado de epistaxis, medido gracias a la escala ESS (epistaxis severity score), la cual clasifica el grado de sangrado de 0 (no enfermedad) a 10 (enfermedad severa) midiendo la frecuencia, duración, intensidad, necesidad de tratamiento, presencia de anemia y la necesidad de transfusiones sanguíneas disminuye en estos pacientes desde ESS > 7 a ESS < 44,5.
La práctica y la experiencia demuestra que los pacientes con ESS < 5 son candidatos al uso de bevacizumab en forma de spray nasal, ya que el sangrado es menor, aumentando el tiempo de contacto del fármaco con la cavidad nasal; pudiéndose repetir cada 2-3 meses. Sin embargo los pacientes con ESS > 5 no muestran beneficios usando esta técnica de administración, por lo que se aconseja el uso de bevacizumab en forma de inyecciones intranasales (dosis de 100 mg), como en nuestro caso. Si después de este tratamiento, el sangrado persiste, los pacientes pueden ser controlados usando el spray nasal. El tratamiento ideal para la mayoría de los autores sería empezar con las inyecciones intranasales y realizar el mantenimiento con dosis repetidas de spray nasal4,5.
Teniendo en cuenta la mejoría del grado de epistaxis de nuestra paciente, se puede concluir que el uso de bevacizumab en forma de inyecciones intranasales podría ser considerada como una opción de tratamiento para aquellos pacientes con HHT que sufren episodios de epistaxis recurrentes que interfieren con su vida cotidiana, sin necesidad de someterse a un tratamiento intravenoso, pudiendo repetir las inyecciones si las epistaxis volvieran a aparecer.
Amaya Echeverría Gorriti, Marta Luri Fernández de Manzanos, Irati Irigoyen Rodríguez, Ane Gutiérrez Lizarazu, Ana Ortega Eslava, Irene Aquerreta González
Servicio de Farmacia, Clínica Universidad de Navarra, Pamplona, España.
Escitalopram es un inhibidor selectivo de la recaptación de serotonina (ISRS) ampliamente utilizado para trastornos depresivos, de ansiedad, angustia y trastornos obsesivo-compulsivos1, cuyo consumo ha aumentado notablemente en la última década (en España de 1,3 dosis diarias definidas por 1.000 habitantes y día en el año 2004 a 15,3 en 2013).
El tratamiento con escitalopram se ha asociado a reacciones adversas que incluyen cefalea, insomnio, artralgias o disminución del apetito1. Aunque menos frecuentemente (1/1.000 a <1/100 pacientes), también se han notificado casos de hemorragias graves en pacientes quirúrgicos especialmente al combinar el uso de inhibidores selectivos de la recaptación de serotonina con antiinflamatorios no esteroideos, aspirina, warfarina y otros anticoagulantes1.
El empleo de productos de medicina alternativa por parte de los pacientes es creciente y en muchas ocasiones lo utilizan combinado con el tratamiento convencional. Por ejemplo, el uso de plantas medicinales ha aumentado, y una de las más consumidas es el té verde.
El té verde presenta efectos antioxidantes, motivo por el cual los pacientes oncológicos lo toman, pero también ha mostrado propiedades anticoa- gulantes2 y protectoras frente a la arterioesclerosis3.
Presentamos el primer caso, que tengamos conocimiento, de hemorragia grave intra y post-operatoria descrita en una paciente con cáncer de ovario intervenida de histerectomía total en tratamiento concomitante con té verde y escitalopram.
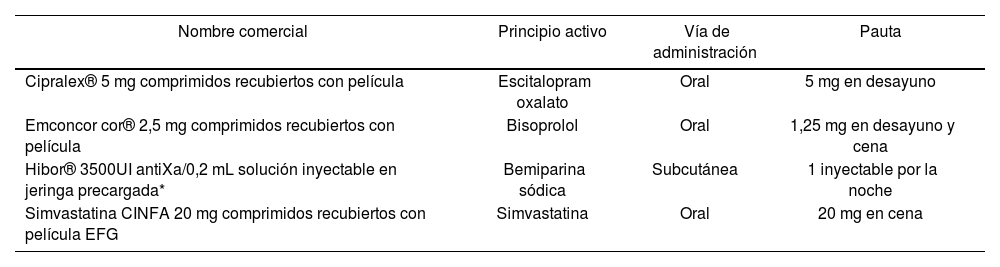
Mujer española, de 68 años de edad, 78 kg y 156 cm (IMC=32,1 kg/m2). Como antecedentes personales destacan: hipertensión arterial en tratamiento con bisoprolol 1,25 mg cada 12 h, hipercolesterolemia en tratamiento con simvastatina 20 mg al día, reflujo gastroesofágico sin tratamiento y síndrome ansioso en tratamiento con escitalopram 5 mg al día que la paciente refiere tomar desde hace varios años (Tabla 1). Además, la paciente es alérgica a sulfamidas y contraste yodado. Niega hábitos tóxicos.
Medicación habitual del paciente
| Nombre comercial | Principio activo | Vía de administración | Pauta |
|---|---|---|---|
| Cipralex® 5 mg comprimidos recubiertos con película | Escitalopram oxalato | Oral | 5 mg en desayuno |
| Emconcor cor® 2,5 mg comprimidos recubiertos con película | Bisoprolol | Oral | 1,25 mg en desayuno y cena |
| Hibor® 3500UI antiXa/0,2 mL solución inyectable en jeringa precargada* | Bemiparina sódica | Subcutánea | 1 inyectable por la noche |
| Simvastatina CINFA 20 mg comprimidos recubiertos con película EFG | Simvastatina | Oral | 20 mg en cena |
Siglas: mg: miligramo; mL: mililitro; UI: unidades internacionales; EFG: especialidad farmacéutica genérica.
En 2005 se le realizó una colpoplastia anterior por presentar prolapso genital, cirugía que discurrió sin incidencias, siendo en aquel momento el tratamiento crónico carvedilol 12,5 mg diarios y alprazolam 0,5 mg en desayuno y cena. En abril de 2015 acudió a consulta en nuestro centro por molestias en la ingle de aproximadamente 2 meses de evolución, realizándose ecografía en la que se observó quiste ovárico. En mayo de 2015 fue sometida a anexectomía bilateral por laparoscopia y resección de implante de ligamento redondo izquierdo, observándose anejos sospechosos de malignidad. En el informe anatomo-patológico se informó cistoadenocarcinoma seroso papilar de alto grado ovárico bilateral que metastatiza en peritoneo (pT2b, Nx). La cirugía transcurrió sin incidencias y sin necesidad de hemoderivados.
Desde entonces recibió bemiparina 3500 UI al día por vía subcutánea como profilaxis de enfermedad tromboembólica. Diez días después, ingresó nuevamente en nuestro centro para tratamiento quirúrgico de cito- rreducción habiendo recibido la última dosis de bemiparina dos días antes de este ingreso. El segundo día de ingreso se realizó citorreducción con histerectomía, linfadenectomía aorto-pélvica, resección de recto con anastomosis termino-terminal, resección de implantes sobre peritoneo de plica vesical, omentectomía, resección de implantes de meso de intestino y resección de mitad posterior de peritoneo subdiafragmático derecho. Durante la cirugía la paciente presentó importante sangrado, llegando a requerir 4 concentrados de hematíes y 1.200 mL de plasma fresco. Además presentó importante inestabilidad hemodinámica que precisó la administración de fenilefrina y expansores plasmáticos. Requirió, además, la administración de 1.000 mg de ácido tranexámico por vía intravenosa ese mismo día. Ingresó en la Unidad de Cuidados Intensivos (UCI) para vigilancia tras la cirugía llegando a necesitar cuatro concentrados de hematíes más y dos unidades de plaquetas en las primeras 24 horas post-operatorias.
En sus primeras 24 horas en la UCI se realizó la conciliación de la medicación mediante entrevista de la farmacéutica con la paciente, quien confirmó el tratamiento crónico citado. Al ser preguntada por la ingesta de medicina alternativa, añadió que tomaba una taza de té verde al día desde hacía varios años y que el tratamiento con escitalopram lo llevaba también desde hacía años. Negaba consumo de antiinflamatorios no es- teroideos (incluido ácido acetil salicílico) en los últimos días. Se volvió a revisar entonces la medicación de la paciente observándose, por un lado, que el sangrado podía ser debido a la toma de escitalopram y, por otro lado, que el té verde podía incrementar dicho riesgo.
El tratamiento con escitalopram fue suspendido desde el momento de la cirugía. Se mantuvo profilaxis antitrombótica únicamente con medidas físicas (botas de compresión neumática) hasta que el quinto día de ingreso (cuarto post-cirugía), dada la mejoría analítica y ausencia de signos de sangrado activo, se decidió reiniciar el tratamiento con bemiparina vía subcutánea comenzando con dosis de 2.500 UI que se aumentó al día siguiente a 3.500 UI, dosis que se mantuvo durante el resto del ingreso.
Como profilaxis post-quirúrgica se administró por vía intravenosa amoxi- cilina con ácido clavulánico 1 g/200 mg cada 8 horas durante los tres días posteriores a la cirugía. Para el tratamiento del dolor la paciente recibió por vía intravenosa 1 gramo de paracetamol cada 8 horas y 2 gramos de metamizol cada 8 horas. Además se le administró 50 mg de ranitidina vía intravenosa cada 8 h como profilaxis de úlcera gástrica, que seis días después se cambió a pantoprazol 40 mg por vía oral. A partir del quinto día post-cirugía se objetivó hipoproteinemia (5 g/dL), motivo por el cuál se inició tratamiento con albúmina 10 gramos cada 8 h durante cuatro días.
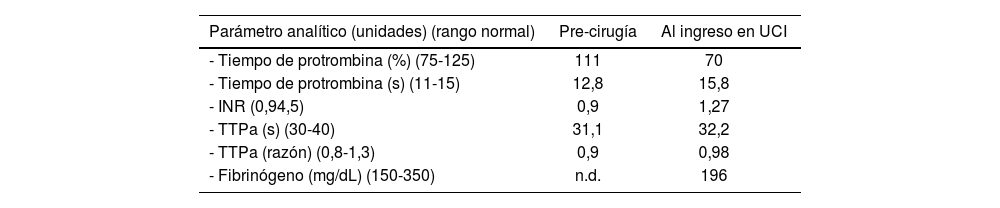
En cuanto a las pruebas analíticas, previo a la cirugía sólo se dispone de pruebas de coagulación anteriores al ingreso para la citorreducción (pruebas del 28/04/15), siendo todos los valores normales (Tabla 2), y la siguiente analítica se realizó al ingreso en UCI.
Pruebas de coagulación antes de la cirugía y al ingreso en UCI tras la cirugía
| Parámetro analítico (unidades) (rango normal) | Pre-cirugía | Al ingreso en UCI |
|---|---|---|
| - Tiempo de protrombina (%) (75-125) | 111 | 70 |
| - Tiempo de protrombina (s) (11-15) | 12,8 | 15,8 |
| - INR (0,94,5) | 0,9 | 1,27 |
| - TTPa (s) (30-40) | 31,1 | 32,2 |
| - TTPa (razón) (0,8-1,3) | 0,9 | 0,98 |
| - Fibrinógeno (mg/dL) (150-350) | n.d. | 196 |
Siglas: UCI: Unidad de Cuidados Intensivos; %: porcentaje; s: segundos; INR: Cociente Normalizado Internacional; TTPa: tiempo de tromboplastina parcial activada; mg/dL: miligramos/decilitro; n.d.: no disponible.
Al alta, el día 28 de mayo, se recomendó a la paciente para próximas intervenciones suspender la toma de escitalopram días antes de la cirugía y se indicó continuar con la administración de bemiparina subcutánea 3.500 UI al día hasta el 26 de junio. Además, se le explicó la posible contribución de la toma de té verde en el sangrado profuso que había padecido, motivo por el cual la paciente no volvió a tomarlo.
Tras el ingreso, el 16 de junio se colocó reservorio venoso central y se administró quimioterapia vía intravenosa (paclitaxel 100 mg y carboplatino 140 mg). La paciente en ese momento ya había suspendido tanto la toma de té como la de escitalopram. El ciclo de quimioterapia se repitió el día 23 de junio. Tres días después, la paciente acudió a Urgencias presentado congestión, edema y dolor en extremidad superior derecha de 24 horas de evolución y fue diagnosticada de trombosis venosa profunda, motivo por el cual requirió iniciar tratamiento con bemiparina 10.000 UI diarias por vía subcutánea. En ese momento la paciente confirmó que desde el ingreso de la cirugía no había vuelto a tomar escitalopram ni té verde, manteniendo el resto del tratamiento habitual sin cambios. El 1 de julio inició tratamiento antidepresivo con duloxetina 30 mg diarios por vía oral. El 14 de julio se disminuyó la dosis de bemiparina a 7.500 UI que se mantuvo hasta enero de 2016 sin haber presentado nuevos episodios de sangrado ni de trombosis.
Según la literatura existente, se presenta el primer caso de sangrado profuso quirúrgico, en una paciente en tratamiento concomitante con esci- talopram y té verde.
El mecanismo de acción de escitalopram se basa en la inhibición por parte de la neurona de la recaptación del neurotransmisor serotonina en el sistema nervioso central1. Esta inhibición también se produce a nivel de las plaquetas. Así, la serotonina es responsable de la activación de las plaquetas para promover la agregación plaquetaria. Puesto que las plaquetas captan el neurotransmisor del plasma, al inhibirse la recaptación se produce un aumento del riesgo de sangrado.
La frecuencia descrita de aparición de sangrado es baja, aunque se han notificado casos graves.
Existen en la bibliografía ejemplos diversos de aumento significativo del riesgo de sangrado al asociar los ISRS con antiinflamatorios no esteroideos que detectan un riesgo tres veces superior de sangrado si el paciente recibe ambos fármacos a la vez.
Por otro lado, el té verde (Camellia sinensis) contiene más de 4.000 componentes activos, siendo el principal grupo las epigalocatequinas (EGC). Las EGC han mostrado, entre otros, efectos antimicrobianos, hi- potensores, de prevención cardiovascular y anticarcinogénicos3. Por esta última acción el consumo de té verde entre los pacientes oncológicos es cada día mayor. Sin embargo, su ingesta no está exenta de riesgos como interacciones farmacocinéticas y farmacodinámicas con fármacos como irinotecan, paracetamol, verapamilo o tamoxifeno y reacciones adversas como náuseas, irritabilidad e insomnio3.
Estudios in vivo en animales han demostrado una inhibición significativa de la agregación plaquetaria en los grupos que recibían EGC mostrando además alargamiento de los tiempos de sangrado y tiempos de trombo- plastina parcial activada4.
Aunque no existe evidencia de que el té verde interaccione con esci- talopram, es posible que la combinación pueda incrementar el riesgo de sangrado. El presente caso podría mostrar un efecto sinérgico de ambos compuestos que tiene como resultado un sangrado anormal en la cirugía a la que se somete la paciente.
Para evaluar la posible interacción del medicamento con la planta medicinal se ha utilizado la escala propuesta por Naranjo, mediante la cual se ha obtenido una puntuación global de 6, que indica probable causalidad (Tabla 3). Además, puesto que la explicación a la reacción puede ser la interacción de ambos fármacos, se ha usado la escala de probabilidad de interacciones entre fármacos (DIPS) resultando una posible interacción entre escitalopram y té, con una puntuación de 3 (Tabla 4).
Aplicación del algoritmo de Naranjo
| Preguntas | Respuesta | Puntuación |
|---|---|---|
| ¿Existen informes previos concluyentes acerca de esta reacción? | NO | 0 |
| El acontecimiento adverso ¿apareció después de que se administrara el fármaco sospechoso? | SI | +2 |
| La reacción adversa ¿mejoró al interrumpirse el tratamiento o cuando se administró un antagonista específico? | SÍ | +1 |
| ¿Reapareció la reacción adversa cuando se volvió a administrar el fármaco? | NO SABE | 0 |
| ¿Hay otras causas (distintas de la administración del fármaco) que puedan por sí mismas haber ocasionado la reacción? | NO | +2 |
| ¿Se ha detectado el fármaco en sangre (o en otros humores) en una concentración cuya toxicidad es conocida? | NO | 0 |
| ¿Aumentó la gravedad de la reacción al aumentarse la dosis o disminuyó al reducirla? | NO | 0 |
| ¿Había sufrido el paciente una reacción similar al mismo fármaco o a fármacos análogos en alguna exposición previa? | NO | 0 |
| ¿Se confirmó el acontecimiento adverso mediante pruebas objetivas? | SÍ | +1 |
| Puntuación final | 6 |
Las categorías correspondientes a la puntuación total son las siguientes: La reacción adversa es: segura: > 9; probable: 5-8; posible: 1-4; improbable: 0.
Aplicación de la escala de probabilidad de interacciones entre fármacos (DIPS).
| Preguntas | Respuesta | Puntuación |
|---|---|---|
| ¿Hay estudios previos de esta interacción? | NO | -1 |
| ¿La interacción observada se justifica por las propiedades del fármaco que la genera? | SÍ | +1 |
| ¿La interacción observada se justifica por las propiedades del fármaco sobre el que se genera? | SÍ | +1 |
| ¿Existe una relación temporal consistente entre el evento producido y el curso de la interacción (comienzo/fin)? | SÍ | +1 |
| Al suspender el fármaco que genera la interacción, ¿cesa su efecto? | SÍ | +1 |
| Si se suspende el fármaco que la genera y transcurrido un tiempo se reintroduce, ¿reaparece la interacción? | NO SABE | 0 |
| La interacción que se produce, ¿puede estar originada por otras causas? | NO | +1 |
| ¿Se detectan en sangre una concentración de fármaco suficiente como para que sea posible dicha interacción? | NO SABE | 0 |
| ¿Se confirma la interacción con otra prueba distinta a la determinación de fármaco en sangre? | NO | 0 |
| ¿Fue la interacción mayor cuando se aumenta la dosis del fármaco que origina la interacción o menor cuando se disminuye la dosis del mismo? | NO SABE | 0 |
| Puntuación final | 4 |
Las categorías correspondientes a la puntuación total son las siguientes: La interacción es: altamente probable: > 8; probable: 5-8; posible: 2-4; dudoso:< 2.
Parece apropiado en este caso el cambio de tratamiento antidepresivo a duloxetina ya que se ha visto que el aumento del riesgo de sangrado no se observa en los inhibidores selectivos de la recaptación de serotonina y noradrenalina5.
En el caso descrito, el farmacéutico presente en la Unidad de Cuidados Intensivos es quien al observar la evolución post-operatoria de la paciente, entrevista a la paciente sobre la medicación habitual y productos de medicina alternativa, advierte de la posible interacción al personal médico, y notifica la reacción adversa. Es importante que como farma- céuticos recojamos minuciosamente tanto la medicación crónica de los pacientes como la ingesta de plantas medicinales u otros productos de medicina alternativa para evaluar posibles causas de los efectos que observamos en los pacientes y colaboremos con el equipo clínico para resolver de la mejor forma cada situación, como se ha realizado en este caso. Es también esencial que tengamos siempre presente que los preparados de medicina natural no son inocuos y que a menudo pueden producir efectos adversos importantes e interacciones con el tratamiento farmacológico.
Everolimus es un inhibidor selectivo de mTOR (diana de rapamicina en los mamíferos). mTOR es una serina-treonina-quinasa que regula la traducción y síntesis de proteínas implicadas en el ciclo celular, en la angiogé- nesis y en la glucolisis, por lo que everolimus es un inhibidor potente del crecimiento y proliferación de las células tumorales, endoteliales, fibroblastos y células del músculo liso asociadas con vasos sanguíneos1. Su uso está aprobado para el tratamiento de pacientes adultos con angiomiolipoma renal y astrocitoma subependimario de células gigantes (SEGA) ambos asociados con el complejo esclerosis tuberosa (TSC), siendo el único fármaco aprobado para dichas manifestaciones. Esta indicación está basada en la disminución del volumen del angiomiolipoma y SEGA producida por everolimus comparado frente a placebo2.
La concentración valle de everolimus debe ser evaluada en sangre total aproximadamente 2 semanas tras el inicio del tratamiento y periódicamente durante el mismo, situándose el rango terapéutico para TSC entre 5 y 15 ng/mL.
Entre las reacciones adversas más frecuentes de everolimus (presentes en al menos 1 de cada 10 pacientes) se encuentran: estomatitis, infecciones del tracto respiratorio superior, amenorrea, hipercolesterolemia, naso- faringitis, acné, menstruación irregular, sinusitis, otitis media y neumonía.
El TSC es una enfermedad genética degenerativa causada por mutaciones en los genes TSC1 y TSC2. La mutación en estos genes conduce a una sobreactivación de mTOR que da lugar a una pérdida del control del crecimiento y división celular y que, con una expresividad variable, causa la formación de tumores benignos (hamartomas) y malformaciones en diferentes órganos vitales como el cerebro, el corazón, los riñones, la piel, los ojos, el hígado y los pulmones. La TSC es además la principal causa genética de epilepsia y autismo.
A continuación exponemos el caso de un paciente que presentó necrosis avascular de cadera tras cuatro meses de terapia con everolimus, lo que condujo a la suspensión del tratamiento.
Varón de 36 años, 76 kg y 178 cm (IMC 24 kg/m2), diagnosticado de esclerosis tuberosa a los 9 meses de edad que cursa con discapacidad li- gera, epilepsia multifocal con crisis prácticamente diarias, angiomiolipoma renal y astrocitoma gigante subependimario próximo a agujero de Monro intervenido quirúrgicamente en 1997. Sin otros antecedentes médicos de interés. Desde entonces mantiene revisiones periódicas en el Servicio de Neurología de nuestro centro, además de seguimiento por Urología y Medicina Interna (en otro centro hospitalario).
A lo largo de su enfermedad, el paciente ha recibido tratamiento antiepiléptico con ácido valproico, carbamazepina, lamotrigina, fenobarbital, fenitoína, primidona, vigabatrina, gabapentina, topiramato, tiaga- bina, levetiracetam, pregabalina, zonisamida, rufinamida, lacosamida, perampanel y es portador de neuroestimulador vagal (inactivo desde 2006 por falta de eficacia), sin un adecuado control de las crisis. Para el ajuste del tratamiento antiepiléptico se ha requerido la determinación de concentraciones séricas en la Unidad de Farmacocinética Clínica del Servicio de Farmacia.
En abril de 2015 fue diagnosticado de angiomiolipoma renal tras la realización de una resonancia magnética (RM), motivo por el que se le indicó tratamiento con everolimus. El tratamiento se inició en septiembre de 2015 con una dosis diaria de 5 mg. Al ser un medicamento de dispensación hospitalaria, se solicitó una consulta de inicio de tratamiento a la Unidad de Pacientes Externos del Servicio de Farmacia (UFPE) para la dispensación y seguimiento farmacoterapéutico. Durante la entrevista mantenida con el paciente se le proporcionó información oral y escrita sobre el tratamiento y se le dieron recomendaciones para su correcta toma y sobre los controles analíticos a realizar durante el tratamiento, conforme a lo acordado con su neurólogo. Se realizó la conciliación de la medicación y se señaló la importancia del cumplimiento terapéutico. En ese momento se acordó con el paciente el plan de dispensaciones de medicación desde el Servicio de Farmacia.
El tratamiento del paciente al inicio de la terapia con everolimus consistía en los siguientes medicamentos antiepilépticos: ácido valproico, clonazepam, levetiracetam y eslicarbazepina (Tabla 1).
En las consultas de continuación de tratamiento realizadas mensualmente en la UFPE entre octubre y diciembre de 2015 el paciente refirió buena tolerancia al tratamiento y se comprobó la correcta adherencia al mismo.
Las determinaciones de everolimus en sangre total en diciembre de 2015 y enero de 2016 mostraron unas concentraciones de 4,8 y 4,4 ng/ mL respectivamente, ambas ligeramente inferiores al límite bajo del rango terapéutico. Las muestras fueron analizadas en la Unidad de Farmacocinéti- ca Clínica del Servicio de Farmacia mediante cromatografía líquida de alta eficacia acoplada a espectrometría de masas (UPLC-MS/SM).
En la revisión en Neurología realizada en enero de 2016, tras 4 meses de tratamiento con everolimus, el paciente refiere dolor localizado en la cadera izquierda irradiado hacia la ingle de varias semanas de evolución con limitación para la deambulación, que había motivado una consulta en Urgencias (en otro centro hospitalario) una semana antes, con clínica compatible con trocanteritis, tratada con paracetamol. Los resultados analíticos vistos en consulta no mostraron hallazgos significativos (Tabla 2).
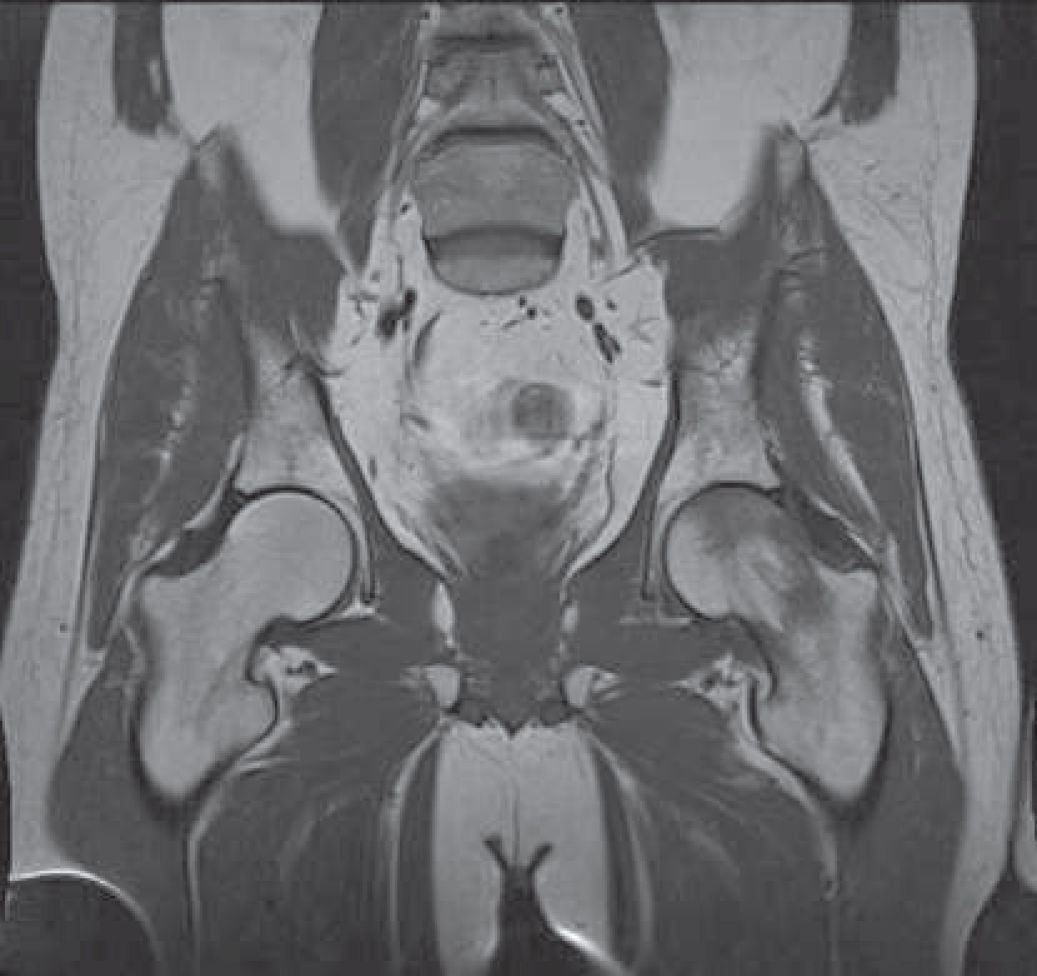
No hubo modificaciones en su tratamiento de base a la espera de la evolución del cuadro articular. En la revisión en Neurología realizada una semana después persistían el dolor articular y la impotencia funcional, por lo que se solicitó consulta en el Servicio de Cirugía Ortopédica y Traumatología (COT). Se realizó una resonancia magnética de cadera en la que se apreciaba un foco de alteración de la señal característico de edema difuso que afectaba a la mitad superior de la cabeza femoral, y se extendía ligeramente por el cuello femoral acompañado de derrame articular compatible con necrosis avascular estadio I (Fig. 1).
Desde la UFPE se estudió la posible relación del tratamiento farmacológico del paciente con el desarrollo de necrosis avascular. Se realizó una búsqueda bibliográfica en Medline (PubMed) y, tras el análisis de la evidencia disponible, se consideró que el cuadro clínico podría estar relacionado con el tratamiento con everolimus debido a las propiedades antiangiogénicas del fármaco. El neurólogo decidió en ese momento interrumpir el tratamiento con everolimus y se citó al paciente en consulta un mes después, momento en el que refiere una ligera mejoría en la intensidad del dolor. El departamento de COT aconseja tratamiento quirúrgico de revascularización de cadera mediante forage percutáneo (descompresión de la cabeza femoral) que se llevó a cabo en marzo de 2016. La biopsia ósea realizada fue informada como necrosis ósea compatible con necrosis avascular de cadera.
El caso fue notificado desde el Servicio de Farmacia como reacción adversa a everolimus y fue analizado por el Centro de Información del Medicamento (CIM) generándose una tarjeta amarilla.
El caso presentado describe una necrosis avascular de cadera tras cuatro meses de tratamiento con everolimus que condujo a la suspensión del tratamiento y requirió revascularización quirúrgica.
La osteonecrosis o necrosis avascular de cadera es una patología grave causada por la disminución del flujo sanguíneo hacia la cabeza femoral, lo que produce inicialmente isquemia y, posteriormente, necrosis de los osteocitos. La necrosis ósea induce un proceso de reparación en el que la reabsorción del hueso excede a la producción. La disminución del flujo sanguíneo hacia el hueso puede ser causada por una interrupción mecánica, una oclusión intravascular, trombos o émbolos de grasa, o por una compresión extravascular3.
La necrosis avascular de cadera se ha relacionado con factores como el uso de glucocorticoides, agentes citotóxicos, consumo de alcohol, lupus sistémico eritematoso, hemoglobinopatías, disbarismo, hiperlipidemia, pancreatitis, gota, enfermedad de Gaucher y la infección por el virus de la inmunodeficiencia humana (VIH)3.
La posible asociación de everolimus con el desarrollo de necrosis avascular se basa en su efecto antiangiogénico. Everolimus disminuye la producción de factor de crecimiento endotelial vascular (VEGF) e inhibe la respuesta de las células endoteliales vasculares a la estimulación por VEGF1,5 a través de la inhibición de mTOR. En un caso descrito en 2013, un varón de 52 años desarrolló osteonecrosis de mandíbula tras 3 años de tratamiento con everolimus a una dosis diaria de 10 mg. El paciente había recibido bifosfonatos intravenosos (ácido zoléndronico) mensualmente durante 5 años hasta 6 años antes de la aparición del cuadro. La osteonecrosis de mandíbula por bifosfonatos está ampliamente documentada en la literatura por lo que estos autores concluyeron que, no pudiéndose excluir a los bifosfonatos como causa de la osteonecrosis, el everolimus podría haberla exacerbado4.
Se ha descrito la relación de otros fármacos con efecto antiangiogénico como sunitinib y bevacizumab con osteonecrosis de mandíbula, sin encontrar casos descritos de osteonecrosis de cadera.
No fue posible encontrar una asociación entre el resto de los medicamentos que recibía el paciente (Tabla 1) y el desarrollo de necrosis avascular.
Para evaluar la relación causal del efecto adverso con everolimus, se aplicó el algoritmo de Karch-Lasagna modificado por Naranjo y se estableció una relación de causalidad de “posible” (puntuación de 7) entre everolimus y el desarrollo de necrosis avascular (Tabla 3).
Como conclusión, el mecanismo antiangiogénico de everolimus junto con la coincidencia temporal y la ausencia de otros factores que pudieran asociarse con el cuadro de necrosis avascular de cadera presentado, nos permiten describir este efecto adverso grave como potencialmente asociado al tratamiento con everolimus, algo no descrito previamente en la literatura.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas