La enfermedad de Niemann Pick tipo C (NPDC) es una enfermedad neurodegenerativa de herencia autosómica recesiva cuya sintomatología principal consiste en esplenomegalia y deterioro neurológico.
Puede presentarse desde el periodo perinatal hasta la edad adulta. Se clasifica en: forma infantil severa (inicio a edad < 2 años), forma infantil tardia (inicio a la edad de 3-5 años), forma juvenil (inicio a la edad de 5-16 años) o forma adulta (inicio a edades > 16 años)1.
Engloba dos genotipos relacionados con mutaciones en el gen NPC1 (95%) y en el gen NPC2 (5%)1. La alteración de estos dos genes conlleva una acumulación de colesterol no-esterificado y glicolipidos en el sistema lisosomal.
El 85% de los pacientes con NPDC presentan hepatoesplenomegalia y alteraciones neurológicas (ataxia, disfagia, deterioro cognitivo, parálisis supranuclear de la mirada vertical, trastorno psiquiátrico, epilepsia…). El pronóstico es variable, siendo la forma más grave la que se presenta en los dos primeros años de vida.
Para poder evaluar la severidad de la enfermedad, monitorizar su progresión y comprobar el efecto del tratamiento recibido, existen diferentes escalas de incapacidad. Una de las más usadas en NPDC se muestra en la Figura 1.
Actualmente no existe ningún tratamiento capaz de detener o revertir el curso de la NPDC. La terapia se basa en el tratamiento sintomático y en la administración del fármaco miglustat, que es un inhibidor de la glucosilceramida sintasa, por lo que inhibe la sintesis de glicolipidos. Además reduce la acumulación de gangliósidos GM2 y GM3, glucosilceramida y lactosilceramida.
Dos de los órganos más afectados en la NPDC1 son el higado y el cerebro. En las células hepáticas predomina una acumulación de colesterol libre, esfingomielina, fosfolipidos y glicolipidos, mientras que en las cerebrales, además, se acumulan glucosilceramidas, lactosilceramidas y gangliósidos. Esto explicaria el hecho de que el miglustat haya mostrado una reducción de la progresión neurológica de la enfermedad en determinados casos, pero que no se haya mostrado igual de eficaz para la sintomatologia colestásica y sistémica.
Datos recientes de estudios en modelos animales2 y la utilización puntual en humanos3-5 sugieren que la hidroxipropil-beta-ciclodextrina (HPBCD) puede minimizar los daños neurológicos en la NPDC.
La HPBCD fue designada como medicamento huérfano en 2010 por la FDA y, en 2013, por la Agencia Europea del Medicamento (EMA) en el tratamiento de la NPDC.
Las ciclodextrinas son compuestos macrocíclicos de unidades de glucosa unidas por enlaces α-D-(1,4), altamente solubles en agua, que forman una cavidad interna apolar que permite la inclusión de moléculas hidrófobas.
El mecanismo de acción que hace que la ciclodextrina pueda ser una buena opción para el tratamiento de la NPDC se basa en su capacidad para disminuir la acumulación de colesterol de la célula. Sin embargo, las ciclodextrinas no atraviesan la barrera hematoencefálica, por lo que no se lograría tratar la enfermedad desde el punto de vista neurológico. Esta limitación hace que se plantee la administración de la HPBCD por vía intratecal (IT).
Descripción del casoPaciente que ingresa por primera vez en nuestro hospital a los 12 meses de edad para estudio de hepatoesplenomegalia y trombocitopenia.
En la exploración, además de la hepatoesplenomegalia, se observa una ligera afectación del oído interno bilateral y retraso en las adquisiciones (no gatea, no se desplaza, no se mantiene en pie, comprensión deficiente…), por lo que se remite a neurología para descartar una posible metabolopatía.
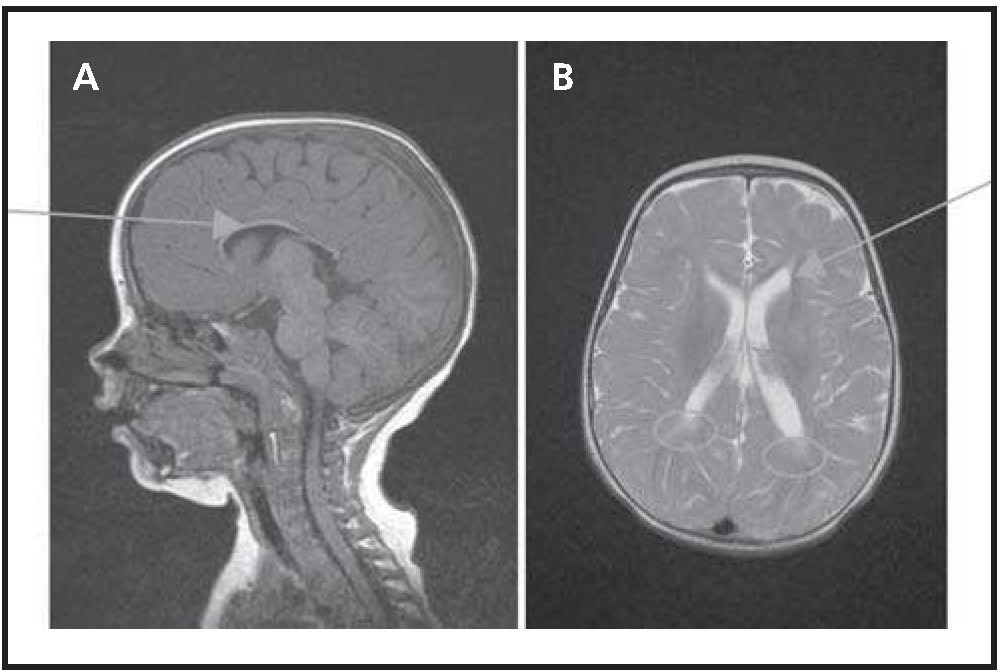
Ante el hallazgo de hepatoesplenomegalia y afectación neurológica se orienta como una posible enfermedad de depósito y se realiza una RMN craneal que muestra signos de discreta atrofia cerebral, con acusado adelgazamiento difuso del cuerpo calloso y lesión de la sustancia blanca periventricular paratrial bilateral (Fig. 2). Estos hallazgos se han descrito en la enfermedad de NPDC.
MRI a los 18 meses de edad.
A. Imagen de línea media sagital ponderada en T1. La imagen muestra una discreta atrofia cerebral, con acusado adelgazamiento difuso del cuerpo calloso (flecha).
B. Imagen de la línea media axial ponderada en 12. Ventriculomegalia (flecha) y lesión de la sustancia blanca periventricular paratrial bilateral (círculos).
Para proseguir con la confirmación diagnóstica se realiza el test de Filipina en cultivo de fibroblastos que resulta positivo a los 19 meses de edad. En este momento la escala de incapacidad es de 11.
A los 22 meses de edad inicia tratamiento con miglustat en su hospital de referencia y 5 meses después (ante la falta de respuesta), se decide añadir al tratamiento HPBCD (IT) en nuestro centro (escala de incapacidad de 14).
Se le administran un total de 43 inyecciones intratecales de HPBCD. La dosis inicial es de 175 mg y se aumenta gradualmente durante los primeros 6 meses hasta llegar a los 325 mg, dosis que se mantiene hasta finalizar el tratamiento. Las dosis se administran cada 15 días en el hospital de día polivalente pediátrico de nuestro centro.
A los 7 meses del inicio del tratamiento con miglustat se suspende este por pérdida de peso acusada y cuadros de diarreas. No obstante, se vuelve a reintroducir al cabo de 3 meses.
La sintomatología de la paciente mejora con la administración de las primeras dosis de HPBCD (mayor contacto visual, mejora de la motricidad). En los primeros 12 meses de tratamiento se objetiva un ligero estancamiento en la progresión de la enfermedad. En todo este tiempo, la escala de incapacidad solo ha aumentado 1 punto (escala de incapacidad de 15). Sin embargo, a partir de esta fecha la paciente presenta un deterioro progresivo (aparición de crisis epilépticas no controladas que requieren cambios en el régimen antiepiléptico de la paciente, empeoramiento de la motricidad, disfagia), lo cual indica que el tratamiento no es eficaz.
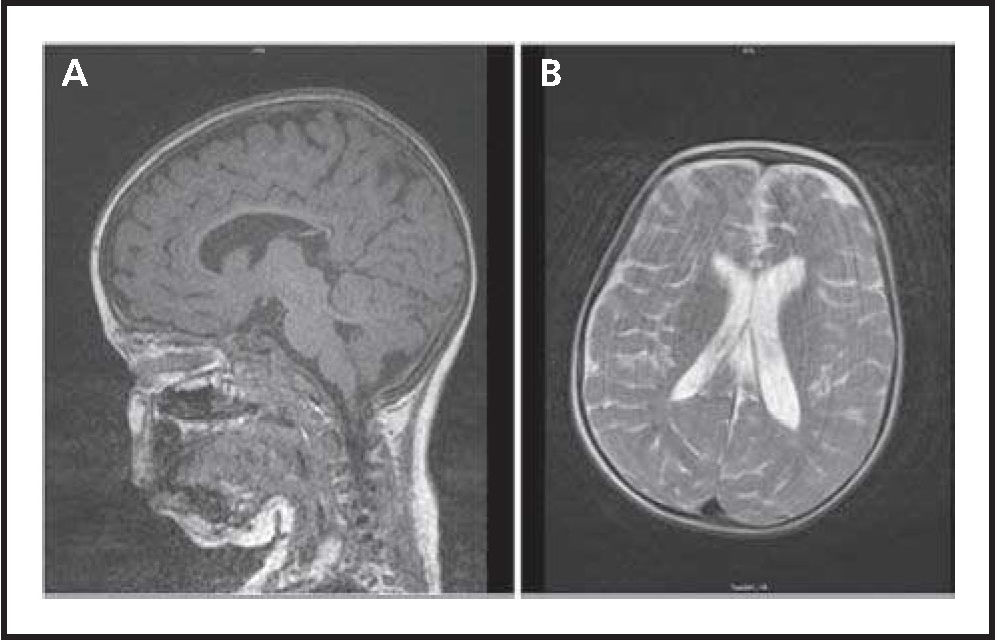
La resonancia magnética a la edad de 30 meses muestra la progresión de la atrofia cerebral, más prominente en el lóbulo occipital (Fig. 3). Un año y 8 meses después de haber iniciado el tratamiento, la HPBCD IT se suspende, presentando una escala de incapacidad de 18.
Antes de cada administración de HPBCD IT se retiró el mismo volumen de líquido cefalorraquídeo (LCR) que de medicamento a administrar (3 ml) y este LCR se analizó. Los parámetros bioquímicos del LCR (proteínas) se mantuvieron estables y en ningún caso se detectó agente infeccioso. Nuestra paciente no manifestó ningún efecto adverso relacionado con su administración.
Discusión y aportación farmacéuticaDesde el Servicio de Farmacia, junto con el Servicio de Neurología, en búsqueda de nuevas alternativas terapéuticas, ante el fallo de la terapéutica con miglustat, se buscó bibliografía en cuanto a la eficacia, seguridad y disponibilidad de la HPBCD administrada por vía intratecal. En base a los casos clínicos publicados3-5, se decidió iniciar el tratamiento con HPBCD IT.
La Dirección del Hospital aprobó la utilización de HPBCD intratecal (previa elaboración de un informe clínico y discusión del comité que evalúa la utilización de fármacos bajo indicaciones no autorizadas). Por otro lado, los tutores del paciente firmaron el consentimiento informado.
La fórmula IT se preparó a partir de viales de 100 ml de Trappsol Cyclo®, de una concentración de HPBCD de 250 mg/ml (CTD Holdings, Inc. – CTDH; USA). Para su adquisición se solicitó su importación a través de la Agencia Española del Medicamento (Gestión de medicamentos en situaciones especiales), previa aprobación del tratamiento por la Dirección del Hospital, junto con la confirmación de suministro por parte del laboratorio distribuidor en Europa (Medical Need Europe AB).
Un hecho diferencial respecto a los casos previos de administración de HPBCD por vía IT en nuestro país, en los que la HPBCD se había importado en forma de materia prima, es que actualmente Medical Need distribuye la HPBCD en solución (viales), presentación que usamos en nuestro caso. De esta forma se garantiza la esterilidad y apirogenicidad del producto inicial.
La elaboración se realizó en el Servicio de Farmacia en cabina de flujo laminar horizontal (ISO clase 5), trabajando en condiciones asépticas y garantizando una preparación estéril y libre de pirógenos.
En función de la dosis prescrita se diluyó el volumen necesario de Trappsol Cyclo (previa filtración por filtro de 0,22 mcm) con solución salina fisiológica (SSF 0,9%) hasta llegar a un volumen final de 3 ml.
Se determinó el pH y la osmolalidad de Trapssol Cyclo (250 mg/ml), de la preparación inicial (175 mg/3 ml) y de la preparación final (325 mg/3ml). Los valores de pH obtenidos fueron de 6,6, 5,7 y 5,8 y los de osmolalidad de 312, 284 y 286 mOsm/kg, respectivamente, por lo que pudimos considerar que todas las preparaciones poseían un pH que no difería significativamente del pH del LCR (7.32) y que eran isoosmóticas con el LCR (292-297 mOsm/kg). Por otro lado, Trappsol Cyclo no contiene excipientes ni conservantes, por lo que descartamos que alguno de sus componentes fuese neurotóxico. Estas dos consideraciones fueron determinantes para poder considerar viable la administración del preparado por vía IT.
A la preparación de HPBCD por vía IT se le asignó una estabilidad de 8 horas a temperatura ambiente y protegida de la luz, para garantizar así su esterilidad.
La HPBCD ha sido utilizada en varios pacientes afectados de NPDC en los que se han conseguido mejoras neurológicas, especialmente en las formas juveniles o tardías. La primera vez que se utilizó por vía IT en humanos fue en el 2009, en el caso de dos gemelas estadounidenses de 7 años, a raíz del cual se pidió el uso compasivo a la FDA. Desde entonces se han publicado 3 casos más, el de una niña de 2 años3, otra de 6 años4 y un niño de 12 años5.
En nuestro caso, durante el primer año de tratamiento con HPBCD IT se retrasa ligeramente la progresión de la enfermedad. No obstante, pasado este tiempo sí que se objetiva un empeoramiento clínico de la paciente, lo cual sugiere una falta de efectividad en las formas severas de NPDC.
La administración de la HPBCD IT ha demostrado ser segura en nuestra paciente, al igual que en los casos clínicos descritos en la literatura. El único efecto adverso descrito en fuentes bibliográficas que probablemente pueda estar relacionado con la administración IT de HPBCD es la pérdida de audición5. Dicho efecto adverso no fue descrito en nuestra paciente.
La dosis y el intervalo de administración ideal se desconocen. La dosificación de la cual se ha partido se basa en estudios animales2 y en otros casos clínicos publicados, en los que el intervalo de dosis oscilaba desde
175 mg de HPBCD iniciales hasta dosis de 450 mg, administrándose ministrándose generalmente cada 15 días.
Recientemente se han iniciado dos ensayos clínicos de HPBCD IT en Estados Unidos en los que se podrá establecer la posología y demostrar si la sintomatología de estos pacientes mejora o si el fármaco es capaz de retrasar o minimizar los síntomas de la enfermedad.