Aunque la fibrosis quística (FQ) es una enfermedad minoritaria, está considerada como una de las enfermedades autosómicas recesivas más prevalentes en Europa y Estados Unidos1. Está causada por mutaciones en el gen CFTR (Cystic Fibrosis Transmembrane Conductance Regulator)2.
En los últimos años, se han desarrollado tratamientos que modulan la proteína CFTR. Existen 2 tipos de moduladores: correctores (elexacaftor, tezacaftor y lumacaftor) y potenciadores (ivacaftor)3. En España, están comercializadas la monoterapia con ivacaftor en pacientes mayores de 4 meses con mutaciones de clase III, la triple terapia: ivacaftor, tezacaftor y elexacaftor (IVA/TEZ/ELX) para mayores de 2 años con al menos una mutación F508del en uno de sus alelos y la doble terapia: lumacaftor o tezacaftor con ivacaftor (LUM/IVA, TEZ/IVA). Estas últimas, con indicación a partir de 6 años para TEZ/IVA y a partir de un año para homocigotos F508del para LUM/IVA. Por tanto, ninguno de los tratamientos tiene indicación antes del primer año, salvo ivacaftor en un grupo muy reducido de pacientes.
A continuación, se presenta un caso de FQ con diagnóstico prenatal cuyo tratamiento con terapia moduladora de CFTR se inició de forma intrauterina.
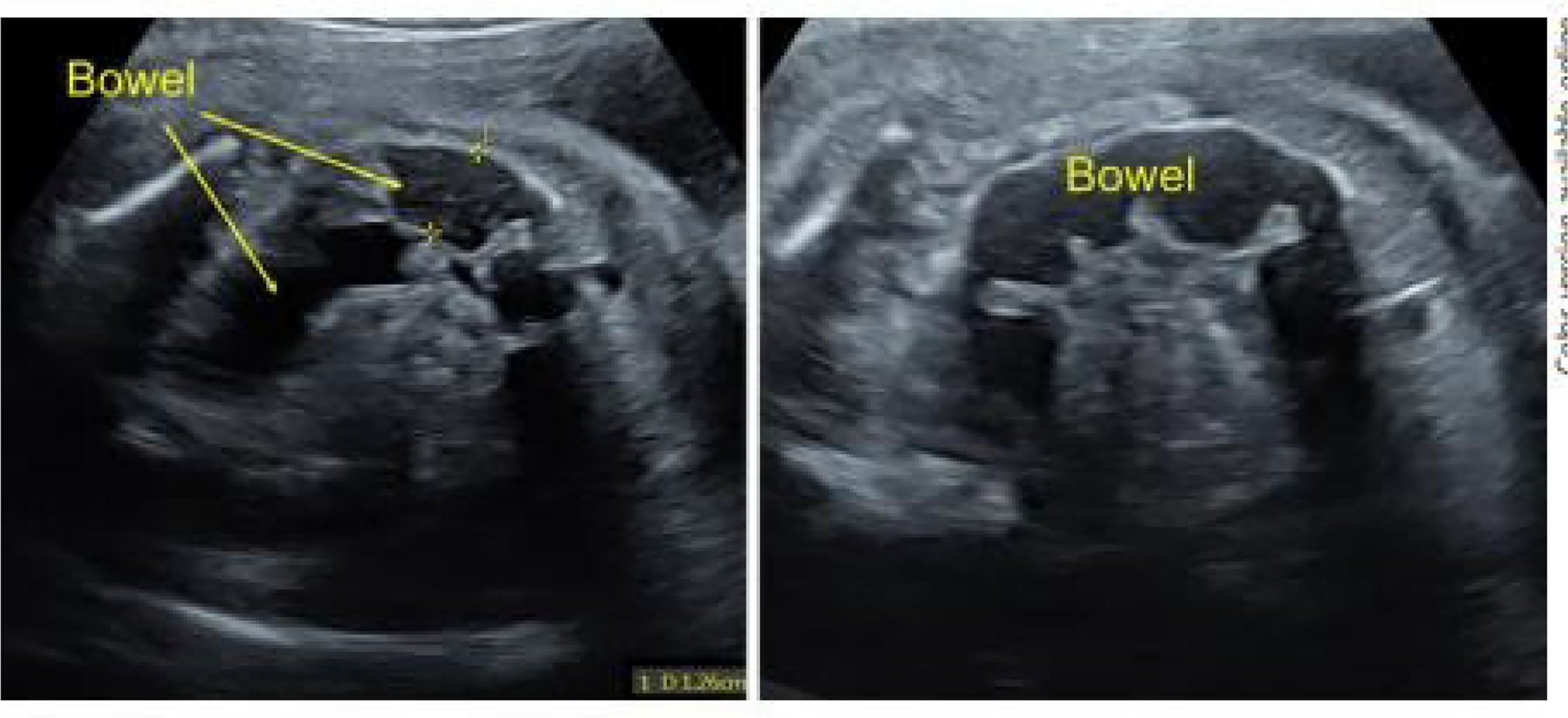
Descripción del casoUna mujer de 32 años acudió a control del embarazo, detectándose en el feto, en la ecografía de segundo trimestre (semana 21), un intestino hiperecogénico. En el control posterior, se observó dilatación del intestino grueso fetal a nivel del colon transverso y descendente con escasos movimientos peristálticos. Como consecuencia de esta obstrucción y dilatación de las paredes intestinales, están descritas complicaciones intrauterinas como perforación intestinal con aparición de peritonitis meconial o desarrollo de polihidramnios. Se realizó un estudio genético a los progenitores, siendo ambos portadores de la mutación F508del CFTR. A la semana 26 + 2 de gestación se confirmó mediante amniocentesis que el feto estaba afectado de FQ con la mutación homocigótica F508del CFTR.
Para evitar la cirugía en el recién nacido y las complicaciones asociadas, se valoraron alternativas en un equipo multidisciplinar formado por la unidad de FQ, obstetricia, neonatología y farmacia. Se propuso el tratamiento de la gestante con IVA/TEZ/ELX en combinación con ivacaftor durante el embarazo, con el objetivo de tratar el íleo meconial detectado en el feto.
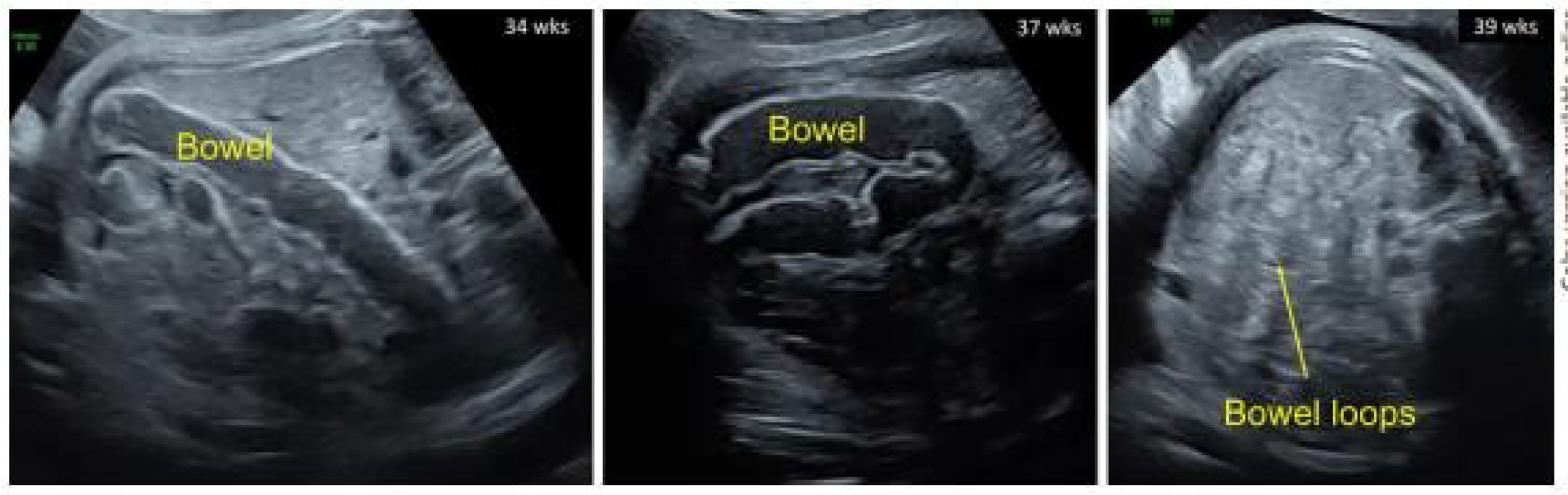
El tratamiento se inició en la semana 31 + 1. La pauta utilizada fue la correspondiente a pacientes ≥30 kg: 2 comprimidos de IVA/TEZ/ELX 75/50/100 mg por la mañana y un comprimido de ivacaftor de 150 mg por la noche. Durante el embarazo, la función hepática de la madre se mantuvo normal y el único posible efecto secundario fue una erupción cutánea, que fue descartada mediante biopsia al tratarse de una foliculitis aguda. El intestino fetal se mantuvo sin cambios hasta la semana 39, donde se observó la resolución de la dilatación (figs. 1 y 2)4.
El crecimiento fetal fue normal, y en la semana 39 se produjo el parto espontáneo, con un peso adecuado para la edad gestacional. Los resultados de la prueba de cloro en sudor fueron elevados (80 mmol/l; valor de referencia <60 mmol/l), la elastasa fecal compatible con insuficiencia pancreática (58,8 μg/g; valor de referencia <100 μg/g) y el tripsinógeno inmunorreactivo en la prueba de talón normal (58,1 ng/ml; valor de referencia <60 ng/ml). A pesar de presentar estos marcadores (característicos de FQ), se pudo evitar la cirugía en el neonato. A partir de entonces, la madre siguió tomando el tratamiento para que al excretarlo a través de la leche materna lo recibiera el neonato. A los 5 meses finalizó la lactancia materna, por lo que no pudo recibir tratamiento con modulador de CFTR hasta los 8 meses, cuando se consiguió gestionar la medicación, constatándose el empeoramiento clínico. A partir de entonces, recibió primero LUM/IVA 75/94 mg granulado oral, seguido de LUM/IVA 100/125 mg granulado oral al superar los 9 kg. A los 16 meses se modificó la biterapia a ELX/TEZ/IVA 80/40/60 mg por la mañana más IVA 59,5 mg por la noche, ambos tratamientos en forma de granulado oral. El paciente actualmente tiene un año y 6 meses y continúa con este tratamiento, enzimas pancreáticas y vitaminas liposolubles. Presenta un peso adecuado para su edad, tiene buen apetito y tolera la alimentación complementaria de manera correcta.
DiscusiónSe trata del primer caso publicado en España en el que se administra tratamiento con moduladores del CFTR a una madre sana con el objetivo de tratar un feto afectado de FQ. Este caso destaca por el diagnóstico prenatal excepcionalmente temprano y por la prolongada duración del seguimiento, lo que ha permitido evaluar los efectos del tratamiento durante la gestación, el periodo de lactancia, la retirada de la misma y su reintroducción por vía oral en el paciente. El tratamiento del feto a través de la madre resolvió el íleo meconial y evitó la cirugía en el recién nacido. Su continuación durante la lactancia y posterior a esta por vía oral fue eficaz, evitando infecciones y facilitando la ganancia de peso en el paciente, hecho que se confirmó con el empeoramiento del mismo durante el periodo libre de fármaco tras retirar la lactancia.
Existe diferente evidencia sobre el empleo de moduladores CFTR en embarazadas5–7. La serie de Taylor-Cousar et al.5 constituye uno de los primeros estudios en los que se evaluó el uso de moduladores del CFTR en mujeres gestantes con FQ cuyos fetos eran sanos, y concluyó que el tratamiento fue seguro tanto para las gestantes como para los fetos. Cabe destacar que 35 de estas pacientes iniciaron el tratamiento durante el primer trimestre de gestación, coincidiendo con el periodo de organogénesis, etapa de mayor riesgo potencial de malformaciones, sin que se observaran anomalías congénitas atribuibles al tratamiento. Asimismo, otros estudios han documentado casos en los que tanto la madre como el feto presentaban diagnóstico confirmado de FQ, con la mutación F508del en homocigosis, observándose una evolución clínica favorable en los recién nacidos sin complicaciones atribuibles a la enfermedad ni malformaciones o efectos adversos atribuibles al tratamiento8,9. En todos estos trabajos5,8,9, el tratamiento administrado a las gestantes consistió en la triple terapia con IVA/TEZ/ELX. En nuestro caso, la elección de esta terapia frente a la biterapia con LUM/IVA, aprobada a partir de un año, se fundamentó en la mayor eficacia demostrada de la triple terapia en pacientes homocigotos para la mutación F508del, su mejor perfil de respuesta en la resolución del íleo meconial y la evidencia publicada en casos similares, así como en un balance beneficio–riesgo favorable a pesar de no estar formalmente indicada en menores de 2 años.
El tratamiento con ELX/TEZ/IVA se empleó inicialmente fuera de ficha técnica en la gestante, basándose en la evidencia científica disponible en la literatura. En un primer momento, no se planteó la administración directa al neonato, ya que este continuaba recibiendo el tratamiento de forma indirecta a través de la lactancia materna. Sin embargo, tras el cese de la lactancia y la consecuente pérdida de efecto clínico, con signos de empeoramiento del estado general del paciente, se consideró necesario instaurar la terapia de manera directa. En ese momento, dado que ELX/TEZ/IVA no estaba comercializado en España para menores de 2 años, se gestionó su acceso mediante la aplicación de Medicamentos en Situaciones Especiales (MSE) de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Para ello, se contactó con el laboratorio fabricante con el objetivo de identificar presentaciones internacionales adaptadas al peso y edad del paciente. Posteriormente, se tramitó la solicitud de autorización a través de la dirección médica del hospital y se formalizó la petición a la AEMPS. Tanto las presentaciones de la LUM/IVA como las de la triple terapia ELX/TEZ/IVA se obtuvieron mediante este procedimiento, ya que se trataba de medicación extranjera indicada oficialmente en pacientes de mayor edad, pero con un perfil de peso corporal comparable al del paciente.
En el presente caso, la decisión terapéutica se basó en la evidencia existente sobre el paso transplacentario de los moduladores del CFTR, así como su excreción en la leche materna, tal como se ha descrito en otros trabajos9–11. Actualmente, no está claro el nivel óptimo del fármaco en leche. En un estudio se descubrieron concentraciones promedio de LUM (0,06 μM) e IVA (0,09 μM) relativamente bajas en la leche materna de una madre que tomaba lumacaftor/ivacaftor durante el embarazo y la lactancia, aunque no se especificó la dosis utilizada12. Esto coincide con otros casos donde los niveles de elexacaftor, ivacaftor y tezacaftor fueron inferiores a 1 μM en muestras de leche tomadas entre 15 y 60 días posparto13, aunque en dichos casos tampoco especificaron las dosis de los moduladores administradas a las madres. Sin embargo, en un caso con dosis más altas de ivacaftor (en el que la madre tomaba elexacaftor 100 mg, tezacaftor 50 mg e ivacaftor 75 mg 2 veces al día, junto con una dosis adicional de ivacaftor 150 mg una vez al día), los niveles en leche alcanzaron 1.795 μM14, lo que sugiere una posible relación dosis-respuesta. Es por ello, que los efectos potenciales de estas concentraciones en el lactante siguen siendo inciertos y requieren mayor evidencia15.
Los últimos datos de elastasa fecal obtenidos en el paciente han sido de 219 y 137 μg/g, de manera que nuestra experiencia refuerza además la hipótesis de que la administración temprana de los fármacos en FQ (antes de los 2 años de edad) consigue una recuperación pancreática y, por tanto, no convendría retrasar la introducción del tratamiento.
El servicio de farmacia hospitalaria desempeñó un papel fundamental en todas las fases del abordaje terapéutico de este caso. Participó activamente en la selección del tratamiento más adecuado basándose en la evidencia científica disponible, a pesar de tratarse de un uso fuera de indicación y en un contexto clínico excepcional. Asimismo, coordinó la gestión del acceso a los medicamentos no comercializados en España a través de MSE de la AEMPS, incluyendo la interlocución con el laboratorio fabricante, la identificación de presentaciones internacionales adaptadas al paciente y la tramitación de la autorización. Además, colaboró con el equipo clínico en el diseño de la pauta posológica, la adecuación de la formulación a las características del lactante y el seguimiento del tratamiento tanto en la madre como en el recién nacido.
Los moduladores de CFTR han mejorado significativamente la función pulmonar y la calidad de vida de los pacientes16. Esto ha facilitado que cada vez haya más situaciones en las que se hace necesario mantener este tratamiento durante el embarazo. Sin embargo, los informes de casos clínicos presentan limitaciones inherentes, como el sesgo de selección y la ausencia de datos sistemáticos sobre la eficacia, seguridad y farmacocinética de estos fármacos en poblaciones pediátricas más jóvenes y en contextos clínicos excepcionales. Esto hace necesario que, aunque existan casos clínicos en los que se reporta la seguridad de los tratamientos tanto para la madre como para el feto, es necesario realizar ensayos clínicos en pacientes embarazadas y en niños. En línea con la última revisión de la Declaración de Helsinki, la exclusión de grupos vulnerables tales como mujeres embarazadas y niños pequeños de estudios controlados y bien estructurados, podría perpetuar disparidades en salud, por lo que su inclusión en la investigación es crucial para garantizar avances terapéuticos equitativos17. En particular, se requiere una mayor comprensión del perfil de exposición y de la eficacia terapéutica de estos fármacos administrados en el periodo prenatal y durante la lactancia, con el fin de establecer pautas de tratamiento basadas en la evidencia para esta población vulnerable.
ConclusiónLa administración de moduladores de la proteína CFTR durante el embarazo y la lactancia fue segura tanto para la madre como para el hijo, y eficaz para el tratamiento de FQ en nuestro paciente, contribuyendo a evitar la cirugía neonatal y favoreciendo un adecuado crecimiento y desarrollo. Se trata del primer caso publicado en España con seguimiento más allá de la lactancia tras la instauración del tratamiento intrauterino, aportando información valiosa para el manejo de situaciones similares en la práctica clínica.
FinanciaciónLos autores declaran que el presente trabajo no ha recibido financiamiento provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación en congresosOrganización: Sociedad Española de Farmacia Hospitalaria (69 Congreso SEFH). A Coruña. 17–19 de octubre de 2024.
ContribucionesPedro del Palacio García, Carmen García Muñoz y María Dolores Canales Siguero han colaborado con la concepción de la idea original, el diseño del trabajo, la escritura y la revisión crítica. Maria Carmen Luna Paredes y Enrique Salcedo Lobato han colaborado con el diseño del trabajo y la revisión crítica del caso clínico. Fernando Huecas Jiménez y Carlota Vaquer Ferrer han colaborado en la escritura, diseño y edición del manuscrito. José Miguel Ferrari-Piquero ha contribuido a la escritura y revisión crítica del artículo.
Todos los autores han aprobado la versión final del artículo.
AgradecimientosNos gustaría expresar nuestro agradecimiento al servicio de ginecología y obstetricia, y al servicio de neonatología por su colaboración.
Responsabilidad y cesión de derechosLos autores cedemos, en el supuesto de publicación, de forma exclusiva los derechos de reproducción, distribución, traducción y comunicación pública (por cualquier medio o soporte sonoro, audiovisual o electrónico) de nuestro trabajo a Farmacia Hospitalaria y por extensión a la SEFH. Para ello se firmará una carta de cesión de derechos en el momento del envío del trabajo a través del sistema online de gestión de manuscritos.
Declaración de contribución de autoría CRediTPedro del Palacio-García: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Methodology, Conceptualization. Carmen García-Muñoz: Writing – original draft, Validation, Supervision, Conceptualization. María Dolores Canales-Siguero: Writing – original draft, Validation, Supervision, Conceptualization. Maria Carmen Luna-Paredes: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision. Enrique Salcedo-Lobato: Writing – review & editing, Writing – original draft, Visualization, Validation. Fernando Huecas-Jiménez: Writing – review & editing, Supervision. Carlota Esperanza Vaquer-Ferrer: Writing – review & editing, Validation, Supervision. José Miguel Ferrari-Piquero: Writing – review & editing, Visualization, Conceptualization.