comparar la supervivencia libre de progresión radiográfica en pacientes con cáncer de próstata metastásico tratados con abiraterona en dosis reducida versus dosis recomendada, y evaluar la supervivencia libre de progresión según el antígeno prostático específico.
Métodosestudio de cohorte retrospectiva de pacientes con cáncer de próstata metastásico, sensible o resistente a la castración, tratados con abiraterona en dosis reducida o dosis recomendada. Todos los pacientes fueron seguidos hasta la aparición de progresión radiográfica o progresión del antígeno prostático específico. Se utilizó la regresión de riesgos proporcionales de Cox para evaluar la supervivencia libre de progresión radiográfica y la supervivencia libre de progresión del antígeno prostático específico según la dosis de abiraterona (reducida versus recomendada). El modelo se ajustó según el índice de comorbilidad de Charlson, el estado de resistencia a la castración, el volumen de la enfermedad según los criterios CHAARTED y la presencia de metástasis de novo.
Resultadosse incluyeron 144 pacientes con cáncer de próstata metastásico; el 28,4% (41) recibió abiraterona en dosis reducida. La mediana de edad fue de 79 años (RIC: 75–85) en el grupo de dosis reducida y de 75 años (RIC: 70–81) en el grupo de dosis recomendada. Luego de ajustar por variables clínicas, el grupo de dosis reducida presentó un hazard ratio de 0,65 (IC 95%: 0,29–1,45) para la supervivencia libre de progresión radiográfica y de 0,58 (IC 95%: 0,29 a 1,14) para la supervivencia libre de progresión basada en niveles de antígeno prostático específico, en comparación con el grupo de dosis recomendada. Para la supervivencia libre de progresión radiográfica, el hazard ratio ajustado fue de 0,65 (IC 95%: 0,29 a 1,45) y para la supervivencia libre de progresión basada en niveles de antígeno prostático específico, el hazard ratio ajustado fue de 0,58 (IC 95%: 0,29–1,14).
Conclusióneste estudio aporta evidencia sobre el uso de abiraterona en dosis reducida en pacientes con cáncer de próstata metastásico, informando resultados de sobrevida y progresión comparables a los de la dosis recomendada. Este enfoque podría mejorar el acceso al tratamiento. Sin embargo, se necesitan estudios con mayor tamaño muestral para validar estos resultados.
To compare radiographic progression-free survival in metastatic prostate cancer patients treated with low-dose abiraterone versus standard-dose abiraterone acetate (Abi-SD), and to evaluate prostate-specific antigen progression-free survival.
MethodsRetrospective cohort study of patients with metastatic prostate cancer, castration-sensitive or castration-resistant, treated with low or standard-dose abiraterone. All patients were followed until radiographic or prostate-specific antigen progression. Cox proportional hazards regression was used to assess radiographic progression-free survival and prostate-specific antigen progression-free survival according to abiraterone dose (low vs. standard-dose). The model was adjusted for Charlson Comorbidity Index, castration resistance status, disease volume based on CHAARTED criteria, and presence of de novo metastases.
ResultsA total of 144 patients with metastatic prostate cancer were included in the study, with 28.4% (n = 41) receiving low-dose abiraterone. The median age was 79 years (IQR: 75–85) in the low-dose group and 75 years (IQR: 70–81) in the standard-dose group. For radiographic progression-free survival, the crude hazard ratio for the low-dose group compared with the standard-dose group was 0.49 (95% CI: 0.23–1.07). After adjusting for clinical variables, the adjusted hazard ratio was 0.65 (95% CI: 0.29–1.45). For prostate-specific antigen progression-free survival, the crude hazard ratio was 0.48 (95% CI: 0.24–0.90), and the adjusted hazard ratio was 0.58 (95% CI: 0.29–1.14).
ConclusionThis study provides evidence supporting the use of low-dose abiraterone in patients with metastatic prostate cancer, showing survival and progression outcomes comparable to those of the standard-dose. This approach may improve access to treatment; however, larger studies are needed to validate these findings.
Debido a su elevada prevalencia, su gran demanda de recursos sanitarios y la importante carga financiera asociada a su tratamiento, el cáncer de próstata (CP) representa un desafío para la salud pública en todo el mundo1,2. En Argentina, el CP es la neoplasia maligna más diagnosticada en los hombres y representa la tercera causa principal de muerte por cáncer3. Esto pone de relieve la necesidad de estrategias que faciliten el acceso a tratamientos eficaces y mantengan al mismo tiempo la sostenibilidad económica de los sistemas de salud.
La abiraterona está aprobada para el tratamiento de pacientes con CP avanzado y muestra mejoras en la supervivencia global, la supervivencia libre de progresión radiográfica (SLPr) y una respuesta significativa del antígeno prostático específico (PSA, por sus siglas en inglés)4–6.
En 2019, la Red Nacional Integral del Cáncer de Estados Unidos (NCCN) incluyó la abiraterona en dosis reducidas (250 mg/día) como opción de tratamiento para el CP resistente a la castración metastásico. Esta dosis más baja, ahora adoptada en entornos clínicos de todo el mundo7, se basó en los resultados de un ensayo en fase II con 72 pacientes, que demostró que la administración de 250 mg con una comida baja en grasas produce una eficacia clínica comparable a la dosis estándar de 1.000 mg tomada en ayunas7.
Una dosis reducida de abiraterona puede reducir el coste total de la atención oncológica, mejorar la asequibilidad del tratamiento y aumentar el acceso de los pacientes, especialmente en entornos con recursos limitados8. Además, esta estrategia podría mejorar la seguridad y la adherencia al tratamiento al reducir el número de comprimidos diarios. También puede reducir los costos del tratamiento, lo que permite a los sistemas sanitarios reasignar recursos para el tratamiento de otras enfermedades y la adopción de terapias innovadoras9–11.
Nuestra institución aplica esta estrategia basándose en las pruebas preclínicas disponibles, los estudios observacionales y las recomendaciones de las guías de práctica clínica12. Este estudio se diseñó para aportar evidencia adicional sobre el uso de abiraterona en dosis reducida en entornos clínicos de la vida real. Presentamos los resultados de supervivencia y progresión asociados a la aplicación de una estrategia de dosis reducida, cuyo objetivo es mejorar la asequibilidad del tratamiento. Concretamente, los objetivos son describir la SLPr en pacientes con CP metastásico que reciben abiraterona en dosis reducida (Abi-DR) frente a la dosis estándar (Abi-DE), y evaluar la supervivencia libre de progresión del PSA (PSA-SLP) y la tasa de respuesta objetiva del PSA (TRO-PSA), definida como una disminución superior al 50%.
MétodosDiseño del estudioEstudio observacional y retrospectivo de cohortes.
EntornoEl estudio se realizó en un hospital universitario de alta complejidad, ubicado en Buenos Aires, Argentina. El hospital también gestiona su propio proveedor de seguros médicos: el Plan de Salud.
ParticipantesEn este estudio participaron pacientes con CP metastásico tratados en un hospital universitario entre 2013 y 2023. Los criterios de inclusión fueron: pacientes mayores de 18 años, inscritos en el plan de salud del hospital universitario, diagnosticados con CP metastásico y tratados con abiraterona.
Fuentes de los datosEl estudio fue aprobado por el Comité de Ética de Protocolos de Investigación (CEPI) local, con el número de aprobación 7048. Los datos clínicos y administrativos se extrajeron de un sistema centralizado de historias clínicas electrónicas (HCE). Se realizó una revisión manual de las HCE para recopilar información demográfica y clínica, garantizando en todos los procedimientos la confidencialidad de los pacientes.
VariablesVariable de exposiciónUso de Abi-DE (1.000 mg al día) o Abi-DR (250 mg al día). Todos los pacientes recibieron prednisona 5 mg por vía oral, 2 veces al día.
Criterios de valoraciónEl criterio de valoración principal fue la SLPr, definida como el tiempo transcurrido desde el inicio del tratamiento con abiraterona hasta la progresión radiográfica de la enfermedad, evaluada mediante los Criterios de Evaluación de la Respuesta en Tumores Sólidos (RECIST, por sus siglas en inglés)13,14. La progresión radiográfica se determinó mediante estudios de imagen que mostraban un aumento mayor al 30% en el tamaño de las lesiones objetivo o la aparición de nuevas lesiones13.
Los criterios de valoración secundarios incluyeron la PSA-SLP, definida como el tiempo transcurrido desde el inicio del tratamiento hasta la progresión del PSA, según los criterios del Grupo de Trabajo 3 de Ensayos Clínicos sobre Cáncer de Próstata (PCWG3, por sus siglas en inglés). La progresión del PSA se caracterizó por un aumento sostenido del PSA de más del 25% y superior a 2 ng/ml por encima del nadir, confirmado en 2 momentos consecutivos con al menos 3 semanas de diferencia13.
Otro criterio de valoración fue la TRO-PSA, definida como la proporción de pacientes que lograron una reducción de los niveles de PSA superior al 50% después del tratamiento.
Dada la probabilidad de que no se informen los acontecimientos adversos menos graves en el HCE, solo se analizaron los eventos de grado mayor que 3, utilizando los datos disponibles15.
Las variables descriptivas incluyeron la edad, el índice de comorbilidad de Charlson, la puntuación de Gleason, la presencia de metástasis viscerales, la sensibilidad o resistencia a la castración, el estado metastásico de novo o recurrente, el volumen de la enfermedad según los criterios CHAARTED, los tratamientos previos y el nivel de PSA.
Variables que influyen en la respuesta (posibles factores de confusión)Índice de comorbilidad de Charlson, criterios CHAARTED, estado sensible a la castración y estado metastásico de novo o recurrente. Estas variables se seleccionaron basándose en criterios clínicos de expertos en oncología, que pueden consultarse en el apéndice a través de un gráfico acíclico dirigido (material complementario, fig. S1).
Tamaño del estudioSe utilizó un tamaño de muestra fijo, ya que se incluyeron a todas las personas disponibles que cumplían los criterios de inclusión.
Análisis estadísticoSe utilizaron estadísticas descriptivas para describir la población del estudio, detallando la tendencia central y la dispersión en función del tipo de distribución. La normalidad se verificó mediante las pruebas de Shapiro-Wilk o Kolmogorov-Smirnov, según correspondiera. Los datos con distribución normal se presentaron como media y desviación estándar, mientras que los datos no normales se presentaron como mediana e intervalo intercuartílico (IIC). Las variables categóricas y ordinales se expresaron como frecuencias absolutas y relativas. Para evaluar la asociación entre las variables descriptivas y Abi-DE o Abi-DR, se realizaron análisis bivariados basados en la normalidad de los datos y la naturaleza de las variables (cuantitativas o categóricas). Para las variables cuantitativas, se utilizó la prueba T o la prueba U de Mann-Whitney, mientras que para las variables categóricas se aplicó la prueba de chi-cuadrado o la prueba exacta de Fisher.
La SLPr y la PSA-SLP se calcularon mediante el análisis del tiempo hasta el evento y se estimaron gráficamente mediante el método de Kaplan-Meier. Los pacientes fueron censurados al final del seguimiento, en la última entrada de datos, en la última visita registrada o debido a la censura administrativa el 19/06/2024. La prueba de log-rank comparó la SLP entre las dosis de abiraterona (1.000 mg/día o 250 mg/día) en la SLPr y la PSA-SLP. Se realizó un análisis de regresión de Cox para ajustar los posibles factores de confusión. Para identificar posibles factores de confusión, expertos en oncología seleccionaron variables clínicamente relevantes, utilizando un gráfico acíclico dirigido (GAD) (material complementario, fig. S1). Las variables elegidas incluyeron el índice de comorbilidad de Charlson, los criterios CHAARTED, el estado sensible a la castración y el estado metastásico de novo o recurrente. Se calcularon el hazard ratio bruto (cHR), el hazard ratio ajustado (aHR) y el intervalo de confianza del 95% (IC del 95%). Se consideró un nivel de significación inferior al 5%.
La TRO-PSA se definió como la proporción de pacientes que lograron una reducción mayor al 50% en los niveles séricos de PSA desde el inicio del tratamiento hasta la finalización del estudio. Los pacientes se clasificaron en función de si lograron esta reducción del PSA, y se evaluó la asociación con la pauta posológica (Abi-DE o Abi-DR) mediante una prueba de chi-cuadrado (χ2). Se consideró estadísticamente significativo un valor p < 0,05. Los análisis estadísticos se realizaron utilizando STATA versión 16.
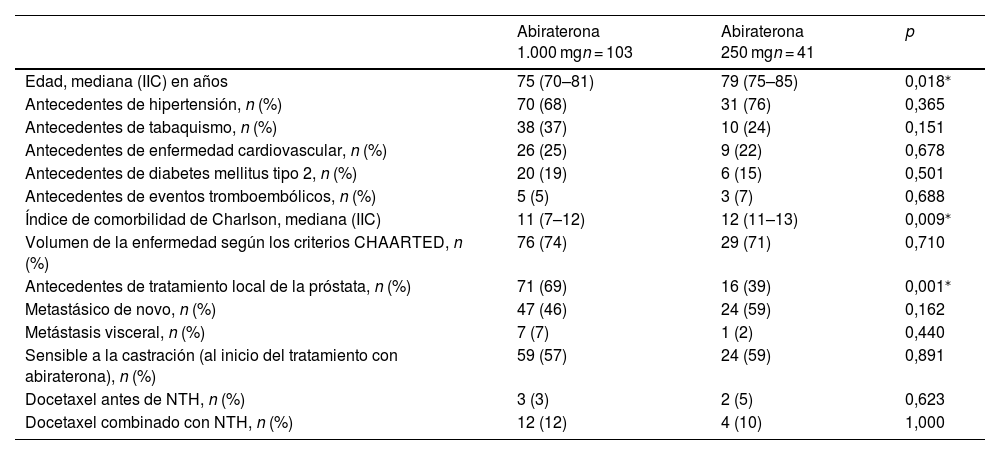
ResultadosEn este estudio se incluyó un total de 144 pacientes con CP, de los cuales el 28,4% (41) fueron tratados con Abi-DR. En la tabla 1 se describen las características demográficas y clínicas basales de la muestra.
Características basales de los pacientes que recibieron dosis estándar y dosis reducida de abiraterona
| Abiraterona 1.000 mgn = 103 | Abiraterona 250 mgn = 41 | p | |
|---|---|---|---|
| Edad, mediana (IIC) en años | 75 (70–81) | 79 (75–85) | 0,018⁎ |
| Antecedentes de hipertensión, n (%) | 70 (68) | 31 (76) | 0,365 |
| Antecedentes de tabaquismo, n (%) | 38 (37) | 10 (24) | 0,151 |
| Antecedentes de enfermedad cardiovascular, n (%) | 26 (25) | 9 (22) | 0,678 |
| Antecedentes de diabetes mellitus tipo 2, n (%) | 20 (19) | 6 (15) | 0,501 |
| Antecedentes de eventos tromboembólicos, n (%) | 5 (5) | 3 (7) | 0,688 |
| Índice de comorbilidad de Charlson, mediana (IIC) | 11 (7–12) | 12 (11–13) | 0,009⁎ |
| Volumen de la enfermedad según los criterios CHAARTED, n (%) | 76 (74) | 29 (71) | 0,710 |
| Antecedentes de tratamiento local de la próstata, n (%) | 71 (69) | 16 (39) | 0,001⁎ |
| Metastásico de novo, n (%) | 47 (46) | 24 (59) | 0,162 |
| Metástasis visceral, n (%) | 7 (7) | 1 (2) | 0,440 |
| Sensible a la castración (al inicio del tratamiento con abiraterona), n (%) | 59 (57) | 24 (59) | 0,891 |
| Docetaxel antes de NTH, n (%) | 3 (3) | 2 (5) | 0,623 |
| Docetaxel combinado con NTH, n (%) | 12 (12) | 4 (10) | 1,000 |
Criterios CHAARTED: ensayo aleatorizado de terapia quimiohormonal frente a ablación androgénica para la enfermedad extensa en el cáncer de próstata; Índice de comorbilidad de Charlson: la puntuación de comorbilidad de Charlson predice el riesgo de mortalidad a 10 años de un paciente basándose en una serie de afecciones concurrentes (comorbilidades) y la edad. A cada afección se le asigna una puntuación de 1, 2, 3 o 6, dependiendo del riesgo de muerte asociado. Las afecciones y sus puntuaciones incluyen infarto de miocardio, insuficiencia cardíaca congestiva, enfermedad vascular periférica, enfermedad cerebrovascular, demencia, enfermedad pulmonar crónica, enfermedad reumatológica, úlcera péptica, enfermedad hepática leve o grave, diabetes controlada o no controlada, hemiplejía o paraplejía, enfermedad renal, neoplasia maligna localizada o metastásica, leucemia, linfoma y sida. Además, se incorpora la edad del paciente, y se añade un punto por cada década por encima de los 50 años. Mediana (IIC): Mediana (intervalo intercuartílico); NTH: Nueva terapia hormonal; n: número. (%): porcentaje
Se notificaron un total de 42 muertes, lo que corresponde a una tasa de mortalidad global del 29,2% (42/144), con un 33% (34/103) en el grupo Abi-DE y un 19,5% (8/41) en el grupo Abi-DR.
Se observó progresión global en el 40% de los pacientes (59/144), con un 46,6% (48/103) en el grupo Abi-DE y del 26,8% (11/41) en el grupo Abi-DR. Se produjo progresión radiográfica en el 32,6% de los pacientes (47/144), de los cuales, el 37,8% (39/103) pertenecían al grupo Abi-DE y el 19,5% (8/41) al grupo Abi-DR. Se notificó progresión del PSA en el 41,6% de los pacientes (60/144), con un 47,5% (49/103) en el grupo Abi-DE y un 26,8% (11/41) en el grupo Abi-DR.
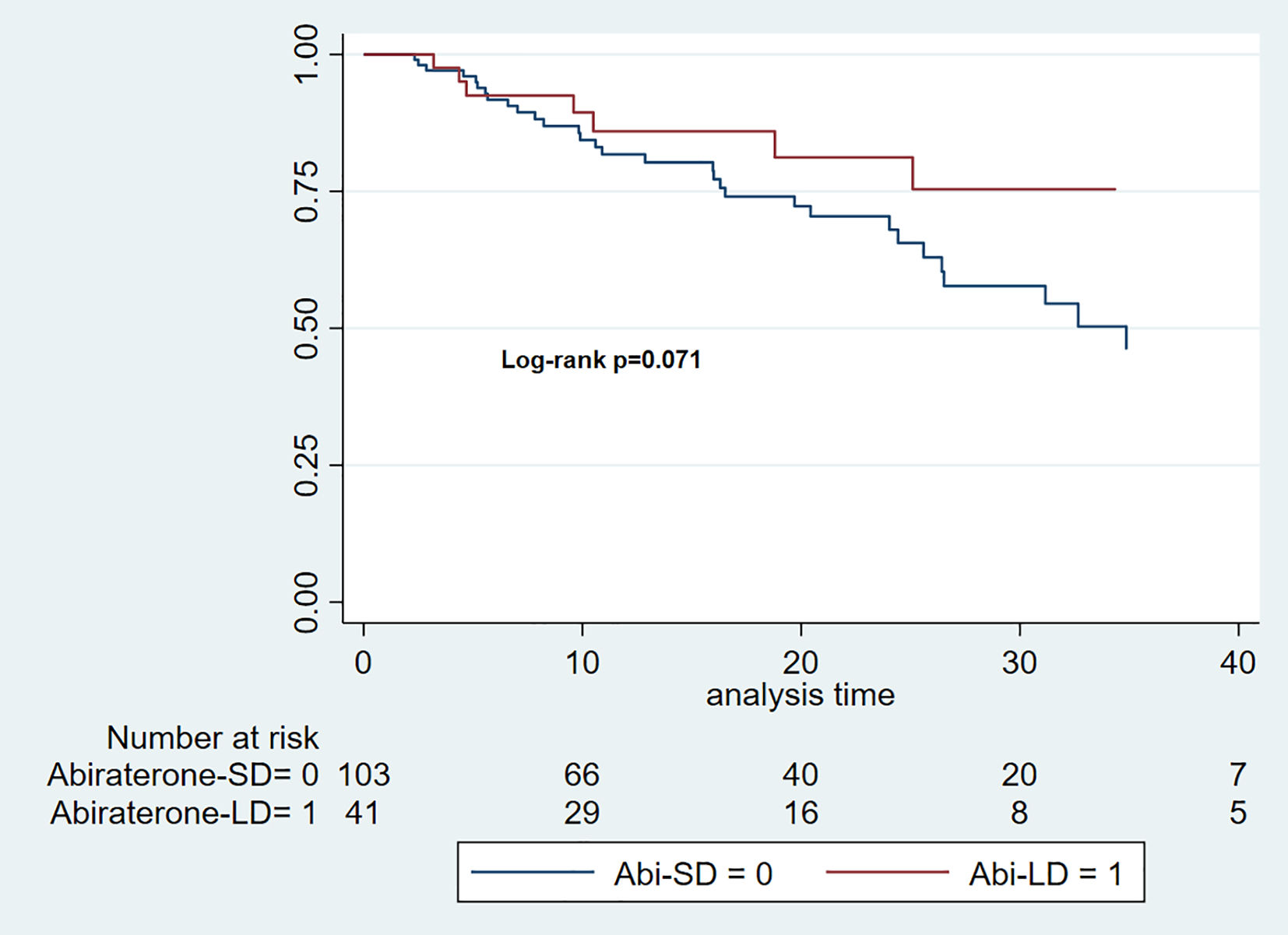
Supervivencia libre de progresión radiográficaLa duración media de seguimiento para el grupo Abi-DE fue de 16 meses (IIC: 7–25), mientras que para el grupo Abi-DR fue de 15 meses (IIC: 9–27). La mediana de la SLPr fue de 34,87 meses para el grupo Abi-DE (IC 95%: 25,6–42,4), pero no se pudo calcular para el grupo Abi-DR, debido a que los eventos de progresión fueron insuficientes (log-rank p = 0,071) (fig. 1).
La cHR para la SLPr durante un tiempo total de riesgo de 2.634 meses fue de 0,49 (IC 95%: 0,23–1,07). Tras ajustar las variables clínicas clave (índice de comorbilidad de Charlson, criterios CHAARTED, sensibilidad a la castración y presencia de enfermedad metastásica de novo), la aHR fue de 0,65 (IC 95%: 0,29–1,45).
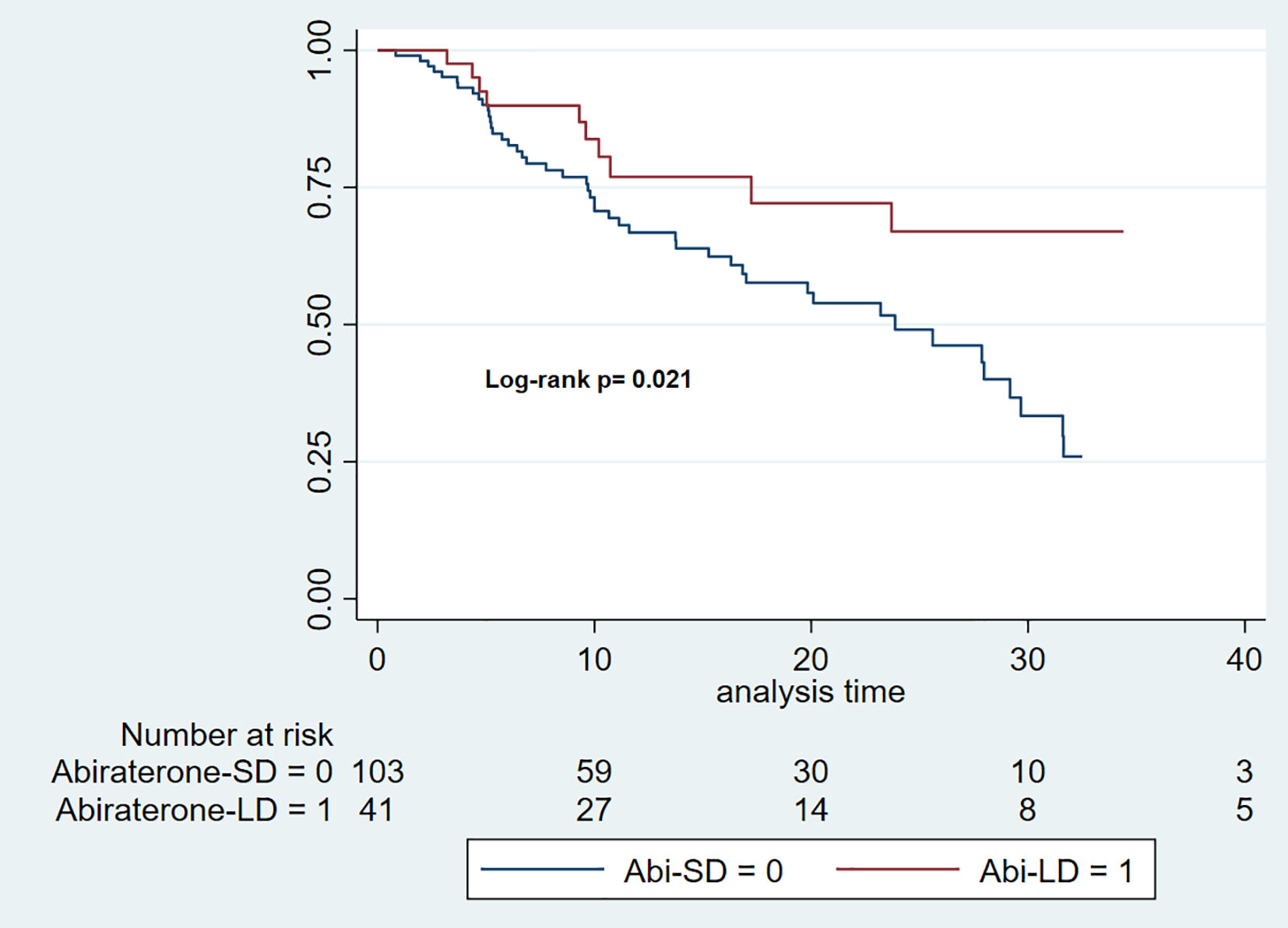
Supervivencia libre de progresión del PSALa duración media de seguimiento para el grupo Abi-DE fue de 11 meses (IIC = 6–22), mientras que para el grupo Abi-DR fue de 13 meses (IIC = 8–27). La mediana de la PSA-SLP fue de 23,87 meses para el grupo Abi-DE (IC 95%: 16,3–29,6), pero no se pudo calcular para el grupo Abi-DR debido a una escasez de eventos de progresión; (log-rank p = 0,021) (fig. 2).
La cHR para la SLPr durante un tiempo total de riesgo de 2.267 meses fue de 0,47 (IC del 95 %: 0,24–0,90). La aHR fue de 0,58 (IC 95%: 0,29–1,14) tras el ajuste por las variables clínicas clave (índice de comorbilidad de Charlson, criterios CHAARTED, sensibilidad a la castración y presencia de enfermedad metastásica de novo).
Tasa de respuesta objetiva de los niveles de PSA superior al 50%Entre los 144 pacientes, el 75,69% (109/144) logró una reducción del PSA superior al 50%, el 5,56% (8/144) no logró dicha reducción y el 18,75% (27/144) no tenía valores de PSA registrados. La asociación entre la pauta posológica (Abi-DE o Abi-DR) y el logro de una reducción del PSA superior al 50% dio como resultado un valor p = 0,265.
Acontecimientos adversosNo se observaron diferencias significativas en la incidencia de efectos adversos (grado ≥ 3) entre los grupos de dosis reducida y dosis estándar.
DiscusiónEl objetivo de nuestro estudio fue presentar una estrategia institucional para mejorar la asequibilidad del tratamiento del CP metastásico. Para ello, comparamos los resultados de supervivencia y progresión entre los pacientes que recibieron la pauta Abi-DE y los que recibieron Abi-DR.
Nuestro análisis mostró resultados comparables de supervivencia y progresión entre ambos grupos. Tras ajustar el volumen de la enfermedad (criterios CHAARTED), la sensibilidad a la castración, el índice de comorbilidad de Charlson y la presencia de enfermedad metastásica de novo, no se observaron diferencias estadísticamente significativas en la SLPr. Estos hallazgos sugieren que Abi-DR no fue inferior a Abi-DE, lo que concuerda con la evidencia farmacológica previa que indica que una dosis reducida de abiraterona puede alcanzar niveles terapéuticos adecuados de eficacia en condiciones específicas7,11.
Para minimizar factores de confusión, ajustamos los modelos de riesgos proporcionales de Cox utilizando variables seleccionadas a priori en función de su relevancia clínica y la revisión bibliográfica. Entre ellas se incluyeron el índice de comorbilidad de Charlson, el estado de resistencia a la castración, el volumen de la enfermedad según los criterios CHAARTED y la presencia de metástasis de novo16,17. La selección de variables se basó en un GAD (material complementario, fig. S1) y se apoyó en la experiencia clínica de nuestro equipo oncológico, que hizo hincapié en las variables clínicamente relevantes en lugar de basarse exclusivamente en la significación estadística. Este enfoque metodológico tenía por objeto mejorar la validez de nuestras estimaciones del efecto de la abiraterona en dosis reducida y los desenlaces sin progresión.
Aunque no encontramos estudios con un diseño comparable, investigaciones previas sobre la abiraterona en dosis administradas con las comidas respaldan la idea de que dosis más bajas de abiraterona podían proporcionar una eficacia similar a la dosis estándar. Sin embargo, las poblaciones de pacientes de estos estudios previos diferían en algunas características como la edad, la carga de la enfermedad y las comorbilidades18–20. Nuestro estudio, realizado en un hospital universitario de Buenos Aires (Argentina), presenta resultados parecidos a los de otros estudios realizados en otros entornos de un solo centro20.
En una encuesta realizada a 118 oncólogos médicos en la India se reveló que casi el 62% de los encuestados afirmaba haber utilizado abiraterona en dosis reducida, un 6,8% la utilizaba de forma habitual y un 55,1% la utilizaba en entornos con recursos limitados12. Estos hallazgos sugieren que, en ausencia de ensayos clínicos aleatorizados, evidencias del mundo real respaldadas por las guías de práctica clínica, podría contribuir a la adopción generalizada de este enfoque en la práctica habitual.
A diferencia de nuestros hallazgos, el estudio de Yamada et al., que analizó retrospectivamente una cohorte japonesa de pacientes con CP resistente a la castración, informó que la reducción de la dosis de abiraterona se asoció con una SLP más corta, aunque no se observaron diferencias en la supervivencia global. Sin embargo, las diferencias en la población de pacientes, el sistema sanitario y las estrategias de reducción de dosis limitan la comparabilidad directa entre los estudios21.
Nuestro análisis de los acontecimientos adversos se centró exclusivamente en las toxicidades de grado mayor que 3, sin que se observaran diferencias significativas entre los grupos de tratamiento. Esta limitación refleja el diseño retrospectivo del estudio y la posibilidad de que exista un subregistro de acontecimientos adversos en los historiales clínicos. Puesto que el ensayo en fase II que comparó la abiraterona en dosis reducida y estándar no mostró diferencias significativas en cuanto a la toxicidad, era de esperar que tampoco se encontrasen diferencias en nuestra cohorte.
Aunque la evaluación de los acontecimientos adversos no era el objetivo principal de nuestro estudio, la dosis reducida de abiraterona puede ofrecer beneficios en términos de reducción de las toxicidades dependientes de la dosis, incluida una menor incidencia de acontecimientos adversos leves a moderados que no se evaluaron en nuestro análisis. Se necesitan estudios prospectivos futuros para explorar el perfil completo de toxicidad y seguridad de la abiraterona en dosis bajas.
En nuestro estudio, todos los pacientes recibieron 10 mg de prednisona al día, independientemente de la dosis de abiraterona o de la sensibilidad hormonal. Siguiendo las pautas clínicas actuales, se coadministró una dosis baja de prednisona para prevenir el exceso de mineralocorticoides, que puede producirse por la inhibición de la CYP17A1 inducida por el tratamiento con abiraterona. Este mecanismo de acción podría causar efectos adversos, independientemente de si se utiliza una dosis estándar o una reducida de abiraterona. Por consiguiente, se recomienda una dosis fija de prednisona como parte del régimen, independientemente de la dosis de abiraterona administrada.
Aunque no realizamos una evaluación directa de los costes, la reducción en un 75% de la dosis de abiraterona constituye una estrategia para mejorar la accesibilidad al tratamiento y facilitar la redistribución de los recursos9.
Las limitaciones de este estudio incluyen aspectos relativos a su validez externa y generalización. Dado que el estudio se llevó a cabo en un centro específico, es posible que los resultados no sean aplicables a otras instituciones debido a las diferencias en las poblaciones de pacientes, incluso en Argentina. Además, la decisión de administrar dosis reducidas se dejó a la discreción del médico, lo que podría introducir variabilidad basada en el criterio médico. Si bien este enfoque refleja la práctica real, también conlleva un riesgo de sesgo de indicación, el que intentamos mitigar mediante el ajuste de los posibles factores de confusión. Es importante reconocer que las diferencias iniciales entre los grupos de tratamiento pueden haber influido en los desenlaces observados. A pesar de los ajustes de las variables clínicas clave, el diseño observacional conlleva el riesgo inherente de confusión residual. Por lo tanto, estos hallazgos deben interpretarse con cautela y se necesitan más estudios para confirmar nuestros resultados.
Aunque nuestro sistema de HCE proporcionó datos clínicos completos, el diseño retrospectivo del estudio introdujo la posibilidad de sesgo de información. Aunque la recopilación de datos fue retrospectiva, la generación y documentación de los datos en la HCE se realizó de forma prospectiva, antes de evaluar los resultados. Esto reduce el riesgo de sesgo de información normalmente asociados a estudios retrospectivos, en los que la dependencia de los recuerdos de los participantes sobre comportamientos o acontecimientos pasados podría dar lugar a errores.
Por último, no se evaluaron los parámetros farmacocinéticos ni las posibles interacciones entre medicamentos o entre medicamentos y alimentos, ya que esta información no se recopila de forma habitual ni sistemática en la práctica clínica habitual. Reconocemos que estos factores son cruciales en el contexto del tratamiento con abiraterona y que su omisión representa una limitación en la evaluación de la seguridad22.
Una de las principales fortalezas de nuestro estudio es la inclusión de datos de la vida real derivados de la práctica clínica habitual, con un seguimiento completo de una cohorte cerrada. Además, nuestro estudio incluyó un número superior de pacientes que otros estudios publicados hasta la fecha19,20,23.
En conclusión, este estudio proporciona pruebas adicionales sobre el uso de Abi-DR en un entorno real, lo que sugiere que sus resultados de supervivencia y progresión son comparables a los de Abi-DE.
Este enfoque reduce la carga del tratamiento al tiempo que mantiene la eficacia terapéutica y puede mejorar la adherencia y la satisfacción de los pacientes al reducir el número de comprimidos diarios necesarios. Sin embargo, se necesitan más estudios prospectivos con muestras de mayor tamaño para evaluar de forma concluyente la eficacia y la seguridad de la abiraterona en dosis reducida en entornos reales.
Responsabilidades éticasLos autores declaran que el estudio fue aprobado por el Comité de Ética de Protocolos de Investigación (CEPI) local, con el número 7048.
FinanciaciónLos autores declaran que no han recibido financiación.
Conflicto de interesesLos autores declaran que han adjuntado los documentos proforma requeridos, completados y firmados por cada autor, según los requisitos de publicación.
AgradecimientosLos autores muestran su agradecimiento al personal de la sección de oncología, a la aseguradora de salud del Hospital Italiano de Buenos Aires y al Departamento de Investigación y Área no patrocinada del Hospital Italiano de Buenos Aires, Argentina.
Contribución a la literatura científicaEste estudio proporciona evidencias de la vida real sobre el uso de abiraterona en dosis reducida en pacientes con cáncer de próstata metastásico.
Implicaciones de los resultadosEl uso de dosis reducidas de abiraterona puede ayudar a reducir el coste del tratamiento y promover una distribución más eficiente de los recursos sanitarios.
Presentación en congresosPresentado en la XLIV Reunión de Actualización Pos-Chicago 2024, 4–5 de julio, Mendoza, Argentina. Trabajo científico - Póster número 0008 - Comparación de la eficacia entre dosis de 1 g y 250 mg de abiraterona en el tratamiento del cáncer de próstata metastásico (ABECS).
Presentado en el XXXIII Congreso Nacional de Medicina, 12–14 de noviembre de 2024, Buenos Aires, Argentina. Presentación oral número 21663: Experiencia institucional en el tratamiento de pacientes con cáncer de próstata metastásico con dosis estándar y reducida de abiraterona.
Declaración de contribución de autoría de CRediTLuis Angel Di-Giuseppe: Writing – review & editing, Writing – original draft, Visualization, Supervision, Project administration, Investigation, Conceptualization. Rodney Alexander Ramirez-Murillo: Writing – review & editing, Writing – original draft, Visualization, Validation, Investigation, Data curation. Mariano Daniel Aymar: Writing – review & editing, Writing – original draft, Validation, Supervision, Software, Project administration, Investigation, Data curation. Luis Roberto Basbus: Writing – original draft, Validation, Supervision, Methodology, Investigation, Formal analysis, Conceptualization. Milagros Cornec: Writing – original draft, Visualization, Validation, Methodology, Investigation. Sergio Adrián Terrasa: Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Methodology, Investigation, Formal analysis. Maria Lourdes Posadas-Martínez: Writing – original draft, Visualization, Validation, Supervision, Resources, Methodology, Investigation, Formal analysis. Mariana Andrea Burgos: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Methodology, Formal analysis, Data curation. Gabriela Buela: Writing – original draft, Supervision, Methodology, Investigation, Conceptualization. Federico Cayol: Writing – original draft, Visualization, Validation, Supervision, Project administration, Methodology, Investigation, Formal analysis, Conceptualization.