En el último congreso de la SEFH celebrado en Zaragoza se debatió la necesidad de encontrar nuevas fórmulas para garantizar la sostenibilidad del sistema sanitario español. Dado que los presupuestos sanitarios son limitados, los diferentes decidores sanitarios, entre ellos el farmacéutico de farmacia hospitalaria, han de controlar el gasto farmacéutico y asegurar un uso eficiente de los fármacos.
En general, los fármacos son aprobados según la evidencia en ensayos clínicos que cumplen los requerimientos de las agencias regulatorias. Sin embargo, sigue existiendo incertidumbre sobre sus resultados en la práctica clínica habitual a medio y largo plazo. Además, medicamentes huérfanos, o indicados para tratamientos de enfermedades con una necesidad terapéutica no cubierta pueden disponer de una evidencia clínica limitada como consecuencia de programas de aprobación rápida o fast-track por parte de las agencias europeas o americanas. Esa incertidumbre sobre los resultados puede llevar a un retraso en la decisión de facilitar su acceso a los pacientes en la práctica, lo cual entra en contradicción con la intención inicial de su rápida aprobación.
Ante la necesidad de garantizar el acceso al mejor tratamiento disponible para los pacientes en este entorno, poniendo en riesgo la sostenibilidad de los sistemas sanitarios y la continuidad de la inversión en I+D de la industria, surgen iniciativas innovadoras de riesgo compartido entre «pagadores» y proveedores como la industria farmacéutica.
Un acuerdo innovador (AI) es un compromiso de riesgo compartido donde el «pagador» y el proveedor del fármaco pactan una cobertura condicional a través de un acuerdo contractual1.
Principalmente los productos especialmente susceptibles de un AI son fármacos que tratan una patología grave, con una necesidad clínica no cubierta, y cuya predicción de respuesta clínica es incierta, lo que conlleva a dificultades de evaluar la relación costes/beneficio. Suelen ser tratamientos que han sido aprobados rápidamente, por lo que la transferibilidad de los resultados de los ensayos clínicos a la práctica habitual es también incierta, y esto hace difícil juzgar el valor terapéutico que aportan. Estos productos suelen tener además un coste e impacto presupuestario elevados, y en ocasiones pueden estar relacionados con una demanda política y social, principalmente en áreas como oncología, enfermedades raras y/o crónicas y progresivas.
Tradicionalmente, los acuerdos a los que llegaban «pagadores» y proveedores eran de tipo comercial y basados exclusivamente en aspectos financieros, típicamente descuentos, reducciones de precio, acuerdos de precio/volumen, o asociados a la cartera de productos ofrecidos, que no tienen en cuenta los resultados en salud.
El objetivo de los AI es limitar el riesgo que asumen los decidores sanitarios, si bien estos acuerdos pueden estar enfocados principalmente en aspectos económicos o en conseguir resultados en salud. Los AI son variados en diseño y estructura y susceptibles de diferir en función de la naturaleza de la tecnología sanitaria y la enfermedad a ser tratada. Difieren en las variables de resultados utilizadas y los planteamientos económicos asociados. Dentro de los AI de enfoque económico, se observan diferentes tipos de acuerdos. Existen por ejemplo acuerdos asociados al consumo del fármaco. En este tipo de acuerdos se puede garantizar un impacto presupuestario máximo, optando por la capitación, o bien la dosis total máxima a pagar, o el coste total máximo por paciente, o limitando el tipo de paciente al que va dirigido. Como ilustración, Novartis propone a algunos «pagadores» que como máximo paguen 14 inyecciones de ranibizumab (Lucentis) por paciente con degeneración macular2 asociada con la edad.
También hay acuerdos asociados al uso de recursos sanitarios, como por ejemplo la disminución de hospitalizaciones o la duración de las estancias hospitalarias.
Lo preferible de los acuerdos innovadores es que se basen en medidas de resultados de salud. Si bien hay acuerdos basados en marcadores clínicos como la disminución de los niveles de colesterol o biomarcadores, hay otros basados en resultados en salud o comportamiento (p. ej. progresión libre de enfermedad, disminución del riesgo cardiovascular), o incluso en la satisfacción del paciente con el tratamiento. Un ejemplo es el pago que Procter & Gamble y Sanofi-Aventis realizan a una aseguradora americana por cada fractura de muñeca o cadera que risedronato sódico, tratamiento para la osteoporosis, no ha podido evitar3.
Uno de los primeros AI públicos en Europa fue en el 2002. El NICE consideró que los tratamientos con interferones beta para esclerosis múltiples no eran coste-efectivos y se llegó al acuerdo de considerar un precio condicional hasta que se demostrara un ratio coste/efectividad aceptable (coste por año de vida ajustado por calidad). En la práctica, se ha demostrado la dificultad de medir la respuesta al tratamiento y la complejidad asociada al modelo económico en que se basa el acuerdo4.
Contrariamente el acuerdo llegado para bortezomib, tratamiento para pacientes con mieloma múltiple, la variable de resultados es concreta y fácil de medir. El acuerdo consiste en que el NHS británico únicamente paga por los tratamientos que obtienen una respuesta total o parcial tras cuatro ciclos de tratamiento (reducción del 50% en la concentración de proteína M en el suero5).
El Reino Unido no es el único país en el que se han establecido AI, encontramos también este tipo de acuerdos en Italia, Francia, Canadá, Australia y EEUU.
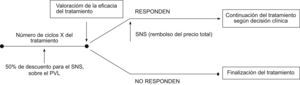
En Italia, la financiación por parte del Servicio sanitario italiano de los nuevos fármacos antineoplásicos viene condicionada por su efectividad clínica. Su implementación requiere un sistema de monitorización y control de los resultados, que se realiza a través de registros. La figura 1 ilustra el proceso que se suele seguir; durante un cierto número de ciclos de tratamiento, el laboratorio ofrece un descuento hasta que se demuestra la respuesta al tratamiento. Los productos que están siendo monitorizados actualmente son erlotinib, sunitinib, sorafenib, dasatinib, nilotinib, bevacizumab6.
En Estados Unidos, donde las grandes aseguradoras se encargan de la gestión de enfermedades (o disease management) el laboratorio Merck & Co. se ha comprometido recientemente a controlar los pacientes diabéticos de una de ellas. En este acuerdo, los pacientes pueden mejorar sus niveles de glucosa tomando cualquier medicación. El incentivo es conseguir mejores resultados en salud y reducir costes médicos futuros, basándose en el supuesto que una mejor adherencia al tratamiento reduce en 24% las hospitalizaciones y visitas a urgencias7. Por ello, la compañía se ha asegurado entrar como primera elección en el criterio de la aseguradora.
Los ejemplos anteriores, que se han pactado tanto con administraciones centrales como locales, ponen de manifiesto la disposición tanto de administraciones sanitarias como de laboratorios farmacéuticos para explorar e implementar iniciativas que puedan beneficiar a ambas partes y en especial al paciente.
Las AI pueden ayudar a evidenciar el valor del producto a los decidores sanitarios, facilitando el acceso a los pacientes que pueden beneficiarse del tratamiento. La mayoría de estos acuerdos reducen la incertidumbre con respecto al impacto presupuestario, eficacia y eficiencia, y permiten la recogida de datos relevantes de la práctica clínica habitual de manera continuada.
Las ventajas anteriores son difícilmente cuestionables, pero sí algunos aspectos relacionados con su implementación. Estos acuerdos requieren el desarrollo de una infraestructura para medir y monitorizar resultados, y pueden generar preguntas sobre la gestión compartida de datos, su financiación y la confidencialidad de los datos de los pacientes. Adicionalmente, están asociados a procesos administrativos y flujos financieros inusuales. Por estos motivos, se utilizan en ocasiones concretas y de manera excepcional.
En España, si bien históricamente se han negociado acuerdos de tipo financiero especialmente con hospitales, no existen por el momento publicaciones sobre la existencia de ningún acuerdo basado en resultados. Sin embargo, hay un creciente interés, aunque no homogéneo, tanto por la administración como por la industria farmacéutica de ponerlos en marcha, según lo expresado en foros públicos como por ejemplo los recientes congresos de la Asociación de Economía de la Salud o la International Society for Pharmacoeconomics and Outcomes Research (ISPOR).
Una de las dificultades puede estar relacionada con las características de nuestro sistema sanitario. Dada la descentralización de las decisiones sanitarias, ¿corresponde a los servicios regionales de salud o a los hospitales negociar este tipo de acuerdos? Otra cuestión que se plantea es si se dispone de un sistema de información apropiado para la recogida y monitorización de los resultados en salud. Los datos que se recogen rutinariamente no tienen por qué incluir el nivel de detalles necesario. Dada la complejidad que puede suponer acordar y poner en marcha este tipo de acuerdos, pueden preferirse otro tipo de iniciativas para facilitar el acceso y/o controlar costes.
Por otro lado, los laboratorios pueden verse limitados por la falta de experiencia en el desarrollo de este tipo de acuerdos y la disponibilidad a asumir el riesgo dada la incertidumbre (este no es un caso de información asimétrica, para el laboratorio los resultados finales también son inciertos).
Los acuerdos innovadores, y en particular aquellos que implican «pago por resultados en salud» deben dirigirse a aumentar la salud de la población, facilitar el acceso de fármacos, y garantizar la sostenibilidad del sistema sanitario en España. Están además en línea con la tendencia a considerar efectividad y eficiencia en la toma de decisiones. Para que funcionen, es necesario diseñar programas que beneficien tanto a «pagadores» como a la industria. Y que exista una relación entre ambas partes de confianza y colaboración para implementar los necesarios mecanismos administrativos y logísticos asociados.