este artículo describe un protocolo de estudio para evaluar la adherencia a la quimioterapia oral (QTO) en pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico en España.
Métodoseste estudio multicéntrico, observacional y prospectivo que será realizado por 6 farmacéuticos hospitalarios de 6 hospitales españoles. El estudio incluirá hombres y mujeres de 18 años o más con un diagnóstico de CPNM localmente avanzado o metastásico que estén en tratamiento o se les haya prescrito QTO. Una vez incluido, el paciente tendrá un seguimiento prospectivo durante 3 meses, incluidas 4 visitas de estudio para registrar información sobre variables sociodemográficas, tratamiento y adherencia antineoplásica, atención farmacéutica, variables clínicas y resultados comunicados por el paciente (PRO) (la versión de 3 niveles del EQ-5D, el EORTC Core Quality of Life Questionnaire, el Brief Illness Perception Questionnaire, el Treatment Satisfaction with Medicines Questionnaire, y la versión PRO del Common Terminology Criteria for Adverse Events). Doce meses después de la inclusión del paciente, registraremos información sobre el estado de progresión de la enfermedad y las recetas dispensadas. El resultado primario es el porcentaje de adherencia al tratamiento que se calculará en función del recuento de medicación de la siguiente manera: la diferencia entre el número de unidades de medicamento dispensadas menos el número de unidades no utilizadas se dividirá por el número de días de tratamiento multiplicado por el número de unidades/día prescritas por el oncólogo; este cociente se multiplicará por 100 para obtener el porcentaje de adherencia. Basándose en el recuento de medicación, aquellos con un porcentaje de adherencia mayor al 80% serán los que primariamente serán considerados adherentes. De forma secundaria, la adherencia también se estimará con la proporción de días cubiertos y la Escala de adherencia a la medicación de 4-ítems de Morisky Green Levine. Para analizar el impacto de las características de los pacientes y del tratamiento sobre la adherencia, se realizarán análisis bivariados utilizando diferentes puntos de corte de adherencia. Para evaluar el impacto de la adherencia en la eficacia del tratamiento en términos de supervivencia libre de progresión, utilizaremos el método de Kaplan–Meier y lo compararemos con la prueba log-rank y el análisis de regresión de Cox univariado.
ConclusionesEsperamos que nuestro estudio proporcione información inicial sobre aspectos clave de la adherencia a la QTO (medición, facilitadores y barreras) y su relación con los desenlaces relevantes para el clínico y el paciente en el ámbito del CNMP, y que esta información ayude en el diseño de intervenciones farmacéuticas para mejorar la adherencia.
This article describes a study protocol for evaluating adherence to oral chemotherapy (OCT) in patients with locally advanced or metastatic non-small cell lung cancer (NSCLC) in Spain.
MethodsThis multicenter, observational, prospective study will be conducted by six hospital pharmacists from six Spanish hospitals. The study will include men and women aged 18 years or older with a diagnosis of locally advanced or metastatic NSCLC who are being treated or have been prescribed OCT. Once included, the patient will be active and prospectively followed up for 3 months, including four study visits to record information on sociodemographic variables, antineoplastic treatment and adherence, pharmaceutical care, clinical variables, and patient-reported outcomes (PRO) (the 3-level version of EQ-5D, the EORTC Core Quality of Life Questionnaire, the Brief Illness Perception Questionnaire, the Treatment Satisfaction with Medicines Questionnaire, and the PRO version of Common Terminology Criteria for Adverse Events). Twelve months after patient inclusion, we will record information on the disease progression status and dispensed prescriptions. The primary outcome is the percentage of treatment adherence that will be calculated based on the pill count as follows: the difference between the number of pills dispensed minus the number of unused pills will be divided by the number of days of treatment multiplied by the number of pills/day prescribed by the oncologist; this quotient will be multiplied by 100 to obtain the percentage of adherence. Based on the that pill count reconciliation, those with a percentage adherence greater than80% will be primarily categorized as adherent. Secondarily, treatment adherence will be also calculated based on the proportion of days covered and the 4-items Morisky Green Levine Medication Adherence Scale. To analyze the impact of patients' and treatment characteristics on adherence, bivariate analyses will be performed using different adherence cut-off points. To evaluate the impact of adherence on treatment efficacy as evaluated by progression-free survival, we will be using the Kaplan–Meier method and compare it with the log-rank test and univariate Cox regression analysis.
ConclusionsWe expect that our study will provide initial information on key aspects of adherence to OCT (measurement, facilitators, and barriers) and its relationship with patients' and clinically relevant outcomes in the setting of NSCLC, and that this information will help in designing pharmaceutical interventions to improve adherence.
La disponibilidad y el uso de la quimioterapia oral (QTO) han aumentado en los últimos años1,2. Un estudio reciente comunica que entre 2008 y 2020 el aumento en el uso total de QTO fue de casi el 60% en cuanto a unidades dispensadas, y del 800% si se consideran solo los pacientes con carcinomas broncopulmonares no microcíticos (CBPNM)1. Se prevé que esta tendencia vaya en aumento: de los 20 nuevos principios activos anticancerosos comercializados en EE. UU. en 2021, 9 eran agentes orales2. La QTO presenta varias ventajas para los pacientes, como una mayor comodidad de administración, la reducción del número de visitas a la consulta y una sensación de control sobre el propio tratamiento oncológico3. Los datos disponibles manifiestan un claro consenso en que los pacientes con cáncer prefieren la terapia oral a la intravenosa4. Sin embargo, la creciente disponibilidad de la QTO se asocia a varios riesgos para los pacientes, entre ellos la supervisión de la toxicidad y la adherencia a la medicación3. En una pequeña encuesta sobre la cuestión, los participantes se mostraron en gran medida satisfechos con la QTO, pero expresaron su preocupación por la falta de preparación ante los efectos secundarios5.
Según una revisión sistemática, el grado de adherencia deficiente a la QTO varía mucho, del 46 al 100%, en función del estudio, el tipo de medicación, la duración del seguimiento y la herramienta de evaluación, entre otras razones6. Los factores asociados a la adherencia a la medicación oral pueden diferir entre las diferentes enfermedades, incluido el cáncer. En la revisión sistemática citada, los factores más frecuentes relacionados con una adherencia deficiente fueron: la edad (las edades más tempranas y las más avanzadas), no estar casado/vivir solo, la depresión, el número de comorbilidades, la toxicidad de la medicación, el número de prescripciones concomitantes y el coste6. Aunque apenas se ha investigado, la mala adherencia se ha asociado a peores resultados en los pacientes con cáncer. En pacientes con leucemia mieloide crónica, una escasa adherencia al imatinib se asoció a respuestas moleculares deficientes, y no se observaron respuestas moleculares importantes cuando la adherencia era menor al 80%7. La falta de adherencia a la medicación se asocia generalmente a mayores costes sanitarios en diferentes enfermedades, incluido el cáncer8. Destacamos también que, en general, «aumentar la eficacia de las intervenciones de adherencia puede tener un impacto mucho mayor en la salud de la población que cualquier mejora en los tratamientos médicos específicos»9.
Los resultados comunicados por el paciente (PRO, por sus siglas en inglés) se refieren a cualquier comunicación sobre el estado de salud del paciente que proceda directamente del propio paciente, sin interpretación de la respuesta del paciente por parte de un clínico o cualquier otra persona.
Comparado con la atención habitual, la integración de la monitorización de síntomas mediante herramientas PRO durante el tratamiento del cáncer metastásico se asocia a una mayor supervivencia10.
Las medidas de la adherencia a la medicación incluyen medidas directas, como la medición de los niveles de fármacos/metabolitos; y medidas indirectas, como las que implican el análisis de bases de datos secundarias, los dispositivos electrónicos de envasado de medicamentos, el recuento de medicamentos, y las evaluaciones del clínico y el autoinforme mediante cuestionarios (por ejemplo, la escala de adherencia a la medicación de Morisky Green Levine). Se puede encontrar una revisión de estos métodos en otras publicaciones11.
A pesar de su papel clave en el tratamiento de los pacientes con CBPNM, la adherencia a la QTO en este contexto apenas se ha investigado. Así, en la revisión sistemática citada anteriormente, de los 51 estudios que evaluaron la frecuencia y la correlación con la QTO, 32 se centraron en el tratamiento endocrino del cáncer, 9 en la leucemia mieloide crónica, 5 en una combinación de cánceres y 5 en cánceres distintos del CBPNM6. El objetivo primario de este estudio es evaluar en España la adherencia a la QTO en pacientes con CBPNM localmente avanzado o metastásico. Los objetivos secundarios incluyen: a) analizar el impacto de las características de los pacientes y del tratamiento en la adherencia, b) evaluar la relación potencial entre la adherencia y algunos PRO como la calidad de vida relacionada con la salud, la percepción de la enfermedad, la satisfacción con el tratamiento y la percepción de toxicidad, c) evaluar la relación entre 3 métodos diferentes de medición de la adherencia, d) evaluar la asociación potencial entre la adherencia y la utilización de recursos sanitarios y e) evaluar el impacto de la adherencia en la eficacia del tratamiento evaluada con la supervivencia libre de progresión.
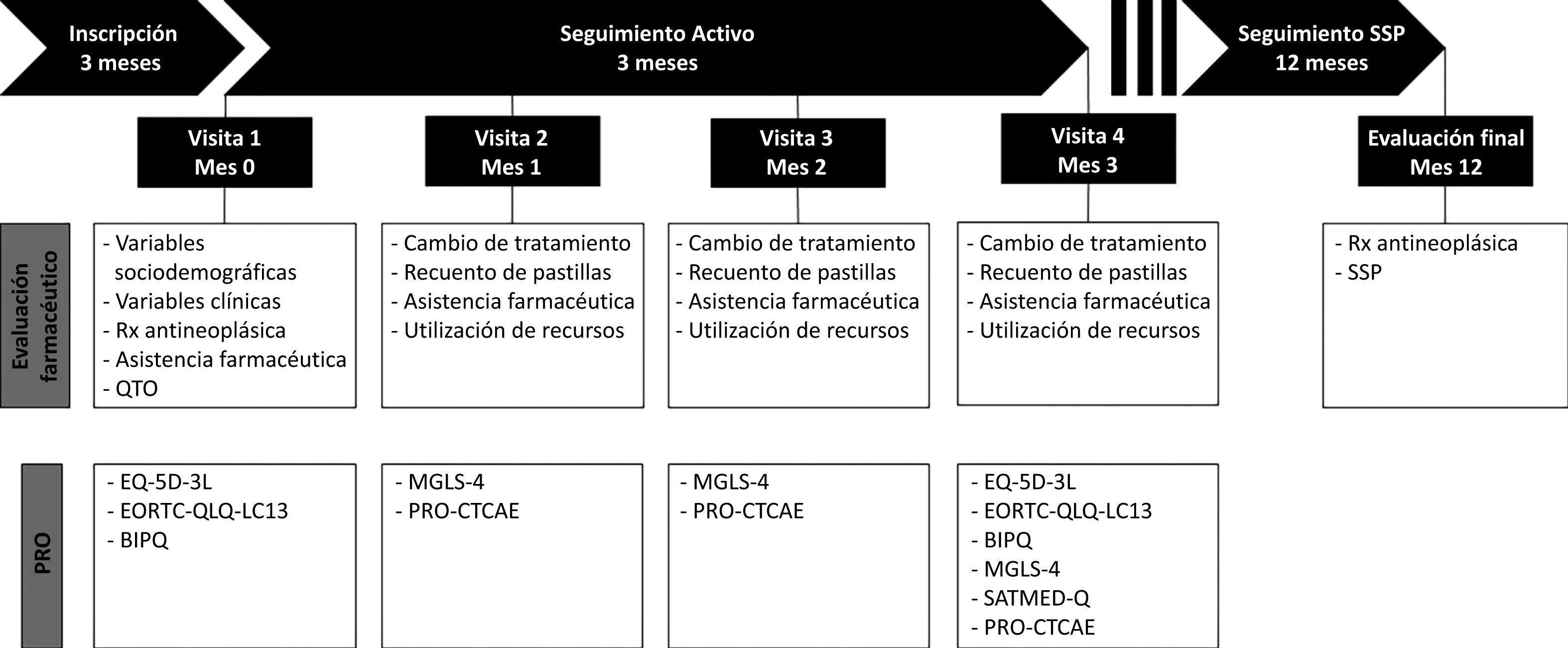
MétodosDiseñoSe trata de un estudio multicéntrico, observacional y prospectivo. La decisión de prescribir el tratamiento es totalmente independiente de la decisión sobre la inclusión del paciente. El tratamiento será prescrito, de acuerdo con la práctica habitual, por los oncólogos responsables, mientras que la decisión de incluir al paciente en el estudio será responsabilidad del farmacéutico participante. Tras su inclusión, se realizará un seguimiento activo y prospectivo del paciente durante 3 meses, que incluirá 4 consultas de estudio para registrar información sobre las variables sociodemográficas, tratamiento antineoplásico y adherencia, atención farmacéutica, variables clínicas y PRO. Doce meses después de la inclusión del último paciente, registraremos información sobre el estado de la progresión y las prescripciones dispensadas. El diseño general se detalla en la figura 1. El estudio ha sido aprobado por el Comité Ético de la Investigación con Medicamentos de Galicia (Santiago de Compostela, España).
Marco del estudioEl estudio se llevará a cabo en 6 hospitales españoles con experiencia en el manejo de pacientes con CBPNM.
Criterios de elegibilidadEl estudio incluirá a hombres y mujeres mayores de 18 años con diagnóstico de CBPNM localmente avanzado o metastásico, que estén recibiendo tratamiento o a quienes se les haya prescrito QTO para el manejo del CBPNM de acuerdo con las normas y criterios de los centros participantes, y que den su consentimiento informado por escrito. Los pacientes serán excluidos si, a juicio del investigador, no son capaces de comprender los cuestionarios administrados durante el estudio o si el paciente está actualmente incluido en un ensayo clínico.
ExposiciónSe considerará que los pacientes están expuestos a la intervención de interés si actualmente reciben o se les ha prescrito QTO. La QTO debe ser prescrita en la práctica clínica habitual, y de acuerdo con la ficha técnica del producto, por el oncólogo responsable del tratamiento, y quien no formará parte del equipo de investigación del estudio.
Evaluaciones del estudio y criterios de valoraciónSe realizarán 4 visitas durante el periodo de seguimiento activo de 3 meses, una visita inicial y cada mes hasta el mes 3 (fig. 1); estas visitas podrían sustituirse por contacto telefónico. En la visita 1 (visita inicial), el farmacéutico registrará la siguiente información en el momento de la inclusión del paciente en el estudio: a) datos demográficos, incluyendo edad, sexo, raza, estudios, situación laboral y consumo de tabaco, b) variables relacionadas con la enfermedad, como fecha del diagnóstico, estadio de la enfermedad en el momento del diagnóstico, histología, la escala funcional ECOG, número y localización de metástasis y biomarcadores (concretamente ALK, EGFR, EGFR-T790M, ROS-1, BRAF) y c) variables relacionadas con el tratamiento, entre ellos los fármacos antineoplásicos previos, medicación concomitante y QTO, para el posterior registro de información sobre la posología y la fecha de dispensación. En la visita 1, el paciente completará la versión de 3 niveles del EQ-5D (EQ-5D-3L)12; el módulo QLQ-LC13 (calidad de vida para el cáncer de pulmón de 13 ítems) de la EORTC13; y el cuestionario BIPQ (Brief Illness Perception Questionnaire)14. En las visitas 2, 3 y 4, el farmacéutico registrará información sobre el recuento de unidades de medicamentos de QTO (es decir, unidades dispensadas y no utilizadas), cambios de tratamiento de medicamentos concomitantes y QTO, intervenciones de atención farmacéutica y uso de recursos (visitas al servicio de urgencias e ingresos). Durante estas visitas, el paciente cumplimentará la escala MGLS-4 (4-items Morisky Green Levine Medication Adherence Scale)15 y el cuestionario PRO-CTCAE® (Patient-Reported Outcomes version of the Common Terminology Criteria for Adverse Events), mientras que los cuestionarios de calidad de vida, el BIPQ y el SATMED-Q (Treatment Satisfaction with Medicines Questionnaire)16 se autoadministrarán de nuevo en la visita 4. La evaluación final tendrá lugar 12 meses después de la inclusión del paciente y el farmacéutico registrará información sobre la progresión de la enfermedad y las prescripciones de QTO dispensadas. Se utilizarán las versiones españolas de los PRO validadas, cuyas características se describen brevemente a continuación y que se administrarán en formato de papel.
Periodos de estudio y evaluaciones.
BIPQ: Cuestionario Breve de Percepción de la Enfermedad; EORTC QLQ-LC13: módulo del cuestionario específico de cáncer de pulmón de 13 ítems del Cuestionario Básico de Calidad de Vida de la EORTC; EQ-5D-3L: versión de 3 niveles del EQ-5D; MGLS-4: Escala de Adherencia a la Medicación de Morisky Green Levine de 4 ítems; QTO: quimioterapia oral; PRO-CTCAE®: Patient-Reported Outcomes Version of the Common Terminology Criteria for Adverse Events (Criterios Terminológicos Comunes para los acontecimientos adversos según la versión resultados comunicados por el paciente; SSP: supervivencia sin progresión; SATMED-Q: Cuestionario de Satisfacción con el Tratamiento con Medicamentos.
El EQ-5D es una medida genérica de la calidad de vida con 5 ítems que comprende 5 dimensiones: movilidad, cuidado personal, actividades cotidianas, dolor/malestar y ansiedad/depresión. Administraremos la versión española del EQ-5D de 3 niveles, donde el grado de deterioro en cada dimensión se evalúa como «sin problemas», «algunos problemas» o «problemas extremos»12. El instrumento EQ-5D incluye una Escala Visual Analógica (EVA) para autoevaluar la salud desde 0 (peor estado de salud imaginable) a 100 (mejor estado de salud imaginable).
El QLQ-LC13 de la EORTC incluye una escala de varios ítems para evaluar la disnea y medidas de un solo ítem de síntomas asociados al cáncer de pulmón como dolor, tos, boca dolorida, disfagia, neuropatía periférica, alopecia y hemoptisis13. El grado en que el paciente haya experimentado estos síntomas o problemas durante la última semana se valora como «nada», «un poco», «bastante» o «mucho».
El BIPQ es un cuestionario de 9 ítems que evalúa las representaciones cognitivas y emocionales de la enfermedad14. Consta de 5 ítems sobre la representación cognitiva de la percepción de la enfermedad (consecuencias, cronología, control personal, control del tratamiento e identidad), 2 ítems sobre la representación emocional (preocupación y emociones), 1 ítem sobre la comprensión de la enfermedad y 1 ítem sobre las causas percibidas de la enfermedad, en el que los encuestados enumeran los 3 factores causales más importantes de su enfermedad. Los 8 primeros ítems se valoran con una escala de 0 (mínimo) a 10 (máximo), y se suman para obtener la puntuación total, que oscila entre 0 y 80.
La escala MGLS-4 incluye 4 preguntas con elementos de olvido y gravedad de los síntomas, que se responden en formato sí/no. La puntuación oscila entre 0 y 4, donde 0 indica una adherencia perfecta y una puntuación igual o superior a 1 indica cierto grado de no adherencia15.
El SATMED-Q es una herramienta autoadministrada con 17 ítems que evalúa la satisfacción con el tratamiento en 6 dimensiones: eficacia del tratamiento, comodidad de uso, impacto en las actividades diarias, atención médica, satisfacción global y efectos secundarios colaterales16. La puntuación global de satisfacción con el tratamiento farmacológico se obtiene sumando las puntuaciones de todos los dominios, con puntuaciones que van de 0 a 68. Las puntuaciones más altas indican una mayor satisfacción.
El PRO-CTCAE es un sistema de medición de PRO desarrollado por el Instituto Nacional del Cáncer de EE. UU. para evaluar la toxicidad sintomática en pacientes de ensayos clínicos oncológicos. Comprende 124 ítems que representan 78 toxicidades sintomáticas extraídas del CTCAE. Los investigadores evaluaron los atributos de frecuencia, gravedad, interferencia, cantidad y presencia/ausencia (mediante 1–3 atributos dependiendo de la toxicidad), y se seleccionaron 21 toxicidades para este estudio.
Análisis estadísticoEl tamaño muestral se ha calculado asumiendo una población finita (N = 19.141 casos de CBPNM estimados en España)17, una variabilidad máxima de los datos entre los participantes (p = q = 0,5), y un error de precisión del 10% con un nivel de confianza del 95%. Suele asumirse el criterio de máxima variabilidad cuando el objetivo final es estimar las proporciones.
Aplicamos la fórmula siguiente18:
Donde N es el tamaño de la población de estudio (N = 19.141); Zα es el 95% de la distribución normal (Zα = 1,96); p = q = 0,5; y e es el error de precisión (10%).
Con estos supuestos, y considerando un 10% de pérdidas, el tamaño de la muestra es de 106 sujetos (18–22 pacientes/hospital).
El criterio de valoración principal es el porcentaje de adherencia al tratamiento que se calculará a partir del recuento de medicación de la siguiente manera: la diferencia entre el número de unidades dispensadas menos el número de unidades no utilizadas se dividirá por el número de días de tratamiento multiplicado por el número de unidades/día prescritas por el oncólogo. Este cociente se multiplicará por 100 para obtener el porcentaje de adherencia. Los pacientes con un porcentaje de adherencia mayor al 80% serán categorizados como adherentes. El porcentaje de adherencia al tratamiento se presentará utilizando tanto la media y la desviación estándar como la mediana y el rango intercuartílico.
Como criterio secundario, también se calculará la adherencia basada en un valor de corte del 90% para el recuento de medicación. La adherencia al tratamiento también se calculará mediante la proporción de días cubiertos (PDC) y la escala MGLS-4. La PDC se calculará como el número de días que el paciente estuvo cubierto por el fármaco en función de la fecha de prescripción y los días de suministro dividido por el número de días del periodo de tratamiento (contado como el número de la fecha de prescripción índice hasta el final del estudio, la interrupción del estudio o el fallecimiento). El cociente resultante se multiplicará por 100. Los pacientes se considerarán adherentes si el CDP es igual o mayor que el 80%. Se considerará que el paciente ha logrado cumplimiento terapéutico según la escala MGLS-4 si la puntuación es 0. Se expresará la proporción de pacientes adherentes según criterios dicotómicos para cada punto de corte del recuento de medicación, PDC y MGLS-4 mediante frecuencias absolutas y relativas con el correspondiente intervalo de confianza del 95%.
Los resultados de adherencia se comunicarán para la muestra global y para los siguientes subgrupos: EGFR-TKI de primera y segunda generación (erlotinib, afatinib y gefitinib), EGFR-TKI de tercera generación (osimertinib) e inhibidores de ALK (alectinib, crizotinib y lorlatinib).
Para analizar el impacto de las características de pacientes y de tratamiento en la adherencia, se realizarán análisis bivariados utilizando los diferentes puntos de corte para la adherencia al recuento de la medicación, la PDC y la escala MGLS-4. Las variables cuantitativas se compararán utilizando la prueba t de Student o una prueba no paramétrica, y las variables cualitativas se compararán utilizando la prueba de chi-cuadrado. Para evaluar la posible relación entre la adherencia y algunos PRO, como la calidad de vida relacionada con la salud, la percepción de la enfermedad, la satisfacción con el tratamiento, la percepción de toxicidad y la utilización de recursos sanitarios, se realizarán análisis bivariantes similares. La concordancia entre las 3 medidas de adherencia se evaluará mediante el índice kappa de Fleiss. Por último, para evaluar el impacto de la adherencia (es decir, el cumplimiento terapéutico según la definición anterior) sobre la eficacia del tratamiento, evaluada por la supervivencia sin progresión, utilizaremos el método de Kaplan-Meier y se comparará con la prueba de log-rank y el análisis de regresión de Cox univariante.
Los análisis estadísticos se realizarán con IBM SPSS Statistics 26.0 o una versión posterior. Todas las comparaciones se considerarán significativas si p < 0,05.
DiscusiónLa creciente disponibilidad y consumo de QTO repercutirá significativamente en todos los aspectos de la atención oncológica y afectará a las funciones de los profesionales sanitarios implicados en la atención al paciente3. Para el oncólogo, habrá una reducción de la carga en términos de visitas a la consulta, pero existirá una mayor necesidad de coordinación con otros profesionales, como el farmacéutico hospitalario, que estará cada vez más implicado en la supervisión de la seguridad y el seguimiento de la adherencia al tratamiento3. Este papel del farmacéutico hospitalario ya está en consonancia con la percepción de algunos pacientes con cáncer que reciben la QTO, que consideran que el servicio de farmacia hospitalaria les facilita el acceso al tratamiento y a información detallada sobre el mismo y sus efectos secundarios19. Además, algunas funciones y responsabilidades tradicionales de oncólogos, enfermeras y farmacéuticos se trasladarán a pacientes y cuidadores3. También es probable que parte de la evaluación continua de los síntomas, la toxicidad y el cumplimiento terapéutico deba realizarse o mejorarse a distancia1,6.
Nuestro estudio presenta varias limitaciones. Se está realizando en un país donde la quimioterapia está subvencionada, y se ha identificado el coste o pago de medicamentos como un factor que afecta a la adherencia al QTO20. Por lo tanto, al interpretar los factores asociados con la adherencia en nuestro estudio, los resultados no serán totalmente representativos de otros entornos. Para evaluar el impacto de la adherencia en la eficacia del tratamiento, según la supervivencia libre de progresión, no utilizaremos todo el periodo de estudio, sino el periodo inicial de 3 meses para definir la adherencia.
Tanto los pacientes como los profesionales sanitarios implicados en el tratamiento de la QTO consideran que proporcionar información a los pacientes de una forma adecuada es un factor facilitador clave, y que la toxicidad es una barrera clave para la adherencia19. A pesar de la escasez de datos sólidos al respecto, coincidimos con otros autores en que el farmacéutico hospitalario desempeña un papel esencial en el seguimiento y la mejora de la adherencia a la QTO y, en general, en la mejora del manejo de la QTO19. Esperamos que nuestro estudio proporcione información preliminar sobre aspectos fundamentales de la adherencia a la QTO (es decir, medidas, factores facilitadores y barreras) y su relación con los resultados clínicos de los pacientes en el contexto del CBPNM, y que esta información ayude a diseñar intervenciones farmacéuticas que mejoren la adherencia.
FinanciaciónEste estudio está financiado por AstraZeneca Farmacéutica España. El apoyo editorial y de redacción fue proporcionado por el Dr. Fernando Rico-Villademoros de APICES, contratado y financiado por AstraZeneca Farmacéutica España. AstraZeneca Farmacéutica España tuvo la oportunidad de revisar el manuscrito desde el punto de vista de la exactitud médica y científica, así como las posibles consideraciones de propiedad intelectual.
Declaración de autoríaTodos los autores fueron responsables del concepto y diseño del estudio, revisaron y aprobaron la versión final del manuscrito y se consideran garantes del mismo. Todos los autores cumplen los criterios de autoría detallados por el Comité Internacional de Editores de Revistas Médicas.
Conflicto de interesesIrene Mangues-Bafalluy ha sido miembro del consejo asesor de Seagen; ha recibido honorarios como consultora de Janssen, Gilead, y ha recibido honorarios como ponente de MSD, GSK.
Beatriz Bernárdez ha recibido pagos por conferencias, asistencia a congresos, viajes a cursos y congresos, consejos asesores, participación en grupos de trabajo, etc., en los últimos años de: AstraZeneca, BMS, Merck, MSD, Novartis, Astellas, Sanofi Pfizer Takeda, GSK, Pharmamar, Daiichi Sankyo, Amgen, Seagen, Ipsen.
José Manuel Martínez-Sesmero ha recibido honorarios como consultor de AstraZeneca, Pfizer, Janssen, UCB; y ha recibido honorarios como ponente de Roche y GSK.
Andrés Navarro-Ruiz ha recibido honorarios como consultor de AstraZeneca, UCB, y ha recibido honorarios como ponente de Roche.
Ana Rosa Rubio-Salvador ha sido miembro del consejo asesor de GSK; ha recibido honorarios por consultoría de Janssen, Lilly, AMGEN, y ha recibido honorarios como ponente de MSD, GSK.
María Teresa Martín-Conde no tiene ningún conflicto de intereses.
AgradecimientosLos autores agradecen a Juan Luis Sanz y Susana Vara (APICES, Madrid, España) su apoyo en el diseño del estudio, y a Fernando Rico-Villademoros (APICES, Madrid, España) la redacción de un borrador de este manuscrito.
Declaración de contribución de autoría CRediTIrene Mangues-Bafalluy: Writing – review & editing, Writing – original draft, Methodology, Conceptualization. Beatriz Bernárdez: Writing – review & editing, Writing – original draft, Methodology, Conceptualization. José Manuel Martínez-Sesmero: Writing – review & editing, Writing – original draft, Methodology, Conceptualization. Andres Navarro-Ruiz: Writing – review & editing, Writing – original draft, Methodology, Conceptualization. Ana Rosa Rubio-Salvador: Writing – review & editing, Writing – original draft, Investigation, Conceptualization. Maria Teresa Martín-Conde: Writing – review & editing, Writing – original draft.