Comparar, desde la perspectiva del Sistema Sanitario, el coste del tratamiento con abatacept subcutáneo en pacientes con artritis reumatoide tras fracaso a metotrexato, frente al resto de fármacos antirreumáticos modificadores de la enfermedad disponibles en España con indicación en primera línea de terapia biológica.
MétodosUna comparación indirecta demostró eficacia y seguridad de abatacept subcutáneo comparables a abatacept intravenoso, adalimumab, certolizumab, etanercept, golimumab, infliximab y tocilizumab, por lo que se optó por una minimización de costes. El análisis incluyó costes farmacológicos y de administración (€, 2013) para un paciente “tipo” de 70 kg y un horizonte temporal de tres años. Se aplicó una tasa anual de descuento del 3%. Se realizaron análisis de sensibilidad determinísticos y probabilísticos.
ResultadosAbatacept subcutáneo tuvo un coste anual de 10.760,41 € durante el primer año, 10.261,29 € en los años siguientes, y un coste total de 29.953,89 € a los tres años, generando ahorros (rango -831,41 € versus infliximab a -9.741,69 € versus tocilizumab) frente a los demás antirreumáticos modificadores de la enfermedad. Las mayores diferencias entre fármacos se observaron durante el primer año de tratamiento. Abatacept subcutáneo se asoció a ahorros en el 100% de las simulaciones del análisis de sensibilidad probabilístico versus adalimumab, certolizumab, etanercept y golimumab, en más del 99,6% versus abatacept intravenoso y tocilizumab y en el 62,3% versus infliximab.
ConclusionesEn base a los resultados, el tratamiento con abatacept subcutáneo genera ahorros frente a abatacept intravenoso, adalimumab, certolizumab, etanercept, golimumab, infliximab y tocilizumab en pacientes con artritis reumatoide que inician tratamiento con fármacos antirreumáticos biológicos.
To compare the cost of treating rheumatoid arthritis patients that have failed an initial treatment with methotrexate, with subcutaneous abatacept versus other first-line biologic disease-modifying antirheumatic drugs.
MethodSubcutaneous abatacept was considered comparable to intravenous abatacept, adalimumab, certolizumab pegol, etanercept, golimumab, infliximab and tocilizumab, based on indirect comparison using mixed treatment analysis. A cost-minimization analysis was therefore considered appropriate. The Spanish Health System perspective and a 3 year time horizon were selected. Pharmaceutical and administration costs (€, 2013) of all available first-line biological disease-modifying antirheumatic drugs were considered. Administration costs were obtained from a local costs database. Patients were considered to have a weight of 70 kg. A 3% annual discount rate was applied. Deterministic and probabilistic sensitivity analyses were performed.
ResultsSubcutaneous abatacept proved in the base case to be less costly than all other biologic antirrheumatic drugs (ranging from € -831.42 to € -9,741.69 versus infliximab and tocilizumab, respectively). Subcutaneous abatacept was associated with a cost of € 10,760.41 per patient during the first year of treatment and € 10,261.29 in subsequent years. The total 3-year cost of subcutaneous abatacept was € 29,953.89 per patient. Sensitivity analyses proved the model to be robust. Subcutaneous abatacept remained cost-saving in 100% of probabilistic sensitivity analysis simulations versus adalimumab, certolizumab, etanercept and golimumab, in more than 99.6% versus intravenous abatacept and tocilizumab and in 62.3% versus infliximab.
ConclusionsTreatment with subcutaneous abatacept is cost-saving versus intravenous abatacept, adalimumab, certolizumab, etanercept, golimumab, infliximab and tocilizumab in the management of rheumatoid arthritis patients initiating treatment with biological antirheumatic drugs.
La artritis reumatoide (AR) es una enfermedad crónica autoinmune caracterizada por el desarrollo de artritis erosiva simétrica y, en mayor o menor grado, manifestaciones extra-articulares1. Se estima que un 0,5% de la población adulta española podría estar afectada, la mayoría con edades comprendidas entre los 30 y 59 años2, coincidiendo con el periodo de mayor productividad laboral. La AR reduce entre 5 y 10 años la esperanza de vida de los pacientes y más del 50% desarrollan discapacidad grave a los 10 años del inicio de la enfermedad3. En España, se estima que hasta un 5% de todas las incapacidades laborales podrían deberse a la AR2.
El tratamiento de la AR ha experimentado importantes avances en los últimos años; de centrarse en el control de síntomas, se ha pasado a conseguir la remisión clínica o un estado de baja actividad de la enfermedad4. Este cambio es debido, en parte, a la disponibilidad de una nueva familia de fármacos antirreumáticos moduladores de la enfermedad. Estos fármacos se conocen como FAMEs biológicos por su naturaleza de anticuerpos monoclonales o proteínas de fusión de receptores, que actúan a nivel de los linfocitos T o B o inhibiendo, directa o indirectamente, la acción de citoquinas específicas5.
En España existen ocho FAMES biológicos disponibles para el tratamiento de pacientes refractarios a MTX: abatacept intravenoso (ABA IV), adalimumab (ADA), anakinra (ANA), certolizumab (CZP), etanercept (ETN), golimumab (GLM), infliximab (IFX) y tocilizumab (TCZ). Recientemente se dispone de una nueva formulación de ABA que permite su administración por vía subcutánea (ABA SC). Adicionalmente existe otro FAME biológico, rituximab (RTX), que por su perfil de seguridad, únicamente está indicado en pacientes que han fracasado al menos a un tratamiento con un inhibidor del factor de necrosis tumoral (TNF) (anti-TNFα)6.
Hasta el momento solo se han realizado tres ensayos clínicos que de forma directa comparen estas alternativas terapéuticas entre sí, en población con respuesta inadecuada a un tratamiento previo con MTX: el estudio ADACTA7 (fase IIIb-doble ciego) que comparó TCZ IV frente a ADA; el AMPLE8 (fase IIIb), que comparó ABA SC frente a ADA; y el estudio ACQUIRE9 (fase IV-doble ciego), que comparó ABA SC frente ABA IV. Por lo tanto, la estimación de eficacia y seguridad relativa entre estos fármacos procede de estudios de comparación indirecta10-14. El más reciente10 comparó la eficacia y seguridad de ABA IV, ADA, ANA, CZP, ETN, GLM, IFX y TCZ. A partir de los resultados de eficacia y seguridad a las 24 y 52 semanas de tratamiento en los ensayos clínicos identificados, los autores concluyeron que todos los FAMEs biológicos evaluados presentaban eficacia y seguridad comparables.
En la actualidad el gasto sanitario representa un importante porcentaje de los presupuestos generales del
Estado en España. En este contexto y considerando la elevada carga económica de la AR, la realización de evaluaciones económicas es de especial importancia para maximizar los resultados sanitarios con los recursos disponibles.
El objetivo de este estudio fue evaluar, desde la perspectiva del Sistema Sanitario español, las consecuencias económicas entre el tratamiento de pacientes con AR en primera línea de terapia biológica con ABA SC, frente a otras alternativas terapéuticas (ABA IV, ADA, CZP, ETN, GLM, IFX y TCZ).
Material y métodosSe realizó un análisis de minimización de costes que comparó ABA SC frente a otros FAMEs biológicos para el tratamiento en primera línea de pacientes con AR con respuesta inadecuada a un tratamiento previo con un FAME incluyendo MTX.
Este tipo de análisis está indicado para comparar opciones terapéuticas que no han demostrado diferencias en cuanto a eficacia en una misma indicación pero se asocian a un consumo de recursos diferente. Por este motivo, en base a los recientes resultados que demuestran una eficacia y seguridad de ABA SC comparable a otros FAMEs10, se optó por un análisis de minimización de costes para el presente estudio.
El horizonte temporal evaluado fue de 3 años, coincidiendo con el utilizado en otros análisis económicos de AR15.
Aplicando las recomendaciones actuales para el desarrollo de evaluaciones económicas en España16 se consideró una tasa de descuento del 3% anual. La tasa de descuento se aplica para ajustar los beneficios aportados por una intervención, de manera que se refleje la preferencia de obtener beneficios inmediatos frente a obtenerlos en un futuro. Para el cálculo de la tasa de descuento a aplicar se empleó un tipo de interés compuesto continuo17.
La perspectiva del estudio fue la del Sistema de Salud español, considerándose únicamente los siguientes costes directos sanitarios: coste farmacológico y coste de administración. El resto de costes asociados al manejo rutinario de los pacientes con AR, no se incluyeron en el modelo al considerarse equivalentes en todos los pacientes independientemente del FAME utilizado.
Los costes farmacológicos y de administración se calcularon desde la premisa de una completa adherencia y persistencia de los pacientes al tratamiento durante los tres años evaluados.
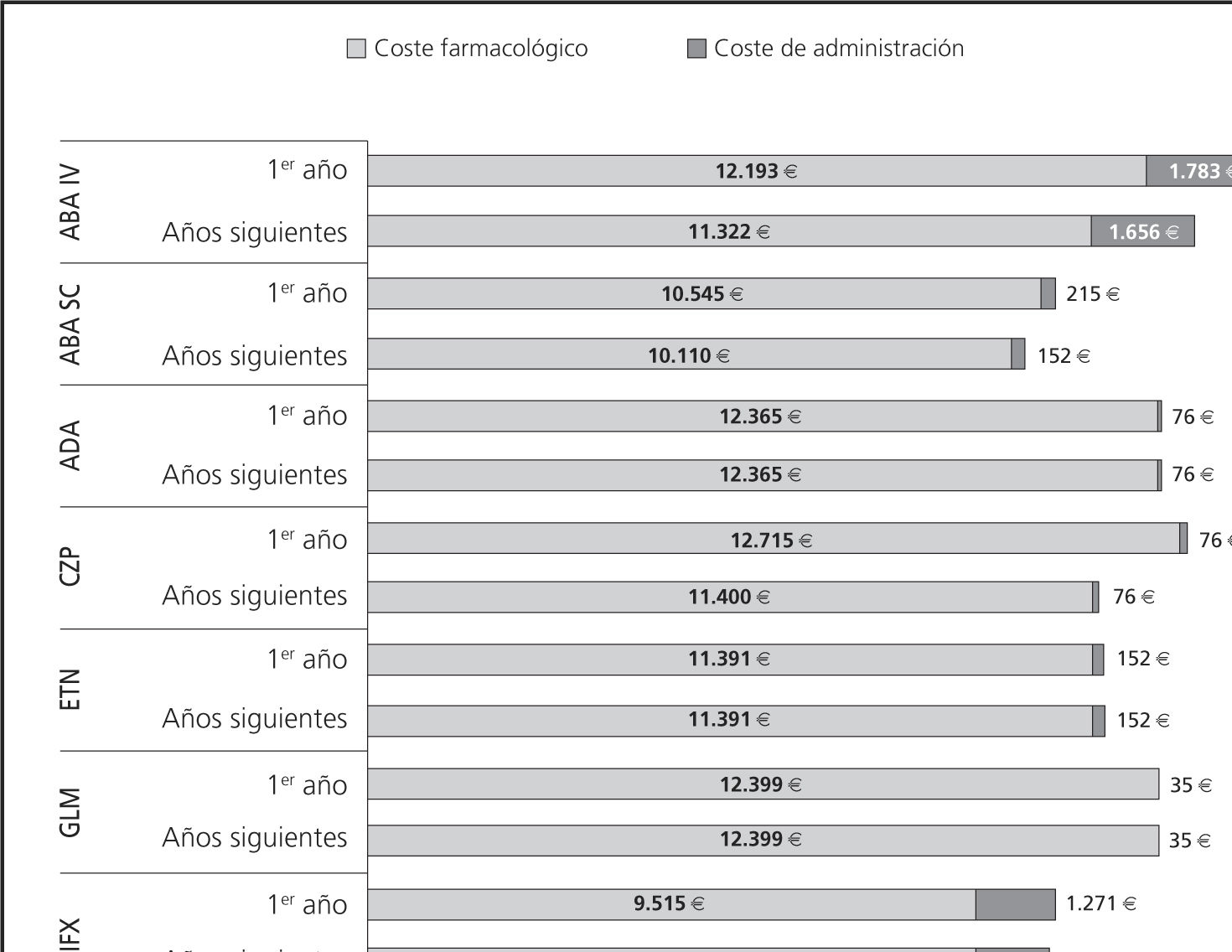
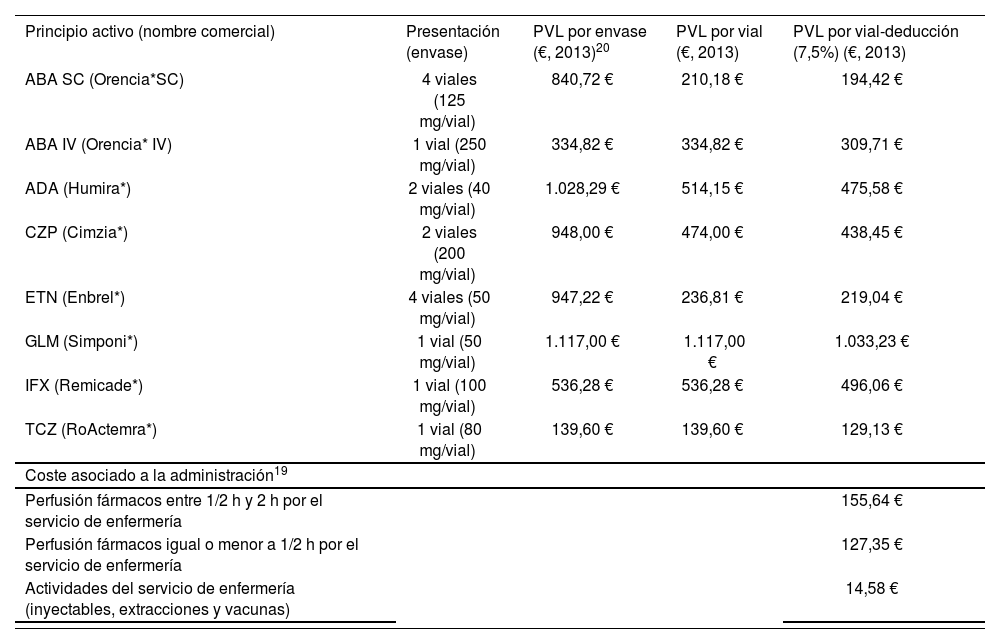
Tanto el coste farmacológico como el de administración reflejan las pautas utilizadas en la práctica clínica en España (Tabla 1), coincidentes con las fichas técnicas. Para IFX se asumió el escalado de dosis observado en práctica clínica española con un estudio observacional18 según el cual a los 6 meses de iniciar el tratamiento un 44% de los pacientes aumentó su dosis de 3 mg/kg a 5 mg/kg y un 8,3% acortó su intervalo de dosificación de 8 a 6 semanas (Tabla 1).
Pautas posológicas consideradas para los distintos FAMEs
| FAME | Pauta posológica |
|---|---|
| ABA SC | Una primera dosis de carga de ABA IV (10 mg/kg), al día siguiente comenzar con 125 mg de ABA SC semanal. |
| ABA IV | 10 mg/kg en las semanas 0,2 y 4 seguido de infusiones cada 4 semanas. |
| ADA | 40 mg cada 2 semanas. |
| CZP | Dos inyecciones de 200 mg en las semanas 0, 2 y 4 seguido de una dosis de mantenimiento de 200 mg cada 2 semanas. |
| ETN | 50 mg una vez a la semana. |
| GLM | 50 mg una vez al mes. |
| IFX | 3 mg/kg en las semanas 0, 2 y 6 y posteriormente cada 8 semanas. A los 6 meses de tratamiento el 8,3% de los pacientes acortarían su intervalo de dosificación de a 6 semanas y otro 44% aumentaría su dosis de 3 a 5 mg/kg. |
| TCZ | 8 mg/kg una vez cada 4 semanas. |
ABA IV: Abatacept intravenoso; ABA SC: Abatacept subcutáneo; ADA: Adalimumab; CZP: Certolizumab; ETN: Etanercept; FAME: Fármaco antirreumático modificador de la enfermedad; GLM: Golimumab; IFX: Infliximab; TCZ: Tocilizumab.
Dados los resultados de estudios que demostraron la obtención de concentraciones efectivas sin la necesidad del uso de dosis de carga de ABA IV8 y el contexto económico actual, los expertos consultados consideraron adecuado que en el caso base del análisis se asumiese que el 50% de los pacientes que iniciaban tratamiento con ABA SC, recibirían una dosis de carga.
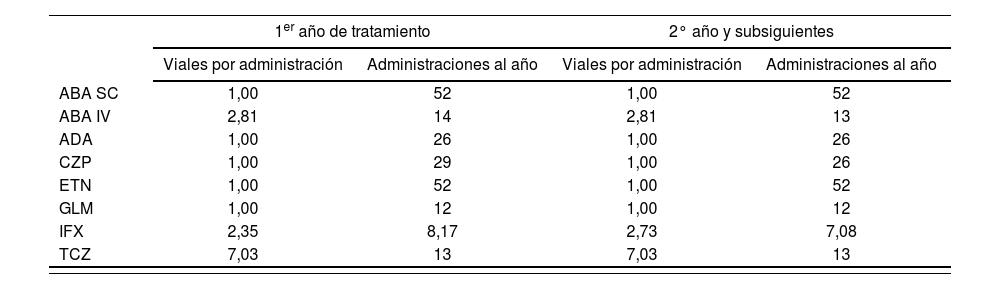
Las dosis de ABA IV, IFX y TCZ se calcularon para un peso promedio por paciente de 70,31kg19. El número de viales utilizados en cada administración de estos fármacos fue calculado desde la premisa del máximo aprovechamiento, es decir, sin desechar el remanente en los viales no acabados, que se asume se aprovecharía para tratar a otros pacientes (Tabla 2).
Dosis y administraciones anuales
| 1er año de tratamiento | 2° año y subsiguientes | |||
|---|---|---|---|---|
| Viales por administración | Administraciones al año | Viales por administración | Administraciones al año | |
| ABA SC | 1,00 | 52 | 1,00 | 52 |
| ABA IV | 2,81 | 14 | 2,81 | 13 |
| ADA | 1,00 | 26 | 1,00 | 26 |
| CZP | 1,00 | 29 | 1,00 | 26 |
| ETN | 1,00 | 52 | 1,00 | 52 |
| GLM | 1,00 | 12 | 1,00 | 12 |
| IFX | 2,35 | 8,17 | 2,73 | 7,08 |
| TCZ | 7,03 | 13 | 7,03 | 13 |
ABA IV: Abatacept intravenoso; ABA SC: Abatacept subcutáneo; ADA: Adalimumab; CZP: Certolizumab; ETN: Etanercept; GLM: Golimumab; IFX: Infliximab; TCZ: Tocilizumab
Para los costes de los medicamentos se consideró el precio de venta del laboratorio (PVL)20 (€, octubre 2013), aplicándose el IVA y la deducción correspondiente (7,5%) estipulada en el Real Decreto-Ley 8/2010 (Tabla 3).
Coste unitario por vial de los distintos FAMEs y coste asociado a la administración
| Principio activo (nombre comercial) | Presentación (envase) | PVL por envase (€, 2013)20 | PVL por vial (€, 2013) | PVL por vial-deducción (7,5%) (€, 2013) |
|---|---|---|---|---|
| ABA SC (Orencia*SC) | 4 viales (125 mg/vial) | 840,72 € | 210,18 € | 194,42 € |
| ABA IV (Orencia* IV) | 1 vial (250 mg/vial) | 334,82 € | 334,82 € | 309,71 € |
| ADA (Humira*) | 2 viales (40 mg/vial) | 1.028,29 € | 514,15 € | 475,58 € |
| CZP (Cimzia*) | 2 viales (200 mg/vial) | 948,00 € | 474,00 € | 438,45 € |
| ETN (Enbrel*) | 4 viales (50 mg/vial) | 947,22 € | 236,81 € | 219,04 € |
| GLM (Simponi*) | 1 vial (50 mg/vial) | 1.117,00 € | 1.117,00 € | 1.033,23 € |
| IFX (Remicade*) | 1 vial (100 mg/vial) | 536,28 € | 536,28 € | 496,06 € |
| TCZ (RoActemra*) | 1 vial (80 mg/vial) | 139,60 € | 139,60 € | 129,13 € |
| Coste asociado a la administración19 | ||||
| Perfusión fármacos entre 1/2 h y 2 h por el servicio de enfermería | 155,64 € | |||
| Perfusión fármacos igual o menor a 1/2 h por el servicio de enfermería | 127,35 € | |||
| Actividades del servicio de enfermería (inyectables, extracciones y vacunas) | 14,58 € | |||
*Únicamente se consideró que un 20% de los pacientes requerirían asistencia por parte del personal de enfermería en la administración de medicación subcutánea en base a la opinión de expertos.
ABA IV: Abatacept intravenoso; ABA SC: Abatacept subcutáneo; ADA: Adalimumab; CZP: Certolizumab; ETN: Etanercept; FAME: Fármaco antirreumático modificador de la enfermedad; GLM: Golimumab; IFX: Infliximab; TCZ: Tocilizumab.
El coste de administración de los FAMES IV se calculó en función de la duración de infusión recomendada en ficha técnica: 30 minutos para ABA IV, 1 hora para TCZ, y entre 1 y 2 horas para IFX.
ABA SC, CZP, GLM, ETN y ADA, al ser fármacos de administración subcutánea, son susceptibles de ser auto-administrados por el paciente; sin embargo, de forma conservadora se asumió que un 20% de éstos requerirían asistencia para su administración. Los costes unitarios asociados se obtuvieron de una base de datos de costes sanitarios nacionales21 (Tabla 3).
Todos los costes empleados en el modelo se expresaron en euros 2013.
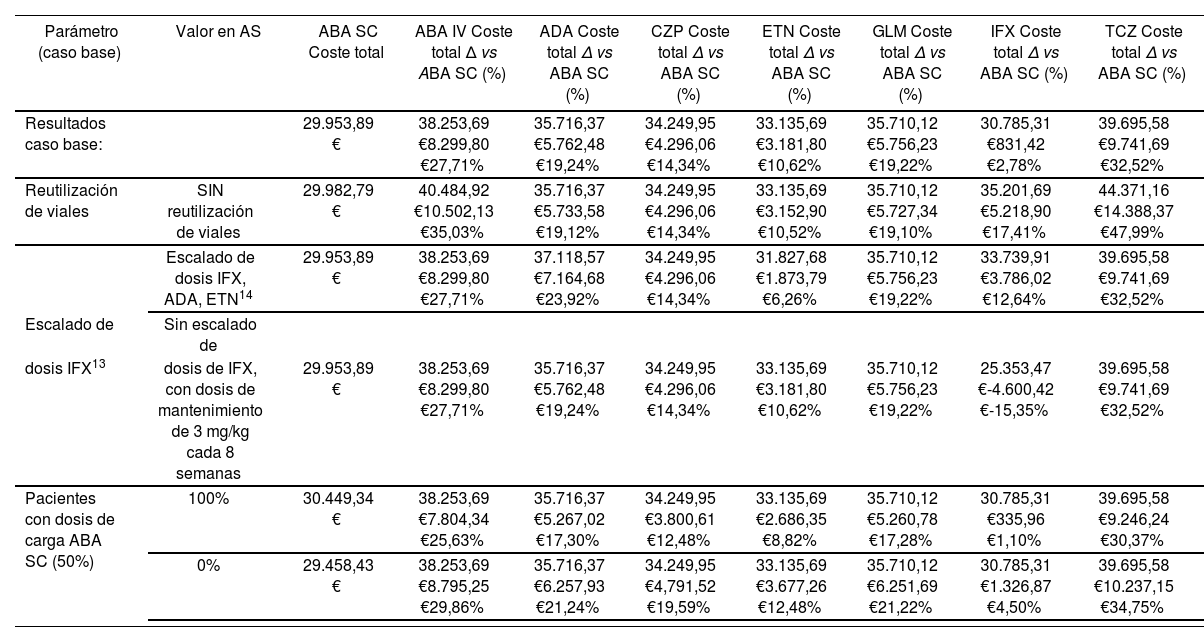
Para evaluar la robustez de los resultados y su sensibilidad a la variación de ciertos parámetros se realizaron análisis de sensibilidad (AS) determinísticos, en los que las variables sujetas a mayor incertidumbre y que influyen en el análisis, son modificadas a fin de valorar su impacto sobre los resultados. Los parámetros modificados fueron: la proporción de pacientes tratados con ABA SC que requerían dosis de carga IV (0% y 100%) y la no re-utilización de viales inacabados. Además, se estudió un escenario con pautas de dosificación y escalados de dosis alternativos basados en los resultados de un estudio observacional realizado en España22, en el cual se observaron escalados de dosis tanto en pacientes tratados con IFX como en los tratados con ADA (con aumento del 38% y del 4% de las dosis recomendadas en ficha técnica, respectivamente), a la vez que los pacientes tratados con ETN recibían dosis inferiores a las especificadas en ficha técnica (reducción del 1,2% de la dosis recomendada), así como un escenario sin escalado de dosis de IFX, manteniendo la dosis inicial recomendada en ficha técnica de 3 mg/kg.
Adicionalmente, y siguiendo las recomendaciones internacionales sobre manejo de la incertidumbre en evaluaciones económicas sanitarias, se realizó un AS probabilístico. Este tipo de análisis consiste en la realización de multitud de simulaciones donde se varía de forma aleatoria, mediante una distribución de probabilidad, el valor de los parámetros evaluados. En el presente modelo se realizaron 1.000 simulaciones para cada terapia, considerando una distribución gamma para los costes de administración y una distribución normal para el peso de los pacientes (70,3 ± 12,1 kg)19.
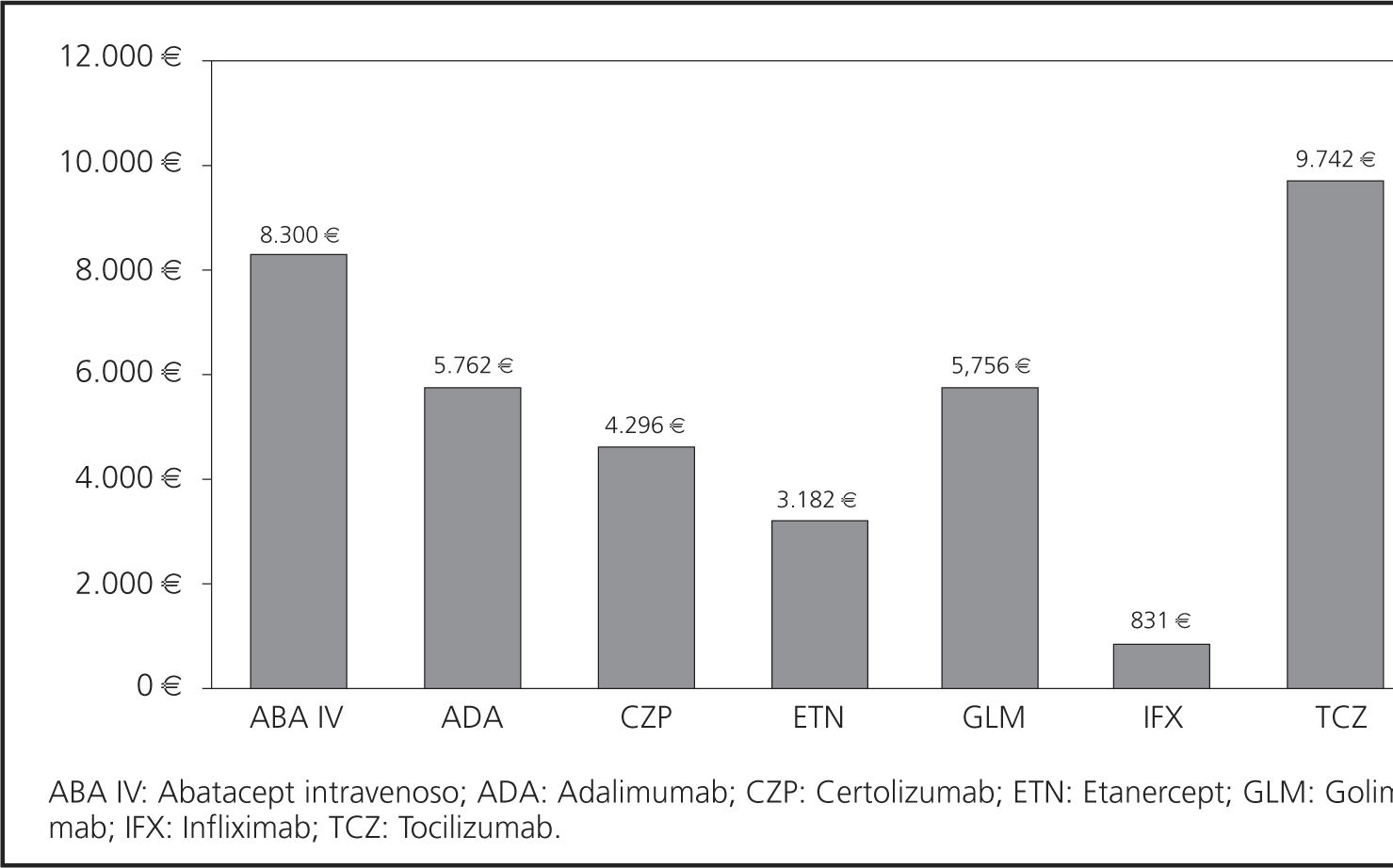
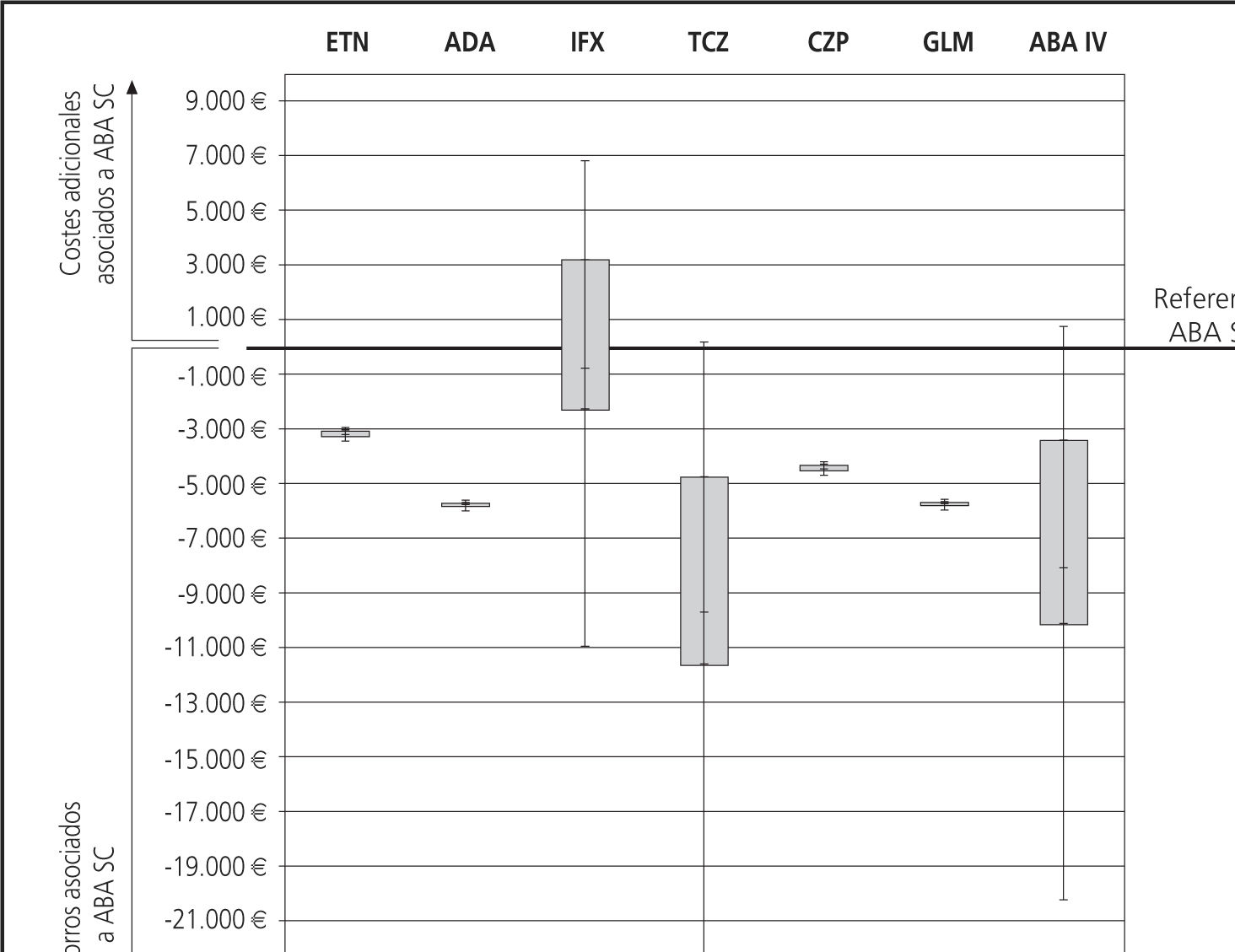
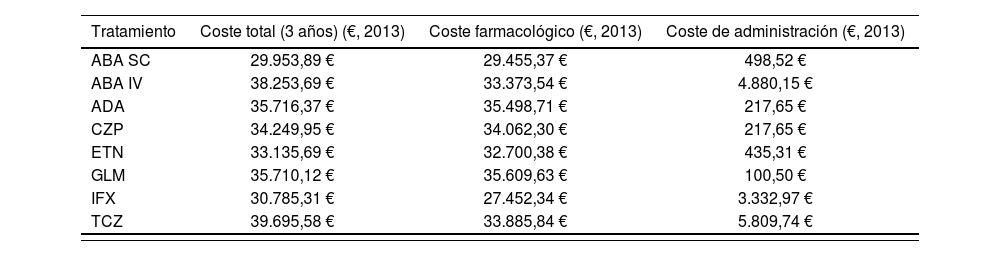
ResultadosEl coste total de ABA SC se estimó en 10.760,41€ durante el primer año de tratamiento y en 10.261,29€ para cada uno de los años siguientes. El coste total anual por paciente de cada terapia evaluada se muestra en la figura 1. En el caso base, ABA SC se asoció a un coste total inferior al de los demás FAMEs analizados (Fig. 2). El coste total al final de los tres años para ABA SC fue de 29.953,89 € (considerando descuento anual del 3%) (Tabla 4). TCZ fue el FAME biológico asociado a mayor coste total (39.695,68 €). En la Tabla 4 se detalla el coste total a tres años de todas las terapias, desglosando el coste farmacológico y el de administración. El concepto con mayor contribución (85%) al total fue el coste farmacológico. GLM fue el FAME con coste farmacológico más elevado, alcanzando los 35.609,63 € a los 3 años de tratamiento, mientras que TCZ se asoció al mayor coste de administración (5.809,74 € a los 3 años) (Tabla 4). La figura 2 representa la diferencia en costes de cada FAME respecto a ABA SC considerando el horizonte de 3 años (Fig. 2). ABA SC permaneció como la alternativa de menor coste en el 100% de los escenarios analizados. El tratamiento con ABA SC se asoció a mayores ahorros cuando se consideró sólo el coste a partir del segundo año y cuando no se permitió la re-utilización de viales (Tabla 5). El efecto de no considerar la re-utilización de viales supuso un aumento respecto al caso base, del coste total de ABA IV, ABA SC, IFX y TCZ. La mayor variación se registró para IFX y para TCZ con aumentos del coste del 14,35% y 11,78%, respectivamente. En los AS determinísticos ABA SC resultó una opción de menor coste en los escenarios estudiados, excepto en el caso de no considerar ningún escalado de dosis de IFX, en los que IFX, con un coste total en 3 años de 25.353,47 € por paciente, resultó la alternativa de menor coste.
Resultados caso base: coste total a los 3 años
| Tratamiento | Coste total (3 años) (€, 2013) | Coste farmacológico (€, 2013) | Coste de administración (€, 2013) |
|---|---|---|---|
| ABA SC | 29.953,89 € | 29.455,37 € | 498,52 € |
| ABA IV | 38.253,69 € | 33.373,54 € | 4.880,15 € |
| ADA | 35.716,37 € | 35.498,71 € | 217,65 € |
| CZP | 34.249,95 € | 34.062,30 € | 217,65 € |
| ETN | 33.135,69 € | 32.700,38 € | 435,31 € |
| GLM | 35.710,12 € | 35.609,63 € | 100,50 € |
| IFX | 30.785,31 € | 27.452,34 € | 3.332,97 € |
| TCZ | 39.695,58 € | 33.885,84 € | 5.809,74 € |
ABA IV: Abatacept intravenoso; ABA SC: Abatacept subcutáneo; ADA: Adalimumab; CZP: Certolizumab; ETN: Etanercept; GLM: Golimumab; IFX: Infliximab; TCZ: Tocilizumab.
Resultados de los análisis de sensibilidad determinísticos
| Parámetro (caso base) | Valor en AS | ABA SC Coste total | ABA IV Coste total Δ vs ABA SC (%) | ADA Coste total Δ vs ABA SC (%) | CZP Coste total Δ vs ABA SC (%) | ETN Coste total Δ vs ABA SC (%) | GLM Coste total Δ vs ABA SC (%) | IFX Coste total Δ vs ABA SC (%) | TCZ Coste total Δ vs ABA SC (%) |
|---|---|---|---|---|---|---|---|---|---|
| Resultados caso base: | 29.953,89 € | 38.253,69 €8.299,80 €27,71% | 35.716,37 €5.762,48 €19,24% | 34.249,95 €4.296,06 €14,34% | 33.135,69 €3.181,80 €10,62% | 35.710,12 €5.756,23 €19,22% | 30.785,31 €831,42 €2,78% | 39.695,58 €9.741,69 €32,52% | |
| Reutilización de viales | SIN reutilización de viales | 29.982,79 € | 40.484,92 €10.502,13 €35,03% | 35.716,37 €5.733,58 €19,12% | 34.249,95 €4.296,06 €14,34% | 33.135,69 €3.152,90 €10,52% | 35.710,12 €5.727,34 €19,10% | 35.201,69 €5.218,90 €17,41% | 44.371,16 €14.388,37 €47,99% |
| Escalado de dosis IFX, ADA, ETN14 | 29.953,89 € | 38.253,69 €8.299,80 €27,71% | 37.118,57 €7.164,68 €23,92% | 34.249,95 €4.296,06 €14,34% | 31.827,68 €1.873,79 €6,26% | 35.710,12 €5.756,23 €19,22% | 33.739,91 €3.786,02 €12,64% | 39.695,58 €9.741,69 €32,52% | |
| Escalado de | Sin escalado de | ||||||||
| dosis IFX13 | dosis de IFX, con dosis de mantenimiento de 3 mg/kg cada 8 semanas | 29.953,89 € | 38.253,69 €8.299,80 €27,71% | 35.716,37 €5.762,48 €19,24% | 34.249,95 €4.296,06 €14,34% | 33.135,69 €3.181,80 €10,62% | 35.710,12 €5.756,23 €19,22% | 25.353,47 €-4.600,42 €-15,35% | 39.695,58 €9.741,69 €32,52% |
| Pacientes con dosis de carga ABA SC (50%) | 100% | 30.449,34 € | 38.253,69 €7.804,34 €25,63% | 35.716,37 €5.267,02 €17,30% | 34.249,95 €3.800,61 €12,48% | 33.135,69 €2.686,35 €8,82% | 35.710,12 €5.260,78 €17,28% | 30.785,31 €335,96 €1,10% | 39.695,58 €9.246,24 €30,37% |
| 0% | 29.458,43 € | 38.253,69 €8.795,25 €29,86% | 35.716,37 €6.257,93 €21,24% | 34.249,95 €4,791,52 €19,59% | 33.135,69 €3.677,26 €12,48% | 35.710,12 €6.251,69 €21,22% | 30.785,31 €1.326,87 €4,50% | 39.695,58 €10.237,15 €34,75% |
ABA IV: Abatacept intravenoso; ABA SC: Abatacept subcutáneo; ADA: Adalimumab; AS: Análisis de sensibilidad; CZP: Certolizumab; ETN: Etanercept; GLM: Golimumab; IFX: Infliximab; TCZ: Tocilizumab.
Los resultados del AS probabilísticos demostraron mayor variabilidad en los FAMES de administración intravenosa: ABA IV, IFX y TCZ. ABA SC resultó la opción de menor coste en el 100% de las simulaciones frente a ADA, CZP, ETN y GLM, en un 99,9% de las simulaciones frente a ABA IV y en un 99,6% frente a TCZ. Adicionalmente se observó que ABA SC supuso ahorros en un 62,3% de las simulaciones cuando se comparó con IFX (Fig. 3). Aun considerando la incertidumbre asociada al peso de los pacientes y a los costes de administración, ABA IV, ADA, CZP, ETN, GLM, IFX y TCZ, se asociaron a mayores costes totales que ABA SC.
DiscusiónLos FAMEs considerados en este análisis (ABA SC, ABA IV, ADA, CZP, ETN, GLM, IFX y TCZ) son todos los actualmente autorizados en primera línea de terapia biológica en el tratamiento de pacientes con AR refractarios a MTX en España4 y coinciden con los evaluados por Janssen y cols.10, a excepción de ANA que, dada su baja utilización en práctica clínica española en esta indicación, no fue incluido en el presente análisis.
De acuerdo con los resultados obtenidos, el tratamiento con ABA SC se asociaría en la práctica clínica en España a menores costes totales que los tratamientos con ABA IV, ADA, CZP, ETN, GLM, IFX y TCZ, de manera que su utilización en sustitución de éstos supondría ahorros para el Sistema Sanitario a la vez que se mantendría la calidad asistencial.
Los resultados del modelo estimaron un coste mayor durante el primer año para los tratamientos con ABA SC y ABA IV que durante los años posteriores. Esto se debió a la dosis de carga y a la dosis de inducción administradas al inicio del tratamiento con ABA SC y ABA IV, respectivamente. Al contrario que para estos fármacos, el coste anual de IFX durante los años siguientes al inicial supera al coste del primer año de tratamiento. Incluso considerándose las dosis de carga asociadas al inicio del tratamiento con este fármaco, el escalado de dosis requerido a lo largo del tiempo para mantener una eficacia ade- cuada con IFX18, hace que los costes en años posteriores superen a los iniciales. IFX solo resulta una opción de menor coste que ABA SC cuando se considera que no se produce ningún escalado de dosis en el tiempo, y los pacientes mantienen la posología de mantenimiento de 3 mg/kg cada 8 semanas, lo que supone un escenario extremo considerando los resultados disponibles en la literatura que analizan extensas bases de datos de pacientes con AR, que reportan incrementos de dosis hasta en el 69,6% de los pacientes en estudios internacionales23 o el 36% en relación a pacientes de nuestro entorno24.
En los AS determinísticos los mayores ahorros se obtuvieron frente a TCZ (14.388 €, un 48% del coste asociado al tratamiento con ABA SC a los 3 años) y ABA IV (10.502 €, un 35% del coste asociado al tratamiento con ABA SC a los 3 años) en el escenario en que no se contempló la re-utilización de viales. Este escenario reflejaría la práctica clínica en centros sanitarios pequeños, donde el número de pacientes tratado es insuficiente para poder aprovechar los viales inacabados en otros pacientes.
En el presente análisis se asume una eficacia de ABA SC comparable a la de los demás FAMES biológicos en base a los resultados del análisis de comparación indirecta más reciente que incluía todas las opciones actualmente empleadas en práctica clínica en España10. Los resultados de este análisis coinciden con los obtenidos en otros estudios similares11,12,25-28 y con los ensayos clínicos que compararon ABA SC vs ABA IV y ADA8,9. En concreto el estudio AMPLE8 realizado en 646 pacientes durante 2 años demostró no inferioridad de ABA SC vs ADA tanto en variables de eficacia: proporción de pacientes que alcanzan respuesta ACR20 a los 24 meses [59,7% (IC 95%; 54,4-65,1) (ABA SC) vs 60,1% (IC 95%; 54,865,4) (ADA)] y mejora medida a través de la escala DAS28 [(-2,35 (de -2,51 hasta -2,19) (ABA SC) y -2,33 (de -2,50 hasta -2,17) (ADA)] como en variables de seguridad: tasa de acontecimientos graves [(13,8% (ABA SC) vs 16,5% (ADA)], infecciones graves [(3,8% (ABA SC) vs 5,8% (ADA)], eventos autoinmunes [(3,8% (ABA SC) vs 1,8% (ADA)], neoplasias [(2,2% (ABA SC) vs 2,1% (ADA)], y discontinuaciones debidas a acontecimientos adversos [3,8% (ABA SC) vs 9,5% (ADA)].
Este perfil de eficacia y seguridad comparable ha de interpretarse adecuadamente ya que el complejo proceso patológico de la enfermedad y la heterogeneidad de los pacientes afectados hace que la respuesta obtenida ante los tratamientos disponibles presente una elevada variabilidad entre pacientes29, por lo que disponer de medicamentos con distintos mecanismos de acción resulta necesario a fin de poder tratar a esta población.
En conocimiento de los autores, éste es el primer análisis de minimización de costes desde la perspectiva española que compara FAMEs biológicos entre sí. En el ámbito de la práctica clínica española el número de estudios farmacoeconómicos que comparan FAMEs biológicos es reducido. De los cinco estudios identificados15,30-33, dos no compararon FAMEs, sino estrategias terapéuticas de uso secuencial de tres FAMEs30,32 y los restantes consistían en un análisis coste-consecuencia31, un coste-utilidad33 y un análisis de costes15. A pesar de la dificultad a la hora de comparar los resultados de estos estudios, dos de ellos15,31 coincidieron en sus conclusiones al identificar a IFX como una opción menos costosa que ADA y que ETN, si bien cuando se consideraron las consecuencias clínicas, el tratamiento con ABA IV resultó una opción coste-efectiva frente a IFX9,31.
Entre las limitaciones de este análisis se encuentra el carácter teórico inherente a cualquier modelo de evaluación económica que, al suponer una simulación, puede no reflejar todas las situaciones existentes en la práctica clínica. En concreto, el caso base considera que los pacientes tienen un peso medio de 70 kg, afectando esta premisa a los costes de los FAMEs cuyas dosis se calculan en función del peso de paciente, con lo que la consideración de otro peso podría modificar los resultados del análisis. En consideración de esta limitación, la sensibilidad de los resultados a las modificaciones de esta variable se estudió en un AS probabilístico.
Otra limitación deriva de considerar eficacia y seguridad comparables entre las terapias evaluadas. Si bien los ensayos clínicos AMPLE8 y ACQUIRE9 y estudios mencionados anteriormente10,11,28 avalan esta premisa, otros autores sugieren la existencia de diferencias entre estos fármacos12,13,14,34. El considerar un perfil de eficacia y seguridad para ABA comparable al resto de los FAMEs se estimó como el planteamiento más correcto y conservador. No obstante, según vayan apareciendo estudios comparativos entre estos fármacos, estaría justificada la actualización de las evaluaciones económicas.
Por otro lado, el presente estudio es un análisis parcial, ya que no considera todos los posibles costes asociados, ni parámetros de calidad de vida o aspectos relacionados con las preferencias de los pacientes por una u otra vía de administración. Existe evidencia disponible35 sobre la mayor predisposición de los pacientes a recibir tratamientos de administración SC sobre otros de administración IV.
En cualquier caso, y a pesar de las limitaciones comentadas, los resultados obtenidos derivan de la adopción de asunciones conservadoras y los AS realizados confirman la robustez del modelo.
En conclusión, los resultados de este estudio sugieren que ABA SC constituye una opción terapéutica más económica que ABA IV, ADA, CZP, ETN, GLM, IFX y TCZ, a la vez que se considera comparable en términos de eficacia y seguridad en los pacientes con AR que, tras el fracaso de monoterapia con MTX, inician tratamiento con un FAME biológico.
AgradecimientosLos autores agradecen a los revisores de Farmacia Hospitalaria, los comentarios aportados durante la revisión del manuscrito.
Conflicto de interesesEste trabajo ha sido financiado por Bristol-Myers Squibb (BMS), titular de autorización de comercialización de Orencia® (abatacept). Lourdes Betegon y Cristina Canal son empleadas de BMS. Anneloes van Walsem y Kristel Janssen son empleados de MAPI Consultancy, empresa contratada por BMS para el diseño y desarrollo del modelo de minimización de costes en el que se basa el presente análisis. Itziar Oyagüez y Celia Roldán son empleadas de Pharmacoeconomics & Outcomes Research Iberia (PORIB), consultora que ha recibido remuneración de BMS para la adaptación del modelo al entorno nacional y la redacción del manuscrito de este proyecto. Rafael Ariza, reumatólogo en el Hospital Universitario Virgen Macarena ha recibido honorarios de PORIB por su asesoría en el desarrollo de este proyecto. El soporte económico del proyecto no ha interferido en su desarrollo.
Cost-minimization analysis of subcutaneous abatacept in the treatment of rheumatoid arthritis in Spain