Describir el uso de bortezomib en un hospital comarcal como alternativa en el tratamiento de gammapatías malignas.
MétodosAnálisis retrospectivo de los pacientes tratados con bortezomib en nuestro hospital desde noviembre de 2005 hasta octubre de 2007. A partir de la revisión de las historias clínicas de los pacientes se recogieron los datos correspondientes al diagnóstico, tratamientos previos a bortezomib, fecha de la última progresión de la enfermedad, número de ciclos de bortezomib, respuesta a éste, supervivencia global y libre de progresión, complicaciones y efectos secundarios.
ResultadosEl 47% de los pacientes estudiados eran varones (5/12), con una mediana de edad de 67 años (rango, 40-81 años). El diagnóstico principal fue mieloma múltiple, solo o asociado a plasmocitoma. El inicio con bortezomib coincidió con la última progressión de la enfermedad en el 83% de los pacientes (10/12). El 50% completó 7-8 ciclos con bortezomib. Se obtuvo respuesta en el 58% de los pacientes (7/12), alcanzándose criterios de respuesta parcial en el 33% (4/12) y respuesta completa en el 25% (3/12). Las reacciones adversas más frecuentes fueron neuropatía y toxicidad gastrointestinal, y supuso la suspensión del tratamiento en el 50% de los casos.
ConclusionesSegún los resultados obtenidos, bortezomib es una buena alternativa en el tratamiento de las gammapatías malignas, sobre todo en el caso de plasmocitomas.
To describe the use of bortezomib in a district hospital as an alternative in the treatment of malignant gammopathy.
MethodsA retrospective analysis was carried out on patients treated with bortezomib in our hospital between November 2005 and October 2007. The patients’ medical histories were used to obtain data regarding diagnosis, treatments prior to bortezomib, date of the last disease progression, number of bortezomib courses, response to bortezomib, overall and event free survival.
Results47% of the patients studied were male (5/12). The median age was 67, (age range between 40 and 81). The main diagnosis was multiple myeloma on its own or associated with plasmocytoma. Bortezomib initiation coincided with the last disease progression in 83% of patients (10/12). 50% of the patients completed 7-8 courses of bortezomib. Response was seen in 58% of the patients (7/12), partial response in 33% of them (4/12) and complete response in 25% (3/12). The most common adverse reactions were neuropathy and gastrointestinal toxicity which required treatment to be discontinued in 50% of cases.
ConclusionsAccording to the results obtained, bortezomib is a good alternative in the treatment of malignant gammopathy, above all in the case of plasmocytomas.
El mieloma múltiple (MM) es la segunda neoplasia hematológica más frecuente, después de los linfomas. En España la tasa de incidencia es de unos 4 casos por 100.000 habitantes y año. Actualmente, tanto la incidencia como la mortalidad de esta enfermedad están aumentando debido, quizás, a la utilización de nuevas tecnologías en el diagnóstico y al envejecimiento de la población1. Antes de utilizarse la quimioterapia, el promedio de supervivencia de la enfermedad era de unos 7 meses, pero con la introducción de ésta, el pronóstico mejoró significativamente (promedio de supervivencia de 24 a 30 meses)2. En las últimas décadas se han desarrollado nuevas estrategias terapéuticas en el tratamiento del mieloma, como el trasplante de células hematopoyéticas progenitoras, el uso de fármacos inmunomoduladores (talidomida, lenalidomida) y de inhibidores del proteasoma (bortezomib). Estos avances han permitido un mejor control de la enfermedad y supervivencia así como una mejora de la calidad de vida de los pacientes con mieloma3.
Bortezomib es un inhibidor reversible del proteasoma que ha mostrado una actividad sustancial frente a múltiples tumores, incluido el MM. Su mecanismo de acción consiste en inhibir específicamente la actividad quimotripsina del proteasoma 26 S de las células del mamífero4. Una de las consecuencias de la inhibición del proteasoma llevada a cabo por el bortezomib es la acumulación de un inhibidor del NFκB (factor nuclear kappa B). En la célula, la inhibición de este factor permite una disminución en la expresión de moléculas de adhesión y de varios factores de crecimiento, supervivencia y angiogénicos, dando lugar a un aumento en los valores de proteínas que promueven la apoptosis de las células del mieloma, entre otros mecanismos5.
La única indicación aprobada para el bortezomib, desde su comercialización el 26 de abril de 2004 hasta la actualidad, es en el tratamiento del MM en progresión, como monoterapia en pacientes que han recibido previamente al menos un tratamiento y que han sido sometidos o no son candidatos al trasplante de médula ósea4. Además de esta indicación también se utiliza en el tratamiento de plasmocitomas6, en la leucemia de células plasmáticas7 y en el tratamiento de linfomas no hodgkinianos8 tramitados como uso compasivo.
El objetivo de este trabajo fue describir la utilización de bortezomib como alternativa para el tratamiento de gammapatías malignas en términos de seguridad y eficacia en un hospital comarcal.
MÉTODOSSe realizó un estudio retrospectivo de los pacientes hematológicos a los que se les había prescrito tratamiento con bortezomib en un hospital comarcal desde noviembre de 2005 hasta octubre de 2007.
Los parámetros recogidos de las historias clínicas de los pacientes y de la base de datos de citostáticos del servicio de farmacia fueron: edad en el momento de inicio del tratamiento con bortezomib; sexo; diagnóstico y fecha; tratamientos previos; fecha de la última progresión de la enfermedad; inicio de tratamiento con bortezomib (solo o asociado); número de ciclos de bortezomib; respuesta a éste; supervivencia global y libre de progresión; complicaciones, y reacciones adversas.
Los criterios diagnósticos utilizados fueron presencia de más del 10% de células plasmáticas en médula ósea o demostración de uno o más plasmocitomas, más uno de los siguientes criterios: componente monoclonal > 30 g/l o presencia de cadenas ligeras en orina o lesiones osteolíticas no atribuibles a otra causa9.
Para poder evaluar la respuesta al tratamiento se definieron los siguientes criterios10:
- –
Respuesta completa: ausencia de inmunoglobulina monoclonal (proteína M) en suero y orina confirmada por inmunofijación, < 5% de células plasmáticas en médula ósea y sin cambios en la forma o número de las lesiones óseas.
- –
Respuesta parcial: reducción de proteína M en suero de al menos el 50% y reducción en orina de al menos el 90%, reducción de células plasmáticas en médula ósea □ 50% (en pacientes con mieloma no secretor) y sin cambios en la forma o número de las lesiones óseas.
- –
Mínima respuesta: reducción de la proteína M en suero del 25 al 49% y una reducción en orina del 50 al 89%, reducción de células plasmáticas en médula ósea del 25 al 49% (en pacientes con mieloma no secretor) y sin cambios en la forma o número de las lesiones óseas.
- –
Enfermedad estable: no se encuentran criterios de respuesta mínima ni de progresión de la enfermedad.
- –
Progresión de la enfermedad: un aumento en suero u orina de proteína M de más del 25%, un aumento en las células plasmáticas de la médula ósea de más del 25%, lesiones óseas nuevas o aumentadas o plasmocitomas.
En el caso de plasmocitomas, se consideró respuesta parcial al tratamiento si se había producido una reducción de la masa y respuesta completa en caso de fusión total del plasmocitoma.
En cuanto a las reacciones adversas o complicaciones se registraron las que, según se reflejaba en las historias clínicas de los pacientes, se consideraron relacionadas o posiblemente relacionadas con el tratamiento con bortezomib, evaluando su gravedad clínica según los Common terminology criteria for adverse events (CTCAE)11.
RESULTADOSSe estudiaron un total de 12 pacientes que habían sido tratados con bortezomib. Del total de pacientes, el 42% eran hombres (5/12) y el 58% restante, mujeres (7/12), con una mediana de edad de 67 años (rango, 40-81 años). La mayoría de los pacientes fueron diagnosticados de MM solo o asociado a plasmocitoma medular. Sólo un paciente fue diagnosticado de plasmocitoma solitario (plasmocitoma maxilar derecho) y otro paciente de leucemia de células plasmáticas. En estos 2 pacientes se utilizó bortezomib como tratamiento de primera línea solicitándolo como uso compasivo.
El diagnóstico y los tratamientos previos de los pacientes se muestran en la tabla 1.
Diagnóstico y tratamiento de los pacientes estudiados
| Paciente | Diagnóstico | Tratamiento previo |
| 1 | MM IgG κ | MP, VBCMP/VBAD (3 ciclos) |
| 2 | MM IgG κ + Pl | VBCMP/VBAD (3 ciclos), radioterapia, TCHP, D |
| 3 | MM IgG κ | MP, CVMP, talidomida |
| 4 | LCP | – |
| 5 | P solitario | – |
| 6 | MM IgA κ | MP, VAD (6 ciclos) |
| 7 | MM IgG κ | MP, ciclofosfamida, D |
| 8 | MM IgG κ + Pl | CVMP, CVMP + bifosfonato |
| 9 | MM IgA κ | VBCMP/VBAD, P + bifosfonato, 2 TCHP |
| 10 | MM IgG κ + Pl | MP, VBCMP/VBAD, TCHP, P + bifosfonatos |
| 11 | MM IgG κ | VAD |
| 12 | MM IgA k | VAD, TCHP |
CVMP: ciclofosfamida, vincristina, melfalán y prednisona; D: dexametasona; LCP: leucemia de células plasmáticas; MM: mieloma múltiple; MP: melfalán y prednisona; Pl: plasmocitoma; TCHP: trasplante de células hematopoyéticas; VAD: vincristina, doxorubicina y dexametasona; VBAD: vincristina, carmustina, doxorubicina y dexametasona; VBCMP: vincristina, carmustina, ciclofosfamida, melfalán y prednisona.
La mediana de tiempo desde el diagnóstico de la enfermedad hasta el inicio del tratamiento con bortezomib fue de 24 meses, y hubo bastante variabilidad si se evalúa a los pacientes de forma individualizada (rango, 0-18 años). Este inicio, excepto en los pacientes 4 y 5, coincidió con la última progresión de la enfermedad. Todos los pacientes iniciaron bortezomib a una dosis de 1,3 mg/m2 los días 1, 4, 8, y 11, solo o asociado a dexametasona, excepto el paciente 4 que inició bortezomib asociado a doxorrubicina y dexamentasona (BAD).
De los 12 pacientes incluidos en el estudio, sólo 6 completaron 7-8 ciclos con bortezomib, alcanzándose respuesta parcial en 3 pacientes diagnosticados de MM (pacientes 1, 3 y 7), respuesta completa en 2 con MM asociado a plasmocitoma (pacientes 2 y 8) por desaparición total del plasmocitoma y sólo 1 paciente no obtuvo respuesta tras los 8 ciclos de bortezomib (paciente 11). En este paciente se inició tratamiento quimioterápico de tercera línea con ciclofosfamida, bortezomib y dexametasona, el primer ciclo, y lenalidomida, bortezomib y dexametasona, el segundo ciclo, sin respuesta, y finalmente falleció.
De los 6 pacientes que no completaron los 7-8 ciclos de bortezomib, 4 lo interrumpieron por efectos adversos o complicaciones relacionadas con el tratamiento, 1 falleció por progresión de su mieloma (paciente 9) y el otro paciente no pudo ser evaluado por continuar todavía con el tratamiento durante el período del estudio (paciente 6). En todos los casos el tratamiento se interrumpió en el segundo ciclo de bortezomib, excepto el paciente 12, que recibió 6 ciclos alcanzándose criterios de respuesta parcial.
En global, en 8 pacientes se observaron reacciones adversas o complicaciones relacionadas con el tratamiento, las más frecuentes fueron toxicidad gastrointestinal y neuropatía. Las reacciones adversas que se observaron en los pacientes que recibieron el tratamiento completo fueron leves (grado I/II) y se resolvieron tras una reducción de la dosis a 1 mg/m2 (tabla 2).
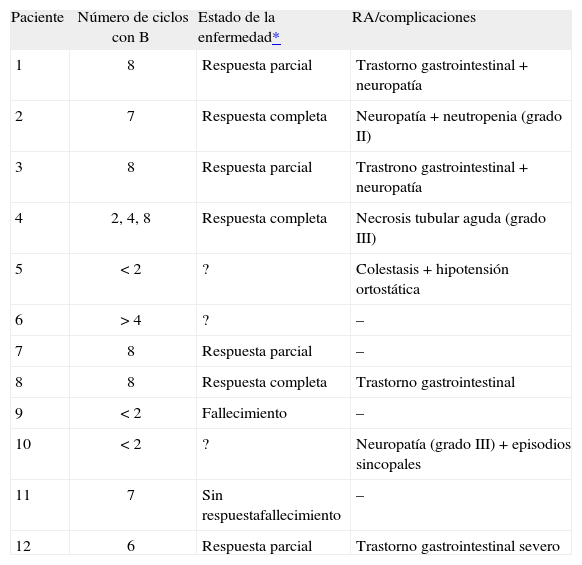
Número de ciclos de bortezomib (B), estado de la enfermedad y reacciones adversas (RA) o complicaciones
| Paciente | Número de ciclos con B | Estado de la enfermedad* | RA/complicaciones |
| 1 | 8 | Respuesta parcial | Trastorno gastrointestinal + neuropatía |
| 2 | 7 | Respuesta completa | Neuropatía + neutropenia (grado II) |
| 3 | 8 | Respuesta parcial | Trastrono gastrointestinal + neuropatía |
| 4 | 2, 4, 8 | Respuesta completa | Necrosis tubular aguda (grado III) |
| 5 | < 2 | ? | Colestasis + hipotensión ortostática |
| 6 | > 4 | ? | – |
| 7 | 8 | Respuesta parcial | – |
| 8 | 8 | Respuesta completa | Trastorno gastrointestinal |
| 9 | < 2 | Fallecimiento | – |
| 10 | < 2 | ? | Neuropatía (grado III) + episodios sincopales |
| 11 | 7 | Sin respuestafallecimiento | – |
| 12 | 6 | Respuesta parcial | Trastorno gastrointestinal severo |
?: no hay datos.
En uno de los pacientes a los que se interrumpió el tratamiento inicial con bortezomib por insuficiencia renal (paciente 4) tras 1 ciclo de vincristina, doxorubicina y dexametasona, se reinició BAD con reducción de la dosis de bortezomib (1 mg/m2) y monitorización de la función renal, con lo que se consiguió una respuesta parcial tras 4 ciclos. Posteriormente, debido a sospecha de progresión de la enfermedad, se reinició bortezomib asociado a dexametasona, alcanzándose criterios de respuesta parcial tras 8 ciclos de tratamiento. Este paciente continuó con tratamiento de mantenimiento con bortezomib cada 15 días (3 dosis) hasta que se le realizó trasplante autólogo de progenitores hematopoyéticos. En la revisión tras los 3 meses postrasplante se observó remisión completa de la enfermedad y continúa con tratamiento de mantenimiento.
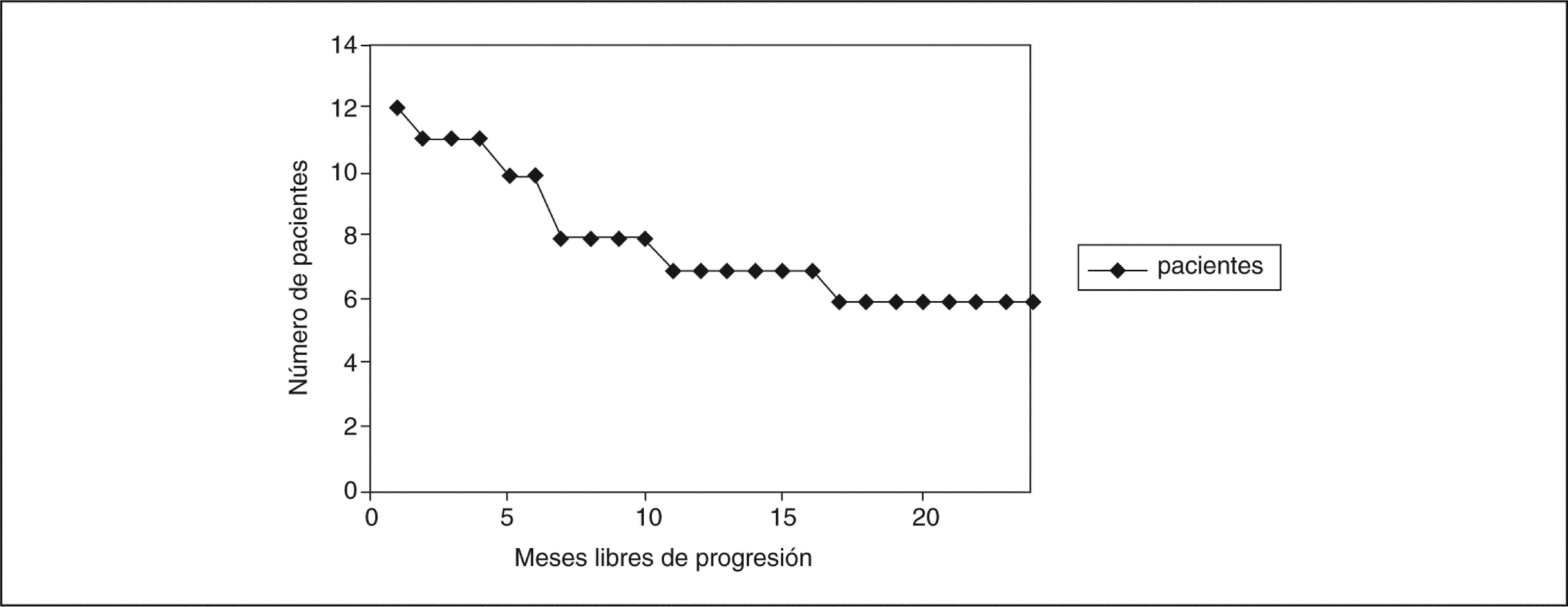
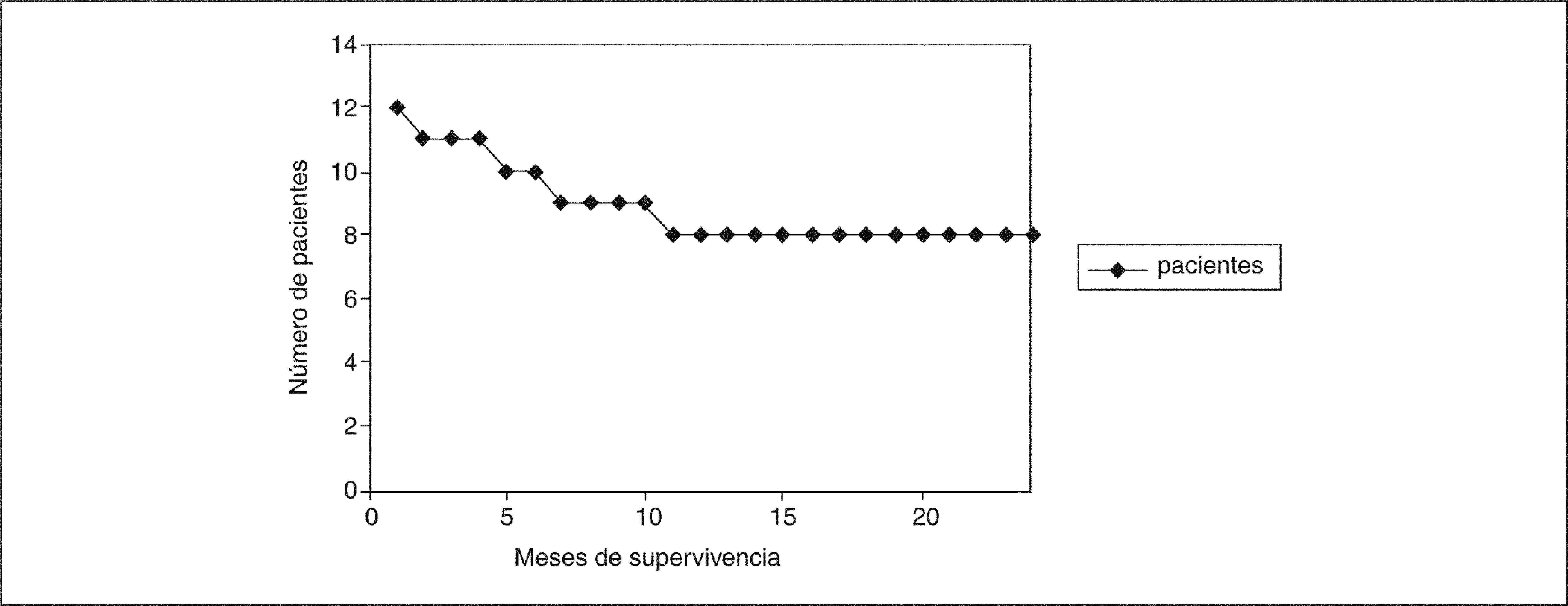
Tras el período de estudio sobrevivieron un total de 8 pacientes, de los cuales 6 se encontraban libres de progresión (figs. 1 y 2).
DISCUSIÓNBortezomib ha mostrado eficacia en el tratamiento del MM en progresión en pacientes que han recibido al menos un tratamiento previo, con un mayor grado de respuesta que dexametasona sola, según muestran los resultados obtenidos en diversos ensayos clínicos12,13. En nuestro estudio se obtuvo respuesta en el 58% de los pacientes tratados con bortezomib (7/12), de los cuales, el 25%(3/12) alcanzó criterios de respuesta completa y el 33% (4/12) de respuesta parcial, resultados superiores a los obtenidos en diversos estudios previos (grado de respuesta del 35%; respuesta parcial del 18%; respuesta cmpleta del 10%)13. Los buenos resultados obtenidos no se pueden generalizar debido al reducido número de pacientes incluidos en el estudio, a que no todos los pacientes habían sido diagnosticados de MM refractario, a las diversas pautas y combinaciones de bortezomib utilizadas, así como al número de ciclos recibidos.
A pesar de que actualmente hay más experiencia con el uso de la talidomida como tratamiento de rescate del MM, en nuestro hospital sólo se utilizó en uno de los pacientes del estudio debido a las múltiples trabas administrativas, tanto del ministerio como del propio laboratorio. Por otro lado, nuestro paciente estuvo en tratamiento con talidomida un período de 17 meses, que supuso un coste total de 47.420,8 ; en cambio, el tratamiento con bortezomib del paciente (un total de 8 ciclos) supuso un gasto de 17.920 €, ya que en cada ciclo sólo se utilizaban 2 viales de bortezomib debido a su estabilidad una vez abierto (5 días)4,14,15. Por otro lado, bortezomib ha demostrado eficacia como tratamiento de primera línea, solo o en combinación con otros agentes, como melfalán, prednisona, doxorubicina, dexametasona, lenalidomida o talidomida, tanto en los pacientes candidatos a trasplante como en los no candidatos16-20. En nuestro caso bortezomib sólo se ha utilizado como tratamiento de primera línea en 2 pacientes, uno de ellos diagnosticado de leucemia de células plasmáticas y el otro de plasmocitoma solitario.
La leucemia de células plasmáticas (primaria o secundaria a MM) se caracteriza por un curso clínico agresivo y suele ser resistente a la quimioterapia convecional21,22, por ello se ha utilizado bortezomib en algunos pacientes con este tipo de leucemia, donde ha demostrado su eficacia7,23,24. El paciente diagnosticado de leucemia de células plasmáticas en nuestro hospital obtuvo criterios de respuesta completa tras varias estrategias terapéuticas con bortezomib y trasplante autólogo de progenitores hematopoyéticos, confirmándose su eficacia en el tratamiento de esta forma leucémica agresiva del mieloma múltiple.
El tratamiento estándar del plasmocitoma, tumor único de células mielomatosas de localización ósea o extraósea, es la radioterapia o la cirugía2. En muchas ocasiones este tratamiento es dificultoso, por ello se han probado otras alternativas terapéuticas, entre ellas el bortezomib con el que se ha observado resolución de los tumores tras varios ciclos6,25-27. En nuestro estudio 2 de los pacientes con plasmocitomas óseos asociados a MM obtuvieron respuesta completa al tratamiento con bortezomib al observarse desaparición total de los plasmocitomas. Estos buenos resultados sugieren que este fármaco sea una alternativa que se debe tener en cuenta en pacientes con plasmocitoma que no responden o en los que no puede aplicarse el tratamiento estándar.
En cuanto a las reacciones adversas asociadas al tratamiento con bortezomib, las más frecuentes en nuestro estudio fueron toxicidad gastrointestinal (50%) y neuropatía (50%) que coinciden con las más frecuentes descritas en la bibliografía4,12. La toxicidad renal descrita en uno de nuestros pacientes no puede relacionarse con seguridad al tratamiento con bortezomib, ya que en esta paciente se dieron otras circunstancias concomitantes (tratamiento con antibióticos aminoglucósidos, cuadro infeccioso e hipovolemia) que también pueden inducir fallo renal. De hecho, hay algunos casos descritos de pacientes con insuficiencia renal que han tolerado la dosis completa del fármaco obteniendo respuesta de la enfermedad e incluso mejoría del fallo renal28, por ello se decidió continuar la terapia con bortezomib en este paciente. En algunos estudios la neuropatía ha mostrado ser más frecuente si los pacientes con gammapatía maligna presentaban neuropatía de base o diabetes mellitus29; en nuestro caso la neuropatía surgió con el tratamiento y no se recogieron datos sobre si los pacientes presentaban diabetes mellitus. Tras la aparición de toxicidad con el tratamiento se realizaron los ajustes posológicos recomendados4. Algunos pacientes no volvieron a iniciar el tratamiento, bien debido a una toxicidad grados III-IV o por solicitud expresa del paciente.
En conclusión, bortezomib ha mostrado buenos resultados en el tratamiento de gammapatías malignas; en nuestro caso, sobre todo, en el tratamiento de plasmocitomas y de leucemia de células plasmáticas. El uso de nuevos agentes, como el bortezomib, en el tratamiento de estas neoplasias mejora la respuesta y la supervivencia de los pacientes, pero aún se necesitan más estudios y un mejor conocimiento de la biología de estas enfermedades.