La púrpura trombocitopénica trombótica adquirida o autoinmune (PTTa) presenta autoanticuerpos dirigidos contra ADAMTS13. El déficit de esta metaloproteasa impide la escisión de los multímeros del factor de von Willebrand (FvW) incrementando la adhesión plaquetaria y, por consiguiente, la microtrombosis1,2. Se manifiesta con sangrado, anemia hemolítica, esquistocitosis, isquemia tisular, manifestaciones neurológicas, trombocitopenia por consumo y elevación de la lactato deshidrogenasa (LDH). Para su diagnóstico es necesario confirmar una actividad de ADAMTS13 inferior al 10%3.
El tratamiento estándar (TE) en un episodio agudo de PTTa es la plasmaféresis, junto con corticoides y rituximab1. Aproximadamente el 20% de los episodios agudos no responden al TE, lo que se define como PTTa refractaria4. En estas situaciones, caplacizumab se encuentra financiado en España5. Caplacizumab es un nanoanticuerpo humanizado bivalente que actúa sobre el dominio A1 del FvW, inhibiendo su interacción con el complejo glicoproteico Ib-V-IX de las plaquetas y previniendo la trombosis.
Este caso clínico destaca el manejo efectivo de una PTTa grave y refractaria en una paciente joven, demostrando la utilidad de caplacizumab en la práctica clínica real con seguimiento de año y medio tras el tratamiento, resaltando además el valor del enfoque multidisciplinario.
Caso clínicoUna mujer de 24 años con síndrome de Sudeck, en tratamiento habitual con parches transdérmicos de norelgestromina/etinilestradiol. Acudió a urgencias en junio de 2023 con malestar general de 3 semanas de evolución: aumento de deposiciones sin productos patológicos, dolor abdominal, cefalea moderada, astenia, fiebre de 38 °C, petequias en las extremidades y el rostro y hematomas en ambos tobillos. Constantes vitales conservadas, el resto de la exploración fue anodina.
En la analítica: hemoglobina 5,1 g/dl, reticulocitos 6,58%, LDH 1.040 U/l, 27.000 plaquetas/μl, esquistocitos 15%, dímero D de 7.181 ng/ml y perfil de coagulación normal.
Ingresó en la unidad de cuidados intensivos (UCI) para seguimiento con hematología y farmacia con juicio clínico de microangiopatía trombótica y alta sospecha de PTTa. Se envió muestra para medir actividad de ADAMTS13, iniciándose plasmaféresis diaria de una volemia y metilprednisolona 1 mg/kg/día. Además de 2 concentrados de hematíes.
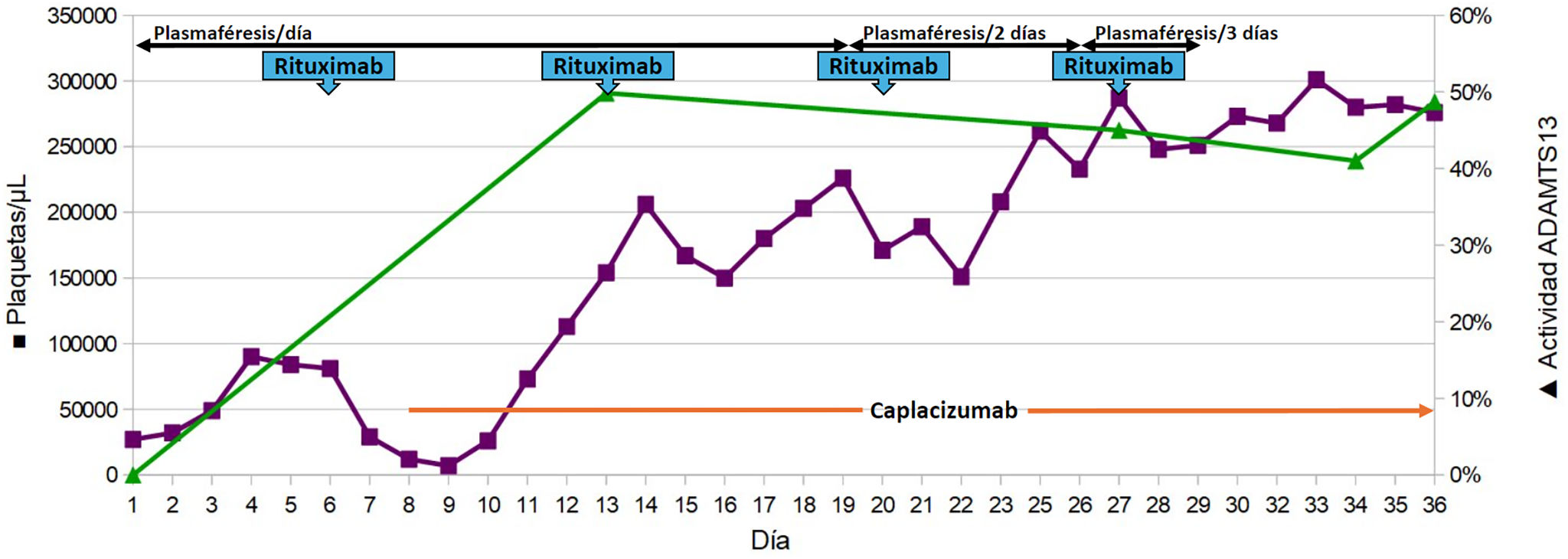
Durante el ingreso, el número de plaquetas aumentó progresivamente, iniciando rituximab 570 mg/semana (375 mg/m2/semana durante 4 semanas) el día 6. En días posteriores se produjo una disminución de las plaquetas que coincidió con la aparición de sintomatología hemorrágica (gingivorragia, metrorragia) y neurológica (cefalea intensa, diplopía). El día 7 se informó el resultado de la actividad de ADAMTS13 al ingreso (0,00%) que confirmó el diagnóstico de PTTa. Tras consultar la evidencia disponible, farmacia y hematología decidieron iniciar caplacizumab, administrándose una primera dosis intravenosa de 10 mg antes del recambio plasmático, seguido de una administración diaria subcutánea de 10 mg.
Tras el inicio de caplacizumab, los parámetros analíticos y clínicos mejoraron notablemente, y la actividad de ADAMTS13 alcanzó un 49,85% el día 13. La serología confirmó un título elevado de anticuerpos anti-ADAMTS13.
El día 23, la paciente se trasladó de la UCI a medicina interna, finalizando los recambios plasmáticos y el tratamiento con rituximab el día 29, siendo dada de alta definitiva el día 38. La reducción progresiva de corticoides comienza el día 30 y finaliza el día 71. El manejo del tratamiento, el recuento de plaquetas y la actividad de ADAMTS13 durante el ingreso se ilustra en la figura 1.
Desde el servicio de farmacia hospitalaria se realizó la validación rutinaria y el seguimiento conjunto del paciente para observar efectividad y seguridad de caplacizumab, así como la participación en la validación de otros tratamientos (plasmaféresis y corticoides). Al alta, se realizó el seguimiento y adiestramiento de la familia para la administración adecuada del tratamiento.
Por parte de hematología se realizó una revisión semanal y, tras la mejoría, mensual. La dispensación se llevó a cabo por el servicio de farmacia hospitalaria hasta el día 59 desde el ingreso (30 días desde la finalización de la plasmaféresis). Durante dicho seguimiento, la evolución clínica y analítica fue favorable.
El recuento de plaquetas alcanzó 290.000 plaquetas/μl con actividad de ADAMTS13 de 61,16% al mes de finalizar caplacizumab. A los 6 meses se realizó la última medida de la actividad de ADAMTS13: 77,00%. Durante año y medio tras el fin del tratamiento con caplacizumab, la paciente presentó cefaleas migrañosas, pero ningún evento tromboembólico ni hemorrágico. El último recuento plaquetario de noviembre de 2024 fue de 198.000 plaquetas/μl. Actualmente, se realizan pruebas para descartar síndrome de Sjögren y conectivopatía por xerostomía y anticuerpos antinucleares (ANA) positivos.
DiscusiónLa eficacia de caplacizumab se evidenció en los ensayos clínicos (EC) TITAN (fase II) y HERCULES (fase III), donde se comparó caplacizumab frente a placebo con intercambio plasmático (IT) e inmunosupresión4. En una revisión sistemática y metaanálisis posterior, donde se tuvieron en cuenta ambos EC y 3 estudios observacionales, se consolidó que caplacizumab disminuye significativamente el riesgo de exacerbación, recaída, tiempo de recuperación plaquetaria, duración de plasmaféresis y tiempo de hospitalización, con un mayor riesgo significativo de sangrado: todo ello frente a placebo. Sin embargo, no se ha demostrado diferencias en la mortalidad1.
En el caso clínico descrito, caplacizumab se utilizó como rescate en un inicio de PTTa grave y refractario al TE. La paciente mejoró significativamente en menos de 4 días el recuento de plaquetas desde el inicio del fármaco, así como la sintomatología clínica, marcadores de daño orgánico, valores analíticos de hemólisis y actividad de ADAMTS13. El manejo y evolución concuerda con el de pacientes de otros casos clínicos y estudios similares, aunque de mayor edad1,6,7, reforzando el adecuado uso del fármaco y consolidando su eficacia más allá de los EC, subrayando su utilidad en el manejo de esta condición crítica.
Cabe destacar que un año y medio posterior a la finalización de caplacizumab la paciente no ha presentado ninguna complicación tromboembólica, reforzando el papel en la prevención de recaídas. No se ha encontrado ningún caso clínico que describa un tiempo de seguimiento tan prolongado en un paciente joven.
Este caso aporta evidencia adicional sobre seguridad y efectividad de caplacizumab en escenarios de alta complejidad clínica y manejo adecuado del paciente crítico joven con tiempo de seguimiento prolongado, que sumado al elevado coste del tratamiento se requiere toda la evidencia disponible, siendo el presente manuscrito un posible ejemplo para un mejor manejo en escenarios similares.
Consentimiento informadoLos autores declaran que se dispone del consentimiento informado del paciente.
FinanciaciónLos autores declaran no haber recibido financiación para este trabajo.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Presentación en CongresosSe aportó un informe preliminar de este caso clínico en el 69° congreso Nacional de la Sociedad Española de Farmacia Hospitalaria (SEFH) el 17–19 de octubre de 2024.
Responsabilidad y cesión de derechosTodos los autores aceptamos la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (disponible en http://www.icmje.org/).
Los autores cedemos, en el supuesto de publicación, de forma exclusiva los derechos de reproducción, distribución, traducción y comunicación pública (por cualquier medio o soporte sonoro, audiovisual o electrónico) de nuestro trabajo a Farmacia Hospitalaria y por extensión a la SEFH. Para ello se firmará una carta de cesión de derechos en el momento del envío del trabajo a través del sistema online de gestión de manuscritos.
Declaración de contribución de autoría CRediTYeray Reyes-de-la-Mata: Writing – review & editing, Writing – original draft, Visualization, Supervision, Software, Resources, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. Gala Cano-Martínez: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Methodology, Investigation, Data curation, Conceptualization. Francisco Javier Salmerón-Navas: Writing – original draft, Validation, Supervision, Methodology, Investigation, Data curation, Conceptualization. Carmen María Domínguez-Santana: Writing – review & editing, Visualization, Validation, Project administration, Methodology, Conceptualization. Silvia Fenix-Caballero: Writing – review & editing, Visualization, Validation, Supervision, Project administration, Methodology, Investigation.