Cuantificar el uso de comparaciones indirectas (CI) en los informes de evaluación de medicamentos publicados en internet por el Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de Medicamentos (GENESIS).
MétodoEstudio retrospectivo de los informes redactados en 2008-2009. Registro de la existencia de comparadores y características de los estudios comparativos directos e indirectos incluidos.
ResultadosEn el 95% de los 337 informes analizados existe un comparador activo, en el 50% hay un estudio frente a éste. En 114 informes (34%), se referencia una CI, el 69% elaborada por el autor del informe. La mayoría fueron CI narrativas, ninguna ajustada. En los casos sin CI podría haberse realizado en el 16% y era dudoso en el 24%.
ConclusionesMuchos medicamentos tienen comparador pero no estudios directos frente a éste, las CI deberían incorporarse en los informes en mayor medida y con criterios de calidad.
Quantify use of indirect comparisons (IC) in drug evaluation reports published on the GENESIS Group web page for new drug assessment, standardisation, and drug selection research.
MethodRetrospective study of drug reports written between 2008 and 2009. Data collected: presence of an active comparator and details from any direct and indirect comparative studies included.
ResultsAn active comparator was present in 95% of the 337 analysed reports; 50% included a direct comparative study vs comparator. In 114 reports (34%), an IC was used; 69% of the ICs were made by the report author. Most ICs were narrative and none were adjusted. An IC could have been made in an additional 16% of the cases and possibly in 24% more.
ConclusionsMost evaluated drugs have an active comparator but studies comparing them directly are not as common. ICs could be included in more reports along with quality control criteria.
En el proceso de selección de nuevos medicamentos, para la toma de decisiones por las comisiones de farmacia y terapéutica en los hospitales, se redactan informes en los que se analizan la eficacia, seguridad y evaluación económica.
Para posicionar el nuevo medicamento en un esquema terapéutico, se debe evaluar respecto a la mejor opción disponible hasta el momento. Pero la disponibilidad de estudios comparativos directos con el medicamento de referencia es muchas veces limitada. Con frecuencia, los ensayos clínicos de registro se basan en la realización de comparaciones respecto a placebo. En otras, el comparador no es el adecuado al no coincidir el grupo control con el tratamiento de referencia. En un reciente estudio realizado en nuestro ámbito1 se revisaron 51 fármacos e indicaciones evaluados en Andalucía entre 2005 y 2007 y en el 59% de los casos el nuevo medicamento no se comparaba con la mejor alternativa terapéutica.
Cuando no se dispone de estudios comparativos directos, pero sí existen estudios del medicamento estudiado y del de referencia frente a un tercer comparador común, es posible, realizar comparaciones indirectas (CI), de las que existen diferentes tipos definidos en los artículos de metodología publicados2–5.
El objetivo de este trabajo es cuantificar el uso y describir las características de las CI en los informes de evaluación de medicamentos publicados en la página web del Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de Medicamentos (GENESIS) de la Sociedad Española de Farmacia Hospitalaria (SEFH), que mantiene un repositorio de informes de un notable número de hospitales españoles6,7. El propósito es obtener información con el fin de incluir los procedimientos de las CI en la metodología GENESIS para la evaluación de nuevos medicamentos.
MétodosSe realizó un estudio descriptivo, observacional, retrospectivo de los informes de evaluación publicados en la web de GENESIS redactados durante los años 2008-2009. Se tabularon los informes y los medicamentos a los que se referían ya que podían existir varios informes para un mismo medicamento. De cada uno de los informes se recogieron los siguientes parámetros: a) existencia o no de un comparador activo; b) existencia o no de estudios comparativos con el comparador de referencia, con placebo o con otro tratamiento no de referencia; y c) consideración o no de una CI y si se podía haber considerado. En los informes en que se consideraron CI se recogió la fuente (si se obtenía de una CI publicada o de otra fuente que hiciera alusión a la misma, o si había sido elaborada por parte del autor del informe), el tipo (si se evaluaba la eficacia, la seguridad o ambos), la metodología empleada (no ajustada, ajustada o network metanálisis), el origen de los datos para la CI (2 ensayos clínicos o más de 2, metanálisis, estudios observacionales, otros), la forma en que se presentaban los resultados (narrativa, clínica, o estadística) y en el caso de resultados estadísticos, si estos se daban en valores absolutos o relativos, con o sin intervalos de confianza. Finalmente, cual fue la conclusión de la CI y si en la conclusión final del informe se tuvo en consideración la CI.
Toda la información se recogió de los propios informes sin recurrir a otras fuentes, existiendo siempre la posibilidad de hacer constar que no existía información suficiente en el informe. La recogida de datos la realizaron 5 investigadores con la ayuda de un cuestionario y con entrenamiento previo en el uso del mismo.
Se excluyeron los informes que eran exactamente iguales a otros informes, aquellos a los que no se pudo acceder al documento o los que eran un anexo a otro informe. Se analizaron de modo separado 2 medicamentos o 2 indicaciones de un mismo medicamento que estuvieran evaluados en un mismo informe.
ResultadosSe analizaron 319 informes correspondientes a 136 medicamentos diferentes y 185 medicamentos-indicación diferentes. De 67 medicamentos había más de un informe y de 3 medicamentos 10 o más informes. Los informes fueron elaborados por 25 hospitales, más la Sociedad Andaluza de Farmacia Hospitalaria y el grupo GENESIS. Debido a que en algún informe se evaluaban varios medicamentos o indicaciones diferentes se desdoblaron algunos informes resultando el total estudiado de 337.
En el 95% de los informes existe un comparador activo del medicamento evaluado, sin embargo solo en el 50% hay un estudio comparativo directo frente al comparador de referencia (tabla 1).
Disponibilidad de ensayos clínicos comparativos del medicamento estudiado en los informes incluidos en el estudio
| Disponibilidad de estudios comparativos del medicamento evaluado en el informe | Número de informes | Porcentaje |
| Frente al tratamiento de referencia para la indicación estudiada | 169 | 50,1 |
| Frente a placebo | 95 | 28,2 |
| Frente a otro tratamiento diferente al tratamiento de referencia | 47 | 13,9 |
| No hay estudios comparativos | 15 | 4,4 |
| Frente a «no tratamiento» | 11 | 3,3 |
| Total | 337 | 100 |
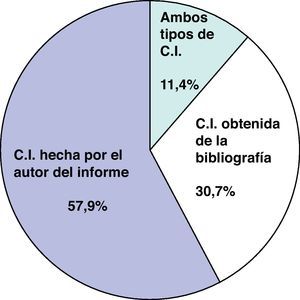
En 114 informes, el 34%, se hace referencia implícita o explícitamente a una CI, que puede ser publicada o realizada por el propio autor (fig. 1). Las CI publicadas correspondían a opiniones de expertos, guías de práctica clínica y revisiones, y solo en 4 ocasiones, en los informes de darunavir y levetiracetam, había un estudio específico de CI y los 2 que se pudieron evaluar eran CI no ajustadas.
En los 79 casos en los que el autor del informe elaboró una CI esta fue informal. Algunas se presentaban solo de modo narrativo y en otras se presentaban los resultados de cada fármaco a comparar por separado y se valoraba la relevancia clínica de la diferencia. Salvo en 2 ocasiones, con dabigatrán y romiplostín, se hizo una CI formal aunque no ajustada.
En los informes en los que no se realizó una CI, se consideró que se podía haber hecho en el 16% de los casos, en el 24% era dudoso o no se sabía con los datos del informe y en el 60% el revisor consideró que no se podía haber hecho.
Cuando hubo CI, se concluyó en superioridad del nuevo medicamento en el 21% de los casos y en equivalencia en el 75%. En los informes con una CI realizada, los resultados de la misma se consideraron en la propuesta final en el 45% de los informes, esta consideración fue dudosa en el 34% y no se consideró en el 19%.
DiscusiónEl primer hallazgo de este trabajo muestra como de la mayoría de los medicamentos que se evalúan en los hospitales para ser introducidos en el formulario, existe un comparador activo, generalmente la alternativa que se está utilizando en la práctica clínica, aunque en muchas ocasiones no existe un ensayo clínico comparativo frente a éste. Posiblemente esto es debido a que la legislación actualmente no exige demostrar el valor añadido de un medicamento respecto a las alternativas para poder ser comercializado y basta con que demuestre que es seguro, eficaz, de calidad y con una relación de beneficio-riesgo favorable8.
Nuestro trabajo muestra que en el 45% de los informes de medicamentos evaluados, existiendo comparador de referencia, no se dispone de comparaciones directas con éste. En el 34% del total de informes, se hacía referencia a una CI. Y en los casos en que no se ha realizado una CI, se estima que se podría haber hecho en un 16% y, posiblemente, en otro 24%. Ello indica que el empleo de las CI en los informes de evaluación de los hospitales españoles podría ser mayor.
Los informes que citan CI publicadas, se refieren sobre todo a revisiones, guías de práctica clínica u opiniones de expertos. Ello puede ser un reflejo de la escasez de estudios formales publicados de CI en el momento de redactar el informe de un nuevo medicamento. En el diseño de este estudio no estaba previsto investigar si no existen, no se buscan, o por el contrario las que hay son de escasa calidad o no se referencian en el informe. Sin embargo, parece necesario incluir en la metodología GENESIS una sistemática para la búsqueda bibliográfica de estudios de CI.
En los informes en que consta la realización de CI del propio autor, cabe señalar la ausencia de CI ajustadas según alguna de las metodologías reconocidas. El motivo puede deberse a muchos factores como falta de tiempo, falta de conocimiento, falta de costumbre, etc.
La principal limitación de este trabajo radica en que no es un análisis de una muestra representativa de los informes elaborados para las comisiones de farmacia hospitalarias españolas, sino solo de aquellos que aparecen en la web de GENESIS. Sin embargo, esta web es la única fuente de informes con esta finalidad existente en nuestro país y en ella están representados más de 30 hospitales, probablemente los más dinámicos en esta actividad. Otra limitación podría ser la subjetividad de los 5 evaluadores, aunque eran expertos en selección de medicamentos que previamente habían evaluado una muestra de informes y consensuado criterios. Igualmente podría ser una limitación el hecho de que la información se obtuviera del informe publicado sin búsquedas bibliográficas adicionales.
Las CI publicadas deberían incorporarse en mayor medida y con criterios de calidad en los informes. En el caso de que no hubiera CI publicadas, pero se pudieran realizar, el autor del informe debería utilizar una metodología adecuada. La incorporación de recomendaciones específicas para la búsqueda y realización de CI en los procedimientos para redacción de informes de GENESIS puede contribuir a integrar las CI a la evaluación y posicionamiento de los nuevos medicamentos.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Un resumen de este trabajo ha sido presentado en el 55 Congreso de la Sociedad Española de Farmacia Hospitalaria, Madrid, octubre de 2010. Este trabajo es parte de un proyecto de investigación «Comparaciones indirectas y su aplicación en los informes de evaluación de nuevos medicamentos» premiado por la Fundación Española de Farmacia Hospitalaria como mejor proyecto de investigación en 2009.