El voriconazol es un antifúngico utilizado en el tratamiento de infecciones fúngicas severas, incluyendo aspergilosis invasiva. Su monitorización farmacocinética está justificada por presentar una alta variabilidad inter- e intraindividual, un elevado riesgo de interacciones, una farmacocinética no lineal y por la presencia de polimorfismos genéticos1.
El voriconazol es metabolizado en el hígado, principalmente por la isoenzima CYP2C19, dando lugar a un metabolito inactivo, el N-óxido2. La determinación de la concentración mínima (Cmin) de N-óxido y el cálculo de la relación metabólica (RM) proporciona información útil acerca de su metabolización3. La RM es el cociente entre la Cmin de N-óxido y la Cmin de voriconazol.
Una RM y Cmin N-óxido elevadas serían atribuibles a pacientes con fenotipo metabolizador rápido, mientras que una RM y Cmin N-óxido disminuidas serían propias de metabolizadores lentos, descartando de este modo la influencia de otros factores como interacciones farmacológicas o disfunción hepática4.
El objetivo es describir el caso de un paciente con aspergilosis invasiva tratado con voriconazol, donde la medición de la Cmin N-óxido y la determinación de la RM fue crucial para identificar el fenotipo metabólico y guiar los ajustes de dosis.
Descripción del casoUn varón de 68 años ingresó en la unidad de cuidados intensivos (UCI) de un hospital terciario por shock séptico con fracaso multiorgánico secundario a infección respiratoria. Durante su estancia, su situación clínica derivó en alteraciones fisiopatológicas tales como inestabilidad hemodinámica, deterioro de la función renal y hepática, hipoglucemia y alteraciones neurológicas con polineuromiopatía severa.
Ante la presencia de fiebre, aumento de reactantes de fase aguda y deterioro respiratorio con broncoespasmo severo, se solicitó cultivo microbiológico de broncoaspirado (BAS) y lavado broncoalveolar (BAL), así como determinación de marcadores fúngicos en muestras respiratorias y suero.
Tras el aislamiento de Aspergillus sp. por crecimiento en cultivo de BAS y BAL, y galactomanano positivo en suero, se inició tratamiento con isavuconazol intravenoso a la dosis estándar ante la sospecha de aspergilosis invasiva.
Las pruebas de tomografía computarizada confirmaron afectación pulmonar y cerebral, por lo que, a los 10 días se decidió modificar el tratamiento a voriconazol por su mayor evidencia en aspergilosis invasiva5 y su alta lipofilia, que garantiza la penetrancia a tejido cerebral6. Se inició voriconazol intravenoso con una dosis de carga de 420 mg/12 h (6 mg/kg), seguido de un mantenimiento de 280 mg/12 h (4 mg/kg)7.
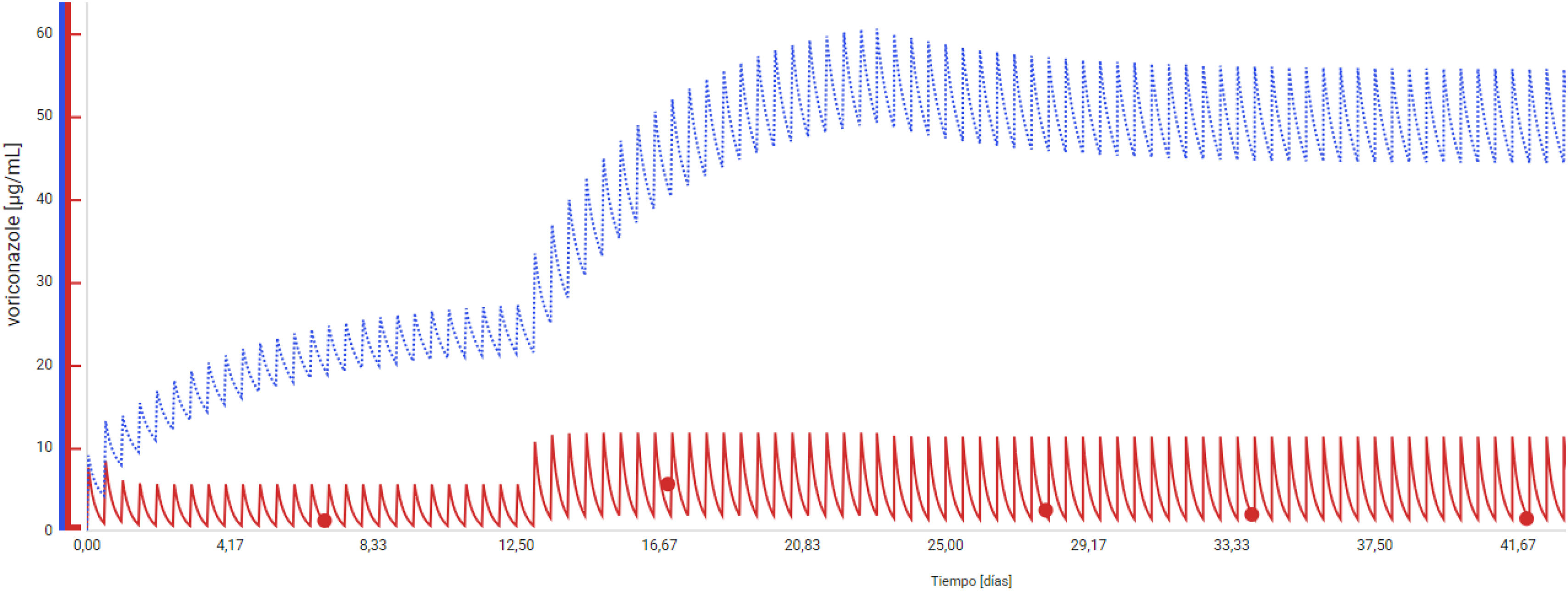
Desde el servicio de farmacia se llevó a cabo la monitorización farmacocinética de voriconazol mediante el programa MwPharm®, basado en ajuste bayesiano, estableciendo un intervalo objetivo entre 2–5,5 μg/ml para el tratamiento3,7. Las muestras fueron enviadas al Centro Nacional de Microbiología. La determinación de la Cmin de voriconazol y de N-óxido fue realizada por cromatografía líquida.
A los 7 días del inicio de voriconazol se obtuvo la primera determinación, una Cmin voriconazol = 1,20 μg/ml, Cmin N-óxido = 2,17 μg/ml y RM = 1,80. Puesto que la determinación de perfiles genéticos no era una técnica rutinaria en nuestro centro, y ante la urgencia de la situación, se optó por utilizar la RM como indicador del fenotipo metabólico del paciente.
Según el algoritmo terapéutico consultado3, cuando la Cmin de voriconazol se encuentra entre 1–2 μg/ml y la RM es mayor a 1,15 el paciente es considerado metabolizador rápido y se debe incrementar la dosis un 33–50%. Con base en esta recomendación, se decidió aumentar la dosis a 560 mg/12 h (8 mg/kg).
Diez días después se realizó una nueva determinación en la que se obtuvo una Cmin voriconazol = 5,60 μg/ml, Cmin N-óxido = 3,57 μg/ml y RM = 0,63. Esta variabilidad farmacocinética puede explicarse por la farmacocinética no lineal de voriconazol, sumado a las alteraciones fisiopatológicas causadas por la situación crítica del paciente8. Por ello, se recomendó una discreta disminución de la dosis a 490 mg/12 h (7 mg/kg), teniendo en cuenta el fenotipo metabolizador rápido. La figura 1 y la tabla 1 muestran cómo las siguientes determinaciones semanales se encontraban en rango terapéutico.
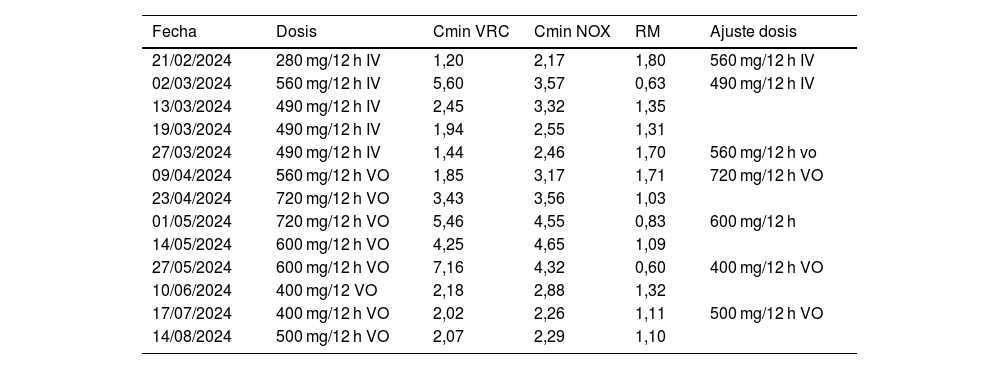
Evolución cronológica de los cambios de dosis, concentraciones plasmáticas de voriconazol (μg/ml) y N-óxido (μg/ml)
| Fecha | Dosis | Cmin VRC | Cmin NOX | RM | Ajuste dosis |
|---|---|---|---|---|---|
| 21/02/2024 | 280 mg/12 h IV | 1,20 | 2,17 | 1,80 | 560 mg/12 h IV |
| 02/03/2024 | 560 mg/12 h IV | 5,60 | 3,57 | 0,63 | 490 mg/12 h IV |
| 13/03/2024 | 490 mg/12 h IV | 2,45 | 3,32 | 1,35 | |
| 19/03/2024 | 490 mg/12 h IV | 1,94 | 2,55 | 1,31 | |
| 27/03/2024 | 490 mg/12 h IV | 1,44 | 2,46 | 1,70 | 560 mg/12 h vo |
| 09/04/2024 | 560 mg/12 h VO | 1,85 | 3,17 | 1,71 | 720 mg/12 h VO |
| 23/04/2024 | 720 mg/12 h VO | 3,43 | 3,56 | 1,03 | |
| 01/05/2024 | 720 mg/12 h VO | 5,46 | 4,55 | 0,83 | 600 mg/12 h |
| 14/05/2024 | 600 mg/12 h VO | 4,25 | 4,65 | 1,09 | |
| 27/05/2024 | 600 mg/12 h VO | 7,16 | 4,32 | 0,60 | 400 mg/12 h VO |
| 10/06/2024 | 400 mg/12 VO | 2,18 | 2,88 | 1,32 | |
| 17/07/2024 | 400 mg/12 h VO | 2,02 | 2,26 | 1,11 | 500 mg/12 h VO |
| 14/08/2024 | 500 mg/12 h VO | 2,07 | 2,29 | 1,10 |
IV: vía intravenosa; NOX: N-óxido; RM: relación metabólica; VO: vía oral; VRC: voriconazol.
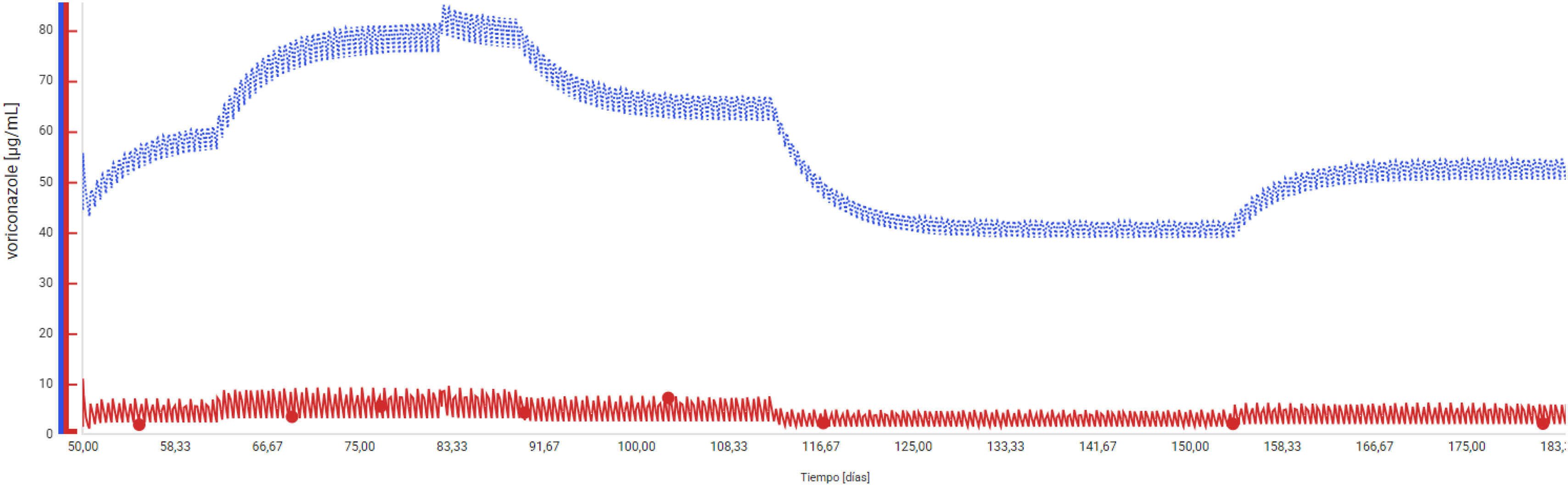
Seis semanas después, por mejoría del paciente, se pasó a vía oral. Puesto que la biodisponibilidad de voriconazol por esta vía es del 96%, se aumentó la dosis a 560 mg/12 h (8 mg/kg). Tras 113 días de ingreso en UCI, se trasladó a la planta de hospitalización por estabilidad hemodinámica, mejoría neurológica y respiratoria. Quince días después, fue dado de alta a un hospital de cuidados intermedios con seguimiento por la unidad de enfermedades infecciosas del hospital de referencia.
Se continuaron realizando determinaciones de voriconazol, N-óxido y ajustes de dosis guiados por el algoritmo terapéutico consultado y los resultados del programa farmacocinético, inicialmente cada 15 días y posteriormente de manera mensual (fig. 2, tabla 1). El paciente estuvo en tratamiento con voriconazol un total de 208 días.
Dada la mejoría radiológica de las lesiones pulmonares y cerebrales, los cultivos negativos de BAS, mejor perfil farmacocinético y menor toxicidad asociada, se decidió modificar el tratamiento a isavuconazol, el cual se mantuvo hasta completar 238 días.
DiscusiónLa medición de la Cmin N-óxido y la determinación de la RM son parámetros de interés para la monitorización farmacocinética de voriconazol. Su determinación es reflejo de la capacidad metabólica del fármaco en un momento dado, y podría ayudar a anticipar y guiar los ajustes de dosis, en particular en situaciones clínicas complejas.
Boglione-Kerrien et al. diseñaron un algoritmo terapéutico basado en la RM, teniendo en cuenta los resultados de su modelo multivariante, para mejorar la monitorización farmacocinética de voriconazol y la calidad del ajuste de dosis. Muestran cómo la RM puede ser una herramienta adicional para comprender la variabilidad del fármaco3.
Se ha descrito ampliamente la variabilidad significativa de voriconazol. Encalada et al. describen una variabilidad interindividual del 75,6% y una variabilidad intraindividual del 40,1% en las Cmin, lo que explica las variaciones de concentraciones obtenidas en nuestro paciente9.
De este caso se puede concluir que la identificación del fenotipo metabólico mediante el algoritmo basado en la RM resulta útil para la optimización del tratamiento con voriconazol en pacientes en quienes se sospeche de un metabolismo alterado, siendo una herramienta complementaria a la genotipificación de CYP2C19. De hecho, a día de hoy, forma parte de nuestra práctica habitual.
Responsabilidades éticasLos autores declaran que para la publicación de este caso se obtuvo el consentimiento informado del paciente.
FinanciaciónLos autores declaran no haber recibido financiación para elaborar este artículo.
Declaración de autoríaLos autores del trabajo que remiten el envío a la revista Farmacia Hospitalaria aseguran que todos han participado de forma sustancial en la elaboración, corrección y aprobación de la versión final del presente manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración de contribución de autoría CRediTIrene Orozco Cifuentes: Writing – review & editing, Writing – original draft. Adrián Domínguez García: Writing – review & editing. María Jiménez Meseguer: Writing – review & editing. Elena García Benayas: Writing – review & editing. Benito García Díaz: Writing – review & editing.