Desarrollar y validar un modelo predictivo para la detección de problemas relacionados con los medicamentos (PRM) en pacientes con tratamiento antirretroviral (TAR), durante su seguimiento periódico en consultas de atención farmacéutica (AF) y previamente a la dispensación.
MétodoEstudio multicéntrico, abierto, prospectivo. Se incluyeron pacientes infectados por el VIH con y sin PRM. Para el diseño del modelo se incluyeron variables demográficas, clínicas y farmacoterapéuticas (relacionadas o no con el TAR).
Para encontrar factores pronósticos de PRM, se realizó un modelo de regresión logística binaria tras un análisis univariante, el cual identificó variables independientes relacionadas con PRM que fueron introducidas en el modelo multivariante para la selección final. La validez del modelo se determinó por el método Shrinkage y la capacidad discriminatoria por el estadístico C-Harrell.
ResultadosSe incluyeron 733 pacientes. Las variables «adherencia», «prescripción de fármacos con necesidad de ajuste posológico» y «número de medicamentos totales prescritos (al margen del TAR)» se relacionaban de manera independiente con la aparición de PRM. Las probabilidades predichas por el modelo, personalizando los coeficientes por el método shrinkage uniforme mostraron un valor R2=0,962 para la muestra de construcción y R2=0,872 para la de validación. La capacidad discriminatoria del modelo fue de 0,816 para la muestra de construcción y 0,779 para la de validación.
ConclusionesEl modelo predictivo desarrollado y validado permite la detección de pacientes con tratamiento antirretroviral y con mayor riesgo de sufrir un PRM. Las variables predictoras utilizadas se corresponden con las manejadas habitualmente en la historia farmacoterapéutica del paciente, permitiendo su empleo sistemático en la práctica asistencial.
To develop and validate a prediction model for the detection of drug-related problems (DRP) in patients on antiretroviral treatment during their regular monitoring in Pharmaceutical Care Clinics before dispensing drugs.
MehodOpen multicentre prospective study. HIV patients with and without DRP were included. Demographic, clinical and pharmacotherapy variables (related and unrelated to antiretroviral treatment) were included in the model design.
To find prognostic factors for DRP, a binary logistic regression model was created after performing a univariate analysis that identified independent variables related to DRP these variables were introduced in the multivariate model for the final selection. Model validity was determined by the shrinkage method and the discriminatory power by Harrell's C-index.
Results733 patients were included. The variables “adherence”, “prescription of drugs needing dosage adjustment”, and “total number of drugs prescribed (apart from the antiretroviral treatment)” were independently related to the appearance of DRP. Probabilities predicted by the model, customising the coefficients using the uniform shrinkage method, showed a R2=0.962 for the construction sample and a R2=0.872 for the validation sample. The discriminatory capacity of the model was 0.816 for the construction sample and 0.779 for the validation sample.
ConclusionsThe developed and validated model enables detection of patients on antiretroviral treatment who are at a higher risk for experiencing a DRP. The prediction variables employed are commonly used in patient's pharmacotherapy record, allowing the model to be used in routine clinical practice.
El tratamiento antirretroviral de gran actividad (TAR) ha contribuido de manera importante al control de la infección por el virus de la inmunodeficiencia humana (VIH), disminuyendo significativamente su morbimortalidad1.
Sin embargo, para conseguir este objetivo es necesario un elevado cumplimiento del tratamiento prescrito. Aunque los factores que influyen en la falta de adherencia al tratamiento son muchos y complejos2, la aparición de efectos adversos, tanto a corto como a largo plazo, ha resultado ser un factor importante y claramente relacionado con el incumplimiento terapéutico3–5, principalmente por estar fuertemente asociado a la calidad de vida del paciente.
Además de la adherencia, en los pacientes con VIH también son frecuentes otros problemas relacionados con los medicamentos (PRM)6, como las interacciones entre fármacos, la tolerancia y la seguridad del TAR y la complejidad añadida de otros tratamientos concomitantes7.
Aunque la atención farmacéutica (AF) a los pacientes con VIH está ampliamente extendida en el conjunto del sistema sanitario español, no siempre es posible realizar el adecuado seguimiento farmacoterapéutico ni detectar todos los PRM que pueden darse en los pacientes. Por lo tanto, las carencias del modelo de AF pueden comprometer los objetivos incluidos en los programas de calidad farmacoterapéutica, principalmente aquellos relacionados con la seguridad8,9. Desde la perspectiva de optimizar los recursos disponibles, tanto humanos como terapéuticos y con el objetivo de mejorar la calidad de la farmacoterapia, la identificación, prevención y resolución de PRM es una actividad absolutamente necesaria, que debe plantearse siempre desde un escenario multidisciplinario10.
En los programas de mejora de la farmacoterapia, se establece que el proceso de validación farmacéutica de la prescripción, previa a la dispensación, debe ser un momento clave, ya que añade valor a la terapia, tratando de prevenir, identificar y resolver los PRM que pueden ocasionar morbilidad. Esta validación requiere realizar una evaluación sistemática y completa de los medicamentos prescritos, conjuntamente con la situación clínica del paciente, con el fin de asegurar que el tratamiento se sitúa en el marco de efectividad y seguridad deseado para la situación del paciente11. Además, es necesario desarrollar sistemas de seguimiento farmacoterapéutico más eficientes que los actuales, para lo cual contribuirá tanto el desarrollo de modelos matemáticos de predicción como el establecimiento de criterios que integren la situación clínica y el tratamiento del paciente. Su finalidad es alertar objetivamente ante cualquier morbilidad farmacoterapéutica que sufra un paciente o bien estimar el riesgo potencial de padecerla y, por lo tanto, no conseguir los principales objetivos farmacoterapéuticos; supresión virológica y recuperación inmunológica. Estos modelos deben diseñarse desde una perspectiva claramente asistencial para poder convertirse en herramientas útiles para los profesionales sanitarios durante el proceso farmacoterapéutico; prescripción y validación12,13.
Aunque no se han establecido específicamente para pacientes con VIH ni ningún autor los ha analizado conjuntamente, diversos estudios han identificado como factores de riesgo para el desarrollo de PRM variables como edad, sexo, presencia de comorbilidades, número de medicamentos prescritos, insuficiencias orgánicas que alteran los procesos de distribución y eliminación de los fármacos, así como determinados fármacos de «alto riesgo»: entre ellos antibióticos, analgésicos opiáceos, agentes cardiovasculares o anticoagulantes14–17. El establecimiento temprano de criterios alertantes para la detección de pacientes permitiría desarrollar un índice pronóstico capaz de clasificar a los mismos en función del riesgo de PRM en pacientes con TAR.
El objetivo de este estudio es desarrollar y validar un modelo predictivo para la detección de PRM en pacientes con TAR, durante su seguimiento periódico en las consultas de AF y previamente a la dispensación de su tratamiento.
MétodosEstudio multicéntrico, abierto y prospectivo, en el que se incluyeron todos aquellos pacientes adultos con TAR activo, en seguimiento farmacoterapéutico periódico en las consultas de AF de los servicios de farmacia de los hospitales participantes, excluyéndose los incluidos en ensayos clínicos o en programas de acceso expandido de fármacos antirretrovirales y aquellos cuyos médicos prescriptores no pertenecieran al mismo centro hospitalario donde se realizan las dispensaciones periódicas.
Como variables del estudio se recogieron los siguientes parámetros demográficos y clínicos: edad y sexo, alergias, creatinina sérica, aclaramiento de creatinina, bilirrubina total, factor de riesgo de adquisición del VIH, consumo de drogas/alcohol, número de comorbilidades no infecciosas y número de comorbilidades infecciosas definidas según Rivas Costa et al.18 y Ollero et al.19.
Las variables farmacoterapéuticas relacionadas con TAR que se incluyeron fueron: fármacos que formaban el TAR y adherencia al mismo. Para considerar al paciente como adherente se utilizaron 2 métodos indirectos de valoración (registros informáticos de dispensación+cuestionario SMAQ). Un paciente fue considerado como «adherente» si simultáneamente el registro de dispensación era mayor del 95% y en el cuestionario SMAQ resultaba adherente. Las variables farmacoterapéuticas recogidas no relacionadas con el TAR fueron: número de medicamentos prescritos (sin incluir el TAR), prescripción concomitante de fármacos de mayor riesgo terapéutico según la clasificación de Ollero et al.19, prescripción de fármacos de administración parenteral y prescripción de fármacos que requieran ajuste posológico en enfermedad renal o hepática según lo descrito en su ficha técnica.
Como definición y clasificación de los PRM, se tomaron aquellos establecidos en el Tercer Consenso de Atención Farmacéutica de Granada6.
Una vez confirmada la participación del paciente en el estudio, se identificó, por parte del farmacéutico de hospital que llevó a cabo el seguimiento farmacoterapéutico, los posibles PRM del paciente. Una vez identificado un PRM, éste fue comunicado al clínico encargado de la prescripción del tratamiento antirretroviral quien confirmó o no la existencia de dicho PRM. Solo aquellos PRM doblemente confirmados por farmacéutico y médico fueron incluidos en el estudio.
Participaron 10 hospitales españoles, de manera que cada uno de ellos incluyó un número de pacientes previamente pactado y predefinido según la carga asistencial de cada centro para alcanzar finalmente el tamaño muestral necesario para llevar a cabo el estudio. Se establecieron 2 cohortes de pacientes; pacientes con PRM y pacientes sin PRM. Se predefinieron cohortes balanceadas, de forma que los centros participantes tuvieron que incluir un mismo número de pacientes en cada cohorte hasta completar el número total de pacientes asignados.
Para cumplir el objetivo del estudio, se desarrolló un modelo multivariante de regresión logística, que permitió identificar las variables independientes predictoras de aparición de PRM. El tamaño muestral fue determinado con la regla de Freeman, 10*(k+1), donde k era el número de posibles variables predictoras. Con el fin de realizar la validación interna (cruzada) del modelo se incrementó el tamaño anterior en un 30%, resultando dos grupos iguales de pacientes con y sin PRM, utilizándose la muestra restante para la creación del modelo. Finalmente, el tamaño muestral mínimo necesario para el desarrollo del modelo considerado, incluyéndose la validación interna (cruzada), fue de 247 pacientes con PRM y 247 sin PRM.
Para la comparación entre subgrupos de variables cuantitativas se aplicó la prueba de la t de Student o la prueba no paramétrica U de Mann-Whitney en caso de distribuciones no normales. Para la comparación de variables cualitativas se utilizó la prueba de la χ2, o bien los métodos no asintóticos de Montecarlo y la prueba exacta. La interpretación de las tablas se efectuó mediante los residuos tipificados corregidos. Por último, con el objetivo de encontrar factores pronósticos de PRM, se realizó un modelo de regresión logística binaria tras un análisis univariante previo, el cual identificó las variables independientes relacionadas con el PRM que fueron introducidas en el modelo multivariante para la selección final.
La evaluación de la validez externa del modelo se efectuó mediante el método Shrinkage, cuyo objetivo era mejorar las predicciones a partir del modelo de regresión logística original. También se determinó la capacidad discriminatoria del modelo calculando los estadísticos C de Harrell y las medidas del poder discriminatorio de los modelos en las muestras de desarrollo y validación. Este análisis fue realizado en los modelos originales y en los modelos ajustados por un factor Shrinkage uniforme. La diferencia de los 2 estadísticos C de Harrell debió ser inferior a 0,10 para considerar que el modelo creado tenía validez discriminatoria y podía ser considerado un modelo muy fiable. Se calibraron los modelos obtenidos mediante el estudio de la concordancia entre los resultados observados y los pronosticados por los modelos generados. Este estudio de calibración se realizó mediante tests de bondad del ajuste (estadístico χ2 y estadístico de Hosmer-Lemeshow), calculando las pendientes de calibración y gráficos de calibración. Dada la naturaleza dicotómica de la variable respuesta, la calibración de las probabilidades de riesgo predichas se estudió por deciles.
El análisis de los datos se realizó con el paquete estadístico SPSS 19.0 para Windows.
ResultadosSe incluyeron en el estudio 733 pacientes. Las características basales de la población de estudio se detallan en la tabla 1 y las farmacoterapéuticas en la tabla 2. El número de sujetos, la asignación a cada uno de los grupos y los tipos de PRM descritos se incluyen en la tabla 3. De entre los PRM, el que con mayor frecuencia se identificó fue el PRM-4, relacionado con infradosificación (incluyendo falta de adherencia) que representa el 47,2% de todos los PRM, seguido del PRM-6, relacionado con las reacciones adversas no debidas a sobredosificación, que llegó al 22,4% de los casos.
Características demográficas y clínicas de los pacientes incluidos en el estudio
| Edad (mediana± IQR) | 44,52 (38-45) años |
| Sexo | |
| Hombres | 529 (72,20%) |
| Mujeres | 204 (27,80%) |
| Factor de riesgo de adquisición del VIH | |
| ADVP | 293 (40,00%) |
| Sexual | 284 (38,70%) |
| Otros/Desconocido | 156 (21,30%) |
| Consumo de drogas | |
| NO | 539 (73,50%) |
| SI | 193 (26,40%) |
| Alergias medicamentosas | |
| NO | 574 (78,30%) |
| SI | 158 (21,60%) |
| Parámetros analíticos | |
| Creatinina Sérica (mediana± IQR) | 0,91 (0,79-1,00) mg/dL |
| Aclaramiento de Creatinina (mediana+ IQR) | 89,90 (65,00-109,05) ml/min |
| Bilirrubina total (mediana+ IQR) | 0,79 (0,3-0,8) mg/dL |
| Número de comorbilidades infecciosas (mediana+ IQR) | 0,68 (0,60-1,00) |
| Número de comorbilidades NO infecciosas (mediana+ IQR) | 1,22 (0,60-2,00) |
ADVP:Adictos a drogas vía parenteral; IQR: rango intercuartilico.
Características farmacoterapéuticas de los pacientes incluidos en el estudio
| TAR que incluye IP | |
| NO | 342 (46,7%) |
| SI | 388 (52,9%) |
| Desconocido | 3 (0,4%) |
| TAR que incluye NO análogos | |
| NO | 406 (55,4%) |
| SI | 326 (44,5%) |
| Desconocido | 1 (0,1%) |
| TAR que incluye II y/o ANT.CCR5 | |
| NO | 621 (84,7%) |
| SI | 111 (15,1%) |
| Desconocido | 1 (0,1%) |
| Número de medicamentos prescritos (excluyendo TAR) (mediana+ IQR) | 2,17 (1-3) |
| Prescripción concomitante de otros fármacos al margen del TAR | |
| NO | 532 (72,6%) |
| SI | 200 (27,3%) |
| Desconocido | 1 (0,1) |
| Prescripción de fármacos de administración parenteral | |
| NO | 693 (94,5%) |
| SI | 39 (5,3%) |
| Desconocido | 1 (0,1) |
| Prescripción de fármacos con necesidad ajuste posológico en enfermedad renal o hepática | |
| NO | 565 (77,1%) |
| SI | 167 (22,8%) |
| Desconocido | 1 (0,1) |
| Adherencia óptima al TAR | |
| NO | 236 (32,2%) |
| SI | 486 (66,3%) |
Prob.PRM=11+e[−(1,444−2,920.Adherencia+0,786.Prescr.Fárm.Ajuste.Posol+0,137.número_tratamientos)]
Prob.PRM= Probabilidad de tener PRM.
Adherencia con 0= NO y 1=SI.
Prescripción fármacos ajuste posológico
con 0 =NO y 1=SI.
IP: Inhibidores de la proteasa; II: Inhibidores de la Integrasa; ANT.CCR5: Antagonista de los correceptores CCR5; TAR: tratamiento antirretroviral.
Distribución de los PRM identificados en los pacientes del estudio
| PRM | N (%) |
| Distribución de pacientes | |
| SIN PRM | 371 (50,5) |
| CON PRM | 362 (49,4) |
| PRM-1 INDICACION | |
| Indicación no tratadaContinuación de tratamientoTratamiento combinado (sinergismo)Tratamiento profiláctico/premedicación | 60 (16,6) |
| PRM- 2 INDICACION | |
| Medicamento InnecesarioMedicamento No indicadoDuración inadecuadaDuplicidad terapéutica | 13 (3,6) |
| PRM-3 EFECTIVIDAD | |
| Medicamento InadecuadoNo indicado para la situaciónNo efectivo para esta indicación/resistenciaForma de dosificación inapropiada | 23 (6,4) |
| PRM-4 EFECTIVIDAD | |
| Dosis/Intervalo/Duración inadecuadaAdministración inadecuadaInteracciones (fármacos-alimentos)Falta de adherencia | 171 (47,2) |
| PRM –5 SEGURIDAD | |
| Dosis/Intervalo inadecuadoDuración inadecuadaInteracciones (fármacos-alimentos) | 14 (3,9) |
| PRM- 6 SEGURIDAD | |
| Reacciones Adversas No debidas a sobredosificación | 81 (22,4) |
La realización del modelo de regresión logística determinó que las variables «adherencia», «prescripción de fármacos con necesidad de ajuste posológico» y «número de medicamentos prescritos (al margen del TAR)» se relacionaban de manera independiente con la aparición de PRM, siendo éstas las que se incluyeron en el análisis multivariante final, que se muestra en la tabla 4.
Variables independientes relacionadas con los PRM y fórmula matemática resultante
| Variables en la ecuación | I.C. 95% | ||
| Exp(B) | Inferior | Superior | |
| Adherencia | 18,545 | 11,003 | 31,255 |
| Prescripción de fármacos con necesidad ajuste posológico en enfermedad renal o hepática | 2,195 | 1,276 | 3,776 |
| Número total de medicamentos prescritos (excluyendo TAR) | 1,147 | 1,043 | 1,261 |
| Constante | 0,229 | ||
Prob.PRM=11+e[−(1,444−2,920.Adherencia+0,786.Prescr.Fárm.Ajuste.Posol+0,137.número_tratamientos)].
Prob.PRM= Probabilidad de tener PRM
Adherencia con 0= NO y 1=SI
Prescripción fármacos ajuste posológico con 0 =NO y 1=SI
Número de ttos.
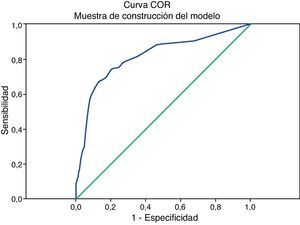
La representación de las curvas COR para el modelo de creación y el modelo de validación de la muestra del estudio se observan en la figura 1. La calibración (comparación de las probabilidades observadas de eventos y las predichas por el modelo) realizada a través de la prueba de Homer y Lemeshow para la muestra de construcción del modelo indicó un valor χ2 de 10,47 y una significación estadística de p=0,164. Para la muestra de validación, el valor χ2 fue de 12,92 y la significación estadística de p=0,074.
Los estadísticos C de Harrell fueron 0,816 IC 95% (0,777-0,855) en la muestra de construcción del modelo y 0,779 (0,718-0,840) en la muestra de validación. Se consideró que el modelo tenía una buena capacidad discriminatoria interna, dado que el valor C superó el 0,75. La diferencia de los estadísticos C de Harrell entre la muestra de construcción y de validación fue inferior a 0,10 (0,816-0,779=0,037), lo que indicó que el modelo creado tenía validez discriminatoria externa y puede ser considerado un modelo muy fiable.
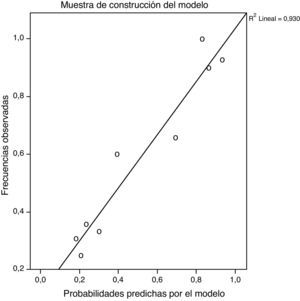
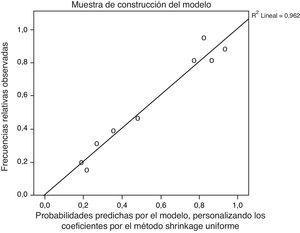
Los gráficos de calibración de las muestras de construcción y validación del modelo se muestran en la figura 2, observándose unos valores de pendientes de calibración R2=0,938 y R2=0,930, respectivamente. Del mismo modo, cuando se ajustaron las pendientes por el método Shrinkage, posterior a la estimación, los valores obtenidos fueron R2=0,962 y R2=0,872, respectivamente (fig. 3).
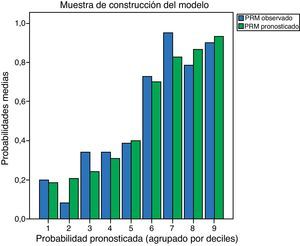
Por último, la calibración del modelo de estudio por deciles para las probabilidades de riesgo de aparición de PRM pronosticadas, tanto para el modelo de construcción como el de validación, se detallan en la figura 4.
DiscusiónEl presente estudio ha desarrollado y validado un modelo predictivo para la detección de pacientes con mayor riesgo de presentar PRM en el contexto de la validación farmacéutica durante las consultas de AF a los pacientes infectados por el VIH con TAR.
Autores como Evans et al.14 o Bates et al.20 han demostrado la relación entre diferentes factores de riesgo, tanto farmacoterapéuticos como clínicos, con altas probabilidades de aparición de PRM en diferentes tipos de pacientes. Sin embargo, hasta la actualidad, ningún autor ha desarrollado un modelo de estratificación del riesgo de PRM basado en análisis multivariantes de variables clínicas, demográficas y farmacológicas en el ámbito del paciente VIH atendido en consultas externas de AF.
El modelo predictivo final obtenido, que permite detectar pacientes de alto riesgo con una gran capacidad discriminatoria, integra 3 factores de riesgo como son la adherencia, la prescripción de fármacos con necesidad de ajuste posológico en enfermedad renal o hepática y el número de medicamentos prescritos al margen del TAR.
La variable que se asocia con mayor potencia con el riesgo de PRM es la adherencia. En nuestro estudio, la complejidad farmacoterapéutica, definida como el número de fármacos prescritos adicionales al TAR, multiplica el riesgo de aparición de PRM en 1,147 por cada medicamento adicional. Por lo tanto, aunque no se ha desarrollado en el presente trabajo un estudio de interrelación de variables, cabe esperar que ambas variables estén íntimamente relacionadas e influyan negativamente sobre la posibilidad de sufrir un PRM. Estos hallazgos refuerzan la necesidad de incluir en la sistematología asistencial de la AF el estudio exhaustivo de la farmacoterapia completa de cada paciente, además de los aspectos consolidados como la estimación de la adherencia, el estudio de las potenciales interacciones, tolerancia, etc.
Tras la adherencia, el principal factor asociado con el riesgo de PRM fue la prescripción de fármacos que requieran ajuste posológico por insuficiencias orgánicas (OR=2,195), siendo el ajuste posológico más común el debido a insuficiencia renal. Diversos programas de AF orientados a la identificación de PRM potenciales con origen en la individualización posológica en pacientes con función renal disminuida, pero no específicos de pacientes con TAR, han reflejado igualmente esta asociación y han encontrado incluso prevalencias de este tipo de fármacos de hasta el 25% de las prescripciones farmacoterapéuticas validadas21,22. Esta variable fue predictor positivo del riesgo de PRM independientemente de la existencia o no de enfermedades hepáticas o renales en los pacientes (medidas por las variables creatinina sérica, aclaramiento de creatinina y bilirrubina total), variables todas ellas que no entraron en el modelo final.
En el análisis univariante, variables como la creatinina plasmática y la bilirrubina total no se asociaron significativamente con el riesgo de padecer un PRM. Analizando las características generales de la población de estudio, se ha observado que la mediana (IQR) de creatinina sérica es de 0,91 (0,79-1,00) mg/dl situándose dentro del intervalo normal de valores (0,5-1,1mg/dl). Otras fórmulas, no utilizadas en este proyecto como el aclaramiento de creatinina obtenido por la fórmula de Cockcroft-Gault o MDRD, han demostrado mejor correlación con la función renal23. En el presente estudio, el 36,9% de los pacientes presento valores de aclaramiento de creatinina ≤ 50ml/min sin mostrar significación en ninguno de los modelos de análisis univariante realizados. En cuanto a los datos de función hepática, tan solo un 3,5% de los pacientes presentó valores de bilirrubina total > 1,2g/dl, condicionando su falta de asociación con los PRM en el análisis univariante.
Respecto a las variables farmacológicas, al contrario que en otros estudios24–26, no se ha asociado la prescripción de ningún fármaco o familias de fármacos con el mayor riesgo de PRM (p=0,705).
El sexo femenino también ha sido considerado como factor de riesgo por diversos autores14,27,28, tanto relacionado con una menor adherencia al TAR como con el riesgo de PRM. Nuestros resultados no confirman significativamente dicha asociación. El número de comorbilidades tanto infecciosas como no infecciosas y el número de fármacos tampoco tuvieron significación en el análisis univariante.
En resumen, el análisis de nuestros datos sugiere la necesidad de disponer de unos criterios específicos y sensibles para la identificación de PRM y las oportunidades de mejora que cada paciente requiere. La identificación de las variables asociadas significativamente con el riesgo de PRM en los pacientes infectados por el VIH y su incorporación a la práctica asistencial de la AF requiere, probablemente, un modelo exclusivo de atención al paciente VIH, separado del resto de pacientes atendidos en las unidades de pacientes externos, circunstancia que se apoya en diversos trabajos ya publicados29–32.
En definitiva, la evaluación sistemática de la adherencia y de la complejidad farmacoterapéutica, integrada por la existencia de medicamentos que requieren un ajuste posológico y por el número total de medicamentos prescritos, constituye, de acuerdo con nuestro modelo, un sistema de alerta farmacoterapéutica que permite la optimización de los recursos farmacéuticos destinados a la validación de la prescripción y el seguimiento farmacoterapéutico de los pacientes con VIH.
La principal limitación de este estudio es la variabilidad en la aplicación de los criterios de validación de la prescripción e identificación de PRM, como consecuencia de la participación de farmacéuticos con distinto grado de formación en la materia. Este hecho se intentó minimizar detallando al máximo el diseño metodológico e invitando a participar en el mismo exclusivamente a centros con características similares en cuanto a la AF que realizan. Igualmente tampoco se estratificó, por carecer de un soporte bibliográfico oportuno, el número mínimo de pacientes a incorporar para cada tipo de PRM sino que se estimó como un bloque global. Por último, tampoco se describió ni evaluó de manera sistematizada, por no ser el objetivo de este estudio, la actuación farmacéutica realizada ni las consecuencias clínicas de cada uno de los PRM detectados durante el estudio.
En este sentido, una posible línea de investigación futura, basada en los resultados del estudio, podría ser el desarrollo de modelos de predicción análogos específicamente diseñados para pacientes con enfermedades relacionadas, como coinfectados VIH-VHC o VIH-VHB, así como la posibilidad de redefinir submodelos matemáticos concretos para cada subtipo de PRM.
En conclusión, el modelo predictivo desarrollado y validado es una herramienta útil para la detección de pacientes con mayor riesgo de aparición de PRM y, por lo tanto, con oportunidad de mejora en su farmacoterapia. Las variables predictoras utilizadas se corresponden con las manejadas sistemáticamente en la historia farmacoterapéutica del paciente, permitiendo su empleo habitual en la práctica asistencial.
FinanciaciónEstudio financiado con ayuda de la Beca Ruiz-Jarabo 2010 de la FEFH.
Presentado en el 56 Congreso Nacional de la SEFH. Santiago de Compostela 2011. El modelo resultante del desarrollo de este estudio puede consultarse en la web: http://estudiopredictor.sefh.es/index.html.