INTRODUCCION
Desde que en1970 se introdujera el cisplatino como una nueva alternativa parael tratamiento de los diferentes tumores hasta la actualidad se haseguido buscando nuevas sustancias con característicasanálogas a éste que mejorasen tanto su perfiltoxicológico como su espectro de actividad, peroúnicamente una docena de compuestos han logrado pasar lasprimeras fases de investigación. Entre estos análogosse encuentran aquellos que contienen en su estructura el grupo1,2-diaminociclohexano (DACH), como es el caso del oxaliplatino(OHP), el cual ha demostrado actividad en líneas celularesresistentes al cisplatino. Este hecho ha sido fundamental paraproseguir con sucesivas fases de la investigación delproducto, ya que el principal problema que presentan laslíneas celulares sometidas a tratamiento con cisplatino esla presencia de resistencias (adquiridas o intrínseca) aderivados del platino (carboplatino y cisplatino) ya queéstas presentan resistencias cruzadas entre sí que,sin embargo, no se han observado con el OHP (l).
Otras ventajasobservadas de los derivados del platino que poseen el grupo DACH essu carencia de nefrotoxicidad (característico delcisplatino), así como la producción demielosupresión en un grado muy inferior al producido por elcarboplatino. Estos dos hechos unidos a la amplitud en el espectrode actividad mostrado por estos derivados, así como suefectividad en tumores intrínsecamente resistentes alcisplatino, han puesto de manifiesto el elevado potencial quepresentan estos compuestos en el futuro tratamiento de lasdiferentes variedades tumorales (2).
Entre estoscompuestos destacan el malonato-platino o el tetraplatino, pero suíndice terapéutico y sobre todo su perfiltoxicológico y galénico les hacen inviables en unfuturo próximo. Únicamente el oxaliplatino[SP-4-2-(lR-trans)]-(1,2 ciclohexanodiamino-N,N') [etanodioato(2-)-O,O'] platino ha sido desarrollado conéxito.
El complejo«platino-DACH» del oxaliplatino puede existir como tresconformaciones isoméricas diferentes: trans L(R,R),trans D(S,S) y CIS (R,S). Estudios posteriores sugieren que laconformación estereoquímica del grupo DACHpodría afectar a su interacción con el ADN e influirsobre su eficacia citotóxica, siendo el isómeroL(R,R) el más activo tanto en líneas celularessensibles al cisplatino como en las líneas resistentes almismo (3).
PERFIL DESEGURIDAD
Laaparición de neuropatía periférica transitoriaparece ser uno de los principales efectos adversos que aparecentras la administración del OHP que se manifiesta comoparestesia y disestesia en extremidades y área perioral.Estos síntomas aparecen desde el momento de suadministración o durantes los minutos posteriores a lamisma, pero pueden retrasarse hasta varios días. Estatoxicidad aparece generalmente a dosis iguales o superiores a 90mg/m2, afectando a más del 75% de los pacientes cuandose alcanza dosis de 200 mg/m2. Laduración e intensidad de los síntomas aumentan con elnúmero de ciclos administrados, afectando a todos lospacientes que han recibido al menos cuatro ciclos de OHP,definiéndose una dosis recomendada de 130mg/m2 cada veintiúndías en perfusión de tres a seis horas (4,5).
El perfilneurotóxico del OHP es característico, tanto en sureversibilidad como en su rápida implantación,localización e intensidad de las alteraciones sensorialescon ausencia de componente motor. En un estudio reciente (3) se haobservado que la incidencia de neuropatía fue superior en elgrupo de oxaliplatino frente al de cisplatino; sin embargo,raramente ésta fue grave, disminuyendo o desapareciendodespués de finalizar el tratamiento, a diferencia de laobservada tras la administración del cisplatino, la cualtiende a aumentar tras el tratamiento sin mostrar signos dereversibilidad.
Brienza et al(6) determinaron como principal factor pronóstico en laaparición de neurotoxicidad la dosis acumulada. Así,dosis acumuladas de 780 mg/m2, 1.170mg/m2 y 1.560mg/m2 se han relacionado con unaincidencia de neurotoxicidad del 10, 50 y 75%, respectivamente.Otros dos estudios fase II consecutivos confirmaron que laseveridad de la neurotoxicidad depende de la dosis acumulada y quees reversible en la mayoría de los casos(7).
La toxicidadhematológica observada tras la administración deoxaliplatino es moderada. La aparición de trombocitopeniaestá relacionada con la dosis, no presentándose adosis iguales o inferiores a 90 mg/m2, perosí con un 13% de incidencia en pacientes con dosis de135-150 mg/m2 y con un 28% deincidencia con dosis de 175-200 mg/m2, siendo siempre de grado igual o menor que 2 (4). Laincidencia de mielosupresión es significativamente inferiora la observada tras la administración de carboplatino(5).
El oxaliplatinono es nefrotóxico, por lo que no se requiere para suadministración pre y posthidratación. Este hecho fueobservado en el primer ensayo clínico fase I llevado a cabopor Mathé et al (8) y corroborado en los todos los ensayosclínicos siguientes, tanto fase I como II y III. Laaparición de náuseas y vómitos escaracterística tras la administráción de estefármaco, pero parece ser que la gravedad de la émesisno parece estar relacionada con la dosis, excepto tras laadministración de dosis muy elevadas. El aumento en laduración de la perfusión no se traduce en unadisminución de este tipo de síntomas; sin embargo, seha observado que el pretratamiento sistémico reduce laaparición de náuseas y vómitos de grado 3-4 aun 11%, así como la aparición de diarreas en un 24%(4, 5). La administración de oxaliplatino se hacorrelacionado con pérdida de audición con menorfrecuencia que el cisplatino, pérdida que suele limitarse alas altas frecuencias (5).
Los datos deseguridad del oxaliplatino confirman la existencia de un perfiltoxicológico diferenciado respecto al resto de componentesderivados del platino, caracterizándose por nulanefrotoxicidad, mínima ototoxicidad y mínimatoxicidad hematológica, mientras que lasintomatología gastrointestinal producida tras suadministración ha sido controlado efectivamente tras laadministración de antieméticos y antidiarreicos. Laneurotoxicidad es el efecto dosis limitante, pero disminuye tras lainterrupción del tratamiento y suele ser completamentereversible (3, 5).
FARMACOCINÉTICA
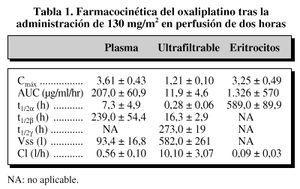
Estudiosrecientes sobre la farmacocinética del oxaliplatino hanpuesto de manifiesto que la via de administración, ya seaintravenosa o intraperitoneal, no influye sobre los procesos dedistribución y aclaramiento, pero influyen de manerasignificativa, sobre el Tmáx y elCmáx (5). Tras la administración de unaperfusión corta de dos horas de oxaliplatino en pacientescon y sin fracaso renal se observa un elevado volumen dedistribución, así como un modelofarmacocinético bicompartimental tanto para el platino totalcomo para la porción ultrafiltrable, no observándosediferencias significativas en el Cmáx (enpacientes con o sin fracaso renal), aunque se observa un incrementodel AUC (9,8 frente a 15,2 referido a platino ultrafiltrable) enlos pacientes con fracaso renal (aclaramiento de creatinina < 60ml/min), sugiriéndose que en pacientes con moderado fracasorenal no haría falta ajustar la dosis (3, 5).
Su unióna proteínas plasmáticas es elevada, no variando trasla administración de cursos sucesivos. La eliminaciónde oxaliplatino es lenta, eliminado el 33% en cuarenta y ochohoras, pero se han detectado niveles residuales a los sesenta ytres días de finalizar el tratamiento (5) (tabla l).
Recientemente seha evaluado la cinética acumulativa del oxaliplatino paraposteriormente inferir posibles toxicidades y determinar losposibles daños celulares. Así, Gamelin et al (9) noobservaron acumulación significativa a nivelplasmático de oxaliplatino tras la administración desiete ciclos de quimioterapia; sin embargo, sí que seobservó acumulación a nivel eritrocitario, siendo latl/2 de cuarenta y ocho ± diez días, peroparece ser que la fracción de oxaliplatinointraeritrocitaria no es intercambiable a nivel plasmático;consecuentemente parece ser que a corto plazo esta porciónno interviene en el mantenimiento de los niveles plasmáticosde oxaliplatino. Estas observaciones pueden explicar parcialmenteel rápido aclaramiento del oxaliplatino comparado con elcisplatino, la ausencia de nefrotoxicidad y la reversibilidad de suneurotoxicidad (3, 5).
BIOTRANSFORMACIÓN YMECANISMO DE ACCIÓN
Diversosestudios realizados con el 1,2 DACH-platino malonato, compuesto conun comportamiento químico similar al oxaliplatino, muestranla capacidad de diferentes nucleófilos débiles, comoson el bicarbonato sanguíneo o el dihidrógeno fosfatointracelular, para desplazar al grupo oxalato del complejo. Losintermedios resultantes son inestables y rápidamente sehidrolizan a la forma dihidratada del 1,2-DACH platino.Posteriormente si el medio donde se encuentra es rico en cloruros(la sangre), se transformará en una especie monohidratada,mientras si se encuentra a nivel celular donde el contenido decloruros es escaso predominará la forma dihidratada(3).
Sin embargo, adiferencia del cisplatino y carboplatino, los cuales mantienen unintermediario cis-diamino común, el metabolito resultante dela biotransformación del oxaliplatino mantiene en suestructura el grupo DACH, el cual podría influir en losdiferentes tipos de aductos formados con el ADN, así como ensus mecanismos de reacción o propiedades biológicas.Recientemente se ha observado que la presencia de este grupo afectaal rango de conversión de monoaductos a diaductos,así como a la posibilidad de las células para toleraraductos de ADN-platino no reparados; esta mayor capacidad pareceser la principal responsable de la diferenciación en laactividad antitumoral del oxaliplatino frente al cisplatino ycarboplatino (3).
EFICACIA
Metodo de revisión yselección de los artículos
Serealizó una búsqueda bibliográfica mediante labase de datos Medline (Index Medicus, National Library of Medicine,Bethesda, USA) en soporte óptico CD-ROM (SilverplatterInformation, Norwood, Bethesda, USA) desde enero de 1993 hastaenero 2000 (ambas inclusive), seleccionando los ensayosclínicos con oxaliplatino. Para ello se buscaron losartículos que contuvieran la palabra clave:«oxaliplatin» (búsqueda libre) y se cruzaron con«randomized clinical trials» (MESH) y «clinicaltrial» (tipo de publicación). Las referenciasencontradas en los artículos seleccionados fueron revisadascon objeto de seleccionar aquellos artículos noidentificados mediante la búsqueda informática paraaumentar la sensibilidad. Sólo se revisaron artículospublicados en inglés, español ofrancés.
Criterios deselección
Para lavaloración de la eficacia en el cáncer colorrectalavanzado (CCA) se seleccionaron estudios que incluyeran pacientesadultos con este diagnóstico, con función renal yhepática dentro de los límites aceptables en ensayosclínicos y con grado de performance mayoritariamente 0-l, ysiempre menor o igual a 3. Los estudios fase III en primeralínea incluidos eran comparativos y aleatorizados. Lamayoría de los estudios seleccionados contaban con uncomité radiológico independiente que valoraba larespuesta, entre ellos, los dos estudios fase III aleatorizados condos ramas comparativas de tratamiento: con y sin OHP.
Efectividad
La efectividaddel tratamiento se valoró como respuesta objetiva (RO) comola suma de la respuesta completa (RC), desaparición deltumor, y respuesta parcial (RP), o disminución de al menosel 50% del tamaño tumoral medido como la suma de losproductos de los mayores diámetros perpendiculares deltumor, sin evidencia de nuevas lesiones.
Los resultadosse evaluaron según el esquema de los fármacosempleados, ya fuese en monoterapia o en poliquimioterapia.Después se obtuvieron según línea detratamiento: primera línea de tratamiento o tratamiento deelección y segunda línea de tratamiento en pacientestratados anteriormente con otros esquemas quimioterápicoscuya enfermedad progresó durante la administración deun esquema de primera línea o recidivaron durante la terapiaadyuvante. Otro criterio de efectividad evaluado fue la mediana deltiempo para progresión de la enfermedad (TPE).
CÁNCER COLORRECTALAVANZADO (CCA): MONOTERAPIA
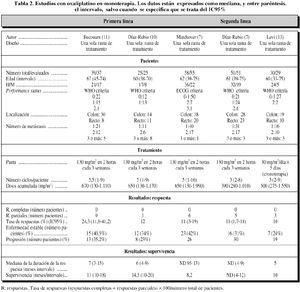
Se seleccionaroncinco ensayos clínicos fase II en monoterapia para eltratamiento del CCA. Dos en primera línea, que incluyeron 63pacientes, y tres en segunda línea, que incluyeron 139pacientes con enfermedad metastásica, previamente tratadoscon 5FU (tabla 2).
Primeralínea
Los dos estudiosmulticéntricos realizados por Díaz-Rubio (10) yBecouarn (11) en primera línea a la dosis de 130mg/m2de OHP en dos horas confirmaron la eficacia yseguridad del medicamento en monoterapia, con una respuesta mediade ambos estudios del 18% (IC95%: 9 a 30%) (12), comparable a la deotros agentes considerados activos en monoterapia. El efectoadverso más importante observado fue la neurotoxicidad. Larespuesta fue validada por un comité externo de expertosradiólogos independiente del estudio.
Segundalínea
La eficacia y laseguridad de la monoterapia con oxaliplatino también seevaluó en pacientes con cancer colorrectal avanzadopreviamente tratados con 5-fluorouracilo (5FU).
En un estudiomulticéntrico llevado a cabo por Matchover et al (7) seincluyeron 58 pacientes que habían sido previamente tratadoscon 5FU. El 83% tenían metástasis hepáticas yel «status» de performance del ECOG era de 0-1 en el86%. Se observó neurotoxicidad periférica en el 98%de pacientes. Se encontró una correlación entre laincidencia y gravedad de NP el incremento de la dosis acumulada deOHP.
Un segundoestudio multicéntrico dirigido por Díaz-Rubio et alincluyó 51 pacientes. Los resultados fueron publicados juntocon los de Matchover et al (7). Los pacientes teníancaracterísticas similares al estudio anterior.
En el estudiomulticéntrico de Levi et al (13) se incluyeron 30 pacientes.El oxaliplatino se administró mediante infusióncontinua cronomodulada de veinticuatro horas (pico a lasdieciséis horas) de 30 mg/m2/díadurante cinco días (total: 150 mg/m2) repetidos cada tres semanas. En ausencia de toxicidadgrado mayor o igual a 3 tras el primer ciclo se aumentó ladosis a 35 mg/m2/ día en elsegundo ciclo y tras el tercero a 40 mg/m2/día.
En total, enestos tres ensayos clínicos se incluyeron 139 pacientes concáncer colorrectal avanzado tratados previamente con 5FU querecibieron oxaliplatino en monoterapia, obteniéndose unatasa de respuestas media del 10,4%, una estabilización de laenfermedad en el 34%, siendo la mediana de la supervivencia de 8,2a 10 meses (12).
Enconclusión en estos cinco estudios fase II sedemostró que el OHP como agente único tiene efectosantitumorales en pacientes previamente tratados y refractarios a5FU (aproximadamente 10% respuestas objetivas) y no tratados(aproximadamente 18% de respuestas objetivas) con una tolerabilidadaceptable (12).
Sin embargo, eloxaliplatino en monoterapia no es recomendable salvo en pacientesque presenten déficit de la dihidropiridina deshidrogenasa oen aquellos con cardiotoxicidad por 5FU, ya que la accióndel 5FU + OHP es sinérgica, tal como mostraron los estudiosfarmacológicos experimentales y posteriormente los ensayosclinicos fase II/III en combinación (12).
EFICACIA DE LA COMBINACION DEOXALIPLATINO + SFU
Primeralínea
Estudios no comparativosfase Il
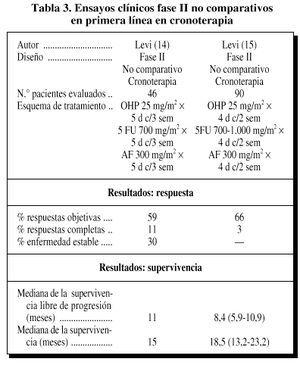
La eficacia delOHP fue estudiada en combinación con SFU y ácidofolínico (AF) por Levi et al (14, 15). En dos ensayosclínicos fase Il utilizando la cronoterapia como forma deadministración, tanto del 5FU/AF como del OHP. Ambosestudios eran no comparativos, con una sola rama de tratamiento: elesquema de tratamiento era similar. La infusióncronomodulada se realizó mediante una bomba multicanalprogramable que permite la infusión a velocidad no constante(para cada medicamento se inicia lentamente hasta alcanzar unmáximo y disminuir luego progresivamente durante variashoras al día) y a lo largo de veinticuatro horas durantevarios días de los tres fármacos (5FU, AF, OHP).Entre producto y producto, el lavado de las vías con glucosaal 5% evita incompatibilidades (15). La tabla3 nos muestra los resultados de estos ensayosclínicos.
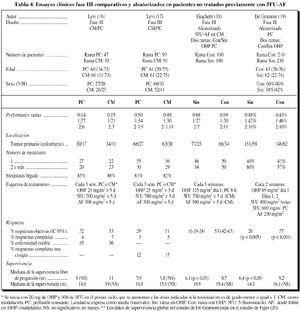
Estudioscomparativos
La tabla 4 muestra los estudios comparativosrealizados en pacientes con cáncer colorrectal avanzado notratados previamente con 5FU/AF. En dos de ellos se compara lainfusión convencional frente a la cronomodulada (16, 17). Delos otros dos (18, 19), en uno (18) se estudia el efecto de laadición de oxaliplatino (125 mg/m2 eninfusión convencional de seis horas a un régimen de5FU/AF cronomodulado). En el otro (19) tanto el OHP como el 5FU/AFson infusión convencional. 5FU/AF se administran cada dossemanas durante los días l y 2, mientras que el OHP seutiliza sólo el día 1, 85 mg/m2cada dos semanas. Estos dos estudios fueronaleatorizados y contaron con revisión radiológicaindependiente para la determinación del porcentaje derespuestas objetivas. De los dos estudios podemos concluir que laasociación OHP + 5FU/AF presenta un efecto sinérgico.En ambos la tasa de respuesta fue significativamente superior en larama que incluía OHP (tabla 4) y tambiénmejoró significativamente la supervivencia libre deprogresión (18, 19). Sin embargo, la diferencia en lasupervivencia global no fue significativa en el análisis porintención de tratar (18, 20).
Segundalínea
El OHP encombinación con 5FU/AF ha sido también evaluado enmás de 1.000 pacientes previamente tratados que presentabancáncer colorrectal metástaticorefractario.
Muchos de ellosfueron evaluados en ensayos clínicos fase II, el resto lofueron en programas de uso compasivo cuyos resultados fueronposteriormente analizados de forma retrospectiva (21).
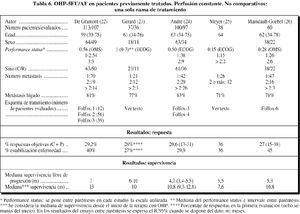
Los primerosestudios en combinación utilizando perfusiones a velocidadconstante utilizaron dosis altas de OHP (130 mg/m2 cadatres-cuatro semanas, 100 mg/m2 cada tres semanas). Posteriormente, en un intento de reducir latoxicidad, se han utilizado dosis más bajas de OHP, conmenor intervalo entre ciclos (dos semanas). Se denominafolfox a los regímenes que asocianoxaliplatino a diferentes pautas de 5FU/AF bimensual (tabla 5). También se han utilizado variaspautas de OHP/5FU/AF en cronoterapia. En la tabla 6 pueden verse los resultados de algunos delos estudios realizados con infusión constante (22-26) y enla tabla 7 los de los estudiosrealizados con cronoterapia (14, 27-29).
De Gramont et al(22) describen su experiencia en la uti-lización de tresregímenes de combinación OHP/5FU/AF (folfox-1,folfox-2, folfox-3) en un estudio fase II. Un total de 113pacientes fueron tratados con alguno de los regímenesdenominados como folfox-1, folfox-2 o folfox-3. El porcentaje derespuestas objetivas obtenidas (RC + RP) en los tres grupos es del29,2% (valor medio).
Gerard (23)utiliza un régimen compuesto por OHP 130 mg/m2 losdías 1, 22 y 43, 5FU 2,6 g/m2 en PC los días 1, 8, 22, 29, 43 y 50 y AF 500mg/m2 una hora antes de la PC de5FU. En la tabla 6 pueden verse los resultados obtenidos tras lasprimeras ocho semanas de tratamiento. La mediana de laduración de la respuesta fue de diez meses y la mediana dela duración de la estabilización fue de seismeses.
André(24) utiliza en el régimen folfox-3 en 40 pacientes y elfolfox-4 (una variante del folfox-3 que emplea la misma pauta parael OHP, y dosis algo menores de 5FU 400 mg/m2 bolodías 1 y 2 + PC 600 mg/m2 días1 y 2 y AF 200 mg/m2 en bolo doshoras días 1 y 2) en otros 57 pacientes. En ambos gruposobtiene respuestas similares. El estudio contó conrevisión radiológica independiente.
Meyer (25)utiliza en 38 pacientes una pauta de OHP 130 mg/m2 día1 cada tres semanas, 1.300 mg/m2 de SFU cada tres semanas y 400 mg/m2 de AF cada tres semanas. Los resultados son los mostradosen la tabla 6.
En conjunto, delos resultados obtenidos por estos ensayos puede deducirse que lospacientes previamente tratados, incluso aquellos que lo han sidocon altas dosis de 5FU/AF, pueden beneficiarse del sinergismo entreestos fármacos, ya que se alcanzan importantes tasas derespuesta (entre un 20-30%) y de estabilización de laenfermedad (20-30%) a pesar de ser un tratamiento de segundalínea, y es de esperar supervivencia, aunque para demostrareste beneficio sería necesario un EC aleatorizado(21).
Tambiéndebemos hablar de los programas de uso compasivo que han permitidoincluir, tratar y evaluar retrospectivamente varios centenares depacientes. Por ejemplo, en una revisión de los datos de 206pacientes (30) que previamente habían recibido SFU ±AF y se habían mostrado resistentes a este tratamiento seobtu-vo una respuesta objetiva del 25% (IC95%: 17-35) en 98pacientes evaluables, claramente refractarios al régimen con5FU. La supervivencia libre de enferrnedad fue de 4,1 meses (IC95%:3,3-5) y la mediana de la supervivencia fue de 9,6 meses (IC95%:8,2-10,9). La evaluación de otros programas de uso compasivoha dado resultados similares (21).
REDUCCION DE METASTASISHEPATICAS NO RESECABLES TRAS QUIMIOTERAPIA CONOXALIPLATINO
El cáncercolorrectal metastatiza fundamentalmente en el hígado y/opulmón. Las metastásis hepáticas son lasmás frecuentes y la proporción de pacientes quepueden curarse mediante una resección hepática seestima igual o menor al 10% debido al elevado número depacientes que presentan metástasis hepáticas noresecables (31).
Parece ser quela respuesta de las metástasis hepáticas altratamiento con 5FU-AF + OHP bisemanal es similar a la respuestaobtenida en el tumor principal (32).
Lasmetástasis hepáticas previamente irresecables puedendisminuir hasta permitir su resecabilidad mediante la quimioterapia(Bismuth, 98). En un estudio realizado por Bismuth (33), de untotal de 330 pacientes que no podían ser sometidos acirugía y recibieron quimioterapia neoadyuvante conoxapliplatino más 5FU-AF después del tratamiento fueposible realizar una resección quirúrgica delcáncer y metástasis en 53 pacientes (16%). Entreéstos, la supervivencia a los cinco años era del40%.
Estos resultadossugieren que para pacientes que no presentan afectaciónextrahepática una buena técnica quirúrgicaunida a un régimen quimioterápico puede hacermanejables metástasis previamente inoperables cambiandopronósticos previos negativos y prolongando de formaimportante la supervivencia (31).
OXALIPLATINO EN OTRASINDICACIONES
Oxaliplatino en cancer deovario
EI OHP hamostrado eficacia como agente único en pacientes resistentesa otros platinos (34). En un estudio se ha utilizado encombinación con cisplatino en pacientes politratadosanteriormente, entre otros con cisplatino con una respuestaobjetiva del 40% (35). En este estudio OHP 130 mg/m2 en doshoras y cisplatino dos horas después 100mg/m2 en dos horas eranadministrados el día primero de cada ciclo, estando elpaciente hospitalizado. Se realizaban ciclos cada semanas. Latoxicidad limitante fue la neuropatía periféricasensorial, y se observó toxicidad hematológica 3-4 enel 35-40% de los ciclos (media de tres ciclos porpaciente).
Tambiénse ha estudiado en 37 pacientes previamente tratados con cisplatinoo carboplatino con cáncer de ovario avanzado lacombinación de OHP 100-130 mg/m2 yplaquitaxel 135-175 mg/m2 (i.v.tres horas) día primero con el paciente fuera del hospitalcada tres a cuatro semanas; media de seis ciclos con una respuestaobjetiva del 48% (IC95%: 31-66). Un 30% de los pacientesexperimentaron neutropenia de grado 4 y un 16% neuropatíaperiférica de grado 3. La supervivencia fue de 25,2 meses(IC95%: 12-39) (36).
Otras indicaciones
Se han realizadotambién estudios de combinación con CPT-11 en 39pacientes: fase I en cánceres digestivos avanzados (colon,gástrico, pancreático, hepático,esófago) (37) con dosis de OHP 85-110 mg/m2 eninfusión de dos y una hora después CPT-l l 150-250mg/m2 en treinta minutos i.v. cadatres semanas con dosis escaladas. La dosis recomendada para losestudios fase II fue de OHP 85 mg/m2 eirinotecán 200 mg/m2.
Tambiénse han realizado un estudio (38) en 22 pacientes con linfoma noHodgkin refractario o recurrente con dosis de 100-130mg/m2cada tres semanas, obteniéndose una respuestaobjetiva del 40% (IC95%: 21-64) y una mediana de duración derespuesta de veintisiete meses (IC95%: 5-44).
Otrasindicaciones en las cuales se han realizado o se estánrealizando estudios piloto incluyen: cáncer de mama ycáncer de pulmón macrocítico (34).
CONCLUSIONES
El oxaliplatinoes un nuevo fármaco antineoplásico bien tolerado y unexcelente candidato para la terapia de combinación. Laneurotoxicidad característica del fármaco es latoxicidad limitante, es aguda y relacionada con la dosis, ygeneralmente es reversible al interrrumpir el tratamiento y puedeser manejada satisfactoriamente en la prácticaclínica (39).
Los estudios enprimera línea de cáncer colorrectal avanzadoaleatorizados que comparan la asociación OHP + 5FU/AF con5FU/AF sólo han demostrado un aumento de las respuestasobjetivas y una mejora de la supervivencia libre deprogresión (18, 19). Esto demuestra el efectosinérgico del OHP con el 5FU. Actualmente, en consecuencia,la combinación de 5FU/AF con OHP o CPT-11 se ha convertidoen tratamiento de primera línea en cáncer colorectalavanzado.
Las futuraslíneas de estudio en este medicamento consisten nosólo en explorar las nuevas indicaciones, sino en clarificarmás su papel en el cáncer colorrectal avanzado:estudiar cual es el régimen terapéutico óptimoy la combinacióm más efectiva con 5FU/AF, estudiar elpapel que pueden desempeñar los nuevos inhibidores de latimidilato sintasa (capecitabina, raltitrexed, UFT) y quéotras combinaciones del oxaliplatino con otros agentes son activasen cáncer colorrectal avanzado (40).