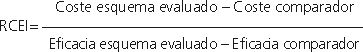Proporcionar estimadores de la eficiencia de esquemas oncológicos empleados en España.
MétodosSe seleccionaron las publicaciones de ensayos clínicos en fase III usados para indicación de las terapias oncológicas de alto impacto empleadas para tratamiento de tumores sólidos en estadíos III-IV. Para cada esquema se calculó la relación coste-eficacia incremental (RCEI) respecto al comparador del ensayo, con la perspectiva del Sistema Nacional de Salud. El coste (€, 2012) farmacológico, en PVL, de cada esquema y comparador se estimó con las unidades de medicamento requeridas en cada administración (aprovechamiento máximo de viales) considerando la posología y el número de ciclos especificado en el ensayo para cada una de las ramas. La efectividad se expresó en meses de supervivencia global (SG) y/o supervivencia libre de progresión (SLP).
ResultadosSe analizaron 40 esquemas oncológicos para trece tumores metastásicos. La SG osciló entre 5,3 y 33,3 meses para las 34 terapias que incluían esa información, con valores de hazard ratio (HR) respecto a sus comparadores de 0,49 a 1,15. La SLP osciló entre 1,5 y 12,4 meses para las 39 terapias con este dato, con HR de 0,33 a 1,52. Los valores de RCEI oscilaron entre 2.142,57 €-60.996,37 €/mes de SG adicional y entre 2.102,54 €-661.845,27 €/mes de SLP adicional.
ConclusiónLa dispersión y heterogeneidad de la supervivencia y RCEI estimadas, sugieren disparidad de criterios en la decisión de precio y financiación de las terapias, en España. Los continuos avances en terapias oncológicas parecen requerir reevaluaciones económicas de los medicamentos.
To provide estimates of the efficiency for chemotherapy strategies used in Spain.
MethodsPublished reports of the phase-III clinical trials for chemotherapies used for the most prevalent solid tumours in Spain were retrieved. The incremental cost-effectiveness ratio (ICER) was calculated for each strategy compared to the control group in the clinical trial, with the National Health System perspective. The total cost (€, 2012) including only drug cost (exfactory price) was estimated based on the total units of each drug required for administration (no vial wastage), with the dosification and number of cycles specified in the publication for each treatment arm. Effectiveness was measured as month of overall survival (OS) and/or month of progression free survival (PFS).
ResultsA total of 40 chemotherapies for 13 different advanced or metastatic tumours were assessed. OS ranged from 5.3 to 33.3 months for the 34 therapies that included the information with hazard ratios (HR) values from 0.49 to 1.15 when compared with its control group. PFS ranged, from 39 therapies with these data, between 1.5 to 12.4 months, with HR from 0.33 to 1.52. ICERs were between €2,142.57 and €60,996.37 per each OS month gained, and from €2,102.54 to €661,845.27 per PFS month gained.
ConclusionsThe variety and heterogenicity of survival and ICERs results, suggest disparity of criteria in the price and reimbursement process of drugs in Spain. The continuous advances in oncology seem to require economic revaluations of drugs.
El cáncer constituye un importante problema de salud pública al que los gobiernos y las administraciones sanitarias destinan cada vez mayores recursos para investigación y tratamiento1.
Las enfermedades cancerosas, en su conjunto, son una patología de una alta incidencia1. En España, según los registros existentes, en el periodo 1998-2002 la incidencia de cáncer fue de entre 324 y 511 casos/100.000 hombres y de entre 204 y 286 casos/100.000 mujeres2.
En los hombres, los tres tumores más frecuentes son el cáncer de próstata, el de pulmón y el colorrectal, suponiendo entre el 55,6 y el 62% del total. El cáncer de mama es el tumor más frecuente en mujeres, responsable de más del 25% de los casos de cáncer, seguido del cáncer de colon y de cuerpo del útero2.
El cáncer fue responsable de más de 98.000 defunciones en el año 2006 en España2. En las últimas décadas los esfuerzos dedicados a su investigación se han traducido en importantes avances con el desarrollo de moléculas que han mejorado ostensiblemente la supervivencia y calidad de vida de los pacientes con cáncer, hasta convertirlo casi, en algunos casos, en una enfermedad crónica3. Esta dualidad del cáncer resulta paradójica, ya que a pesar del aspecto positivo en términos de aumento de la supervivencia, incrementa notablemente el número de pacientes susceptibles de recibir una terapia oncológica.
Esta situación, unida a las condiciones derivadas de la crisis económica y financiera global que estamos viviendo en estos momentos, supone un importante reto para los sistemas sanitarios, que se ven forzados a dedicar una cantidad sustancial de recursos sanitarios, con las limitaciones de disponer de presupuestos restringidos1.
La evaluación económica de tecnologías sanitarias surgió en origen como una herramienta para contribuir de manera decisiva al uso racional de los medicamentos1. Las evaluaciones económicas de fármacos frente al cáncer, pretenden proporcionar información a profesionales médicos, farmacéuticos, gestores sanitarios, pacientes y otros agentes, con el objeto de promover una utilización eficiente de los recursos sanitarios disponibles en este área4.
En los últimos años la evaluación económica se está consolidando en otros sistemas sanitarios, aunque su utilización explícita es destacable principalmente en Reino Unido, con la actividad del National Institute for Care Excellence (NICE), en Canadá con el Common Drug Review (CDR) o en Australia con el Pharmaceutical Benefits Advisory Committee (PBAC). En España, desde el Plan de Calidad para el Sistema Nacional de Salud se ha dado prioridad, a la evaluación de tecnologías sanitarias como soporte de ayuda a las decisiones clínicas5. La reciente propuesta para la creación de un comité Asesor de la Prestación Farmacéutica del Sistema Nacional de Salud con el objeto de reforzar la racionalidad en el ámbito de las decisiones sobre financiación de medicamentos, establecida en el RD 16/20126 y previamente esbozada en el RD 9/2011, con el nombre de Comité de Coste-Efectividad de los Medicamentos y Productos Sanitarios7, constata el creciente interés en este área por parte de las Autoridades. A pesar del incremento experimentado en los últimos años en cantidad y calidad de las publicaciones sobre evaluación económica de tecnologías sanitarias en España5,8, el número de trabajos centrados en enfermedades oncológicas del que se dispone es aún escaso9.
Dentro de la evaluación económica los análisis costeeficacia/coste-efectividad, en concreto, permiten comparar el impacto económico de varias terapias para determinar qué opción de tratamiento representa el mejor valor del dinero invertido9,10. Habitualmente una terapia se considera coste-efectiva si su relación entre el coste incremental y los beneficios clínicos incrementales (relación coste-efectividad/coste-eficacia incremental-RCEI) es inferior al umbral de aceptabilidad definido4. En caso de no disponer de umbrales de aceptabilidad explícitos, una terapia puede considerarse coste-efectiva si su RCEI se encuentra en el rango de otras terapias para las que los gestores sanitarios han demostrado disponibilidad a pagar4.
La Organización Mundial de la Salud propone establecer tres categorías: estrategias altamente coste-efectivas aquellas con RCEI inferiores a la renta per cápita; estrategias coste-efectivas las que presenten valores de RCEI superiores a la renta per cápita, pero inferiores a tres veces la renta per cápita; y estrategias no coste-efectivas aquellas con RCEI por encima de tres veces la renta per cápita11.
En España ante la ausencia de directrices oficiales concretas para el desarrollo de evaluaciones económicas, así como de un umbral de eficiencia o disponibilidad a pagar explícito, nos encontramos con un vacío sobre los criterios objetivos de financiación por el sistema público de los nuevos medicamentos.
El objetivo del presente análisis es proporcionar estimadores de la eficiencia de esquemas con fármacos oncológicos de alto impacto empleados en España, como punto de partida para una reflexión del Sistema Nacional de Salud y los agentes decisores involucrados, en relación al tratamiento del cáncer.
MétodosEl presente análisis para estimación de la relación coste-eficacia de terapias oncológicas empleadas en España, se realizó con el programa Microsoft Excel 2010.
Se seleccionaron las terapias oncológicas de alto impacto, por su elevado coste o su elevada prevalencia, empleadas en España para tratamiento de tumores sólidos en fases avanzadas (Tabla 1). No se incluyeron terapias utilizadas para tratamientos de neoplasias hematológicas, ni otro tipo de fármacos de soporte asociados al tratamiento oncológico como factores estimulantes de colonias, estimulantes de eritropoyesis y fármacos relacionados con prevención de eventos derivados de la enfermedad metastásica.
Esquemas oncológicos identificados, comparadores, tumores y perfil de pacientes analizado en los ensayos clínicos
| Localización tumor | Esquema | Comparador |
|---|---|---|
| 1a LÍNEA | ||
| CABEZA Y CUELLOCarcinoma metastásico de células escamosas de cabeza y cuello | Cetuximab+platino+fluorouracilo67Dosis inicial de 400 mg/m2 de cetuximab i.v., seguida de dosis semanales de 250 mg/m2 hasta progresión Máximo de 6 ciclos cada 3 semanas de cuatro dosis de 1.000 mg/m2al día de fluororuracilo i.v. en combinación con platino (100 mg/m2 de cisplatino i.v. o carboplatino i.v. para un ABC=5) el día 1 | Platino+fluorouraciloMáximo de 6 ciclos cada 3 semanas de cuatro dosis de 1.000 mg/m2 al día de fluororuracilo i.v. en combinación con platino (100 mg/m2 de cisplatino i.v. o carboplatino i.v. para un ABC=5) |
| CÉLULAS RENALESCarcinoma de células renales metastásico | Bevacizumab+IFN alfa-2a35,3610 mg/kg de bevacizumab i.v. cada 2 semanas hasta progresión y 9MUI de IFN, 3 veces/semana hasta máximo de 52 semanas | Placebo+IFN alfa-2a9MUI de IFN s.c., 3 veces/semana hasta máximo de 52 semanas |
| Pazopanib52800 mg diarios orales de pazopanib hasta progresión | Placebo | |
| Sunitinib50Ciclos de 50 mg diarios orales en 4 semanas con 2 semanas de descanso de sunitinib | IFN alfa-2a3 dosis semanales con 3MUI/dosis en la 1a semana, 6MUI/dosis en la 2a semana y 9MUI/dosis en el resto de IFN alfa-2a s.c. | |
| Temsirolimus4225 mg semanales de temsirolimus i.v. hasta progresión | IFN alfa-2a3 dosis semanales con 3MUI/dosis en la 1a semana, 9MUI/dosis en la 2a semana y 18MUI/dosis en el resto de IFN alfa-2a s.c. | |
| COLORRECTALCarcinoma colorrectal metastásico | Bevacizumab+irinotecan+ fluororuracil+leucovorin435 mg/kg de bevacizumab i.v. cada 2 semanas hasta progresiónCiclos i.v. cada 6 semanas de 125 mg/m2 de irinotecan, 500 mg/m2 de fluorouracil y 20 mg/m2 de leucovorin, semanales hasta progresión | Placebo+irinotecan+fluorouracil+leuc ovorínCiclos cada 6 semanas de 125 mg/m2 de irinotecan, 500 mg/m2 de fluorouracil y 20 mg/m2 de leucovorin, semanales hasta progresión |
| Bevacizumab+FOLFOX-4407,5 mg/kg de bevacizumab i.v. cada 2 semanas en combinación con FOLFOX-4 hasta progresión | FOLFOX-4Ciclos cada 2 semanas de 85 mg/m2 de oxaliplatino i.v., 200 mg/m2 de leucovorin i.v. y 400 mg/m2 de fluorouracil i.v. en bolus seguido de 600 mg/m2 de fluorouracil en infusión continua en días 1 y 2 de cada ciclo, hasta progresión | |
| Cetuximab+FOLFIRI54Dosis inicial de 400 mg/m2 de cetuximab i.v., seguida de dosis semanales de 250 mg/m2 hasta progresión Ciclos cada 2 semanas de 180 mg/m2 de irinotecan i.v., 200 mg/m2 de leucovorin i.v. y 400 mg/m2 de fluorouracil i.v. en bolus seguido de 2.400 mg/m2 de fluorouracil en infusión continua durante 2 días, hasta progresión | FOLFIRICiclos cada 2 semanas de 180 mg/m2 de irinotecan i.v., 200 mg/m2 de leucovorin i.v. y 400 mg/m2 de fluorouracil i.v. en bolus seguido de 2.400 mg/m2 de fluorouracil en infusión continua durante 2 días, hasta progresión | |
| ADENOCARCINOMA GÁSTRICO | Trastuzumab+quimioterapia288 mg/kg en inducción, y 6 mg/kg cada 3 semanas hasta progresión | Quimioterapia |
| HÍGADOCarcinoma hepatocelular avanzado | Sorafenib57400 mg diarios orales de sorafenib hasta progresión | Placebo |
| MAMA | Bevacizumab+paclitaxel5810 mg/kg de bevacizumab i.v. cada 2 semanas hasta progresión90 mg/m2 de paclitaxel en días 1, 8 y 15 de cada ciclo de 28 días hasta progresión | Paclitaxel90 mg/m2 de paclitaxel en días 1, 8 y 15 de cada ciclo de 28 días hasta progresión |
| Bevadzumab+capecitabina5915 mg/kg de bevacizumab i.v. cada 3 semanas hasta progresión1.000 mg/m2 de capecitabina oral, dos veces diaria durante 14 días de cada ciclo de 3 semanas | Placebo+capecitabina | |
| Lapatinib+letrozol441.500 mg diarios de lapatinib oral hasta progresión 2,5 mg diarios de letrozol oral hasta progresión | Placebo+letrozol2,5 mg diarios de letrozol oral hasta progresión | |
| Trastuzumab+paclitaxel604 mg/kg de trastuzumab i.v. en inducción y 2 mg/kg semanales hasta progresión 175 mg/m2 de paclitaxel i.v. cada 3 semanas durante 6 ciclos | Paclitaxel175 mg/m2 de paclitaxel i.v. cada 3 semanas durante 6 ciclos | |
| Trastuzumab+anastrozol464 mg/kg de trastuzumab i.v. en inducción y 2 mg/kg semanales hasta progresión 1 mg diario de anastrozol oral | Anastrozol1 mg diario de anastrozol oral | |
| Doxorubicina liposomal+ciclofosfamida3175 mg/m2 de doxorubicina liposomal i.v. cada 3 semanas hasta progresión o máximo de 8 ciclos 600 mg/m2 de ciclofosfamida cada 3 semanas hasta progresión o máximo de 8 ciclos | Epirubicina+ciclofosfamida75 mg/m2 de epirubicina i.v. cada 3 semanas hasta progresión o máximo de 8 ciclos 600 mg/m2 de ciclofosfamida cada 3 semanas hasta progresión o máximo de 8 ciclos | |
| PÁNCREAS | Erlotinib+gemcitabina61150 mg diarios orales de erlotinib 1.000 mg/m2 de gemcitabina i.v. en días 1, 8, 15, 22,29, 36 y 43 con una semana de descanso y en días 1, 8 y 15 de los restantes ciclos de 4 semanas | Placebo+gemcitabina1.000 mg/m2 de gemcitabina i.v. en días 1, 8, 15, 22,29, 36 y 43 con una semana de descanso y en días 1, 8 y 15 de los restantes ciclos de 4 semanas |
| PULMÓNCáncer de pulmón de células no microcíticas | Bevacizumab+paclitaxel+ carboplatino6415 mg/kg de bevacizumab i.v. cada 3 semanas hasta progresión200 mg/m2 de paclitaxel y carboplatino para un ABC=6, cada 3 semanas hasta máximo de 6 ciclos | Paclitaxel+carboplatino200 mg/m2 de paclitaxel y carboplatino para un ABC=6 cada 3 semanas hasta máximo de 6 ciclos |
| Pemetrexed+cisplatino66500 mg/m2 de pemetrexed y 75 mg/m2 de cisplatino y cada 3 semanas hasta máximo de 6 ciclos | Cisplatino+gemcitabina75 mg/m2 de cisplatino cada 3 semanas y 1.250 mg/m2 de gemcitabina en días 1 y 8 cada 3 semanas, hasta máximo de 6 ciclos | |
| 2a LÍNEA | ||
| CÉLULAS RENALES | Everolimus+BSC4910 mg diarios orales de everolimus | Placebo+BSC |
| Pazopanib52800 mg diarios orales de pazopanib hasta progresión | Placebo | |
| Sorafenib37400 mg dos veces al día orales de sorafenib, administrados en ciclos de 6 semanas para las 24 primeras semanas y en ciclos de 8 semanas para el resto, hasta progresión | Placebo | |
| COLORRECTAL | Bevacizumab+FOLFOX-45110 mg/kg de bevacizumab i.v. cada 2 semanas en combinación con FOLFOX-4 hasta progresión | FOLFOX-4Ciclos cada 2 semanas de 85 mg/m2 de oxaliplatino i.v., 200 mg/m2 de leucovorin i.v. y 400 mg/m2 de fluorouracil i.v. en bolus seguido de 600 mg/m2 de fluorouracil en infusión continua en días 1 y 2 de cada ciclo, hasta progresión |
| Cetuximab+irinotecan34Dosis inicial de 400 mg/m2 de cetuximab i.v., seguida de dosis semanales de 200 mg/m2 hasta progresión 180 mg/m2 de irinotecan cada 2 semanas hasta progresión | CetuximabDosis inicial de 400 mg/m2 de cetuximab i.v., seguida de dosis semanales de 200 mg/m2 hasta progresión | |
| Cetuximab+BSC45Dosis inicial de 400 mg/m2 de cetuximab i.v., seguida de dosis semanales de 200 mg/m2 hasta progresión | BSC | |
| Panitumumab+BSC536 mg/kg de panitumumab i.v. cada 2 semanas hasta progresión | BSC | |
| Panitumumab+FOLFIRI556 mg/kg de panitumumab i.v. cada 2 semanas hasta progresión. Ciclos cada 2 semanas de 180 mg/m2 de irinotecan i.v., 400 mg/m2 de leucovorin i.v. y 400 mg/m2 de fluorouracil i.v. en bolus seguido de 2.400 mg/m2 de fluorouracil en infusión continua durante 2 días, hasta progresión | FOLFIRICiclos cada 2 semanas de 180 mg/m2 de irinotecan i.v., 400 mg/m2 de leucovorin i.v. y 400 mg/m2 de fluorouracil i.v. en bolus seguido de 2.400 mg/m2 de fluorouracil en infusión continua durante 2 días, hasta progresión | |
| GASTROINTESTINAL | Sunitinib5650 mg diarios orales de sunitinib durante 4 semanas, con 2 semanas de descanso | Placebo |
| MAMA | Lapatinib+capecitabina30,391.250 mg diarios de lapatinib hasta progresión 2.000 mg/m2 de capecitabina en 2 días de cada ciclo de 3 semanas hasta progresión | Capecitabina2.500 mg/m2 de capecitabina en 2 días de cada ciclo de 3 semanas hasta progresión |
| Doxorubicina liposomal pegilada (DLP)4750 mg/m2 de Doxorubicina liposomal pegilada i.v. cada 4 semanas | Vinorelbina o mitomicina C+vinblastina30 mg/m2 de vinorelbina i.v. semanal ó 10 mg/m2 diarios de mitomicina C i.v. cada 4 semanas con 5 mg/m2 de vinblastina i.v. en días 1 y 14 de los 2 primeros ciclos de 4 semanas y en días 1 y 21 de cada ciclo de 4 semanas posterior | |
| OVARIO | Trabectedina+DLP481,1 mg/m2 de trabectedina i.v. y 30 mg/m2 de DLP i.v., cada 3 semanas hasta progresión | DLP50 mg/m2 de DLP i.v. cada 3 semanas hasta progresión |
| Bevacizumab+gemcitabina+carboplatino15 mg/kg de bevacizumab i.v. cada 3 semanas 1.000 mg/m2 de gemcitabina i.v. en días 1 y 8 de cada ciclo de 3 semanas y unmáximo de 10 ciclos de carboplatino i.v. para un ABC=4 en ciclos de 3 semanas | Gemcitabina+carboplatino1.000 mg/m2 de gemcitabina i.v. en días 1 y 8 de cada ciclo de 3 semanas y unmáximo de 10 ciclos de carboplatino i.v. para un ABC=4 en ciclos de 3 semanas | |
| PRÓSTATA | Cabazitaxel6225 mg/m2 de cabazitaxel i.v. cada 3 semanas hasta máximo de 10 ciclos | Mitoxantrona12 mg/m2 de mitoxantrona i.v. cada 3 semanas hasta máximo de 10 ciclos |
| Abiraterona38,631g diario oral de abiraterona hasta progresión | Placebo | |
| PULMÓN | Erlotinib65150 mg diarios orales de erlotinib | Placebo |
| Erlotinib33150 mg diarios orales de erlotinib | Quimioterapia (docetaxel o pemetrexed)500 mg/m2 de pemetrexed i.v. cada 3 semanas o 75 mg/m2 de docetaxel i.v. cada 3 semanas | |
| Pemetrexed41500 mg/m2 de pemetrexed i.v. cada 3 semanas hasta progresión | Docetaxel75 mg/m2 de docetaxel i.v. cada 3 semanas | |
| Pemetrexed+BSC32500 mg/m2 de pemetrexed i.v. cada 3 semanas hasta progresión | Placebo+BSC | |
| VEJIGA | Vinflunina29320 mg/m2 de vinflunina i.v. cada 3 semanas hasta progresión | Placebo |
| MELANOMA | Ipilimumab683 mg/kg de ipilimumab i.v. cada 3 semanas con máximo de 4 ciclos | Placebo+vacuna péptido gp100 |
ABC: área bajo la curva; BSC: Best supportive care; IFN: Interferón
Para cada terapia o esquema oncológico identificado se localizaron las publicaciones existentes hasta septiembre 2012, de los resultados de los ensayos clínicos en fase III, considerados pivotales y que avalan, por tanto, la indicación autorizada de cada una de las terapias evaluadas.
Para cada uno de los esquemas terapéuticos evaluados, se calculó la RCEI respecto al comparador del ensayo clínico pivotal de acuerdo con la siguiente fórmula:
La eficacia se expresó en meses de supervivencia global (SG) y/o en meses de supervivencia libre de progresión (SLP) en función de la información disponible en las publicaciones seleccionadas.
En aquellos casos con ausencia de datos de SLP, se acordó considerar como variable de eficacia el tiempo transcurrido hasta la progresión (TTP), si este dato se incluía en la publicación12.
Como coste de las terapias analizadas, se consideró únicamente el coste farmacológico de los esquemas oncológicos, sin considerar otros posibles costes asociados, como el coste de administración, el coste de premedicación o medicación concomitante o el coste de manejo de acontecimientos adversos experimentados con las terapias evaluadas.
El coste farmacológico se calculó en función del PVL de los medicamentos considerados, resultante de la aplicación de los márgenes comerciales establecidos13 sobre el PVP-IVA del Catálogo del Consejo General de Colegios Oficiales de Farmacéuticos14, y con la correspondiente deducción (4%, 7,5% ó 15%) sobre el PVL establecida por el RD 8/201015 y proporcionada por el Ministerio de Sanidad, Servicios Sociales e Igualdad con fecha Octubre-201216. Para aquellos medicamentos en los que existían formulaciones genéricas, se escogió la de precio menor. En la tabla 2 se especifican los PVL considerados.
Precio de los medicamentos incluidos en el análisis (€, 2012)
| Principio activo | Medicamento | PVP IVA por presentación | PVL por presentación | PVL con deducción |
|---|---|---|---|---|
| Abiraterona | Zytiga®, 250 mg, 120 compr | 3.594,15 € | 3.400,00 € | 3.145,00 €* |
| Anastrozol | Arimidex®, 1 mg 28 compr | 60,09 € | 38,49 € | 38,49 € |
| Bevacizumab | Avastin®, 25 mg/mL, 1 vial 4 mL | 408,32 € | 341,71 € | 316,08 €* |
| Avastin®, 25 mg/mL, 1 vial 16 mL | 1.381,95 € | 1.272,89 € | 1.177,42 €* | |
| Cabazitaxel | Jevtana®, 40 mg/mL, 1 vial 1,5 mL | 4.322,15 € | 4.100,00 € | 3.792,50 €* |
| Capecitabina | Xeloda®, 150 mg, 60 compr | 80,94 € | 51,85 € | 47,96 €* |
| Xeloda®, 500 mg, 120 compr | 410,75 € | 344,04 € | 318,24 €* | |
| Carboplatino | Carboplatino Teva EFG, 50 mg, 1 vial 5 mL | 11,93 € | 7,64 € | 7,64 € |
| Carboplatino Teva EFG, 150 mg, 1 vial 15 mL | 35,78 € | 22,92 € | 22,92 € | |
| Carboplatino Teva EFG, 450 mg, 1 vial 45 mL | 107,34 € | 68,78 € | 68,76 € | |
| Carboplatino Teva EFG, 600 mg, 1 vial 60 mL | 143,12 € | 91,71 € | 91,71 € | |
| Cetuximab | Erbitux®, 5 mg/mL, 1 vial 20 mL | 247,74 € | 192,30 € | 177,88 €* |
| Ciclofosfamida | Genoxal®, 1g, 1 vial polvo sol. | 12,08 € | 7,74 € | 7,16 €* |
| Genoxal®, 200 mg 1 vial Genoxal®, 50 mg 20 grageas | 6,70 € | 4,29 € | 3,97 €* | |
| Cisplatino | Cisplatino Actavis EFG, 10 mg, 1 vial 10 mL | 3,48 € | 2,23 € | 2,23 € |
| Cisplatino Actavis EFG, 50 mg, 1 vial 50 mL | 17,44 € | 11,17 € | 11,17 € | |
| Cisplatino Actavis EFG, 25 mg, 1 vial 50 mL | 8,71 € | 5,58 € | 5,58 € | |
| Cisplatino Pharmacia EFG, 100 mg, 1 vial 100 mL | 34,87 € | 22,34 € | 22,34 € | |
| Doxorubicina liposomal | Myocet®, 50 mg 2 viales | 1.053,61 € | 957,18 € | 813,60 €* |
| Doxorubicina liposomal pegilada | Caelyx®, 20 mg 1 vial 10 mL | 437,60 € | 369,86 € | 314,38 €¥ |
| Docetaxel | Docetaxel Ebewe, 10 mg/mL, 1 vial 16 mL | 418,78 € | 351,76 € | 351,76 € |
| Docetaxel Actavis, 20 mg/mL, 1 vial 7 mL | 373,05 € | 307,79 € | 307,79 € | |
| Docetaxel Teva EFG, 40 mg/mL, 1 vial 2 mL | 230,66 € | 175,88 € | 175,88 € | |
| Epirubicina | Epirubicina Accord EFG, 10 mg 1 vial 5 mL | 7,04 € | 4,51 € | 4,51 € |
| Epirubicina Accord EFG, 20 mg 1 vial 10 mL | 14,11 € | 9,04 € | 9,04 € | |
| Epirubicina Accord EFG, 50 mg 1 vial 25 mL | 35,26 € | 22,59 € | 22,59 € | |
| Epirubicina Accord EFG, 200 mg 1 vial 100 mL | 141,09 € | 90,38 € | 90,38 € | |
| Erlotinib | Tarceva®, 25 mg, 30 compr | 546,28 € | 474,36 € | 438,78 €* |
| Tarceva®, 100 mg, 30 compr | 1.784,61 € | 1.660,06 € | 1.535,56 €* | |
| Tarceva®, 150 mg, 30 compr | 2.185,34 € | 2.045,38 € | 1.891.98 €* | |
| Everolimus | Afinitor®, 5 mg, 30 compr | 2.693,04 € | 2.533,55 € | 2.432,21 €f |
| Afinitor®, 10 mg, 30 compr | 3.491,16 € | 3.300,97 € | 3.168,94 €f | |
| Fluorouracilo | Fluorouracilo Accord EFG, 50 mg/mL, 1 vial 5 mL | 2,19 € | 1,40 € | 1,40 € |
| Fluorouracilo Accord EFG, 50 mg/mL, 1 vial 100 mL | 17,31 € | 11,09 € | 11,09 € | |
| Gefitinib | Iressa®, 250 mg, 30 compr | 2.185,34 € | 2.045,38 € | 1.891,98 €* |
| Gemcitabina | Gemcitabina Accord EFG, 200 mg, 1 vial | 13,64 € | 8,74 € | 8,74 € |
| Gemcitabina Accord EFG, 1g, 1 vial | 68,22 € | 43,70 € | 43,70 € | |
| Gemcitabina Medac, 1,5g, 1 vial | 102,33 € | 65,55 € | 65,55 € | |
| Gemcitabina Actavis EFG, 2 g, 1 vial | 136,44 € | 87,40 € | 87,40 € | |
| Interferon alfa-2a | Roferon®, 3MUI, 6 jeringas, 0,5 mL | 135,77 € | 86,97 € | 73,92 €¥ |
| Roferon®, 4,5MUI, 6 jeringas, 0,5 mL | 178,42 € | 125,65 € | 106,80 €¥ | |
| Roferon®, 6MUI, 6 jeringas, 0,5 mL | 219,75 € | 165,39 € | 140,58 €¥ | |
| Roferon®, 9MUI, 6 jeringas, 0,5 mL | 305,19 € | 242,54 € | 206,16 €¥ | |
| Ipilimumab | Yervoy®, 5 mg/mL 40 mL | 17.738,15 € | 17.000,00 € | 15.725,00 €* |
| Yervoy®, 5 mg/mL 10 mL | 4.478,15 € | 4.478,15 € | 3.931,25 €* | |
| Irinotecán | Irinotecan GP-Pharm EFG, 40 mg, 1 vial 2 mL | 13,46 € | 8,62 € | 8,62 € |
| Irinotecan GP-Pharm EFG, 100 mg, 1 vial 5 mL | 33,64 € | 21,55 € | 21,55 € | |
| Irinotecan GP-Pharm EFG, 300 mg, 1 vial 15 mL | 100,92 € | 64,65 € | 64,65 € | |
| Irinotecan GP-Pharm EFG, 500 mg, 1 vial 25 mL | 159,81 € | 107,75 € | 107,75 € | |
| Lapatinib | Tyverb®, 250 mg, 140 compr | 2.167,89 € | 2.028,60 € | 1.876,46 €* |
| Letrozol | Femara®, 2,5 mg, 30 compr | 92,10 € | 59,00 € | 59,00 € |
| Leucovorina(folinato cálcico) | Folinato cálcico Teva EFG, 50 mg, 1 ampolla 5 mL | 5,29 € | 3,39 € | 3,39 € |
| Folinato cálcico Teva EFG, 50 mg, 5 ampollas 5 mL | 26,44 € | 16,94 € | 16,94 € | |
| Folinato cálcico Teva EFG, 300 mg, 1 ampolla 30 mL | 31,74 € | 20,33 € | 20,33 € | |
| Mitomicina C | Mitomycin C (2 mg, 10 viales) | 37,56 € | 24,06 € | 20,45 € |
| Mitomycin C (10 mg, 1 vial) | 20,93 € | 13,41 € | 11,40 € | |
| Mitoxantrona | Mitoxantrona Ferrer Farm EFG, 2 mg/mL, 1 vial 10 mL | 122,08 € | 78,20 € | 78,20 € |
| Oxaliplatino | Oxaliplatino GP-Pharm EFG, 5 mg/mL, 1 vial 10 mL | 99,27 € | 63,59 € | 63,59 € |
| Oxaliplatino GP-Pharm EFG, 5 mg/mL, 1 vial 20 mL | 180,00 € | 127,17 € | 127,17 € | |
| Oxaliplatino Ratiopharm EFG, 5 mg/mL, 1 vial 30 mL | 246,14 € | 190,76 € | 190,76 € | |
| Oxaliplatino Accord EFG, 5 mg/mL, 1 vial 40 mL | 317,46 € | 254,34 € | 254,34 € | |
| Paclitaxel | Paclitaxel Stada EFG, 6 mg/mL, 1 vial 5 mL | 61,30 € | 39,27 € | 39,27 € |
| Paclitaxel Stada EFG, 6 mg/mL, 1 vial 16,7 mL | 159,21 € | 107,18 € | 107,18 € | |
| Paclitaxel Teva EFG, 6 mg/mL, 1 vial 25 mL | 251,94 € | 196,34 € | 196,34 € | |
| Paclitaxel Stada EFG, 6 mg/mL, 1 vial 50 mL | 461,32 € | 392,67 € | 392,67 € | |
| Panitumumab | Vectibix®, 20 mg/mL, 1 vial 5 mL | 469,08 € | 400,13 € | 370,12 €* |
| Vectibix®, 20 mg/mL, 1 vial 10 mL | 890,15 € | 800,00 € | 740,00 €* | |
| Vectibix®, 20 mg/mL, 1 vial 20 mL | 1.722,1 5 € | 1.600,00 € | 1.480,00 €* | |
| Pazopanib | Votrient®, 200 mg, 30 compr | 873,49 € | 783,98 € | 725,19 €* |
| Votrient®, 400 mg, 60 compr | 2.947,89 € | 2.778,60 € | 2.570,20 €* | |
| Pemetrexed | Alimta®, 100 mg, 1 vial | 302,55 € | 240,00 € | 222,00 €* |
| Alimta®, 500 mg, 1 vial | 1.306,15 € | 1.200,00 € | 1.110,00 €* | |
| Sorafenib | Nexavar®, 200 mg, 112 compr | 3.603,63 € | 3.409,12 € | 3.272.76 €† |
| Sunitinib | Sutent®, 12,5 mg, 30 cápsulas | 1.382,08 € | 1.273,01 € | 1.177,54 €* |
| Sutent®, 25 mg, 30 cápsulas | 2.700,19 € | 2.540,43 € | 2.349,89 €* | |
| Sutent®, 50 mg, 30 cápsulas | 5.312,42 € | 5.052,19 € | 4.673,27 €* | |
| Temsirolimus | Torisel®, 25 mg/mL, 1 vial 1 mL | 968,15 € | 875,00 € | 840,00 €† |
| Trabectedina | Yondelis®, 0,25 mg, 1 vial | 609,35 € | 530,00 € | 508,80 €† |
| Yondelis®, 1 mg, 1 vial | 2.131,91 € | 1.994,00 € | 1.914,24 €† | |
| Trastuzumab | Herceptin®, 150 mg, 1 vial | 678,53 € | 596,52 € | 551,78 €* |
| Vinblastina | Vinblastina EFG, 10 mg 1 vial | 12,49 € | 8,00 € | 6,80 €¥ |
| Vinflunina | Javlor®, 25 mg/mL 1 vial 10 mL (tapón butilo) | 942,15 € | 850,00 € | 786,25 €* |
| Javlor®, 25 mg/mL 1 vial 2 mL (tapón butilo) | 224,55 € | 170,00 € | 157,25 €* | |
| Javlor®, 25 mg/mL 1 vial 2 mL (tapón clorbutilo) | 224,55 € | 170,00 € | 157,25 €* | |
| Vinorelbina | Vinorelbina IPS, 10 mg/mL 1 vial 1 mL | 4,26 € | 2,73 € | 2,73 € |
| Vinorelbina IPS, 10 mg/mL 1 vial 1 mL | 21,34 € | 13,67 € | 13,67 € |
♦ Deducción del 7,5%; ¥Deducción del 15%; † Deducción del 4% (medicamento huérfano)
El coste farmacológico total para cada esquema oncológico y cada comparador se estimó en base a las unidades estrictas de cada medicamento requeridas en cada administración, es decir, asumiendo un aprovechamiento máximo de los viales, y considerando la posología y el número promedio de ciclos o administraciones especificado en cada ensayo para cada una de las ramas. En aquellos casos en los que no se especificaba explícitamente la duración mediana de tratamiento, y en los que se mencionaba que la terapia se mantendría hasta progresión de la enfermedad se asumió como duración de tratamiento el valor de SLP.
En el análisis se asumieron meses de 30,4 días17.
Para los esquemas oncológicos que se administran en función de las características antropométricas de los pacientes, se consideraron valores 70,15 kg de peso y 1,78 m2 de superficie corporal en población general18. Para los casos concretos de tumores que afectan a población femenina (cáncer de mama y cáncer de ovario) se emplearon valores de 64,3 kg de peso y 1,68 m2 de superficie corporal; y para el caso de tumores que afectan exclusivamente a población masculina (cáncer de próstata) se asumieron valores de 76,4 kg de peso y 1,89 m2 de superficie corporal18. La administración de carboplatino, para obtener el área bajo la curva (ABC) deseada, viene determinada por la tasa de filtración glomerular (TFG). En el presente trabajo se utilizó la fórmula de Calvert para estimar los miligramos de carboplatino necesarios en cada administración19.
El análisis realizado no se restringe a un horizonte temporal común, sino que considera la duración total de cada tratamiento. Dada la limitada supervivencia de los pacientes afectados por los tumores evaluados, ninguno de los esquemas oncológicos superó el año de tratamiento y no fue oportuna la aplicación correctora de la tasa de descuento.
Todos los costes incluidos en el análisis se expresaron en euros (€) del año 2012.
ResultadosInicialmente se identificaron 47 esquemas oncológicos para trece tipos diferentes de tumores sólidos en fase avanzada o metastásica.
Tras una primera fase de revisión de los resultados de los estudios seleccionados, se eliminaron los siguientes cuatro esquemas por no detallar en la publicación correspondiente los datos necesarios para el cálculo de alguno de los RCEIs (ausencia de datos de mediana de SG, SLP y/o TTP, o ausencia de datos sobre el consumo farmacológico o la duración del tratamiento imprescindibles para el cálculo del coste de las alternativas evaluadas): imatinib vs placebo como tratamiento en 1a línea de GIST20, paclitaxel-albúmina vs paclitaxel en cáncer de mama21, doxorrubicina liposomal pegilada (DLP) vs topotecan en cáncer de ovario22 y gefitinib vs asociación de paclitaxel y carboplatino en cáncer de pulmón de células no microcíticas23.
Por ausencia de PVL oficial en España o de PVL autorizado para la indicación evaluada en el estudio identificado (a fecha septiembre 2012), se eliminaron otros tres esquemas: eribulina vs quimioterapia para tratamiento en líneas avanzadas del cáncer de mama24, vemurafenib vs dacarbazina25 en melanoma y panitumumab combinado con FOLFOX vs FOLFOX como terapia de 1a línea en cáncer colorrectal metastásico26.
En la tabla 1 se detallan los cuarenta esquemas finalmente seleccionados para el análisis27-68.
De ellos, 19 (47,5%) eran terapias de 1a línea de tratamiento, las otras 21 eran terapias indicadas a partir de 2a línea de tratamiento.
Un 27,5% (n=11) de los regímenes evaluados no incluían información sobre mediana de SG o mediana de SLP. En tres53,56,59 de los seis casos sin dato de mediana de SG, si se incluía el valor de hazard ratio para ese parámetro. En cuatro31,34,57,60 de los cinco esquemas sin datos de SLP, la publicación incluía dato de TTP, que se asumieron como equiparables a SLP para el cálculo de la RCEI en €/mes de SLP adicional. La terapia restante sin dato de SLP, incluía únicamente el valor de hazard ratio para la SLP.
La tabla 3 recoge los meses de SG y SLP o TTP de cada esquema oncológico considerado y su correspondiente comparador en el ensayo clínico, con el valor hazard ratio estimado en cada caso. La SG osciló entre 5,3 y 33,3 meses para las 34 terapias que incluían esa información en la publicación del ensayo clínico, con valores de hazard ratio respecto a los correspondientes comparadores de entre 0,49 y 1,15 para los 37 esquemas con ese dato. La SLP osciló entre 1,5 y 12,4 meses para las 39 terapias en las que se reportó este dato (incluyendo los cuatro esquemas con TTP en lugar de SLP), con valores de hazard ratio respecto al comparador de 0,33 a 1,52.
Resultados de supervivencia (SG y SLP) de los esquemas oncológicos y los comparadores
| TUMOR | Esquema terapéutico | Comparador | SG (meses) | SLP/TTP (meses) | ||||
|---|---|---|---|---|---|---|---|---|
| Esquema | Comparador | HR | Esquema | Comparador | HR | |||
| 1a LÍNEA | ||||||||
| CABEZA Y CUELLO | Cetuximab+platino+fluorouracilo67Duración de tratamiento (mediana): 18 semanas de cetuximab, 15 semanas de cisplatino (67%) o 18 semanas de carboplatino (33%) y 17 semanas de fluorouracilo | Platino+fluorouraciloDuración de tratamiento (mediana):12 semanas de cisplatino (61%) o13 semanas de carboplatino (39%) y 13 semanas de fluorouracilo | 10,1 | 7,4 | 0,80 | 5,6 | 3,3 | 0,54 |
| CÉLULAS RENALES | Bevacizumab+IFN alfa-2a35,36Duración de tratamiento (mediana):42 semanas de bevacizumab y 34 semanas de IFN | Placebo+IFN alfa-2aDuración de tratamiento (mediana): 27 semanas de IFN | 23,335 | 21,335 | 0,9135 | 10,236 | 5,436 | 0,6336 |
| Pazopanib52Duración de tratamiento (mediana): 7,4 meses* | Placebo | ND | ND | 11,1 | 2,8 | 0,40 | ||
| Sunitinib50Duración de tratamiento (mediana): 11 meses | IFN alfa-2aDuración de tratamiento (mediana): 4 meses | 26,4 | 21,8 | 0,82 | 11,0 | 5,0 | 0,54 | |
| Temsirolimus42Duración de tratamiento (mediana): 17 semanas | IFN alfa-2aDuración de tratamiento (mediana): 8 semanas | 10,9 | 7,3 | 0,73 | 3,8 | 1,9 | ND | |
| COLORRECTAL | Bevacizumab+irinotecan+ fluororuracil+ leucovorina43Duración de tratamiento (mediana): 40,4 semanas | Placebo+irinotecan+fluorourac il+leucovorínDuración de tratamiento (mediana): 27,6 semanas | 20,3 | 15,6 | 0,66 | 10,6 | 6,2 | 0,54 |
| Bevacizumab+FOLFOX451Duración de tratamiento (mediana): 12 ciclos | FOLFOX4Duración de tratamiento (mediana): 12 ciclos | 21,2 | 20,3 | 0,94 | 9,4 | 8,6 | 0,890,89 | |
| Cetuximab+FOLFIRI54Duración de tratamiento (mediana):25 semanas de cetuximab y 26 semanas deFOLFIRI | FOLFIRIDuración de tratamiento (mediana): 25,7 semanas | 19,9 | 18,6 | 0,93 | 8,9 | 8,0 | 0,85 | |
| ADENOCARCINOMA GÁSTRICO | Trastuzumab+quimioterapia28Duración de tratamiento (mediana): 8 ciclos | Quimioterapia | 13,8 | 11,1 | 0,74 | 6,7 | 5,5 | 0,71 |
| CARCINOMA HEPATOCELULAR | Sorafenib57Duración de tratamiento (mediana): 5,3 meses | Placebo | 10,7 | 7,9 | 0,69 | 4,1¥ | 4,9¥ | 1,08¥ |
| MAMA | Bevacizumab+paclitaxel58Duración de tratamiento (mediana): 7,1 meses de terapia combinada y 3,7 meses adicionales de bevacizumab en monoterapia | PaclitaxelDuración de tratamiento (mediana): 5,1 meses | 26,7 | 25,2 | 0,88 | 11,8 | 5,9 | 0,60 |
| Bevacizumab+capecitabina59 | Placebo+capecitabina | ND | ND | 0,85 | 8,6 | 5,7 | 0,69 | |
| Duración de tratamiento (mediana): 11,2 ciclos de bevacizumab y 10,3 ciclos de capecitabina | Duración de tratamiento (mediana):8,7 ciclos | |||||||
| Lapatinib+letrozol44 | Placebo+letrozol | 33,33 | 2,3 | 0,74 | 8,2 | 3,0 | 0,71 | |
| Duración de tratamiento (mediana): 40 semanas | Duración de tratamiento (mediana): 38 semanas | |||||||
| Trastuzumab+paclitaxel60 | Paclitaxel | 22,1 | 18,4 | 0,80 | 6,9¥ | 3,0¥ | 0,38¥ | |
| Duración de tratamiento (mediana): 36 dosis de trastuzumab | ||||||||
| Trastuzumab+anastrozol46 | Anastrozol | 28,5 | 23,9 | ND | 4,80 | 2,40 | 0,63 | |
| Duración de tratamiento (mediana):25 infusiones de trastuzumab y 189 dosis de anastrozol | Duración de tratamiento (mediana):98 dosis | |||||||
| Doxorrubicina liposomal+ ciclofosfamida31Duración de tratamiento (mediana): 5,7 meses | Epirubicina+ciclofosfamidaDuración de tratamiento (mediana): 4,4 meses | 18,3 | 16,0 | 1,15 | 7,7¥ | 5,6¥ | 1,52¥ | |
| PÁNCREAS Erlotinib+gemcitabina61 | Placebo+gemcitabina | 6,2 | 5,9 | 0,82 | 3,8 | 3,6 | 0,77 | |
| Duración de tratamiento (mediana): ND, se calculó con SLP | Duración de tratamiento (mediana): ND, se calculó con SLP | |||||||
| PULMÓN | Bevacizumab+paclitaxel+ carboplatino64Duración de tratamiento (mediana): 7 ciclos de bevacizumab y 6 ciclos de paclitaxel y carboplatino | Paclitaxel+carboplatinoDuración de tratamiento (mediana): 5 ciclos | 12,3 | 10,3 | 0,79 | 6,2 | 4,5 | 0,66 |
| Pemetrexed+cisplatino66 | Cisplatino+gemcitabina | 10,3 | 10,3 | 0,94 | 4,8 | 5,1 | 1,04 | |
| Duración de tratamiento (mediana): 5 ciclos | Duración de tratamiento (mediana): 5 ciclos | |||||||
| 2a LÍNEA | ||||||||
| CÉLULAS | Everolimus+BSC49 | Placebo+BSC | 14,8 | 14,4 | 0,87 | 4,9 | 1,9 | 0,33 |
| RENALES | Duración de tratamiento (mediana): 141 días | |||||||
| Pazopanib52 | Placebo | ND | ND | 7,4 | 4,2 | 0,54 | ||
| Duración de tratamiento (mediana): 7,4 meses* | ||||||||
| Sorafenib37 | Placebo | 19,3 | 15,9 | 0,77 | 5,5 | 2,8 | 0,44 | |
| Duración de tratamiento (mediana): 23 semanas | ||||||||
| COLORRECTAL | Bevacizumab+FOLFOX440 | FOLFOX4 | 12,9 | 10,8 | 0,75 | 7,3 | 4,7 | 0,61 |
| Duración de tratamiento (mediana): 10 ciclos | Duración de tratamiento (mediana): 7 ciclos | |||||||
| Cetuximab+irinotecan34 | Cetuximab | 8,6 | 6,9 | 0,91 | 4,1¥ | 1,5¥ | 0,54¥ | |
| Duración de tratamiento (mediana): 18 infusiones | Duración de tratamiento (mediana): 7 infusiones | |||||||
| Cetuximab+BSC45 | BSC | 6,1 | 4,6 | 0,77 | ND | ND | 0,68 | |
| Duración de tratamiento (mediana): 8,1 semanas | ||||||||
| Panitumumab+BSC53 | BSC | ND | ND | 1,00 | 1,9 | 1,7 | 0,54 | |
| Duración de tratamiento (mediana): ND, calculado con SLP | ||||||||
| Panitumumab+FOLFIRI55 | FOLFIRI | 14,5 | 12,5 | 0,85 | 5,9 | 3,9 | 0,73 | |
| Duración de tratamiento (mediana): 9 ciclos de panitumumab y 10 ciclos de FOLFIRI en pacientes con genKRASwild-type y 8 ciclos de panitumumab y 9 ciclos de FOLFIRI en pacientes con gen KRAS mutado | Duración de tratamiento (mediana): 8 ciclos | |||||||
| GIST | Sunitinib56Duración de tratamiento (mediana): 56 días | Placebo | ND | ND | 0,49 | 5,5 | 1,4 | 0,33 |
| MAMA | Lapatinib+capecitabina30,39Duración de tratamiento (mediana): ND, se calculó con SLP | CapecitabinaDuración de tratamiento (mediana): ND, se calculó con SLP | 15,630 | 15,330 | 0,7830 | 8,439 | 4,139 | 0,4739 |
| DLP47Duración de tratamiento (mediana): 66 días | Vinorelbina o mitomicina C+vinblastinaDuración de tratamiento (mediana): 57 días de vinorelbina (85,43%) y 71 días de mitomicina C+vinblastina (14,57%) | 10,4 | 9,0 | 1,07 | 2,90 | 2,50 | 1,26 | |
| OVARIO | Trabectedina+DLP48Duración de tratamiento (mediana): 6 ciclos | DLPDuración de tratamiento (mediana): 5 ciclos | ND | ND | 7,3 | 5,8 | 0,79 | |
| Bevacizumab+gemcitabina+ carboplatino27Duración de tratamiento (mediana):12 ciclos de bevacizumab y 6 ciclos de gemcitabina y carboplatino | Gemcitabina+carboplatinoDuración de tratamiento (mediana): 6 ciclos de gemcitabina y carboplatino | 33,3 | 35,2 | ND | 12,4 | 8,4 | 0,48 | |
| PRÓSTATA | Cabazitaxel62Duración de tratamiento (mediana): 6 ciclos | MitoxantronaDuración de tratamiento (mediana): 4 ciclos | 15,1 | 12,7 | 0,70 | 2,8 | 1,4 | 0,74 |
| Abiraterona38,63Duración de tratamiento (mediana): 8 meses | Placebo | 15,838 | 11,238 | 0,7438 | 5,663 | 3,663 | 0,6763 | |
| PULMÓN | Erlotinib65Duración de tratamiento (mediana): ND, se calculó con SLP | Placebo | 6,7 | 4,7 | 0,70 | 2,2 | 1,8 | 0,61 |
| Erlotinib+quimioterapia33Duración de tratamiento (mediana): ND, se calculó con SLP | QuimioterapiaDuración de tratamiento (mediana): 2 ciclos de docetaxel (52,49%) y 3 ciclos de pemetrexed (47,51%) | 5,3 | 5,5 | 0,96 | 1,6 | 2,2 | 1,19 | |
| Pemetrexed41Duración de tratamiento (mediana): 4 ciclos | DocetaxelDuración de tratamiento (mediana): 4 ciclos | 8,3 | 7,9 | 0,99 | 2,9 | 2,9 | 0,97 | |
| Pemetrexed+BSC32Duración de tratamiento (mediana): 5 ciclos | Placebo+BSC | 13,4 | 10,6 | 0,79 | 4,0 | 2,0 | 0,60 | |
| VEJIGA | Vinflunina29Duración de tratamiento (mediana): 9,5 semanas | Placebo | 6,9 | 4,6 | 0,88 | 3,0 | 1,5 | ND |
| MELANOMA | Ipilimumab68Duración de tratamiento (mediana): ND, se calculó con SLP | Placebo+vacuna péptido gp100 | 10,1 | 6,4 | 0,66 | 2,9 | 2,8 | ND |
BSC: Best supportive care; DLP: Doxorrubicina liposomal pegilada; IFN: Interferón; HR: Hazard ratio; ND: No disponible; SG: Supervivencia global; SLP: Supervivencia libre de progresión; TTP: Tiempo hasta progresión.
*Duración de tratamiento para el total de la muestra de 1a y 2a línea, ya que la publicación o proporciona dato desagregado de duración promedio para cada uno de los grupos evaluados (1a y 2a línea)
¥ Referido a TTP
En la tabla 4, se muestran las diferencias incrementales en SG, SLP y costes, así como el resultado de la RCEI expresada como coste por mes de SG adicional y/o coste por mes de SLP adicional obtenido con los esquemas oncológicos evaluados respecto a los comparadores de los ensayos clínicos fase III identificados para la correspondiente indicación, en función de la información recogida en las publicaciones de dichos estudios.
Resultados de supervivencia y coste incrementales de los esquemas oncológicos respecto al comparador
| Localización | Esquema | Comparador | Meses de SG incremental | Meses de SLP/TTP incremental | Coste incremental (€) | RCEI (€/mes de SG adicional) | RCEI (€/mes de SLP/TTP adicional) |
|---|---|---|---|---|---|---|---|
| 1a LÍNEA | |||||||
| Cabeza y cuello | Cetuximab+platino+fluorouracilo67 | Platino+ | 2,7 | 2,3 | 14.849,60 | 5.499,85 | 6.456,35 |
| fluorouracilo | |||||||
| Células renales | Bevacizumab+IFN alfa-2a35,36 | Placebo+IFN alfa-2a | 2,0 | 4,8 | 46.716,90 | 23.358,45 | 9.732,69 |
| Pazopanib52 | Placebo | ND | 8,3 | 20.512,40 | ND | 2.471,37 | |
| Sunitinib50 | IFN alfa-2a | 4,6 | 6,0 | 32.832,41 | 7.137,48 | 5.472,07 | |
| Temsirolimus42 | IFN alfa-2a | 3,6 | 1,9 | 12.608,62 | 3.502,39 | 6.636,11 | |
| Colorrectal | Bevacizumab+irinotecan+ fluororuracil | Placebo+irinotecan | 4,7 | 4,4 | 22.123,98 | 4.707,23 | 5.028,18 |
| +leucovorina43 | +fluorouracil | ||||||
| +leucovorín | |||||||
| Bevacizumab+FOLFOX451 | FOLFOX4 | 0,9 | 0,8 | 12.846,27 | 14.273,63 | 16.057,84 | |
| Cetuximab+FOLFIRI54 | FOLFIRI | 1,3 | 0,9 | 20.304,65 | 15.618,96 | 22.560,73 | |
| Adenocarcinoma | Trastuzumab+quimioterapia28 | Quimioterapia | 2,7 | 1,2 | 12.902,09 | 4.778,55 | 10.751,74 |
| gástrico | |||||||
| Carcinoma | Sorafenib57 | Placebo | 2,8 | -0,8 | 18.832,37 | 6.725,85 | NA |
| hepatocelular | |||||||
| Mama | Bevacizumab+paclitaxel58 | Paclitaxel | 1,5 | 5,9 | 49.818,29 | 33.212,19 | 8.443,78 |
| Bevacizumab+capecitabina59 | Placebo+capecitabina | ND | 2,9 | 33.350,58 | ND | 11.500,20 | |
| Lapatinib+letrozol44 | Placebo+letrozol | 1,0 | 5,2 | 22.544,99 | 22.544,99 | 4.335,58 | |
| Trastuzumab+paclitaxel60 | Paclitaxel | 3,7 | 3,9 | 17.492,34 | 4.727,66 | 4.485,22 | |
| Trastuzumab+anastrozol46 | Anastrozol | 4,6 | 2,4 | 12.471,01 | 2.699,35 | 5.173,75 | |
| Doxorrubicina liposomal | Epirubicina+ | 2,3 | 2,1 | 16.449,57 | 7.151,99 | 7.833,13 | |
| +ciclofosfamida31 | ciclofosfamida | ||||||
| Páncreas | Erlotinib+gemcitabina61 | Placebo+ | |||||
| gemcitabina | 0,3 | 0,2 | 5.979,87 | 18.120,81 | 29.899,34 | ||
| Pulmón | Bevacizumab+paclitaxel+carboplatino64 | Paclitaxel+ | |||||
| carboplatino | 2,0 | 1,7 | 23.028,88 | 11.514,44 | 13.546,40 | ||
| Pemetrexed+cisplatino66 | Cisplatino+ | ||||||
| gemcitabina | 0,0 | -0,3 | 8.9901,56 | NA | NA | ||
| 2a LÍNEA | |||||||
| Células renales | Everolimus+BSC49 | Placebo+BSC | 0,4 | 3,0 | 18.878,38 | 46.679,96 | 6.292,79 |
| Pazopanib52 | Placebo | ND | 3,2 | 20.512,40 | ND | 6.410,13 | |
| Sorafenib37 | Placebo | 3,4 | 2,7 | 18.818,34 | 5.534,81 | 6.969,76 | |
| Colorrectal | Bevacizumab+FOLFOX440 | FOLFOX4 | 2,1 | 2,6 | 22.102,63 | 10.525,06 | 8.501,01 |
| Cetuximab+irinotecan34 | Cetuximab | 1,7 | 2,6 | 9.339,57 | 5.493,86 | 3.592,14 | |
| Cetuximab+BSC45 | BSC | 1,5 | ND | 6.894,66 | 4.596,44 | ND | |
| Panitumumab+BSC53 | BSC | ND | 0,2 | 6.229,81 | ND | 38.650,26 | |
| Panitumumab+FOLFIRI55 | FOLFIRI | 2,0 | 2,0 | 13.467,92 | 6.733,96 | 6.733,96 | |
| GIST | Sunitinib56 | Placebo | ND | 4,2 | 8.762,89 | ND | 2.102,54 |
| Mama | Lapatinib+capecitabina30,39 | Capecitabina | 0,3 | 4,3 | 18.298,91 | 60.996,37 | 4.255,56 |
| DLP47 | Vinorelbina o | 1,4 | 0,4 | 2.999,59 | 2.142,57 | 7.498,98 | |
| mitomicina C+vinblastina | |||||||
| Ovario | Trabectedina+DLP48 | DLP | ND | 1,5 | 20.047,23 | ND | 13.364,82 |
| Bevacizumab+gemcitabina+carboplatino27 | Gemcitabina | -1,9 | 4,0 | 35.304,05 | NA | 8.826,01 | |
| +carboplatino | |||||||
| Próstata | Cabazitaxel62 | Mitoxantrona | 2,4 | 1,4 | 17.564,85 | 7.318,69 | 12.546,32 |
| Abiraterona38,63 | Placebo | 4,6 | 2,0 | 25.495,47 | 5.542,49 | 12.747,73 | |
| Pulmón | Erlotinib65 | Placebo | 2,0 | 0,4 | 5.073,97 | 2.536,98 | 12.684,91 |
| Erlotinib+quimioterapia33 | Quimioterapia | -0,2 | -0,5 | 562,22 | NA | NA | |
| Pemetrexed41 | Docetaxel | 0,4 | 0,0 | 6.737,21 | 16.843,03 | NA | |
| Pemetrexed+BSC32 | Placebo+BSC | 2,8 | 2,0 | 9.890,75 | 3.532,41 | 4.945,38 | |
| Vejiga | Vinflunina29 | Placebo | 2,3 | 1,5 | 5.679,53 | 2.469,36 | 3.786,35 |
| Melanoma | Ipilimumab68 | Vacuna péptido Gp100 | 3,7 | 0,1 | 66.184,53 | 17.887,71 | 661.845,27 |
BSC: Best supportive care; DLP: Doxorubicina liposomal pegilada; IFN: Interferon; NA: No aplicable; ND: No disponible; RCEI: Relación coste-eficacia incremental; SG: Supervivencia global; SLP: Supervivencia libre de progresión; TTP: Tiempo hasta progresión
Al calcular la diferencia incremental de supervivencia entre los esquemas oncológicos y sus comparadores se obtuvieron valores que oscilaron desde -1,9 meses (bevacizumab+gemcitabina+carboplatino vs gemcitabina+carboplatino en 2a línea de tratamiento del cáncer de ovario)27 a 4,7 meses (bevacizumab+IFL vs IFL en 1a línea de cáncer colorrectal metastásico)43 para la SG y desde -0,8 meses (sorafenib como terapia de 1a línea del carcinoma hepatocelular)57 a 8,3 meses para SLP (pazopanib para tratamiento en 1a línea del carcinoma de células renales)52. Los valores negativos obtenidos, indican que el comparador aportaba mayor SG o SLP que el esquema oncológico evaluado.
La ausencia de valores de la RCEI en algunos casos se debe a ausencia de información de SG o SLP en las publicaciones seleccionadas (datos no disponibles) o a imposibilidad metodológica, es decir, la diferencia incremental entre el esquema oncológico y el comparador del ensayo clínico era nula (igual a cero) o menor que cero, lo que impidió aplicar la fórmula de cálculo establecida.
Esto sucedió en nueve de las 40 terapias (22,5%) para el cálculo de la RCEI en meses de SG y en cinco (12,5%) para el cálculo de la RCEI en meses de SLP.
Los valores de RCEI oscilaron entre 2.142,57 €-60.996,37 € por cada mes de SG adicional y entre 2.102,541 €-661.845,27 € por cada mes de SLP adicional.
Entre las diecinueve terapias de 1a línea de tratamiento los RCEI por cada mes de SG adicional variaron de 2.699 € a 33.212 €, correspondientes a trastuzumab+ anastrozol vs anastrozol46 y a bevacizumab+paclitaxel vs paclitaxel58, ambas en cáncer de mama, respectivamente.
Para las veintiuna terapias de 2a línea la variación del RCEI por mes de SG adicional fue entre 2.142 € (DLP vs vinorelbina o mitomicinaC+vinblastina)47 y 60.996 € (lapatinib+capecitabina vs capecitabina)30, ambos esquemas para tratamiento del cáncer de mama.
Las RCEI por mes de SLP adicional se incluyeron en el rango de 2.471 € (pazopanib vs placebo en carcinoma de células renales)52 y 29.899 € (erlotinib+gemcitabina vs gemcitabina en cáncer de páncreas)61 para las terapias de 1a línea, y en el rango de 2.102 € (sunitinib vs placebo en GIST)56 y 661.845 € (ipilimumab vs vacuna péptido gp100 en melanoma)68 para las de 2a línea.
DiscusiónA pesar de los progresos conseguidos en las tasas de supervivencia del cáncer, existen áreas de mejora en relación al manejo de pacientes oncológicos que abarcan prevención y diagnóstico además del tratamiento terapéutico, a las que tanto investigadores, clínicos como gestores pueden contribuir con las decisiones adoptadas.
Diversos autores han evidenciado la necesidad de desarrollar evaluaciones económicas adicionales a las actualmente disponibles, sobre intervenciones dirigidas a enfermedades oncológicas, incluyendo el análisis tanto de nuevos fármacos9 como de las tecnologías emergentes en el área de genómica que están desarrollándose en esta área69.
El presente análisis no pretende establecer con precisión la eficiencia de las terapias oncológicas en España, sino más bien proporcionar estimadores del coste por cada mes de supervivencia (SG o SLP) adicional conseguido con ellas, que puedan servir tanto de aliciente para análisis más pormenorizados y exhaustivos, como de punto de partida de una reflexión ineludible sobre la disponibilidad a pagar implícita que implica la administración de estos esquemas.
En oncología, la SG es el parámetro asociado a mayor relevancia clínica dado que es el objetivo final y supone una medida exenta de sesgo de evaluación. Sin embargo, la interpretación de la SG en terapias enfocadas como 1a línea de tratamiento puede verse alterada por diversos factores, como la disponibilidad de tratamientos posteriores, y la existencia de cambios de terapias70. La SLP puede remplazar a la SG en determinadas situaciones, como es el caso de tumores metastásicos, en la valoración de los beneficios clínicos70.
La situación actual de crisis global requiere un proceso de reflexión de todos los agentes involucrados (desde la industria farmacéutica, autoridades sanitarias, sociedades científicas, decisores sobre aspectos de accesibilidad y financiación, gestores de organismos sanitarios, hasta el personal sanitario e incluso los pacientes), sobre la futura sostenibilidad del sistema público sanitario en España tal y como lo conocemos.
Las medidas de contención del gasto exigidas por la actual coyuntura económica, deberían idealmente realizarse sin restricción del acceso de los pacientes a las terapias consideradas más eficaces, pero resulta indiscutible que la adopción de medidas que optimicen la distribución de los recursos supondrá un beneficio social a medio y largo plazo. La evaluación económica de tecnologías sanitarias mediante herramientas como los análisis coste-efectividad proporciona información que puede servir de orientación a los agentes responsables de decisiones relacionadas con la incorporación de medicamentos al arsenal terapéutico frente a una enfermedad.
En España no existe un umbral de eficiencia oficialmente establecido, aunque tradicionalmente y recientemente constatado por Rodriguez-Barrios y cols8 se emplea el valor de 30.000 € por año de vida ganado estimado por Sacristán y cols en el año 200271, en la mayoría de las publicaciones referidas a España.
La Organización Mundial de la Salud durante su propuesta de clasificación de la relación coste-efectividad en función de la renta per cápita estimó, en valores de 2005, que para los países de la zona europea donde se integraría España72 los umbrales que podrían establecerse serían 30.439$ para medidas altamente coste-efectivas y 31.318$ para medidas coste-efectivas.
La interpretación de los resultados del presente análisis, tal y como se ha mencionado previamente, debe entenderse como una aproximación a la eficiencia de los esquemas oncológicos y en cualquier caso debe ir acompañada de la consideración de una serie de limitaciones.
La principal limitación debe entenderse derivada de la consideración únicamente del coste farmacológico de los esquemas oncológicos, aunque algunas terapias podrían asociarse con costes adicionales para el sistema sanitario como los derivados de su administración, monitorización o manejo de acontecimientos adversos sufridos por el paciente a consecuencia de la medicación. La aproximación elegida para el análisis, considerando solo el coste farmacológico, pretende igualar los resultados de los diferentes esquemas evaluados.
Con objeto de homogeneizar la metodología, para el cálculo del coste de aquellos medicamentos que se administran en función de las características antropométricas de los pacientes, se optó por definir un perfil de paciente promedio; sin embargo cabe destacar que algunas de las terapias evaluadas están indicadas en tumores que afectan a un segmento de la población que podría no estar representado por dicho perfil. Para el caso del cáncer de ovario y el cáncer de mama que afectan a población femenina se utilizaron valores de peso y superficie corporal menores, con intención de contrarrestar el efecto de estos parámetros en los resultados de coste.
También es importante mencionar el hecho de que el coste se ha estimado sin contemplar descuentos de ningún tipo en los PVL de los fármacos, aunque es habitual que algunos de ellos sean adquiridos por los hospitales a un precio menor del máximo establecido. Si se aplica al PVL la deducción (7,5%, 15% o 4%) especificada en el RD 8/201015, a pesar de ser una medida, en principio, de carácter temporal. Los resultados obtenidos reflejan, por tanto, un valor menor del que se obtendría si las mencionadas deducciones dejarán de estar vigentes.
Además, en algunos casos, el coste farmacológico puede incluir un cierto sesgo, ya que al haberse calculado en base al número de ciclos o administraciones finales recibidos por los pacientes de cada estudio, penaliza las terapias que al ser más efectivas, conllevan mayor supervivencia y por tanto mayor número de administraciones, lo que suele asociarse principalmente a los esquemas evaluados, más que a los comparadores. El efecto final de este sesgo se traduciría en un incremento de la RCEI. Este hecho, junto al anteriormente mencionado del PVL utilizado, hace que los valores obtenidos pueden considerarse derivados de una postura conservadora en cuanto al concepto de coste. Debido a la amplia diversidad de información entre los estudios localizados se optó por considerar que todos los pacientes cumplían con la dosificación inicial establecida, aunque en algunos casos el protocolo incluía la posibilidad de reducciones de dosis por problemas de tolerancia principalmente.
Por otra parte, los ensayos clínicos revisados abarcan tanto tratamientos en pacientes naïve (primera línea) como en pacientes previamente tratados, lo que obliga a extremar las precauciones si se pretende realizar una comparación entre los estimadores de RCEI obtenidos para los diferentes esquemas evaluados.
La decisión sobre financiación y selección posterior de un medicamento, viene determinada, además de por la RCEI, por el número de pacientes susceptibles de recibir el tratamiento, factores que repercutirán en el impacto presupuestario final. En el presente análisis se incluyen esquemas oncológicos para tumores con muy diferente prevalencia, incluso algunos con calificación de medicamentos huérfanos, por estar indicados en tumores que cumplen requisitos de enfermedad rara (en Europa aquellas con prevalencia < 5 por 10.000 habitantes)73,74.
El tratamiento del cáncer está evolucionando e incrementando su complejidad debido a los continuos avances en el conocimiento de las patologías y a la disponibilidad de nuevas opciones terapéuticas, más efectivas, y a menudo asociadas a un mayor coste4,75. En la actualidad uno de los focos del debate, se centra en el valor real de las mejoras en la efectividad (en términos de supervivencia) proporcionadas por estos nuevos fármacos, ya que comparados con otros tratamientos existentes, las mejoras en supervivencia que aportan los medicamentos oncológicos enfocados a pacientes con enfermedad metastásica terminal pueden considerarse relativamente pequeñas76,77.
A la vista de los resultados obtenidos, resulta curioso comprobar que según las condiciones del ensayo clínico, algunos de los esquemas terapéuticos no se asocian con ganancias en términos de supervivencia (SG y/o SLP) respecto a los comparadores incluidos en esos ensayos. La demostración de la hipótesis de no inferioridad, aunque no exenta de controversia, es habitualmente aceptada bajo el punto de vista clínico78. La autorización de un fármaco en base a esta hipótesis, supone incrementar el arsenal terapéutico del clínico para tratar una patología, con el considerable aumento de posibilidades de beneficio para los pacientes. Sin embargo, deberíamos reflexionar sobre el coste extra que supone la administración de una terapia autorizada sin demostrar superioridad, sino únicamente no inferioridad de resultados, o superioridad en base a diferencias estadísticamente significativas pero difíciles de traducir a supervivencia real en la práctica clínica79.
La dispersión de los valores de RCEI estimados, despierta la sensación de existencia de disparidad de criterios en el momento de decisión de precio y financiación de las terapias. Valorando el continuo avance existente en el campo de la oncología, merece la pena plantearse la posible necesidad de realizar revaluaciones económicas de medicamentos ya comercializados, debido a que la disponibilidad de nuevas opciones puede asociarse a una modificación de las condiciones que conduzcan a que un determinado fármaco no cumpla con los criterios de eficiencia que se exigen a estas nuevas terapias. Las revaluaciones deberían, además, integrar análisis de impacto presupuestario, especialmente en el caso de aprobación de indicaciones que conlleven un aumento significativo del número de pacientes susceptibles de beneficiarse de determinadas terapias.
La existencia, en España, de diecisiete Comunidades Autónomas, todas ellas con capacidad para desarrollar sus propios planes de salud y gestionar sus presupuestos, hace que la introducción de nuevas tecnologías sanitarias no sea únicamente una decisión central a nivel del Ministerio de Sanidad, Servicios Sociales e Igualdad. La intervención de las autoridades regionales se traduce en diferencias significativas a nivel del acceso de los pacientes a estas nuevas tecnologías, lo que cuestiona el principio de equidad a nivel nacional, particularmente en terapias focalizadas al tratamiento de un área tan sensible como es el cáncer1.
Existe una amplia variabilidad en la metodología para la realización de análisis coste-efectividad, por lo que es frecuente encontrar en la literatura médica una extensa variedad de diseños y aproximaciones metodológicas. En vista de la heterogeneidad presente entre los estudios en cuanto a la características de la población evaluada incluso en los estudios en las mismas patologías, al diseño y a la presentación de los resultados obtenidos (en términos de costes y beneficios en salud) resulta extremadamente difícil realizar comparaciones entre diversos análisis coste-efectividad incluso entre los realizados para el mismo entorno4.
Aunque la existencia de un umbral de eficiencia explícito podría en algunos casos facilitar la decisión sobre la financiación pública de los medicamentos, no se puede obviar la existencia y necesidad de respeto a otros principios como equidad y justicia, que deben formar parte del proceso, para que la decisión final aúne criterios democráticos80. Además algunos autores han evidenciado la necesidad, por diversas razones, de modificar los umbrales existentes en otros países de nuestro entorno, tanto en el sentido de objetivizarlos como de flexibilizarlos81 y de buscar fórmulas alternativas de gestión económica que introduzcan el concepto de «patient Access» como son las estrategias de adjudicación de precio basado en el valor del producto (Value Based Pricing, VBP). La implementación de estos procesos, incluyen entre otros aspectos la financiación de medicamentos no a la totalidad de la población englobada en la indicación, sino a determinados subgrupos de pacientes en los que la terapia resulte ser más eficiente70,82,83.
Los análisis económicos en el campo de la oncología constituyen una valiosa herramienta para gestores y proveedores de servicios para el proceso de incorporación de las terapias emergentes a la cartera de servicios. El objetivo de la evaluación económica es comparar diversas alternativas de actuación en términos de sus costes y efectos sobre la salud, no sólo como referencia para escoger entre dos o más alternativas dirigidas a una misma condición clínica sino también para priorizar entre intervenciones diferentes para diferentes condiciones84. En la actualidad, dicho acceso depende cada vez menos del libre criterio médico en el momento de la prescripción, y está más condicionado por el abanico de opciones disponibles. En este punto, los farmacéuticos hospitalarios pasan a ser un eslabón clave de la cadena. La existencia de grupos de trabajo especializados en áreas terapéuticas, como es el caso de GEDEFO (Grupo Español para el desarrollo de la Farmacia Hospitalaria) dentro de la Sociedad de Farmacia Hospitalaria, avalan el interés de la comunidad científica en asegurar el comentado acceso de los pacientes a terapias seguras y eficaces.
Los resultados del presente trabajo, intentan servir de ayuda en la evaluación de la eficiencia de las terapias oncológicas en la situación actual en España, así como alentar la creación de criterios homogéneos y concretos en materia de evaluación económica de terapias frente al cáncer.
Conflicto de interesesIO, MGB y MAC son empleados de PORIB, una consultora especializada en evaluación económica de tecnologías sanitarias que ha realizado este trabajo con el apoyo financiero no condicionado de Eisai Farmaceutica SA.
CF, MQG y MAS declaran haber colaborado en este proyecto de manera totalmente independiente, sin haber recibido compensación ni económica, ni de otra naturaleza derivada de su participación.
AgradecimientosLos autores agradecen a los revisores de Farmacia Hospitalaria, los comentarios aportados durante la revisión del manuscrito.
Efficiency of oncologic treatments for solid tumours in Spain