COMUNICACION BREVE
ESTABILIDAD DEL VALPROATO SODICO EN FLUIDOS INTRAVENOSOS
Torres-Bondía, F. I., Licenciado en Farmacia, Residente II de Farmacia Hospitalaria; Carmona-Ibáñez, G., Doctora en Farmacia, Especialista en Farmacia Hospitalaria, Farmacéutica Adjunta; Guevara-Serrano, J., Doctor en Farmacia, Especialista en Farmacia Hospitalaria, Farmacéutico Adjunto; López-Briz, E., Licenciado en Farmacia, Especialista en Farmacia Hospitalaria, Jefe de Servicio.
Servicio de Farmacia. Hospital General Universitario de Valencia.
Correspondencia:
F. I. Torres Bondía.
Servicio de Farmacia.
Hospital General Universitario de Valencia.
Avda. Tres Cruces, s/n.
46014 Valencia.
Parte de este trabajo fue presentado como comunicación oral en el XLIII Congreso de la SEFH. Granada. Octubre de 1998.
Fecha de recepción: 29-12-98
Palabras clave:
Valproato. Estabilidad. Fluidos intravenosos. Envases.
Resumen:
Objetivo: Cuantificar en el tiempo la estabilidad del valproato sódico en diferentes fluidos intravenosos, así como en distintos tipos de envase.
Método: Se preparó valproato sódico a la concentración de 1,6 mg/ml a partir de Depakine inyectable® (Lab. Sanofi). Los vehículos utilizados fueron solución salina 0,9%, glucosado 5%, glucosalino isotónico (glucosa 3,3%, cloruro sódico 0,3%) y ringer lactato. Cada solución se preparó por duplicado en envase de vidrio, polietileno y cloruro de polivinilo. Las muestras se cuantificaron a lo largo de un período de seis días mediante inmunoanálisis de polarización fluorescente.
Comentarios: La concentración de valproato sódico se mantuvo constante a lo largo del tiempo, no observándose pérdidas superiores al 10% con respecto a la concentración inicial.
A la dilución estudiada, el valproato sódico para administración intravenosa fue compatible con los diferentes envases y vehículos, no presentando degradación durante al menos seis días a temperatura ambiente.
STABILITY OF SODIUM VALPROATE IN INTRAVENOUS FLUIDS
Key words:
Sodium valproate. Stability. Infusion diluents. Containers.
Summary:
Objetive: Quantify the stability of valproate sodium in differents diluents and containers.
Method: We prepared sodium valproate at concentration of 1.6 mg/ml with Depakine injection®. The infusion i.v. solutions assayed were sodium chloride 0.9%, dextrose 5%, dextrose 3.3% in sodium chloride 0.3% and ringer''s injection, lactated. Each solution was prepared twice in three differents containers: glass, polyethylene and polyvinyl chloride. Samples were tested, evaluated and quantified during six days by fluorescence polarization inmmunoassay.
Comments: Sodium valproate concentration was stable during the time of the study, over 10% of the drug was observed.
At this concentration, sodium valproate for intravenous infusion was compatible with the different containers and diluents assayed. At room temperature valproate sodium showed no decomposition within six days (after six days of storage).
INTRODUCCION
El valproato sódico (Depakine inyectable®) es un agente antiepiléptico usado ampliamente en el tratamiento de varias formas de epilepsia, principalmente en crisis generalizadas del tipo de las ausencias, mioclonías y crisis atónicas, además de ser útil en las tónicas y tonicoclónicas, así como en la profilaxis de las convulsiones febriles (1-3).
Aunque la mayor parte del consumo de valproato sódico (VPA) se realiza en formas orales, la áparición del inyectable permite su utilización en el tratamiento de urgencia de las formas de epilepsia para las que está indicado, lo que incluye las convulsiones febriles infantiles.
El laboratorio preparador recomienda su administración en perfusión intravenosa intermitente o continua en solución salina 0,9% (SF) o glucosa 5% (G5%); sin embargo, no aporta información acerca de la conservación de la mezcla intravenosa ni los factores que influyen en su estabilidad (4).
Estudios previos de estabilidad de envejecimiento acelerado en los que se sometió al valproato sódico a condiciones extremas de temperatura en envase de vidrio concluyeron que la única sustancia proveniente de la degradación del valproato sódico aparecía en cantidades traza (5).
Ante la escasa información de que se dispone sobre estudios de estabilidad del valproato sódico en diferentes vehículos intravenosos y en distintos envases de amplio uso en nuestro entorno, el objetivo del presente trabajo fue cuantificar en el tiempo la estabilidad del valproato sódico a una concentración de 1,6 mg/ml en diferentes fluidos tan comúnmente utilizados en clínica como son la solución salina 0,9% (SF), glucosado 5% (G5%), glucosalino, glucosa 3,3% en cloruro sódico 0,3% (GS) y ringer lactato (RL) en envases de vidrio (V), polietileno (PET) y cloruro de polivinilo (PVC).
MÉTODO
Se preparó valproato sódico a la concentración recomendada por el fabricante de 1,6 mg/ml (800 mg/500 ml) a partir de un preparado para uso i.v. de 400 mg (Depakine inyectable®, lote: M-02/M-01). Los vehículos y sus respectivos envases utilizados fueron: SF-V (lote: M-155), SF-PET (lote: M195B 11), SF-PVC (lote: M-354), G5%-V (lote: M1007), G5%-PET (lote: M202B 04), GS-PET (lote: M364B 09), GS-V (lote: M034B 07), RL-PET (lote: M371B 04), RL-PVC (lote: M-100) de Laboratorios Grifols y Braun.
Cada una de las soluciones se preparó por duplicado y se conservó a temperatura ambiente.
Se analizaron las muestras a los siguientes tiempos: cero, ocho, dieciocho, veinticuatro, cuarenta y ocho, setenta y dos, noventa y seis y ciento cuarenta y cuatro horas. La concentración de valproato sódico se determinó mediante inmunoanálisis de polarización fluorescente (FPIA) en autoanalizador AxSYM® (Laboratorios Abbott).
Las muestras fueron diluidas 1/20 con solución salina 0,9% hasta alcanzar una concentración final de 78 µg/ml previamente a su determinación con el fin de adecuar su concentración al método analítico.
El análisis estadístico de los resultados se realizó con el programa estadístico Sigmastat®. Con el fin de estudiar la variación de la concentración de valproato sódico en función del tiempo se aplicó un análisis de la varianza de una vía.
Para determinar si los diferentes envases y vehículos utilizados en el estudio modificaron de manera estadísticamente significativa en algún momento la concentración de valproato sódico se realizó una comparación múltiple aplicando un análisis de varianza multifactorial de dos vías en el que se utilizó el método de Bonferroni para aumentar la sensibilidad, siendo las variables independientes el vehículo y tipo de envase y la variable dependiente la concentración experimental.
COMENTARIO
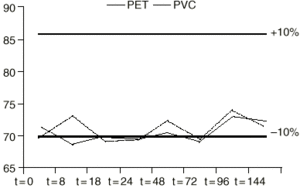
La concentración de 1,6 mg/ml de las diferentes mezclas intravenosas fue elegida por ser la pauta posológica más comúnmente utilizada en nuestras unidades asistenciales. Las concentraciones experimentales obtenidas, así como el intervalo de variación de ± 10% con respecto a la concentración teórica inicial a lo largo del período de estudio, se muestran en las figuras 1, 2, 3 y 4.
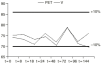
Figura 1.--Variación de la concentración (µg/ml) de VPA en función del tiempo (h), utilizando G5% como vehículo en envases de PET y V.
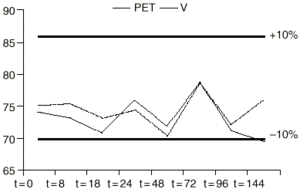
Figura 2.--Variación de la concentración (µg/ml) de VPA en función del tiempo (h), utilizando SF como vehículo en envases de PET y V.
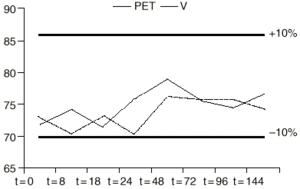
Figura 3.--Variación de la concentración (µg/ml) de VPA en función del tiempo (h), utilizando GS como vehículo en envases de PET y V.
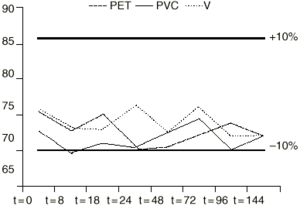
Figura 4.--Variación de la concentración (µg/ml) de VPA en función del tiempo (h), utilizando RL como vehículo en envases de PET y PVC.
Los datos muestran que durante el intervalo de tiempo estudiado la concentración de valproato sódico no sufrió pérdidas superiores al 10% con respecto a la concentración teórica inicial en todas las soluciones y en los diferentes tipos de envases. Además no se produjo cambio apreciable visualmente en ninguna de las soluciones.
En lo referente a las dos variables dependientes del estudio, vehículo y envase el análisis de comparación múltiple demostró la influencia de manera estadísticamente significativa (p = 0,0062 y 0,0067, respectivamente) sobre la concentración de valproato sódico.
El método de Bonferroni permitió aislar los grupos de envases y vehículos que influyeron sobre la concentración de valproato sódico: se obtuvo diferencias significativas (p < 0,05) tanto en los envases de P frente a PV y V frente a PV como en los vehículos G5% frente a RL y RL frente a GS.
Es lógico pensar que las diferencias entre los grupos anteriormente citados se debieron a la metodología experimental y no a una verdadera influencia tanto del vehículo como del envase en la concentración de valproato sódico, ya que cuando se comparó las distintas concentraciones halladas en los sucesivos tiempos de estudio no se obtuvo diferencias significativas (p = 0,049).
Por su parte, la elección del método analítico se basó en su sencillez, comodidad y precisión; sin embargo, esta técnica no ha sido validada que sepamos para la realización de estudios de estabilidad de VPA.
Aunque los datos previos (5) sugieren una muy escasa degradación del VPA y siempre a altas temperaturas (lo que indirectamente refrendaría la validez del método FPIA), sólo la utilización de técnicas más resolutivas (HPLC, CG) permitiría asegurar rotundamente la validez de nuestras conclusiones, dado que la realización de un barrido en el UV-VIS se muestra impracticable debido a la opacidad del VPA a tal longitud de onda (6).
Concluimos indicando que se ha ensayado la posible influencia en el tiempo sobre la concentración de valproato sódico de diferentes fluidos para administración intravenosa (G5%, SF, GS y RL), en envases de vidrio, polietileno y de cloruro de polivinilo, observándose la compatibilidad con todas las mezclas estudiadas, así como con los distintos tipos de envase, no apareciendo degradación superior al 10% en el tiempo ensayado.
Con todo ello puede concluirse que el valproato sódico, en los diferentes vehículos y tipo de envase estudiados es estable al menos seis días a temperatura ambiente.
Aun así es necesario un estudio más exhaustivo para la determinación de posibles productos de degradación del valproato sódico que enmascararan su detección mediante FPIA.
BIBLIOGRAFIA
1.Bazil CW, Pedley TA. Advances in the medical treatment of epilepsy. Annu Rev Med 1998;49:135-62.
2.Shirai H, Miura H, Sunaoshi W. Effectiveness and plasma levels of sodium valproate monotherapy in treatment of epilepsies in children: a further study. Jpn J Psichiatry Neurol 1989;43:517-8.
3.Pinder RM, Bragden RN, Seight TM, et al. Sodium valproate: a review of its pharmacological properties and therapeutic efficacy in epilepsy. Drugs 1977;13: 81-123.
4.Catálogo de Especialidades Farmacéuticas. Consejo General de Colegios Oficiales de Farmacéuticos; 1998. p. 1413-4.
5.Información Técnica del Laboratorio. Departamento Técnico; Lab. Sanofi Winthrop, SA.
6.Clarke''s Isolation Identification of Drugs. Moffatt AC, 2.a ed. Londres: The Pharmaceutical Press; 1986. p. 1059-60.