estandarizar las diluciones de los fármacos administrados por vía intravenosa en una unidad de cuidados intensivos pediátricos y caracterizar dichas diluciones en función de su pH, osmolaridad y poder vesicante, con la finalidad de guiar la elección del dispositivo de acceso vascular más adecuado, minimizando el riesgo de complicaciones asociadas y preservando el capital venoso del paciente.
Métodosmediante consenso entre los servicios de farmacia y pediatría, se seleccionaron los fármacos de administración intravenosa empleados con más frecuencia en la unidad de cuidados intensivos pediátricos. Se establecieron 2 diluciones diferentes para cada fármaco, con la posterior determinación de los valores de osmolaridad y pH correspondientes a cada una. El poder vesicante del fármaco se estableció según la clasificación de Clark et al. Asimismo, la selección del dispositivo de acceso vascular se realizó siguiendo el algoritmo propuesto por Manrique et al., considerando las propiedades del fármaco, la duración de la terapia intravenosa y el estado del capital venoso del paciente.
Resultadosse analizaron 60 diluciones asociadas a 30 fármacos correspondientes a los siguientes grupos terapéuticos: antiinfecciosos (56%), antiepilépticos (13%), sedantes (7%), diuréticos (7%), antiinflamatorios y analgésicos (7%), y otros (10%). El 25% de las diluciones mostraron al menos un factor de riesgo elevado de producir flebitis (osmolaridad >600 mOsm/l o pH < 4 o > 9), mientras que el 35% presentaron un riesgo intermedio (osmolaridad 450–600 mOsm/l o pH 4–5 o > 7,5–9). Solo el 10% de los fármacos analizados fueron clasificados como vesicantes (aciclovir, fenitoína y vancomicina). Se identificaron 17 diluciones asociadas a 9 fármacos distintos que no deberían administrarse a través de un catéter venoso periférico, incluso en tratamientos de corta duración. De estas diluciones, 15 presentaron un riesgo elevado de producir flebitis y 2 un riesgo intermedio.
Conclusioneslas propiedades fisicoquímicas (osmolaridad y pH) y el poder vesicante de los fármacos administrados por vía intravenosa son factores que contribuyen a la aparición de flebitis en el paciente crítico pediátrico. Estandarizar y caracterizar las diluciones de estos fármacos facilitará la selección del dispositivo de acceso vascular más adecuado, incrementando la seguridad y efectividad del tratamiento intravenoso.
To standardize the drug dilutions administered intravenously in a Pediatric Intensive Care Unit and to characterize these dilutions based on their pH, osmolarity, and vesicant nature. This aims to guide the selection of the most appropriate vascular access device, minimizing associated complications, and preserving the patient's venous capital.
MethodsThrough a consensus between Pharmacy and Pediatric Services, the most frequently administered intravenous drugs in the Pediatric Intensive Care Unit were selected. Two different dilutions were established for each drug, followed by the determination of their respective osmolarity and pH values. The vesicant nature of each drug was assessed according to the classification proposed by Clark et al. Additionally, vascular access device selection was guided by the algorithm proposed by Manrique et al., which considers the drug’s properties, the duration of intravenous therapy, and the patient's venous capital status.
ResultsA total of 60 dilutions corresponding to 30 drugs from the following therapeutic groups were analyzed: antimicrobials (56%), antiepileptics (13%), sedatives (7%), diuretics (7%), anti-inflammatory and analgesics (7%), and others (10%). Twenty-five percent of the dilutions exhibited at least one high-risk factor for phlebitis (osmolarity >600 mOsm/L or pH < 4 or > 9), while 35% were classified as intermediate risk (osmolarity 450–600 mOsm/L or pH 4–5 or > 7.5–9). Only 10% of the analyzed drugs were classified as vesicants (acyclovir, phenytoin, and vancomycin). Seventeen dilutions of nine different drugs were identified that should not be administered through a peripheral venous catheter, even in short-term treatments. Of these, 15 had a high risk of causing phlebitis, while 2 had an intermediate risk.
ConclusionsThe physicochemical properties (osmolarity and pH) and vesicant nature of drugs are key factors contributing to the development of phlebitis in critically ill pediatric patients. Standardizing and characterizing drug dilutions will facilitate the selection of the most appropriate vascular access device, improving the safety and effectiveness of intravenous therapy.
En el ámbito hospitalario, los catéteres venosos periféricos (CVP) se utilizan ampliamente para la administración de fluidos y medicamentos en los pacientes pediátricos. Sin embargo, su uso puede conducir a la aparición de efectos adversos como flebitis, extravasación, infiltración, oclusión e infecciones, entre otros1.
La tasa de complicaciones asociadas al CVP en el paciente pediátrico oscila entre 34 y 56%2, incrementándose a partir del segundo y tercer día tras la inserción del CVP3. Estas complicaciones se asocian con mayor morbimortalidad, retrasos o interrupciones en el tratamiento intravenoso y estancias hospitalarias prolongadas2,4.
Una de las complicaciones más frecuentes asociadas al CVP en el paciente pediátrico es la flebitis1,5, que se define como la inflamación de una vena producida por una lesión endotelial. Puede ocasionar síntomas como dolor, enrojecimiento, hinchazón, endurecimiento o la presencia de un cordón venoso palpable6. Existen numerosos factores que promueven su aparición, asociados con el catéter, el capital venoso del paciente y el tratamiento administrado.
Los factores atribuidos al catéter incluyen el calibre, el tamaño, el lugar de inserción y el tiempo de permanencia1.
Dentro de los factores relacionados con el paciente, destaca el estado del capital venoso. En este sentido, los pacientes pediátricos son más susceptibles a la aparición de flebitis7, ya que presentan venas más delgadas y frágiles, así como un mayor porcentaje de tejido adiposo5,8.
Respecto al tratamiento, es importante considerar el pH y la osmolaridad de la solución. Cuando estas propiedades difieren de las de la sangre (pH 7,35–7,45 y osmolaridad 285–310 mOsm/l), existe mayor riesgo de que se produzca flebitis9,10. Otros factores incluyen el tipo de diluyente, la forma de administración, la velocidad de infusión, el poder vesicante del fármaco y la duración de la terapia intravenosa6.
Las fichas técnicas de los fármacos no siempre proporcionan información detallada acerca de sus propiedades fisicoquímicas y, cuando lo hacen, se refieren al fármaco sin diluir. Además, la información disponible en la literatura científica no siempre es aplicable en nuestro contexto particular, debido a diferencias en las concentraciones estudiadas y los vehículos empleados, entre otros factores.
Este estudio tiene como objetivo estandarizar y caracterizar las diluciones de los fármacos de administración intravenosa empleados con más frecuencia en la UCIP, en función de sus propiedades fisicoquímicas (pH, osmolaridad) y poder vesicante, para guiar la selección del dispositivo de acceso vascular (DAV) más adecuado y la duración estimada de la terapia intravenosa.
MétodosSe llevó a cabo un estudio multidisciplinar en el que participaron miembros de diferentes servicios pertenecientes a un hospital de tercer nivel: farmacia hospitalaria, UCIP y bioquímica clínica.
Mediante consenso entre los servicios de farmacia y pediatría, se seleccionaron los fármacos empleados con mayor frecuencia en la UCIP. Para cada uno de ellos, se establecieron 2 concentraciones, teniendo en cuenta el rango de estabilidad de cada fármaco11–14 y el protocolo de la unidad. La selección de 2 concentraciones, una situada en el límite superior del rango de estabilidad y otra intermedia, se debe a que en el tratamiento del paciente crítico pediátrico es habitual recurrir a fármacos altamente concentrados para evitar la sobrecarga de volumen.
La preparación de las diluciones, así como la determinación del pH y la densidad, se realizó en la unidad de farmacotecnia del servicio de farmacia. La medición de la osmolalidad se llevó a cabo en el servicio de bioquímica clínica del mismo hospital.
La reconstitución y la dilución de los fármacos se realizaron siguiendo las indicaciones especificadas en su ficha técnica11. Siempre que fue posible, se utilizó agua para inyección (API) como agente reconstituyente, por presentar una osmolaridad de 0 mOsm/l. En cuanto al diluyente, en la mayoría de los casos se empleó suero salino fisiológico al 0,9% (SF 0,9%), por ser el vehículo de uso preferente en la UCIP. Los fármacos que no eran compatibles con SF 0,9% se diluyeron con suero glucosado al 5% (SG 5%).
Las diluciones elaboradas se caracterizaron en función del pH, la osmolaridad y el poder vesicante.
Determinación de la osmolaridad y el pHLa osmolaridad se define como el número de miliosmoles de soluto por litro de disolución, mientras que la osmolalidad se refiere al número de miliosmoles de soluto por kilogramo de disolvente. Ambos parámetros están relacionados mediante un factor de conversión basado en la densidad de la dilución10:
Osmolaridad (mOsm∕l) = osmolalidad (mOsm∕kg) × densidad de la dilución (g∕ml).
La osmolalidad se midió utilizando el microsmómetro Osmo1® (Advanced Instruments Inc.) y los resultados, expresados como la media ± desviación estándar (DS) de 3 medidas diferentes, fueron utilizados para calcular la osmolaridad según la ecuación proporcionada.
La densidad se determinó utilizando los valores del peso y volumen de la solución mediante la siguiente fórmula:
Densidad = peso de la solución (g)∕volumen de la solución (ml).
Para la determinación del peso de la solución, se utilizó la balanza analítica Mettler-Toledo, S.A.E.
El pH, que indica el grado de acidez o alcalinidad de una disolución en función de la concentración de hidrogeniones, se midió utilizando el pHmetro Basic 20 Crison® (Hach Lange Spain, S.L.U). Los resultados también se expresaron como la media ± DS de 3 medidas diferentes.
Cada dilución se preparó en un volumen final de 50 ml, de los cuales 30 μl se emplearon para medir la osmolalidad, 6 ml se utilizaron para determinar la densidad y el volumen restante para medir el pH.
Identificación del poder vesicanteLos agentes vesicantes son sustancias capaces de producir ampollas, desprendimiento de tejido o, incluso, necrosis cuando se extravasan hacia el tejido circundante. Por otro lado, los agentes irritantes provocan sensación de ardor, escozor o dolor como resultado de la irritación en la luz interna de la vena, con o sin presencia de signos externos inmediatos de inflamación. A pesar de estas distinciones, es importante tener en cuenta que el daño en el endotelio vascular puede llevar, a su vez, a procesos de flebitis, infiltración y extravasación15. Estos fenómenos son más frecuentes en pacientes pediátricos, ya que presentan un menor calibre venoso y mayor dificultad para la inmovilización16,17.
Se considera que la gravedad de la extravasación es proporcional a la cantidad de fármaco extravasado; sin embargo, propiedades como el pH, la osmolaridad, el poder vasoactivo y la citotoxicidad también pueden influir en la capacidad vesicante16,17. Aunque la extravasación puede ocurrir a través de cualquier acceso vascular, es más probable que se produzca cuando se utiliza un CVP. Por este motivo, se recomienda utilizar un catéter venoso central (CVC) cuando se administra un fármaco con riesgo elevado de causar daño tisular17.
La identificación de los fármacos según su capacidad vesicante se basó en la clasificación de Clark et al.17. La mayoría de los agentes vesicantes considerados en esta clasificación presentan valores extremos de pH (p. ej., aciclovir, fenobarbital, fenitoína), o tienen una osmolaridad elevada (p. ej., cloruro sódico ≥3%, soluciones glucosadas ≥12,5%). No obstante, existen otros fármacos que no presentan ninguna de estas propiedades y son considerados vesicantes por un mecanismo de citotoxicidad directa15.
Selección del dispositivo de acceso vascularLa incidencia de flebitis aumenta si el pH y la osmolaridad difieren de los de la sangre (pH 7,35–7,45 y osmolaridad 285–310 mOsm/l)9,10. Con base en esta premisa, Manrique et al. establecieron una clasificación del riesgo de flebitis según las características de las diluciones estudiadas18:
- -
Riesgo elevado: osmolaridad >600 mOsm/l o pH < 4 o pH >9 o vesicante.
- -
Riesgo intermedio: osmolaridad 600–450 mOsm/l o pH 4–5 o pH 7,5–9 o no vesicante.
- -
Riesgo bajo: osmolaridad <450 mOsm/l o pH 5–7,5 o no vesicante.
La duración prevista del tratamiento también se considera un factor importante a la hora de elegir el DAV19.
En general, las soluciones administradas mediante catéteres alojados en vasos de mayor calibre experimentan una tasa de flujo más elevada y una mayor dilución, produciendo menor irritación de la vena. De esta forma, se facilita la administración de soluciones hiperosmolares, con pH extremos, vesicantes y terapias prolongadas10,20.
ResultadosSe realizaron análisis de 30 fármacos correspondientes a los siguientes grupos terapéuticos: antiinfecciosos (56%), antiepilépticos (13%), sedantes (7%), diuréticos (7%), antiinflamatorios y analgésicos (7%), y otros (10%). Para cada uno de los fármacos, se establecieron 2 concentraciones, a excepción de la rasburicasa, que se evaluó en una sola dilución y la ampicilina que se analizó en 3 diluciones. En total, se llevaron a cabo 60 diluciones diferentes.
De las 60 diluciones analizadas, 15 presentaron al menos un factor de riesgo elevado de producir flebitis, mientras que 21 diluciones mostraron algún factor de riesgo intermedio.
En relación con la osmolaridad, 5/60 diluciones correspondientes a 3 fármacos diferentes presentaron una osmolaridad >600 mOsm/l, mientras que 4/60 preparaciones correspondientes a 4 fármacos distintos mostraron una osmolaridad entre 600–450 mOsm/l.
Respecto al pH, 13/60 diluciones se caracterizaron por presentar valores de pH extremos. De estas, 8 diluciones correspondientes a 4 fármacos diferentes mostraron un pH > 9, mientras que 5 diluciones asociadas a 3 fármacos distintos presentaron un pH < 4. Además, 17/60 diluciones mostraron valores de pH situados entre 4 y 5 o entre 7,5 y 9. En concreto, 3 diluciones relacionadas con 3 fármacos presentaron un pH entre 4 y 5, y 14 diluciones, que involucraban a 9 fármacos, mostraron valores de pH entre 7,5 y 9.
De los 30 fármacos estudiados, únicamente 3 (10%) fueron considerados vesicantes de acuerdo con la clasificación de Clark et al.17: aciclovir, fenitoína y vancomicina. Estos fármacos, a las concentraciones estudiadas, también presentaron riesgo de causar flebitis con base en sus valores de pH y osmolaridad.
Para guiar la selección del DAV más adecuado, se utilizó el algoritmo propuesto por Manrique et al., que tiene en cuenta las propiedades del fármaco (osmolaridad, pH y poder vesicante), la duración estimada del tratamiento y el estado del capital venoso del paciente18.
De acuerdo con este algoritmo, si el capital venoso del paciente se encuentra en mal estado o la dilución a administrar presenta, al menos, un factor de riesgo elevado de causar flebitis (> 600 mOsm/l, pH < 4 o > 9, o si el fármaco es un agente vesicante), se recomienda utilizar un acceso venoso central. El tipo de catéter empleado dependerá de la duración estimada del tratamiento:
- •
<1 mes: CVC no tunelizado o catéter central de inserción periférica (PICC)
- •
1 mes - 1 año: PICC
- •
>1 año: CVC tunelizado o implantado
Por otro lado, si el paciente presenta un capital venoso en buen estado y la dilución no se considera de riesgo elevado, la selección del DAV se realizará atendiendo a los siguientes criterios:
- •
Osmolaridad < 450 mOsm/l y pH en rango de bajo riesgo (5–7,5) o intermedio (4–5o7,5–9):
- o
<7 días: CVP
- o
7 días - 1 mes: catéter de línea media (MC, del inglés midline catheter)
- o
>1 mes: CVC no tunelizado o PICC
- •
Osmolaridad entre450–600 mOsm/l y pH entre 5 y 7,5:
- o
<7 días: CVP
- o
7 días - 1 mes: MC
- o
>1 mes: CVC no tunelizado o PICC
- •
Osmolaridad ≤ 600 mOsm/l y pH entre 4 y 5 o 7,5 y 9:
- o
<7 días: MC
- o
7 días - 1 mes: MC
- o
>1 mes: CVC no tunelizado o PICC
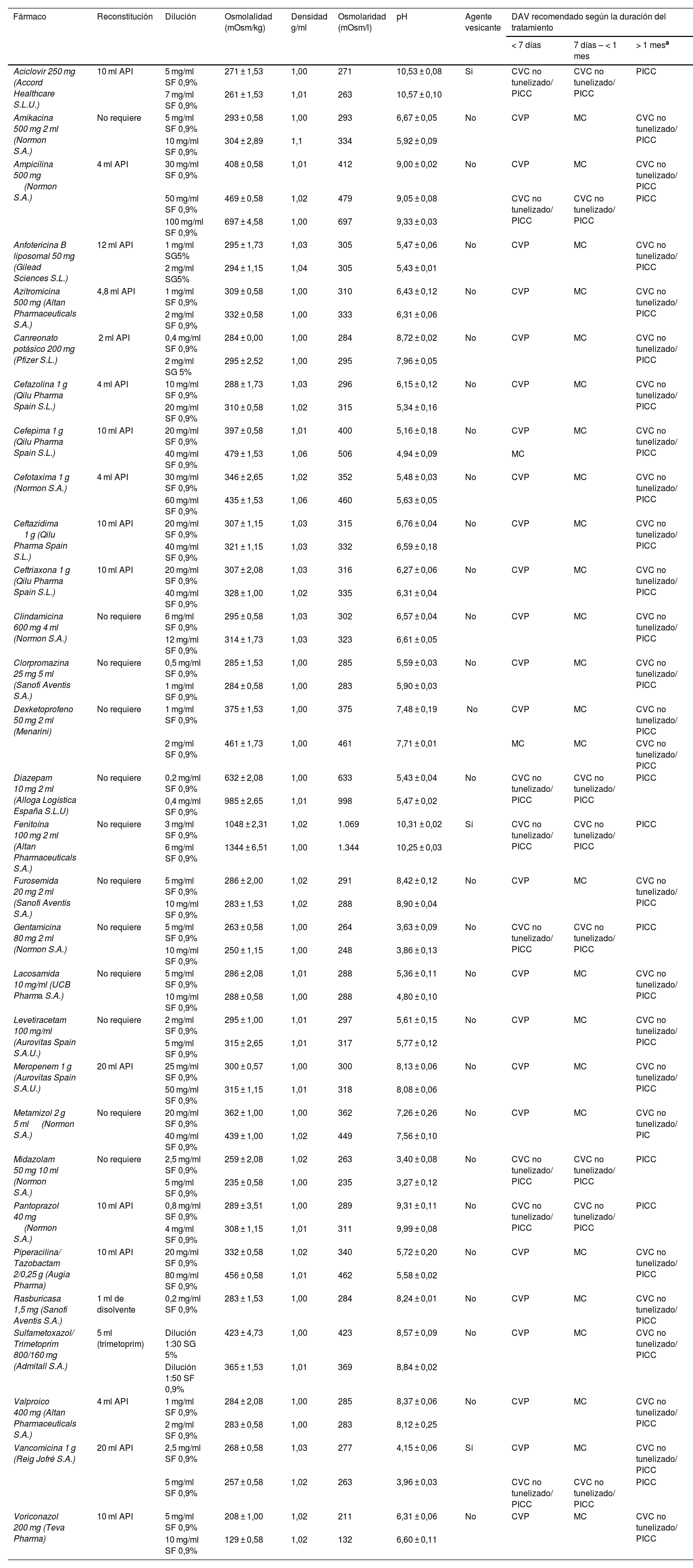
En la tabla 1 se recogen los fármacos y las características de las diluciones estudiadas, así como el DAV más adecuado en función de la duración del tratamiento.
Propiedades fisicoquímicas y poder vesicante de las diluciones estudiadas y dispositivo de acceso vascular más adecuado según la duración del tratamiento intravenoso
| Fármaco | Reconstitución | Dilución | Osmolalidad (mOsm/kg) | Densidad g/ml | Osmolaridad (mOsm/l) | pH | Agente vesicante | DAV recomendado según la duración del tratamiento | ||
|---|---|---|---|---|---|---|---|---|---|---|
| < 7 días | 7 días – < 1 mes | > 1 mesa | ||||||||
| Aciclovir 250 mg (Accord Healthcare S.L.U.) | 10 ml API | 5 mg/ml SF 0,9% | 271 ± 1,53 | 1,00 | 271 | 10,53 ± 0,08 | Si | CVC no tunelizado/ PICC | CVC no tunelizado/ PICC | PICC |
| 7 mg/ml SF 0,9% | 261 ± 1,53 | 1,01 | 263 | 10,57 ± 0,10 | ||||||
| Amikacina 500 mg 2 ml (Normon S.A.) | No requiere | 5 mg/ml SF 0,9% | 293 ± 0,58 | 1,00 | 293 | 6,67 ± 0,05 | No | CVP | MC | CVC no tunelizado/ PICC |
| 10 mg/ml SF 0,9% | 304 ± 2,89 | 1,1 | 334 | 5,92 ± 0,09 | ||||||
| Ampicilina 500 mg (Normon S.A.) | 4 ml API | 30 mg/ml SF 0,9% | 408 ± 0,58 | 1,01 | 412 | 9,00 ± 0,02 | No | CVP | MC | CVC no tunelizado/ PICC |
| 50 mg/ml SF 0,9% | 469 ± 0,58 | 1,02 | 479 | 9,05 ± 0,08 | CVC no tunelizado/ PICC | CVC no tunelizado/ PICC | PICC | |||
| 100 mg/ml SF 0,9% | 697 ± 4,58 | 1,00 | 697 | 9,33 ± 0,03 | ||||||
| Anfotericina B liposomal 50 mg (Gilead Sciences S.L.) | 12 ml API | 1 mg/ml SG5% | 295 ± 1,73 | 1,03 | 305 | 5,47 ± 0,06 | No | CVP | MC | CVC no tunelizado/ PICC |
| 2 mg/ml SG5% | 294 ± 1,15 | 1,04 | 305 | 5,43 ± 0,01 | ||||||
| Azitromicina 500 mg (Altan Pharmaceuticals S.A.) | 4,8 ml API | 1 mg/ml SF 0,9% | 309 ± 0,58 | 1,00 | 310 | 6,43 ± 0,12 | No | CVP | MC | CVC no tunelizado/ PICC |
| 2 mg/ml SF 0,9% | 332 ± 0,58 | 1,00 | 333 | 6,31 ± 0,06 | ||||||
| Canreonato potásico 200 mg (Pfizer S.L.) | 2 ml API | 0,4 mg/ml SF 0,9% | 284 ± 0,00 | 1,00 | 284 | 8,72 ± 0,02 | No | CVP | MC | CVC no tunelizado/ PICC |
| 2 mg/ml SG 5% | 295 ± 2,52 | 1,00 | 295 | 7,96 ± 0,05 | ||||||
| Cefazolina 1 g (Qilu Pharma Spain S.L.) | 4 ml API | 10 mg/ml SF 0,9% | 288 ± 1,73 | 1,03 | 296 | 6,15 ± 0,12 | No | CVP | MC | CVC no tunelizado/ PICC |
| 20 mg/ml SF 0,9% | 310 ± 0,58 | 1,02 | 315 | 5,34 ± 0,16 | ||||||
| Cefepima 1 g (Qilu Pharma Spain S.L.) | 10 ml API | 20 mg/ml SF 0,9% | 397 ± 0,58 | 1,01 | 400 | 5,16 ± 0,18 | No | CVP | MC | CVC no tunelizado/ PICC |
| 40 mg/ml SF 0,9% | 479 ± 1,53 | 1,06 | 506 | 4,94 ± 0,09 | MC | |||||
| Cefotaxima 1 g (Normon S.A.) | 4 ml API | 30 mg/ml SF 0,9% | 346 ± 2,65 | 1,02 | 352 | 5,48 ± 0,03 | No | CVP | MC | CVC no tunelizado/ PICC |
| 60 mg/ml SF 0,9% | 435 ± 1,53 | 1,06 | 460 | 5,63 ± 0,05 | ||||||
| Ceftazidima 1 g (Qilu Pharma Spain S.L.) | 10 ml API | 20 mg/ml SF 0,9% | 307 ± 1,15 | 1,03 | 315 | 6,76 ± 0,04 | No | CVP | MC | CVC no tunelizado/ PICC |
| 40 mg/ml SF 0,9% | 321 ± 1,15 | 1,03 | 332 | 6,59 ± 0,18 | ||||||
| Ceftriaxona 1 g (Qilu Pharma Spain S.L.) | 10 ml API | 20 mg/ml SF 0,9% | 307 ± 2,08 | 1,03 | 316 | 6,27 ± 0,06 | No | CVP | MC | CVC no tunelizado/ PICC |
| 40 mg/ml SF 0,9% | 328 ± 1,00 | 1,02 | 335 | 6,31 ± 0,04 | ||||||
| Clindamicina 600 mg 4 ml (Normon S.A.) | No requiere | 6 mg/ml SF 0,9% | 295 ± 0,58 | 1,03 | 302 | 6,57 ± 0,04 | No | CVP | MC | CVC no tunelizado/ PICC |
| 12 mg/ml SF 0,9% | 314 ± 1,73 | 1,03 | 323 | 6,61 ± 0,05 | ||||||
| Clorpromazina 25 mg 5 ml (Sanofi Aventis S.A.) | No requiere | 0,5 mg/ml SF 0,9% | 285 ± 1,53 | 1,00 | 285 | 5,59 ± 0,03 | No | CVP | MC | CVC no tunelizado/ PICC |
| 1 mg/ml SF 0,9% | 284 ± 0,58 | 1,00 | 283 | 5,90 ± 0,03 | ||||||
| Dexketoprofeno 50 mg 2 ml (Menarini) | No requiere | 1 mg/ml SF 0,9% | 375 ± 1,53 | 1,00 | 375 | 7,48 ± 0,19 | No | CVP | MC | CVC no tunelizado/ PICC |
| 2 mg/ml SF 0,9% | 461 ± 1,73 | 1,00 | 461 | 7,71 ± 0,01 | MC | MC | CVC no tunelizado/ PICC | |||
| Diazepam 10 mg 2 ml (Alloga Logística España S.L.U) | No requiere | 0,2 mg/ml SF 0,9% | 632 ± 2,08 | 1,00 | 633 | 5,43 ± 0,04 | No | CVC no tunelizado/ PICC | CVC no tunelizado/ PICC | PICC |
| 0,4 mg/ml SF 0,9% | 985 ± 2,65 | 1,01 | 998 | 5,47 ± 0,02 | ||||||
| Fenitoína 100 mg 2 ml (Altan Pharmaceuticals S.A.) | No requiere | 3 mg/ml SF 0,9% | 1048 ± 2,31 | 1,02 | 1.069 | 10,31 ± 0,02 | Sí | CVC no tunelizado/ PICC | CVC no tunelizado/ PICC | PICC |
| 6 mg/ml SF 0,9% | 1344 ± 6,51 | 1,00 | 1.344 | 10,25 ± 0,03 | ||||||
| Furosemida 20 mg 2 ml (Sanofi Aventis S.A.) | No requiere | 5 mg/ml SF 0,9% | 286 ± 2,00 | 1,02 | 291 | 8,42 ± 0,12 | No | CVP | MC | CVC no tunelizado/ PICC |
| 10 mg/ml SF 0,9% | 283 ± 1,53 | 1,02 | 288 | 8,90 ± 0,04 | ||||||
| Gentamicina 80 mg 2 ml (Normon S.A.) | No requiere | 5 mg/ml SF 0,9% | 263 ± 0,58 | 1,00 | 264 | 3,63 ± 0,09 | No | CVC no tunelizado/ PICC | CVC no tunelizado/ PICC | PICC |
| 10 mg/ml SF 0,9% | 250 ± 1,15 | 1,00 | 248 | 3,86 ± 0,13 | ||||||
| Lacosamida 10 mg/ml (UCB Pharma S.A.) | No requiere | 5 mg/ml SF 0,9% | 286 ± 2,08 | 1,01 | 288 | 5,36 ± 0,11 | No | CVP | MC | CVC no tunelizado/ PICC |
| 10 mg/ml SF 0,9% | 288 ± 0,58 | 1,00 | 288 | 4,80 ± 0,10 | ||||||
| Levetiracetam 100 mg/ml (Aurovitas Spain S.A.U.) | No requiere | 2 mg/ml SF 0,9% | 295 ± 1,00 | 1,01 | 297 | 5,61 ± 0,15 | No | CVP | MC | CVC no tunelizado/ PICC |
| 5 mg/ml SF 0,9% | 315 ± 2,65 | 1,01 | 317 | 5,77 ± 0,12 | ||||||
| Meropenem 1 g (Aurovitas Spain S.A.U.) | 20 ml API | 25 mg/ml SF 0,9% | 300 ± 0,57 | 1,00 | 300 | 8,13 ± 0,06 | No | CVP | MC | CVC no tunelizado/ PICC |
| 50 mg/ml SF 0,9% | 315 ± 1,15 | 1,01 | 318 | 8,08 ± 0,06 | ||||||
| Metamizol 2 g 5 ml (Normon S.A.) | No requiere | 20 mg/ml SF 0,9% | 362 ± 1,00 | 1,00 | 362 | 7,26 ± 0,26 | No | CVP | MC | CVC no tunelizado/ PIC |
| 40 mg/ml SF 0,9% | 439 ± 1,00 | 1,02 | 449 | 7,56 ± 0,10 | ||||||
| Midazolam 50 mg 10 ml (Normon S.A.) | No requiere | 2,5 mg/ml SF 0,9% | 259 ± 2,08 | 1,02 | 263 | 3,40 ± 0,08 | No | CVC no tunelizado/ PICC | CVC no tunelizado/ PICC | PICC |
| 5 mg/ml SF 0,9% | 235 ± 0,58 | 1,00 | 235 | 3,27 ± 0,12 | ||||||
| Pantoprazol 40 mg (Normon S.A.) | 10 ml API | 0,8 mg/ml SF 0,9% | 289 ± 3,51 | 1,00 | 289 | 9,31 ± 0,11 | No | CVC no tunelizado/ PICC | CVC no tunelizado/ PICC | PICC |
| 4 mg/ml SF 0,9% | 308 ± 1,15 | 1,01 | 311 | 9,99 ± 0,08 | ||||||
| Piperacilina/ Tazobactam 2/0,25 g (Augia Pharma) | 10 ml API | 20 mg/ml SF 0,9% | 332 ± 0,58 | 1,02 | 340 | 5,72 ± 0,20 | No | CVP | MC | CVC no tunelizado/ PICC |
| 80 mg/ml SF 0,9% | 456 ± 0,58 | 1,01 | 462 | 5,58 ± 0,02 | ||||||
| Rasburicasa 1,5 mg (Sanofi Aventis S.A.) | 1 ml de disolvente | 0,2 mg/ml SF 0,9% | 283 ± 1,53 | 1,00 | 284 | 8,24 ± 0,01 | No | CVP | MC | CVC no tunelizado/ PICC |
| Sulfametoxazol/ Trimetoprim 800/160 mg (Admitall S.A.) | 5 ml (trimetoprim) | Dilución 1:30 SG 5% | 423 ± 4,73 | 1,00 | 423 | 8,57 ± 0,09 | No | CVP | MC | CVC no tunelizado/ PICC |
| Dilución 1:50 SF 0,9% | 365 ± 1,53 | 1,01 | 369 | 8,84 ± 0,02 | ||||||
| Valproico 400 mg (Altan Pharmaceuticals S.A.) | 4 ml API | 1 mg/ml SF 0,9% | 284 ± 2,08 | 1,00 | 285 | 8,37 ± 0,06 | No | CVP | MC | CVC no tunelizado/ PICC |
| 2 mg/ml SF 0,9% | 283 ± 0,58 | 1,00 | 283 | 8,12 ± 0,25 | ||||||
| Vancomicina 1 g (Reig Jofré S.A.) | 20 ml API | 2,5 mg/ml SF 0,9% | 268 ± 0,58 | 1,03 | 277 | 4,15 ± 0,06 | Sí | CVP | MC | CVC no tunelizado/ PICC |
| 5 mg/ml SF 0,9% | 257 ± 0,58 | 1,02 | 263 | 3,96 ± 0,03 | CVC no tunelizado/ PICC | CVC no tunelizado/ PICC | PICC | |||
| Voriconazol 200 mg (Teva Pharma) | 10 ml API | 5 mg/ml SF 0,9% | 208 ± 1,00 | 1,02 | 211 | 6,31 ± 0,06 | No | CVP | MC | CVC no tunelizado/ PICC |
| 10 mg/ml SF 0,9% | 129 ± 0,58 | 1,02 | 132 | 6,60 ± 0,11 | ||||||
API: agua para inyectables; CVC: catéter venoso central; CVP: catéter venoso periférico; DAV: dispositivo de acceso vascular; MC: catéter de línea media (del inglés, midline catheter); PICC: catéter central de inserción periférica; SF 0,9%: suero fisiológico al 0,9%; SG 5%: suero glucosado al 5%.
Si el capital venoso del paciente se encuentra en mal estado, la selección del DAV se realizará según lo establecido para las diluciones que presentan al menos un factor de riesgo elevado de causar flebitis.
Se identificaron 17 diluciones asociadas a 9 fármacos distintos que no deberían administrarse a través de un CVP, incluso en tratamientos de corta duración. De estas diluciones, 15 presentaron un riesgo elevado de producir flebitis y 2, un riesgo intermedio.
DiscusiónSegún la evidencia disponible, el presente estudio es el primero en analizar las propiedades fisicoquímicas de las diluciones de los fármacos administrados por vía intravenosa en el paciente crítico pediátrico.
Si bien estudios previos han abordado la caracterización de las diluciones de fármacos administrados por vía intravenosa18,21, se han encontrado diferencias notables en la selección de fármacos, concentraciones y vehículos utilizados en cada uno de ellos. Respecto al reconstituyente, en nuestro estudio se empleó API, mientras que Ballesteros-Peña et al. utilizaron SF 0,9%, y en el estudio de Manrique et al. no se especifica esta información. Estas discrepancias pueden influir en las propiedades fisicoquímicas de las diluciones, lo que dificulta la posibilidad de extrapolar los resultados obtenidos entre los diferentes estudios.
ReconstituciónLa reconstitución se realizó con API en la mayoría de los casos, por ser un diluyente hipotónico (0 mOsm/l). Si en lugar de API se utilizara otro suero compatible, habría que extrapolar la osmolaridad aportada (SF 0,9%: 280 mOsm/l; SG 5%: 289 mOsm/l) al valor obtenido21.
DiluciónRespecto al diluyente empleado, en la mayoría de los casos se utilizó SF 0,9% por ser el vehículo de uso preferente en UCIP. En caso de utilizar un diluyente distinto al SF 0,9%, no sería adecuado extrapolar el valor de la osmolaridad aportada. Esto se debe al comportamiento no ideal de las soluciones, motivo por el que se producen fenómenos de solvatación e interacciones iónicas22. El estudio de Manrique el al. puso de manifiesto que las soluciones elaboradas con SG 5% presentaban una osmolaridad ligeramente superior a las preparadas con SF 0,9%, mientras que las diferencias en el pH eran mínimas18. Una de las estrategias propuestas para reducir la carga osmótica de las soluciones hiperosmolares es emplear cloruro sódico al 0,45% (137 mOsm/l)21 como diluyente, siempre que sea compatible con el fármaco a administrar10,18.
ConcentraciónLa osmolaridad, definida como el número de partículas osmóticamente activas por litro de disolución, se considera una medida de concentración. Con base en esto, se podría suponer que las soluciones más concentradas presentan una osmolaridad mayor. Sin embargo, esto no siempre se cumple, ya que no existe una relación lineal entre la concentración y la osmolaridad22. Por ejemplo, la solución de voriconazol a 5 mg/ml presenta una osmolaridad de 211 mOsm/l, mientras que la dilución de voriconazol a 10 mg/ml tiene una osmolaridad de 132 mOsm/l. Considerando que la solución más concentrada contiene mayor cantidad de fármaco, pero menor volumen de diluyente, podemos suponer que el diluyente contribuye en mayor medida a la osmolaridad que el propio fármaco, en este caso.
Para fármacos como la ampicilina, el dexketoprofeno y la piperacilina/tazobactam, el incremento de la concentración resultó en un aumento de la osmolaridad, lo que implicó un cambio en la clasificación de riesgo de flebitis.
A pesar de las mínimas diferencias de pH entre las distintas diluciones de un mismo fármaco, el aumento de la concentración conllevó modificaciones en la clasificación de riesgo de flebitis, ya sea por aumento o disminución de su pH. Esto se observó para el dexketoprofeno, el metamizol, la lacosamida y la vancomicina.
DensidadAunque la clasificación del riesgo de flebitis se basa en los valores de osmolaridad, dado que las diluciones analizadas tienen una densidad de alrededor de 1 g/ml, los términos «osmolalidad» y «osmolaridad» se pueden considerar intercambiables.
Marca comercialPara la realización de este estudio se ha tenido en cuenta el laboratorio fabricante de cada medicamento, ya que las propiedades fisicoquímicas pueden variar en función de los excipientes empleados en su formulación. En el estudio de Manrique et al. se observaron ligeras variaciones en el pH y la osmolaridad según la marca comercial utilizada. Sin embargo, esas diferencias no implicaron un cambio en la clasificación de riesgo de flebitis18.
Poder vesicanteRespecto a los fármacos considerados vesicantes, la vancomicina se ha relacionado con una mayor tasa de complicaciones en comparación con otros antibióticos que presentan pH ácido7. Esto demuestra que un pH extremo por sí solo no es responsable de causar daño en el endotelio.
Medidas para reducir el daño endotelialAdemás de las propiedades fisicoquímicas y el poder vesicante, existen otros factores relacionados con los fármacos que pueden influir en la capacidad de producir daño endotelial.
- -
Forma de administración: la administración de fármacos mediante infusión intermitente parece reducir la irritación venosa y la tasa de flebitis en comparación con la administración en infusión continua. Con base en esto, se puede afirmar que la toxicidad local no solo es concentración-dependiente sino también tiempo-dependiente23.
- -
Velocidad de administración: reducir la velocidad de administración e incrementar el volumen de la solución se han considerado estrategias útiles para minimizar el daño endotelial7. Sin embargo, esto no siempre es factible debido a la restricción de fluidos y a las situaciones de urgencia de tratamiento7, como ocurre en el entorno de la UCIP. Otros estudios han puesto de manifiesto que aumentar la velocidad de infusión de soluciones irritantes reduce el riesgo de flebitis10,24.
Este estudio presenta ciertas limitaciones que deben considerarse al interpretar los hallazgos obtenidos. En primer lugar, los resultados se basan en el contexto específico de la UCIP del hospital donde se llevó a cabo, por lo que pueden no ser generalizables a otros entornos clínicos con diferentes protocolos de preparación y administración de las diluciones intravenosas. Además, el algoritmo de selección del DAV de Manrique et al. establece diferentes periodos de duración del tratamiento. Con base en esto, se ha considerado que las terapias con una duración inferior a 7 días siguen las mismas recomendaciones que aquellas con una duración menor a un mes, lo que podría condicionar la toma de decisiones en determinados escenarios clínicos.
Por otro lado, además de las propiedades fisicoquímicas de las diluciones, existen otros factores que deben valorarse para la selección del DAV y que no se han abordado en este estudio. Entre ellos, la edad, las comorbilidades y la situación clínica del paciente, además de las habilidades del personal, el lugar de inserción del catéter y la administración concomitante de varios fármacos por vía intravenosa25.
En conclusión, la estandarización y caracterización de las diluciones administradas por vía intravenosa en el paciente crítico pediátrico permite guiar la selección del DAV más apropiado. Dado que un 25% de las diluciones presentan un riesgo elevado de producir flebitis y un 35% se consideran de riesgo intermedio, una adecuada elección del DAV contribuirá a minimizar el daño endotelial y preservar el capital venoso, optimizando la seguridad y eficacia del tratamiento.
Aportación a la literatura científicaEstandarizar y caracterizar las diluciones de los fármacos administrados por vía intravenosa de forma frecuente en el paciente crítico pediátrico facilitará la toma de decisiones sobre la selección del dispositivo de acceso vascular más adecuado, minimizando el riesgo de complicaciones asociadas.
FinanciaciónLos autores declaran que no recibieron financiación.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.
Declaración de contribución de autoría CRediTLaura Torralba-Fernández: Writing – original draft, Supervision, Methodology, Formal analysis, Conceptualization. Marta García-Palomo: Writing – original draft, Supervision, Methodology, Formal analysis, Conceptualization. Miguel López de Abechuco-Ruíz: Writing – original draft, Supervision, Methodology, Formal analysis, Conceptualization. Natalia Ramos-Sánchez: Writing – original draft, Supervision, Methodology, Formal analysis, Conceptualization. Clara Jiménez-Méndez: Writing – original draft, Supervision, Methodology, Formal analysis, Conceptualization. Rocío Prieto-Galindo: Writing – original draft, Supervision, Methodology, Formal analysis, Conceptualization. María Carmen Lorenzo-Lozano: Writing – original draft, Supervision, Methodology, Formal analysis, Conceptualization. Pablo Aguado-Barroso: Writing – original draft, Supervision, Methodology, Formal analysis, Conceptualization.