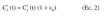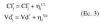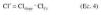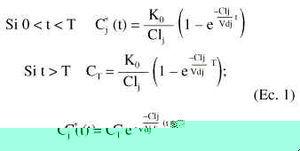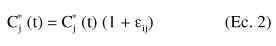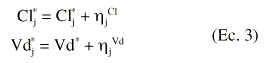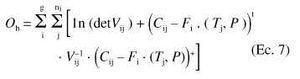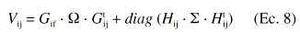ORIGINALES
ESTIMACIÓN DE PARÁMETROS FARMACOCINÉTICOS POBLACIONALES DE TOBRAMICINAEN PACIENTES CRÍTICOS
Pérez Ruixo, J.J., Licenciado en Farmacia. Residente 2.o año. Servicio de Farmacia. Hospital Universitario Dr. Peset. Mateu García, M.T.,Doctor en Farmacia. Servicio de Farmacia. Hospital Universitario Dr. Peset.Casabó Alós, V.G.,Doctor en Farmacia. Profesor Titular del Departamento de Farmacia y Tecnología Farmacéutica. Universidad de Valencia.Jiménez Torres, N.V.,Doctor en Farmacia. Jefe del Servicio de Farmacia. Hospital Universitario Dr. Peset. Catedrático del Departamento de Farmacia y Tecnología Farmacéutica. Universidad de Valencia.
Correspondencia: Juan José Pérez Ruixo. Servicio de Farmacia. Hospital Univesitario Dr. Peset. Avda. Gaspar Aguilar, 90. 46017 Valencia.
E-mail: Farmapese @ san.gva.es
Fecha de recepción: 9-7-98
Palabras clave: Tobramicina. Pacientes críticos. Parámetros farmacocinéticos.
Resumen: Objetivo: Evaluar la exactitud y la precisión, en la estimación de los parámetros farmacocinéticos poblacionales de tobramicina en pacientes críticos, mediante el método estándar en dos etapas y el modelo no lineal de efectos mixtos, utilizando las técnicas de simulación de Monte Carlo.
Método: El estudio se realizó simulando las concentraciones plasmáticas de tobramicina en una población con características análogas a los pacientes adultos, ingresados en la Unidad de Cuidados Intensivos (UCI), y subsidiarios de tratamiento con tobramicina. Los datos simulados se analizaron mediante el método estándar en dos etapas, con las aplicaciones informáticas PKS y USC * PACK, y modelo no lineal de efectos mixtos, con las aplicaciones informáticas NONMEM y MULTI-ELS. La evaluación de exactitud y precisión en la estimación de parámetros farmacocinéticos poblacionales se realizó mediante la teoría de errores y el número de diseño.
Resultados y discusión: Los métodos en dos etapas y los métodos en una etapa estiman de forma similar los valores de tendencia central de los parámetros farmacocinéticos de tobramicina. La variabilidad interindividual que se obtiene con los
métodos en dos etapas se encuentra sobrestima-
da y los métodos en una etapa caracterizan de forma más eficiente los parámetros de variabilidad. Asimismo, el número de diseño se confirma como un estadígrafo tan útil como otros para cuantificar la exactitud y precisión en la estimación de los parámetros farmacocinéticos poblacionales, con la ventaja de evaluar, simultáneamente, la exactitud y precisión.
Conclusión: El modelo no lineal de efectos mixtos implementado en el programa NONMEM es el método más eficiente para la estimación de parámetros farmacocinéticos poblacionales, tanto de tendencia central como de variabilidad.
ESTIMATION OF PHARMACOKINETIC OF TOBRAMYCIN IN A POPULATION OF CRITICALLY ILL PATIENTS
Key words: Tobramycin. Critically ill patients. Pharmacokinetic parameters.
Summary: Objective: To evaluate the accuracy and precision of an estimate of pharmacokinetic parameters of tobramycin in a population of critically ill patients, with a standard two-statge method and a nonlinear mixed effects model, using Monte Carlo simulation techniques.
Method: Plasma concentrations of tobramycin were simulated in a population with characteristics analogous to those of adult patients hospitalized in the intensive care unit (ICU) who were receiving subsidiary treatment with tobramycin. The simulated data were analyzed with a standard two-statge method using PKS and USC * PACK software, and with a nonlinear mixed effects model using NONMEM and MULTIELS software. Accuracy and precision of the estimates of popu-
lation pharmacokinetic parameters were judged with error theory and design number approaches.
Results and discussion: The two-statge and one-statge methods both provided similar estimates of the main trend of pharmacokinetic parameters of tobramycin. The two-statge model overestimated intersubject variability, and the one-step method more efficiently characterized variability parameters. As a statistical tool, design number was as useful as other methods for quantifying accuracy and precision of the estimates of populational pharmacokinetic parameters, and had the advantage of simultaneously evaluating accuracy and precision.
Conclusion: The nonlinear mixed effects model used by the NONMEM software program was the most efficient method for estimating both the main trend and variability in population pharmacokinetic parameters.
Farm Hosp 1999; 23: 57-63
INTRODUCCION
La farmacocinética poblacional estudia la variabilidad de las concentraciones plasmáticas entre los distintos individuos que reciben pautas posológicas normalizadas (1). En su concepción actual, una de las aplicaciones clínicas más importantes son los estudios retrospectivos realizados con datos observacionales obtenidos de la rutina clínica asistencial (2, 3). Entre las limitaciones inherentes a este tipo de estudios destacan, el sesgo introducido por las distintas pautas posológicas, su duración, y el insuficiente número de pares de valores concentración plasmática-tiempo; estas situaciones generan información dispersa y, generalmente, escasa de los tiempos de muestreo seleccionados que dista mucho de la obtenida con un esquema óptimo de tiempos de extracción (4). Sin embargo, los resultados disponibles tienen gran utilidad y relevancia clínica al permitir realizar extrapolaciones a otros pacientes, sometidos al mismo tratamiento. En cualquier caso, la utilización a priori de esta información permitirá una mayor eficiencia en la predicción individual de niveles plasmáticos mediante métodos bayesianos.
En este contexto, cuando el número de pacientes tratados con el fármaco a estudio es elevado, se puede suplir la escasez de observaciones por individuo, a través del análisis de los datos con el método estándar en dos etapas, el método no paramétrico de máxima verosimilitud (5) y el modelo no lineal de efectos mixtos, implementado en el programa NONMEM (6). No obstante, la distinta base farmacoestadística que soporta cada método justifica la distinta exactitud y precisión de la estimación de los parámetros farmacocinéticos poblacionales (4). Es más, la utilización a priori de esta información puede ocasionar importantes errores en la individualización posológica si la caracterización de los parámetros farmacocinéticos poblacionales no se ha realizado con suficiente exactitud y precisión. Así, Vozeh et al (7) al estudiar la exactitud y precisión en la predicción de las concentraciones plasmáticas de lidocaína y mexiletina mediante un método bayesiano, concluyen que una incorrecta estimación de los parámetros farmacocinéticos de tendencia central tiene relativamente escasa importancia, comparado con la influencia de la incorrecta estimación de los parámetros que cuantifican la variabilidad interindividual y residual. Por tanto, cuanto más exacta y precisa sea la estimación de los parámetros farmacocinéticos poblacionales, menor variabilidad se genera en la predicción y ajuste individidualizado de dosis. Este planteamiento aboca a admitir que, «a priori», el método que genere parámetros más exactos y precisos será el de elección para desarrollar el algoritmo bayesiano que permita la individualización posológica.
Las técnicas de simulación de Monte Carlo son de elección cuando se requiere el estudio de las diversas situaciones que pueden afectar a la estimación de los parámetros farmacocinéticos poblacionales (8, 9). Las simulaciones sirven de elemento único de referencia para validar las estimaciones paramétricas de un fármaco, proporcionadas por los métodos disponibles para definir su comportamiento cinético en una población determinada de pacientes.
El objetivo de este trabajo es evaluar la exactitud y la precisión, en la estimación de los parámetros farmacocinéticos poblacionales de tobramicina en pacientes críticos, mediante el método estándar en dos etapas y el modelo no lineal de efectos mixtos, utilizando las técnicas de simulación de Monte Carlo (10).
MÉTODO
La población de individuos simulados posee características análogas a las de una muestra de 25 pacientes adultos, ingresados en la Unidad de Cuidados Intensivos (UCI), y subsidiarios de tratamiento con tobramicina (tabla 1). Se asumió que la tobramicina se administraba en perfusión intravenosa de 30 minutos y la toma de muestras de sangre se realizaba justo antes de la siguiente administración (Cmín), y 30 minutos después de finalizar la perfusión intravenosa (Cmáx).
Tabla 1. Características de la población de pacientes adultos (n=25) utilizada para realizar el estudio de simulación | |
| Parámetro | Media (DE) |
| Edad (años) | 56,81 (19,56) |
| Talla (cm) | 166,64 (9,35) |
| Peso (kg) | 73,42 (11,07) |
| Sexo (V/M) (%) | 35,5/64,5 |
| Crs (mg/dl) | 1,1 (1,1) |
También se asumió que la determinación de tobramicina se realizaba mediante inmunofluorescencia polarizada TDx/FLx de Abbott Diagnostic Division, con un límite de sensibilidad de 0,18 mg/l y un coeficiente de variación es inferior al 10 % en el ámbito de concentraciones comprendido entre 0,18 y 8 mg/l.
El comportamiento farmacocinético poblacional se caracterizó asumiendo como modelo farmacocinético estructural el modelo monocompartimental abierto, con administración intravenosa en perfusión intermiente a velocidad constante, K0, y eliminación corporal de primer orden (ecuación 1).
En la ecuación 1, Cj* (t) es la concentración plasmática estimada a tiempo t en el individuo j-ésimo, tras la administración de una dosis única. Para caracterizar la evolución temporal de las concentraciones plasmáticas de tobramicina tras la administración de dosis múltiples se aplicó el principio de superposición. Los parámetros del individuo j-ésimo son el aclaramiento plasmático Clj, y el volumen de distribución, Vdj, y T es el tiempo de perfusión. Se asume que la concentración plasmática experimental, Cj(t), se halla sujeta a un error residual proporcional, y por tanto, Cj(t) se expresa como:
donde *j es una variable aleatoria que se distribuye de forma normal con media 0 y variada *2. La variabilidad interindividual del aclaramiento plasmático y del volumen de distribución se describe mediante un modelo de error aditivo:
en las que *jCl y *jVd cuantifican las desviaciones del individuo j-ésimo respecto al valor poblacional típico del aclaramiento plasmático y del volumen de distribución en la población Cl* y Vd*, y son variables aleatorias independientes que se distribuyen de forma normal con media 0 y varianzas *2cl y *2vd, respectivamente. Además, el modelo de regresión del aclaramiento de tobramicina asume que el aclaramiento plasmático del fármaco es directamente proporcional al aclaramiento de creatinina (Clcr), calculado según la ecuación de Jellife & Jellife (11) (ecuación 4):
donde Clslope es la constante de proporcionalidad entre el aclaramiento de tobramicina y el aclaramiento de creatinina. Mediante este modelo farmacoestadístico (tabla 2) se crearon 10 lotes de 25 individuos cada uno y 84 pares de valores concentración plasmáticatiempo. Cada uno de los lotes se estudió mediante los métodos paramétricos referidos, método estándar en dos etapas y modelo no lineal de efectos mixtos. En el primero, los parámetros farmacocinéticos individuales se calcularon mediante regresión no lineal por mínimos cuadrados ponderales, utilizando el algoritmo de minimización de Nelder-Mead. La media de los valores obtenidos para cada parámetro farmacocinético y su dispersión (o varianza) indentifican el comportamiento cinético en la población. Para realizar este análisis farmacocinético se han utilizado los programas Abbott Pharmacokinetics System (PKS) versión 1.1 (12) y USC* PACK versión 10.0 (13).
Tabla 2. Modelo farmacoestadístico utilizado para la simulación de los pares de valores concentración plasmática-tiempo | ||
| Modelo estructural | ||
| -- Modelo farmacocinético | ||
| * Modelo monocompartimental abierto con administración intravenosa en perfusión intermitente a velocidad constante y eliminación corporal de primer orden | ||
| -- Modelo de regresión | ||
| * Clp (ml/min) = 0,814 Clcr (ml/min) | ||
| Modelo de varianza | ||
| -- Modelo de variabilidad interindividual | ||
| * Vdi (l) = 29,5 + n1 | n1 = N (0,76.56) | |
| * Cli (ml/min) = Clp + n2 | n2 = N (0,1.21) | |
| -- Modelo de variabilidad residual | ||
| * Cpij (mg/l) = Cpij* (mg/l) *(1 + e1) | e1 = N (0,0.04) | |
Los parámetros farmacocinéticos poblacionales de tendencia central y su variabilidad, se estimaron, en una sola etapa, mediante regresión no lineal por mínimos extendidos (ELS), utilizando el modelo no lineal de efectos mixtos (14). La función objetivo de máxima verosimilitud, que se minimiza, puede expresarse de acuerdo con la siguiente ecuación:
donde g es el número de grupos de población a evaluar, ni es el número de pacientes incluidos en cada grupo i, Cij es el vector de la variable dependiente del individuo j-éximo en el grupo i-éximo, Tj es el vector de las variables independientes, Fi(Tj, P) es el vector media poblacional del grupo i que corresponde al modelo farmacocinético adoptado y P es el vector correspondiente a los parámetros medios poblacionales establecidos en cada grupo. Vij representa la matriz de covarianza poblacional de Cij que incluye el modelo de variabilidad interindividual y residual que puede definirse mediante la siguiente expresión:
siendo la matriz de covarianza de la variabilidad interindividual y la matriz de varianza de la variabilidad residual, que incluye el error experimental. Gij es la matriz jacobiana con respecto a la variabilidad interindividual y Hij es la matriz jacobiana con respecto a la variabilidad intraindividual. El operador diag iguala a cero todos los elementos no diagonales de la matriz. En el método de mínimos cuadrados extendidos, el modelo estructural que establece el comportamiento poblacional del fármaco, para cada grupo, queda especificado por el vector Fi(Tj, P) y el modelo estructural de variabilidad interindividual y residual queda especificado por la matriz Vij(1). Los programas informáticos utilizados para realizar el análisis farmacocinético mediante el modelo no lineal de efectos mixtos han sido MULTI-ELS (15) Y NONMEM versión III (16).
La exactitud y precisión en la estimación de los parámetros farmacocinéticos poblacionales de cada programa informático se evaluó mediante el análisis del error relativo de la estimación (ERi) y el análisis del número de diseño. Para cada programa informático se determina la media, como medida de exactitud, y la desviación estándar del error relativo de estimación, como medida de precisión. Se realizó un ANOVA de una vía para comparar los ER medios (ERM) en la estimación que cada programa informático realizada de cada parámetro farmacocinético poblacional. Se realizaron las comparaciónes mútiples post-hoc mediante el test de Scheffé.
El cálculo del error sistemático en la estimación de un parámetro ignora que las estimaciones de los parámetros realizadas con cada programa informático se producen con su correspondiente error estándar; además, en muchas ocasiones es muy difícil elegir un método de estimación de los parámetros farmacocinéticos poblacionales sin considerar la fiabilidad de la estimación paramétrica. El número de diseño, *, es un estadígrafo que combina simultáneamente elementos de exactitud y precisión. Para tener en cuenta la exactitud y precisión en la estimación de todos los parámetros farmacocinéticos poblacionales se calculó el número de diseño absoluto y relativo, Fa y Fr, respectivamente. Para comparar los Fa y Fr obtenidos con cada diseño experimental se utilizó la prueba no paramétrica de Kruskal-Wallis. La significación estadística utilizada en todos los análisis estadísticos fue p<0,05. Una descripción más detallada del procedimiento de cálculo de estos índices se puede encontrar en el trabajo original de Ette et al (8), y en esta misma revista en el trabajo de Pérez Ruixo et al (9).
RESULTADOS
En la población de individuos utilizada para simular los datos se administraron 2,97 (0,86) mg/kg de tobramicina durante 8,23 (3,68) días. El valor medio del Cmáx, tras la primera monitorización comparado con las sucesivas, no dió diferencias significativas, 4,47 (1,83) mg/l frente a 5,53 (2,31) mg/l (p>0,05); y, el valor medio de la Cmín, tras la primera monitorización comparada con las sucesivas, tampoco dió diferencias significativas 1,25 (1,11) mg/l frente a 1,24 (1,12) mg/l (p>0,05).
La exactitud, medida como la media del error relativo de estimación, y la precisión, medida como la desviación estándar del error relativo de estimación, para cada uno de los parámetros farmacocinéticos poblacionales definidos, proporcionada por las distintas aplicaciones informáticas utilizadas se recogen en la tabla 3. Por otra parte, en la tabla 4 se informa de la medida simultánea de la exactitud y precisión a través de los números de diseño globales, absoluto y relativo, proporcionados por las mismas aplicaciones informáticas.
Tabla 3. Exactitud y precisión en la estimación de los parámetros cinéticos poblacionales de tobramicina con las diferentes aplicaciones informáticas | |||||
Programa de farmacocinética | |||||
| Parámetro | PKS | USC-PACK* | MULTI-ELS | NONMEN | P |
| Vd | 1,62 (11,10) | 1,35 (11,38) | 19,93 (24,01) | 3,25 (8,40) | <0,05 |
| *Vd | 32,23 (39,15) | 33,23 (37,24) | 13,49 (41,53) | 8,37 (23,39) | n.s. |
| Clslope | 46,00 (15,94) | 0,06 (7,30) | 12,32 (26,76) | 2,85 (5,87) | <0,001 |
| *cl | 331,46 (63,28) | 397,00 (154,65) | 32,27 (59,87) | 12,09 (54,09) | <0,001 |
Tabla 4. Medida de exactitud y precisión simultánea (número de diseño) proporcionada en la estimación de los parámetros cinéticos poblacionales de tobramicina con las diferentes aplicaciones informáticas | ||||
Programa de farmacocinética | ||||
| Parámetro | PKS | USC | MULTI-ELS | NONMEN |
| Fa | 0,56 | 1,93 | 0,0065 | 0,0021 |
| Fr | 0,2470 | 0,2496 | 0,1887 | 0,1520 |
DISCUSIÓN
El número de pacientes simulados se encuentra dentro del orden de magnitud empleado en otros estudios de simulación (3, 17, 18). En este estudio, se decidió excluir la evaluación de la variabilidad residual debido a que la variabilidad ocasionada por la técnica TDx/FLx, para determinar las concentraciones plasmáticas de tobramicina, es el principal determinante de la misma. Por tanto, en este caso el modelo de error de la técnica analítica es la mejor estimación de la varianza residual y la ponderación más adecuada para la correcta utilización de los algoritmos bayesianos (19).
En este estudio, la exactitud en la estimación de la tendencia central (valor medio) de los parámetros farmacocinéticos de tobramicina es parecida para los métodos y programas informáticos manejados. No obstante, el programa USC * PACK proporciona el menor error relativo de estimación o error sistemático. La comparación mediante el ANOVA de los errores relativos de estimación referentes al Vd, muestra que el error relativo de estimación (sesgo) cometido por MULTI-ELS difiere significativamente del resto de procedimientos (p<0,05). En lo que se refiere al sesgo en la estimación de Clslope, esta misma prueba revela diferencias estadísticamente significativas (p<0,001) entre el método estándar en dos etapas ejecutado por el programa PKS y el resto de métodos y programas ensayados.
La mayor exactitud en los parámetros que definen la variabilidad interindividual (*Vd y *Cl) se ha obtenido con el programa NONMEM, cuyos errores relativos medios son los más próximos a cero. Sin embargo, esta diferencia no resulta estadísticamente significativa en lo que concierne a *Vd. Por otro lado, en lo rerferente a *Cl, el ANOVA solo detectó diferencias estadísticamente significativas (p<0,001) entre los métodos estándar en dos etapas y los métodos en una etapa. En cuanto a la precisión en las estimaciones de los parámetros farmacocinéticos de tendencia central y variabilidad se confirma que el modelo no lineal de efectos fijos implementado en el programa NONMEM es el más preciso.
La selección de uno u otro método de estimación parámetrica condiciona de forma significativa la capacidad predictiva del algoritmo bayesiano. Para discernir, de entre diversos métodos de estimación, aquel con menor sesgo y mayor precisión, se ha utilizado el número de diseño inicialmente empleado por Ette et al (8) para evaluar distintas estrategias de toma de muestras de sangre. El parámetro peor estimado de forma individual ha sido *Cl a pesar de estar incluido como predictor del modelo de regresión el aclaramiento de creatinina. Para realizar la comparación de medias de los distintos Fr se considera de elección la aplicación del método de Kruskal-Wallis sin embargo con este tipo de datos no parece aconsejable el empleo de pruebas para comparaciones múltiples de tipo no paramétrico. La estimación más eficiente de los parámetros, menor número de diseño, ha sido la realizada con el modelo no lineal de efectos mixtos implementado en el programa NONMEM.
En la figura 1 se representan las gráficas de las distribuciones de frecuencias de los valores del volumen aparente de distribución estimado por el método en dos etapas (programa USC * PACK) y por el modelo no lineal de efectos mixtos (NONMEM). Se observa como ambos métodos proporcionan estimaciones exactas y precisas del parámetro de tendencia central; en la misma figura, también se pone de manifiesto la sobreestimación de la variabilidad interindividual que provoca el método en dos etapas, y que se produce, de forma sistemática, en la estimación de los parámetros farmacocinéticos de variabilidad del modelo. La causa de la sobreestimación (10) es atribuible al error en la estimación individual de cada parámetro, ya que, la calidad en la estimación de los parámetros farmacocinéticos está condicionada por factores como un número de muestras plasmáticas insuficientes u obtenidas a tiempos inadecuados, un modelo cinético inapropiado o una ponderación errónea (19). Por tanto, este error de estimación añade una variabilidad a la estimación del parámetro que no es biológica en su origen, resultando, en una sobreestimación de la variabilidad interindividual, que es mayor cuanto peor es el diseño experimental del estudio (20). La estimación de la variabilidad interinvidual por el modelo no lineal de efectos mixtos tiende a ser más fiable porque no esta afectado con el error implicado en la estimación de los parámetros individuales. La capacidad predictiva de las estimaciones poblacionales realizadas con el método en dos etapas puede verse limitada por el hecho de realizar estos estudios en pequeños grupos de voluntarios sanos o pacientes seleccionados que, con frecuencia, no son lo suficientemente representativos de la población. Sin embargo, entre las ventajas más sobresalientes de este método se puede citar que considera a cada individuo aislado de la población, su relativa sencillez y la existencia de un número elevado de programas informáticos para el análisis de los datos. Se ha comprobado que el método en dos etapas proporciona buenas estimaciones de los parámetros poblacionales cuando se estudia un número muy amplio de individuos con muestreos exhaustivos. Este hecho limita su uso en la práctica clínica habitual.
Figura 1.--Comparación de la distribución de frecuencias del volumen de distribución estimado (o predicho) por el programa informático USC*PACK (método en dos etapas) y por el NONMEM (modelo no lineal de efectos mixtos).
En definitiva, el estudio de simulación realizado confirma que los métodos en dos etapas y los métodos en una etapa estiman de forma similar los valores de tendencia central de los parámetros farmacocinéticos de tobramicina. Sin embargo, la variabilidad interindividual que se obtiene con los métodos en dos etapas se encuentra sobreestimada y su distribución de frecuencias presenta una tendencia log-normal. Por el contrario, los métodos en una etapa caracterizan de forma más eficiente los parámetros de variabilidad. Además, este estudio demuestra que el modelo no lineal de efectos mixtos implementado en el programa NONMEM es el método más eficiente para estimación de parámetros farmacocinéticos poblacionales, tanto de tendencia central como de variabilidad. Asimismo, el número de diseño se confirma como un estadígrafo tan útil como otros para cuantificar la exactitud y precisión en la estimación de los parámetros farmacocinéticos poblacionales, con la ventaja de evaluar, simultáneamente, la exactitud y precisión.
BIBLIOGRAFÍA
1. Mandema JW. Population pharmacokinetics and pharmacodinamics. En Welling P, Tse FLS (eds): Pharmacokinetics: regulatory, industrial, academic perspective. Marcel Dekker®. 1995;441-50.
2. Sheiner LB, Rosenberg B, Marathe VV. Estimation of population characteristics of pharmacokinetics parameters from routina clinical data. J Pharmacokin Biopharm 1977;5:445-79.
3. Sheiner LB y Beal SL. Evaluation of methods for estimation population pharmacokinetic parameters. III Monoexponential model: routine pharmacokinetics data. J Pharmacokin Biopharm 1983;11:303-19.
4. Rodriguez Larrea J. Estudio de la variabilidad poblacional en farmacocinética y farmacodinamia. I. Conceptos generale. Scienc Pharm, 1996;6:96-106.
5. Steimer JL, Mallet A, Golmard JL, Boisvieux JF. Alternative approaches to estimation of population pharmacokinetic parameters: comparison with the nonlinear mixed-effect model. Drug Metabolism Reviews 1984;15:262-92.
6. Steimer JL, Mallet A, Mentre F. Estimating interinvidual pharmacokinetic variability. En: Rowland M, Sheiner LM, Steimer JL, eds. Variability in drug therapy: description, estimation, and control. New York; Raven Press; 1985. p. 65-111.
7. Vozeh S, Maitre PO, Stanski DR. Evaluation of population (NONMEM) pharmacokinetic parameter estimates. J Pharmacokin Biopharm 1990;18:161-73.
8. Ette EI, Kelman AW, Hovie CA, Whiting B. Interpretation of simulation studies for efficient estimation of population pharmacokinetic parameters. Ann Pharmacother 1993;27:1034-9.
9. Perez-Ruixo JJ, Medina C, Casabó VG, Jiménez NV. Influencia del diseño experimental en la estimación de los parámetros farmacocinéticos poblaciones de ciclofosfamida en pacientes con cáncer de mama. Farma Hosp 1998;1:15-21.
10. Sheiner LB, Beal SL. Evaluation of methods for estimating population pharmacokinetic parameters. II. Biexponential model and experimental pharmacokinetic data. J Pharmacokin Biopharm 1981;9:635-51.
11. Jellife RW, Jellife SM. A computer program for estimation of creatinine clearance from unestable serum creatinine levels, age, sex and weight. Math Biosci 1972;14:17-24.
12. ABBOTTBASE Pharmacokinetic System version 1.1. Abbot Laboratories, Illinois, 1991.
13. Jellife RW, Schumitzky A, Van Guilder M. User manual for version 10.0 of the USC * PACK PC programs. University of Souther California, 1993.
14. Metzler CM. Extended least squares (ELS) form pharmacokinetic models. J Pharm Sci 1987;76:565-71.
15. Yamaoka K, Tanaka H. A new version of Multi-(ELS) for extended nonlinear least squares. J Pharmacobio-Dynn 1986;9:161-73.
16. Beal SL. Sheiner LB. NONMEM User''s Guides. San Francisco: NONMEM Project Group, University of California San Francisco, 1989.
17. Sheiner LB. Analysis of pharmacokinetic data using parametric models. I: Regression models. J Pharmacokin Biopharm. 1984;12:93-117.
18. Sheiner LB. Analysis of pharmacokinetic data using parametric models. II: Point estimates of a individual''s parameters. J Pharmacokin Biopharm 1985; 13:515-41.
19. Jimenez NV, Casabó VG, Sancho V. Manual de procedimientos para farmacocinética clínica. 1.a ed. Valencia: AFAHPE; 1997.
20. Rodriguez Larrea J. Estudio de la variabilidad poblacional en farmacocinética y farmacodinamia (II). Métodos paramétricos. Cienc Pharm 1996;6:152-62.