ORIGINALES
ESTUDIO COMPARATIVO DEL EFECTO QUE PRODUCEN DOS EMULSIONES LIPIDICAS SIMILARES SOBRE LA FUNCION HEPATICA
Pons Busom, M., Licenciada en Farmacia, Especialista en Farmacia Hospitalaria, Farmacéutico Adjunto; Martínez Bernabé, E., Licenciada en Farmacia, Farmacéutico Residente; Aguas Compaired, M., Licenciada en Farmacia, Especialista en Farmacia Hospitalaria, Jefe de Sección; Roca Rosellini, N., Licenciada en Medicina, Médico Adjunto, Servicio de Cirugía General y Digestiva; Eguileor Partearroyo, B., Licenciada en Farmacia, Especialista en Farmacia Hospitalaria, Jefe de Sección, Director Servicio de Farmacia; Hernández Gómez, F., Licenciado en Medicina, Director de Servicio, Servicio de Cirugía General y Digestiva.
Servicio de Farmacia. Hospital Sagrat Cor. Barcelona.
Servicio de Cirugía. Unidad de Nutrición. Hospital Sagrat Cor. Barcelona.
The results suggest that lipid preparations that seem to have the same composition a priori may affect liver function parameters differently.
Correspondencia:
Montserrat Pons Busom.
Servicio de Farma-cia.
Hospital Sagrat Cor.
Viladomat, 288. 08029 Barcelona.
Fecha de recepción: 28-7-98
Comunicación presentada de forma resumida al XV Congreso Nacional de la Sociedad Española de Nutrición Parenteral y Enteral el 15 de mayo de 1998.
Palabras clave:
Lípidos. Pruebas de función hepática. Nutrición parenteral.
Resumen:
Se ha realizado un estudio prospectivo, a ciego simple, de todos los pacientes adultos tratados con nutrición parenteral durante más de cuatro días con el propósito de evaluar si dos emulsiones lipídicas similares (L1 y L2) podían alterar de forma distinta las pruebas de función hepática.
El análisis univariante efectuado entre los valores iniciales y los obtenidos después de la primera semana de tratamiento han mostrado que los pacientes tratados con L1 mostraban un aumento significativo en los niveles de alanin-aminotransferasa, fosfatasas alcalinas y gamma-glutamil transferasa (p = 0,013, p = 0,006 y p = 0,001), mientras que los tratados con L2 mostraban únicamente un aumento significativo de gamma-glutamil transferasa (p = 0,041).
Los resultados obtenidos han permitido concluir qué preparados lipídicos de composición, a priori similar, pueden alterar de forma distinta los parámetros indicadores del funcionamiento hepático.
COMPARATIVE STUDY OF THE EFFECT OF TWO SIMILAR LIPID EMULSIONS ON LIVER FUNCTION
Key words:
Lipids. Liver function tests. Parenteral nutrition.
Summary:
A prospective, simple-blind study was made of all adult patients who received parenteral nutrition for more than four days in order to determine if two similar lipid emulsions (L1 and L2) affect liver function tests differently.
Univariant analysis of baseline values and those obtained after the first week of treatment showed that patients treated with L1 had a significant increase in alanine-aminotransferase, alkaline phosphatase, and gamma-glutamyl transferase concentrations (p = 0.013, p = 0.006 and p = 0.001). Patients treated with L2 only showed a significant increase in gamma-glutamyl transferase (p = 0.041).
INTRODUCCION
La administración de nutrición parenteral (NP) se asocia en un porcentaje elevado de pacientes a una alteración de los parámetros indicadores de la función hepática. Generalmente en estos casos se aconseja retirar la nutrición parenteral e iniciar nutrición enteral si es posible, para estimular el flujo biliar, impedir la alteración de la mucosa intestinal y evitar la absorción de productos hepatotóxicos (ácido litocólico y endotoxinas) producidos por el sobrecrecimiento anaerobio que ocurre durante el reposo intestinal. En los pacientes en los que no es posible suspender la NP se aconseja no sobrealimentarlos para reducir, en la medida de lo posible, el estrés metabólico adicional (1, 2).
La alteración de las pruebas hepáticas parece ser de causa multifactorial y aunque no suele tener implicación clínica debe ser considerada (1, 3-11).
Entre los factores que predisponen a esta alteración cabe citar:
--El tipo y la gravedad de la patología de base, así como de las patologías subyacentes (1, 7).
--Grado de malnutrición antes de iniciar el soporte nutricional (1, 7).
--Aporte de carbohidratos. El aporte excesivo de carbohidratos fue considerado durante mucho tiempo la causa principal de la alteración hepática. Esta teoría parecía reafirmarse al observar que la adición de lípidos a las NP, con la consecuente disminución del aporte de carbohidratos, reducía de forma considerable la alteración hepática (2, 5). Sin embargo, fue descartada por algunos autores que observaron que a pesar de disminuir el aporte de glucosa la alteración hepática persistía (1, 4, 8, 12).
--Aporte excesivo o carencia de algunos aminoácidos (1, 5, 12, 13):
--* El exceso de metionina puede producir una acumulación de grupos sulfuro que puede ser causa de la hepatotoxicidad asociada a la NP (1).
* El déficit de taurina en pacientes pediátricos sometidos a la NP se ha relacionado con la gravedad de la colestasis, ya que ésta mejora cuando los pacientes reciben dietas enriquecidas en taurina (1, 5, 11, 13).
--Déficit de otros nutrientes (1, 5, 13):
--* El déficit de glutamina produce atrofia de la mucosa gástrica y como consecuencia empeoramiento de la función hepática. Este déficit aparece generalmente en la NP prolongada (5, 13).
--* Déficit de colina. La colina es un componente esencial de membranas celulares que actúa como precursor de la síntesis de fosfolípidos. En condiciones normales la colina no se considera esencial ya que puede sintetizarse a partir de la metionina. Sin embargo, en algunos pacientes sometidos a NP y específicamente en cirróticos se considera esencial (1, 13-15).
--Duración del tratamiento con NP. En pacientes sometidos a NP prolongada se observan frecuentemente complicaciones hepáticas. Esto se debe a que el reposo del tubo digestivo imposibilita la estimulación de la liberación de hormonas digestivas, como la colecistoquinina, favoreciendo la colestasis (1, 5, 12).
--Presencia de sustancias contaminantes:
* El bisulfto sódico, que se encuentra como antioxidante en algunas soluciones de aminoácidos forma un complejo inestable en presencia de triptófano, que puede ser causa de hepatopatía (5, 13).
* Los fitosteroles, que se hallan como contaminantes de emulsiones lipídicas, han sido identificados por algunos autores como posibles causantes de colestasis asociada a NP (16).
--Acumulación de triglicéridos (TG) en el hígado. Durante el catabolismo proteico que ocurre en situaciones de estrés, disminuye la síntesis de la fracción proteica o apoproteína y de la lipoproteína de muy baja densidad (VLDL). Esto ocasiona una falta de liberación de los TG sintetizados en el hígado y como consecuencia una acumulación de los mismos (4, 17).
--Aporte de lípidos. Existen numerosos trabajos que demuestran la relación entre la alteración de las pruebas de función hepática y el aporte de lípidos. Estas alteraciones pueden ser debidas a un aporte excesivo de los mismos, al tipo de mezcla lipídica y al preparado comercial empleado (1, 4, 10, 12, 18-20):
* Aporte excesivo. El aporte de más del 50% de calorías en forma de lípidos puede ser una causa directa de depósito de ácidos grasos en el hígado (12).
* Tipo de mezcla lipídica. La mayor parte de los trabajos publicados muestran que el aporte de mezclas de triglicéridos de cadena larga (LCT) más triglicéridos de cadena media (MCT) alteran en menor grado los parámetros bioquímicos indicadores del funcionamiento hepático que las mezclas que aportan únicamente LCT (1, 4, 21).
* Preparado comercial. Se ha descrito que preparados lipídicos de composición similar pueden afectar de forma diferente el funcionamiento hepático. Esta diferencia puede ser debida al diferente tamaño de las partículas, a la presencia de oleato sódico en algún preparado y al proceso de purificación de los lípidos (22).
El objetivo de este estudio ha sido evaluar si dos emulsiones lipídicas similares, compuestas por LCT, alteraban de forma diferente los parámetros indicadores del funcionamiento hepático.
MÉTODO
Se ha realizado un estudio prospectivo, a ciego simple, en todos los pacientes sometidos a NP.
Fueron incluidos en el estudio todos los pacientes mayores de dieciocho años con tratamiento nutricional superior a cuatro días.
Todos los pacientes recibían aporte de carbohidratos en forma de glucosa. El aporte de proteínas era mediante una solución estándar de aminoácidos que contenía un 40% de aminoácidos esenciales y un 60% de aminoácidos no esenciales.
La composición de los preparados lipídicos empleados en el estudio era la siguiente:
--L1 (500 ml): aceite de soja, 50 g; glicerol, 12,5 g; lecitina de yema de huevo, 6 g; oleato sódico, 0,15 g; agua para inyección, c.s.p., e hidróxido sódico para ajuste de pH, c.s.p.
--L2 (500 ml): aceite de soja, 50 g; glicerol USP, 11,25 g; lecitina de yema de huevo, 6 g, y agua para inyección, c.s.p.
El aporte de micronutrientes se efectuó de acuerdo al protocolo del hospital:
--El aporte de electrólitos en la nutrición parenteral se realizaba, en la mayoría de los pacientes, mediante una solución de electrólitos estándar de 50 ml (Na+, 40 mEq; K+, 60 mEq; Ca++, 9,2 mEq; Mg++, 10 mEq; Cl, 60 mEq, y acetato, 50 mEq). Los pacientes que requerían un aporte específico de electrólitos recibían la cantidad necesaria de cada uno de ellos de acuerdo a sus niveles plasmáticos y a sus pérdidas.
--Las vitaminas se administraban diariamente, excepto los miércoles, en que se administraba la solución de oligoelementos. A partir de la segunda semana de tratamiento se administraban a días alternos vitaminas y oligoelementos.
--La vitamina K, por no estar incluida en el complejo vitamínico, se administraba por vía intramuscular dos días por semana.
La asignación del preparado lipídico a los pacientes fue al azar, mediante una tabla de números aleatorios. La solicitud de las analíticas era siempre mediante petición normal, nunca urgente, para evitar posibles desviaciones debidas a las técnicas empleadas. Asimismo se procuraba que la extracción fuera en ayunas y por la mañana para asegurar que todos los pacientes estuvieran en las mismas condiciones. Los parámetros analíticos a evaluar se determinaron a partir de uno de los perfiles habitualmente solicitados en el hospital para evitar gastos innecesarios.
Se registraron los parámetros analíticos indicadores de la función hepática [aspartato amino transferasa (AST), alanina amino-transferasa (ALT), fosfatasas alcalinas (FA), bilirrubina total (BT) y gamma-glutamil transferasa (*GT)], los relacionados directamente con el metabolismo de los lípidos [triglicéridos (TG)] y los indicadores del estado nutritivo [albúmina (A) y proteínas totales (PT)].
Para cada paciente se realizó un control analítico antes de iniciar la NP y posteriormente cada siete días hasta que finalizaba el tratamiento.
Los datos fueron registrados mediante la base de datos Dbase III plus y fueron procesados mediante el paquete estadístico SPSSPC versión 6.0 para windows.
De las variables incluidas en el estudio se llevó a cabo un estudio descriptivo, una prueba de «t» de Student de comparación de medias entre variables cuantitativas y una prueba de *2 para variables cualitativas. Asimismo se llevó a cabo un análisis de la varianza (método Oneway) y un análisis multivariante. Se consideraron significativas las pruebas con p < 0,05.
RESULTADOS
Se estudiaron 83 pacientes que iniciaron tratamiento con NP durante un período del siete meses. Doce de estos pacientes fueron excluidos del estudio por no cumplir los criterios de inclusión requeridos.
Los 71 pacientes incluidos en el estudio tenían una media de edad 68,2 años (DE: 12,7), de los cuales 39 eran hombres y 32 mujeres. Los diagnósticos que se observaron mayoritariamente fueron las neoplasias de intestino grueso y las fístulas digestivas (respectivamente 12 y 11 pacientes). En la mayoría de los tratamientos la NP finalizaba por mejoría clínica (56 pacientes) (tabla 1).
Tabla 1. Homogeneidad de la población de estudio respecto a las variables edad, sexo, diagnóstico y motivo de suspensión del tratamiento nutricional | |||||
| Variable | Total | L1 | L2 | Test | Significación |
| Edad [media (DE*)] | 68,2 | 67,2 | 69,1 | F = 0,37 | ns |
| (DE: 12,7) | (DE: 13,2) | (DE: 12,3) | |||
| Sexo (n.° pacientes): | *2 = 0,11 | ns | |||
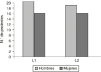
| -- Hombres | 39 | 20 | 19 | ||
| -- Mujeres | 32 | 16 | 16 | ||
| Diagnóstico (n.° pacientes): | *2 = 9,99 | ns | |||
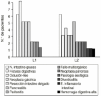
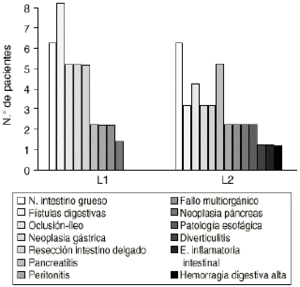
| -- Neoplasia intestino grueso | 12 | 6 | 6 | ||
| -- Fístula digestiva | 11 | 8 | 3 | ||
| -- Oclusión-íleo | 9 | 5 | 4 | ||
| -- Neoplasia gástrica | 8 | 5 | 3 | ||
| -- Resección intestino delgado | 8 | 5 | 3 | ||
| -- Pancreatitis | 7 | 2 | 5 | ||
| -- Peritonitis | 4 | 2 | 2 | ||
| -- Fallo multiorgánico | 4 | 2 | 2 | ||
| -- Neoplasia páncreas | 3 | 2 | 1 | ||
| -- Patología esofágica | 2 | 0 | 2 | ||
| -- Diverticulitis | 1 | 0 | 1 | ||
| -- Enfermedad inflamatoria intestinal | 1 | 0 | 1 | ||
| -- Hemorragia digestiva alta | 1 | 0 | 1 | ||
| Motivo del fin (n.° pacientes): | *2 = 5,79 | ns | |||
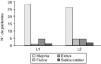
| -- Mejoría | 56 | 29 | 27 | ||
| -- Exitus | 8 | 5 | 3 | ||
| -- Fiebre | 4 | 1 | 3 | ||
| -- Salida del catéter | 3 | 1 | 2 | ||
* DE: desviación estándar. | |||||
Al inicio de tratamiento los valores medios de lo parámetros analíticos indicadores del funcionamiento hepático (AST, ALT, BT, FA) y del metabolismo lípidico (TG) estaban dentro de los límites de referencia establecidos en nuestro centro. La media de los parámetros indicadores del estado nutricional era inferior a la normalidad y los valores medios de la *GT eran ligeramente superiores a los valores de referencia establecidos (tabla 2).
| Tabla 2. Media de los parámetros bioquímicos de los 71 pacientes evaluados al inicio del tratamiento | |
| Parámetros bioquímicos | Media (DE) |
| Albúmina (g/l) | 28,3 (6,8) |
| Proteínas totales (g/l) | 53,1 (8,8) |
| Triglicéridos (TG) (mmol/l) | 1,6 (0,8) |
| Aspartato aminotransferasa (GPT-ALT) (U/l) | 29,2 (25,9) |
| Alanin aminotransferasa (GOT-AST) (U/l) | 30,0 (26,0) |
| Bilirrubina total (mg/dl) | 0,9 (1,3) |
| Fosfatasas alcalinas (FA) (U/l) | 239,5 (188,1) |
| Gammaglutamil transferasa (*GT) (U/l) | 76,8 (89,1) |
El aporte diario medio de nutrientes, por paciente, durante la primera semana de tratamiento fue:
--Carbohidratos: 211,42 g (DE: 28,25).
--Lípidos: 50,39 g (DE: 10,8).
--Proteínas: 82,5 g (DE: 58,94), equivalente a 13,2 g de nitrógeno (DE: 9,4).
Y a lo largo de todo el tratamiento:
--Carbohidratos: 3.657,96 g (DE: 3.125,85).
--Lípidos: 783,1 g (DE: 609,4).
--Proteínas: 1.310,0 g (DE: 1.103,1), equivalente a 209,6 g de nitrógeno (DE: 176,5).
La duracion media del tratamiento con NP fue de 17,4 días (DE: 13,3).
A 36 de los 71 pacientes evaluados se les administró el preparado lipídico L1 y a los 35 restantes se les administró el preparado L2.
El estudio comparativo entre ambos grupos de pacientes al inicio del tratamiento mostró que no existían diferencias significativas en ninguno de los parámetros cualitativos evaluados (Figs. 1, 2 y 3) ni en ninguno de los cuantitativos (tablas 1, 3 y 4).
Figura 1.--Distribución, según el sexo, de los dos grupos de pacientes (*2 = 0,11 ns).
Figura 2.--Distribución de pacientes según el diagnóstico (*2 = 9,99 ns).
Figura 3.--Distribución de pacientes según el motivo de suspensión del tratamiento con NP (*2 = 5,79 ns).
| Tabla 3. Media de los parámetros cuantitativos, aporte de nutrientes y duración de tratamiento en los grupos de pacientes | ||||
| L1 | L2 | F | Significación | |
| Aporte medio lípidos* (g) | 50,6 (DE: 12,6) | 50,0 (DE: 8,7) | 0,06 | ns |
| Aporte total lípidos** (g) | 827,8 (DE: 617,7) | 737,1 (DE: 606,2) | 0,38 | ns |
| Aporte medio carbohi dratos* (g) | 214,6 (DE: 28,3) | 208,2 (DE: 28,2) | 0,92 | ns |
| Aporte total carbohidra tos** (g) | 3.921,2 (DE: 3.353) | 3.387,1 (DE: 2.896,2) | 0,13 | ns |
| Aporte medio nitróge no* (g) | 14,4 (DE: 13,1) | 11,9 (DE: 1,5) | 2,26 | ns |
| Aporte total nitróge no** (g) | 226,4 (DE: 182,7) | 192,3 (DE: 170,7) | 0,11 | ns |
| Suplemento albúmina (g) | 140 (DE: 60) | 173,3 (DE: 93,5) | 0,44 | ns |
| Duración de la NP | 18,5 (DE: 13,2) | 16,4 (DE: 13,4) | 0,20 | ns |
| * Aporte medio de lípidos durante la primera semana de tratamiento. ** Aporte de lípidos durante todo el tratamiento. | ||||
Tabla 4. Media de los parámetros bioquímicos al inicio del tratamiento en los dos grupos de pacientes | ||||
| L1 | L2 | F | Significación | |
| Albúmina (g/l) | 29,5 (DE: 7,3) | 27,2 (DE: 6,3) | 1,72 | ns |
| Proteínas totales (g/l) | 53,6 (DE: 9,7) | 52,6 (DE: 7,8) | 2,00 | ns |
| TG (mmol/l) | 1,7 (DE: 0,9) | 1,4 (DE: 0,7) | 2,07 | ns |
| ALT (U/l) | 27,5 (DE: 20,6) | 31,0 (DE: 30,5) | 0,30 | ns |
| AST (U/l) | 30,0 (DE: 26,1) | 30,0 (DE: 26,5) | 0,00 | ns |
| Bilirrubina total (mg/dl) | 0,8 (DE: 0,9) | 1,1 (DE: 1,6) | 1,24 | ns |
| FA (U/l) | 1963,4 (DE: 100,3) | 281,2 (DE: 239,5) | 3,32 | ns |
| *GT (U/l) | 61,5 (DE: 52,4) | 91,5 (DE: 113,0) | 1,81 | ns |
El análisis univariante efectuado entre los valores iniciales y los registrados después de una semana de tratamiento mostró que en el grupo de pacientes que recibian la mezcla L1 no existían diferencias significativas en los parámetros indicadores del estado nutricional (A y PT) ni en los niveles de TG. Sin embargo, sí existía un aumento significativo en alguno de los parámetros indicadores del funcionamiento hepático (ALT, FA y *GT, respectivamente, p = 0,013, p = 0,006 y p = 0,001) (tabla 5).
Tabla 5. Parámetros bioquímicos evaluados al inicio y a los siete días de tratamiento en los pacientes tratados con el preparado lipídico L1 | ||||
| Parámetros bioquímicos | Inicio tratamiento | Séptimo día tratamiento | «t» de Student | Significación |
| Albúmina (g/l) | 31,2 (DE: 6,9) | 29,5 (DE: 7,6) | 1,28 | ns |
| Proteínas totales (g/l) | 54,8 (DE: 10,4) | 55,1 (DE: 11,8) | 0,20 | ns |
| TG (mmol/l) | 1,7 (DE: 0,9) | 1,7 (DE: 0,6) | 0,07 | ns |
| ALT (U/l) | 28,5 (DE: 21,4) | 39,7 (DE: 25,5) | 2,68 | 0,013 |
| AST (U/l) | 25,8 (DE: 15,3) | 26,8 (DE: 14,1) | 0,24 | ns |
| FA (mg/dl) | 197,4 (DE: 104,7) | 304,2 (DE: 165,4) | 3,06 | 0,006 |
| Bilirrubina total (mg/dl) | 0,8 (DE: 1,0) | 0,5 (DE: 0,3) | 1,49 | ns |
| *GT (U/l) | 64,1 (DE: 55,9) | 143,5 (DE: 111,3) | 3,74 | 0,001 |
En los pacientes a los que se administraba la mezcla L2, el análisis univariante después de la primera semana de tratamiento mostró un aumento significativo en los valores de A y PT (respectivamente p = 0,037 y p = 0,001). En relación a los parámetros indicadores de la función hepática, solamente se observó un aumento significativo en los niveles de *GT (p = 0,041) (tabla 6).
Tabla 6. Parámetros bioquímicos evaluados al inicio y a los siete días de tratamiento en los pacientes tratados con el preparado lipídico L2 | ||||
| Parámetros bioquímicos | Inicio tratamiento | Séptimo día tratamiento | «t» de Student | Significación |
| Albúmina (g/l) | 27,7 (DE: 6,1) | 31,8 (DE: 7,7) | 2,19 | 0,037 |
| Proteínas totales (g/l) | 53,0 (DE: 7,8) | 58,1 (DE: 9,3) | 3,60 | 0,001 |
| TG (mmol/l) | 1,3 (DE: 0,7) | 1,3 (DE: 0,6) | 0,15 | ns |
| ALT (U/l) | 29,4 (DE: 30,6) | 40,5 (DE: 33,1) | 1,39 | ns |
| AST (U/l) | 25,7 (DE: 27,7) | 42,3 (DE: 40,2) | 1,77 | ns |
| FA (mg/dl) | 295,5 (DE: 262,1) | 370,2 (DE: 419,7) | 1,42 | ns |
| Bilirrubina total (mg/dl) | 1,1 (DE: 1,6) | 1,0 (DE: 1,7) | 0,36 | ns |
| *GT (U/l) | 93,0 (DE: 119,8) | 150,4 (DE: 171,9) | 2,15 | 0,041 |
El análisis multivariante mostró que no existían diferencias significativas al inicio del tratamiento entre los dos grupos de pacientes L1 y L2 en ninguna de las variables evaluadas tanto en los indicadores del estado nutritivo como del funcionamiento hepático o del metabolismo de los lípidos (tabla 7).
Tabla 7. Resultados del análisis multivariante efectuados el primer día, el séptimo día y la diferencia entre el primer y séptimo día | ||||||
| Parámetros bioquímicos | Inicio tratamiento | Séptimo día tratamiento | Diferencia séptimo-primer día | |||
| F | p | F | p | F | p | |
| Albúmina (g/l) | 0,87 | ns | 2,47 | ns | 7,21 | 0,011 |
| Proteínas totales (g/l) | 0,00 | ns | 4,95 | 0,031 | 7,06 | 0,012 |
| TG (mmol/l) | 2,61 | ns | 3,03 | ns | 0,00 | ns |
| ALT (U/l) | 0,31 | ns | 0,55 | ns | 0,00 | ns |
| AST (U/l) | 0,04 | ns | 3,71 | ns | 0,21 | ns |
| FA (mg/dl) | 1,99 | ns | 1,00 | ns | 0,02 | ns |
| Bilirrubina total (mg/dl) | 1,14 | ns | 2,09 | ns | 0,6 | ns |
| *GT (U/l) | 1,66 | ns | 0,24 | ns | 0,16 | ns |
El análisis multivariante efectuado con los valores de las variables a los siete días de tratamiento mostró que no existían diferencias significativas entre ambos grupos de pacientes en los indicadores del funcionamiento hepático ni en los niveles plasmáticos de TG, pero sí se observó un aumento significativo en uno de los parámetros indicadores del estado nutritivo (PT p = 0,031) (tabla 7).
Por último, el análisis multivariante de la diferencia entre los valores obtenidos al inicio del estudio y después de la primera semana de tratamiento mostró que los pacientes tratados con el preparado L2 presentaban mayores aumentos de los parámetros indicadores del estado nutritivo A y PT (p = 0,011 y p = 0,012) que los pacientes tratados con L1 (tabla 7).
DISCUSIÓN
Los pacientes incluidos en este estudio mostraron al inicio del tratamiento un incremento de los niveles plasmáticos de *GT en relación con los valores de referencia. No obstante, dado que entre ambos grupos de pacientes no existían diferencias significativas en los valores de esta variable y que el objetivo del estudio era evaluar si las dos emulsiones lipídicas podían alterar de forma distinta las pruebas de funcionamiento hepático, no se tuvo en cuenta esta alteración previa.
Los resultados obtenidos en este estudio son comparables a los obtenidos por otros autores. Fundamentalmente se observa una elevación en los niveles plasmáticos de la FA y de la *GT, mientras que los otros parametros indicadores del funcionamiento hepático no presentan alteración significativa (AST y BT) (1, 4, 5, 19, 22, 23).
En la mayor parte de la bibliografía consultada los autores efectúan estudios comparativos entre emulsiones lipídicas con aporte exclusivo de LCT y emulsiones que aportan LCT y MCT. En estos estudios se demuestra que el aporte de mezclas de LCT y MCT producen en menor proporción alteración de las pruebas de funcionamiento hepático (1, 4).
El estudio realizado por Gerard-Boncompain et al (22) muestra que pacientes sometidos a NP domiciliaria con aporte lipídico de LCT presentan citolisis hepática y colestasis cuando cambian de marca comercial de emulsión lipídica y que ésta remite cuando se reinicia la infusión del preparado lipídico inicial. Estos autores indican que esta alteración puede estar relacionada con el tamaño de la partícula lipídica, la presencia de oleato sódico en uno de los preparados y a la diferencia en el proceso de purificación de la lecitina.
En este estudio hemos comparado dos preparados lipídicos, con características a priori muy similares, que contenían únicamente LCT. Los resultados obtenidos en el análisis univariante mostraron que estos dos preparados alteraban de forma distinta los parámetros bioquímicos indicadores del funcionamiento hepático en nuestro grupo de pacientes. El preparado L1 alteraba de forma significativa los valores de ALT, FA y *GT, mientras que el L2 únicamente producía alteración de la *GT, resultados comparables a los obtenidos por Gerard-Boncompain et al (22).
Además de alterar de forma distinta las pruebas de funcionamiento hepático, se ha observado que los parámetros indicadores del estado nutricional que se realizan de forma sistemática en nuestro hospital aumentan de forma distinta en ambos grupos de pacientes. En el análisis univariante los pacientes tratados con L1 no mostraban diferencias significativas ni en los niveles de A ni en los de PT después de la primera semana de tratamiento, mientras que los tratados con L2 mostraban un incremento significativo de los niveles de A y PT (p = 0,037 y p = 0,001).
Estos resultados fueron confirmados por el análisis multivariante efectuado al séptimo día de tratamiento en el que se observaron diferencias significativas en los valores de las PT entre ambos grupos de pacientes (p = 0,031) y por el análisis multivariante de la diferencia entre los valores obtenidos al inicio del estudio y después de la primera semana de tratamiento en el que se observó que los pacientes tratados con L2 mostraban mayores incrementos en los niveles de A y PT (p = 0,011 y p = 0,012).
A pesar de que estos resultados no pueden ser contrastados con los obtenidos por otros autores, consideramos que deben ser comentados ya que podrían ser objeto de posteriores estudios.
Aunque se han registrado los datos de los pacientes con tratamiento nutricional superior a siete días, no se ha efectuado el análisis estadístico de los mismos debido a la reducción considerable de cada grupo que conducía a un tamaño de muestra insuficiente.
Los resultados obtenidos hacen difícil poder concluir que el preparado L1 produce con mayor frecuencia alteración de las pruebas hepáticas. No obstante, este estudio nos ha demostrado que preparados lipídicos de diferentes firmas comerciales, a pesar de tener composición similar, pueden actuar de forma distinta, por lo que el cambio de marca comercial deberá hacerse con pleno conocimiento de su composición. Asimismo deberá instaurarse un período de prueba que permita evaluar que la utilización del nuevo preparado en el hospital no repercuta en la evolución de los pacientes.
Concluimos indicando lo siguiente:
-- La mezcla L1 altera de forma significativa los valores de ALT, FA y *GT. La mezcla L2 ocasiona una leve alteración de la *GT.
-- El preparado L2 produce mayores aumentos en los parámetros indicadores del estado nutricional A y PT.
-- Preparados lipídicos de composición a priori similar pueden alterar de forma distinta los parámetros indicadores del funcionamiento hepáticos. El cambio de marca comercial de emulsiones lipídicas creemos que debe hacerse con precaución.
BIBLIOGRAFÍA
1.Malone M. Parenteral nutrition induced hepatic disease. Hosp Pharma 1995;30:933-7.
2.Otras complicaciones de la nutrición parenteral domiciliaria. En: NADYA, ed. Manual de nutrición artificial domiciliaria y ambulatoria. Zaragoza: Eurolibro; 1996. p. 163-71.
3.Ang SD, Daly JM. Potential complications and monitoring of patients receiving total parenteral nutrition. En: Rombeau JL, Caldwell MD, eds. Clinical nutrition parenteral nutrition. Philadelphia: WB Saunders; 1986. p. 331-43.
4.Jaurrieta E, Biondo A, Rfecas P, Moreno-Llorente P, Llop J, Fabregat J, et al. Estudio comparativo de la colestasis hepática entre la infusión de triglicéridos de cadena larga y mezcla de triglicéridos de cadena media y larga . Nutr Hosp 1991;6:152-5.
5.Longoni M, Tuneu L, Cardona D, Bonal J. Complicaciones hepáticas asociadas a la nutrición parenteral total prolongada. Revista SEFH 1995;15:79-82.
6.Complicaciones de la nutrición parenteral. En: Celaya S, ed. Guía práctica de nutrición artificial. Zaragoza: Eurolibro; 1996. p. 189-91.
7.Leaseburge LA, Winn NJ, Schloerb PR. Liver test alterations vith total parenteral nutrition and nutritional status. JPEN 1992;16:348-52.
8.Reif S, Tado M, Oliverio R, Young C, Rossi T. Total parenteral nutrition induced steatosis: reversal by parenteral lipid infusion. JPEN 1991;15:102-4.
9.Leaseburge LA, Winn NJ, Schloerb MD. Liver test alterations with total parenteral nutrition and nutritional status. JPEN 1992;16:348-52.
10.Craig RM, Coy D, Green R, Meersman R, Rubin H, Janssen I. Hepatotoxicity related to total parenteral nutrition: comparison of low-lipid and lipid-supplemented solutions. J Crit Care 1994;9:111-3.
11.Meehan BJ, Georgeson KE. Prevention of liver failure in parenteral nutrition-dependent children with short bowel syndrome. J Pediatr Surg 1997;32:473- 5.
12.Quigley EMM, Marsh MN, Shaffer JL, Markin RS. Hepatobiliary complications of total parenteral nutrition. Gastroenterology 1993;104:286-301.
13.Sax HC, Bower RH. Hepatic complications of total parenteral nutrition. JPEN 1988;12:615-8.
14.Buchman AL, Dubin MD, Moukarzel M, Jenden DJ, Roch M, Rice KM, Gornbein J, Ament ME. Choline deficiency: a cause of hepatic steatosis during parenteral nutrition that can be reversed with intravenous choline supplementation. Hepatology 1995;22:1399-403.
15.Politzer E. Essential nature of choline with implications for total parenteral nutrition. J Am Diet Assoc 1997;97:639-9.
16.Iyer KR, Spitz L, Clayton P. New insight into mechanisms of parenteral nutrition. Associated cholestasis: role of plant sterols. J Pediatr Surg 1998;33:1-6.
17.Nishihira T, Komatsu H, Sagawa J, Shineha R, Mori S. Prevention of fatty liver and maintenance of systemic valine depletion using a newly developed dual infusion system. JPEN 1995; 19:199-203.
18.Drum W, Fischer M, Pidlich G, Lenz K. Fat elimination in chronic hepatic failure: long-chain vs medium-chain triglycerides. Am J Clin Nutr 1995;61:812-7.
19.Rubin M, Naor N, Sirota I, Mover A, Pakula R, Harell D, Sulkes J, et al. Are bilirubin and plasma lipid profiles of premature infants dependent on lipid emulsion infused? J Pediatr Gastroenterol Nutr 1995;21:25-30.
20.Messing B. La prescription des emulsions lipidiques par voie intraveineuse. Le Bulletin du Medicament. Assistance publique Hôpitaux de Paris 1997;6:1-2.
21.Baldermann H, Wicklmayr M, Rett N, et al. Changes in Hepatic morphology during parenteral nutrition with lipid emulsions containing LCT or MCT/LCT quantified by ultrasound. JPEN 1991;15:601-3.
22.Gerard-Boncompain G, Claudel JP, Gaussorgues P, et al. Hepatic citolytic and cholestatic changes related to a change of lipid emulsions in four long-term parenteral nutrition patients with short bowel. JPEN 1992;16:78-83.
23. Nanji AA, Anderson FH. Sensitivity and specificity of liver function tests in the detection of parenteral nutrition-associated cholestasis. JPEN 1985;9: 307-8.