Evaluar la eficacia y seguridad de una actualización de un protocolo antiemético de quimioterapia en tumores ginecológicos.
MétodoEstudio prospectivo, observacional, realizado durante 12 meses en un hospital general de 400 camas. Se evaluó la eficacia del protocolo antiemético antiguo, se implantó el protocolo nuevo, y se midió su eficacia. Se incluyeron pacientes con tumores ginecológicos que acudían al hospital de día. Tras cada ciclo de quimioterapia, en una encuesta, registraban el número y severidad de náuseas/vómitos y otros efectos adversos. Se midió la eficacia como respuesta completa (sin náuseas y sin vómitos) en la fase aguda (primeras 24h posquimioterapia) y en retardada (día 2-5 posquimioterapia). Se evaluó si la edad, el tipo de protocolo y el poder emetógeno de los esquemas podían influir en la respuesta.
ResultadosSe analizaron 102 ciclos de quimioterapia con el protocolo antiguo (52 pacientes) y 293 ciclos (98 pacientes) con el protocolo nuevo. Se encontraron diferencias significativas en la respuesta completa en la fase retardada con el protocolo nuevo (67,38 vs 36,27%), p < 0,0001. La probabilidad de obtener respuesta completa con el protocolo nuevo era dos veces mayor que con el antiguo en emesis aguda (OR=1,85; IC 95% = 1,05-3,24; p=0,03) y cuatro veces mayor en emesis retardada (OR=4,27; IC 95% = 2,59-7,02; p<0,0001).
ConclusionesCon el nuevo protocolo se consiguió un mayor porcentaje de respuesta completa en la emesis retardada. La edad y el bajo poder emetógeno de los esquemas fueron factores predictivos de respuesta completa en la emesis aguda.
To evaluate the efficacy and safety of an update to an anti-emetic protocol in chemotherapy for gynecological tumours.
MethodProspective observational study performed over 12 months in a general hospital with 400 beds. We evaluated the efficacy of the old anti-emetic protocol, a new protocol was implemented, and its efficacy was determined. We included patients with gynaecological tumours that sought treatment at the Day Hospital. After each chemotherapy cycle, patients filled out a survey that registered the number and severity of episodes of nausea/vomiting and other adverse effects. The efficacy of treatment was measured as complete response (no nausea or vomit) in the acute phase (first 24h after chemotherapy) and late phase (2-5 days after chemotherapy). We also evaluated whether age, the type of protocol, and the emetogenous power of the different treatment schemes could influence patient response.
ResultsWe analysed 102 chemotherapy cycles under the old protocol (52 patients) and 293 cycles under the new protocol (98 patients). We observed significant differences in complete response rates in the late phase between old and new protocols (36.27% vs 67.38%, P<.0001). The probability of obtaining a complete response using the new protocol was twice as high as with the old protocol in acute emesis (OR=1.85, 95% CI: 1.05-3.24, P=.03) and four times higher in late emesis (OR=4.27, 95% CI: 2.59-7.02, P<.0001).
ConclusionsA greater percentage of complete responses to late emesis was obtained using the new protocol. Age and the low emetogenous power of the treatment schemes were predictive factors for complete response in acute emesis.
Las náuseas y los vómitos (NV) inducidos por la quimioterapia (QT) son efectos adversos comunes y desagradables del tratamiento del cáncer, experimentados por un 70-80% de los pacientes en tratamiento con QT. Asimismo, se presentan con carácter anticipatorio en un 10-44%1–3 de los casos, repercutiendo de manera negativa en la calidad de vida de los pacientes y obligando, en ocasiones, a una no adherencia a los tratamientos o a la necesidad de disminuir la dosis de los fármacos antineoplásicos4.
Los pacientes siguen presentando NV post-QT a pesar de que a lo largo de las décadas se ha ido mejorando su control, en los años 1970 no se hacía profilaxis, en los noventa se introdujeron los antagonistas 5-HT3 y recientemente los inhibidores de los receptores NK1.
Además del poder emetógeno de los esquemas de QT, otros factores como el número de ciclos recibidos y otros aspectos relativos al paciente (sexo, edad, grado de ansiedad, consumo de alcohol, etc.) pueden contribuir a su aparición4–7.
El cáncer de mama es el tumor con mayor incidencia en el sexo femenino seguido del colorrectal y otros tumores ginecológicos (cáncer de útero, ovario, trompas de Falopio y cáncer de cérvix). Según datos de la Sociedad Española Oncología Médica (SEOM) la incidencia global prevista de cáncer en mujeres españolas en el año 2015 será de 85.108, de los cuales casi el 25% (21.000) serán diagnosticados como cáncer de mama. Los esquemas de QT que se utilizan para su tratamiento incluyen asociaciones de fármacos con poder emetógeno moderado. En las primeras 24 h post-QT pueden inducir NV en un 40-60% de los casos (emesis aguda) y en 40-80% de los casos hasta 5 días después de administración de la QT (emesis retardada)7.
En nuestro hospital, aprovechando la introducción de los antagonistas 5-HT3 en el año 1994, se diseñó e implantó un protocolo de profilaxis de emesis inducida por QT ginecológica8.
Según este antiguo protocolo (PA), para evitar la emesis en las primeras 24 h, en esquemas moderadamente emetógenos (ciclofosfamida+flurouracilo junto a antraciclinas (CAF) o metotrexato (CMF), se utilizaba, previo a la QT, 10mg dexametasona intravenosa más 8mg de ondansetrón, seguido de 8mg de ondansetrón por vía oral (v.o.), a las 4 y 8 h post-QT. En esquemas altamente emetógenos (cisplatino) previo a la QT se administraban 250mg de metilprednisolona por vía intravenosa (i.v.)+8mg de ondansetrón i.v., seguido de 8mg de ondansetrón i.v. a las 4 y 8h post-QT. En todos los esquemas introducidos en la práctica clínica con posterioridad (carboplatino, doxorubicina liposomal, topotecan, trastuzumab, etc.) el control de la emesis aguda se hacía con 8mg de ondansetrón i.v. previo a QT, seguido de 8mg de ondansetrón por vía oral, a las 4 y 8 h post-QT. La emesis retardada se controlaba con 8mg de ondansetrón por vía oral/8h hasta el día 2 o hasta el día 3 en esquemas que incluían derivados de platino. Si no se conseguía un buen control de NV, al paciente se le prolongaban los días de ingesta de ondansetrón v.o. con la misma pauta, 8mg/8h v.o.
Con el paso de los años el control antiemético con este PA no parecía ser el adecuado, las pacientes seguían vomitando en su domicilio y demandaban más medicación de rescate. Esto, unido a que se llegó a estandarizar una única pauta antiemética para nuevos esquemas, independientemente de su poder emetógeno, 8mg de ondansetrón i.v. previo a QT y 8mg v.o. administrado cada 8 h (5 dosis en total), llevó al personal implicado en la prescripción, dispensación y administración a evaluar si eran adecuadas las pautas antieméticas que se estaban utilizando.
El objetivo de este estudio fue evaluar la eficacia y seguridad de una actualización de un protocolo antiemético de quimioterapia en tumores ginecológicos.
MétodosEstudio llevado a cabo en un hospital general de 400 camas que da cobertura a una población de 300.000 habitantes.
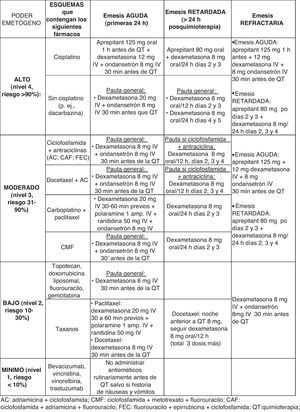
Inicialmente un grupo multidisciplinario (ginecólogos, farmacéuticos y enfermería de hospital de día) revisó las principales y recientes guías en profilaxis antiemética inducida por QT9–13, para finalmente proceder a la actualización de las recomendaciones en un protocolo nuevo (PN). Los principales cambios que aportaba el PN (fig. 1) eran que la profilaxis antiemética se haría según el riesgo emético del esquema definido por la Multinational Association of Supportive Care In Cancer (MASCC), mínimo ([< 10%], bajo [10-30%], moderado [30-90%] y alto [> 90%]). La emesis retardada se pasaría a controlar con dexametasona y se introduciría aprepitant como primera elección en esquemas que incluyeran cisplatino y en emesis resistente de esquemas de poder emetógeno moderado/alto.
Este estudio, prospectivo, observacional, se realizó durante 12 meses (desde noviembre de 2008 a noviembre de 2009). La eficacia del PA se evaluó durante los 4 primeros meses, el PN se implantó en marzo de 2009 y su eficacia se evaluó durante los 9 meses siguientes.
La población del estudio incluía aquellas pacientes con cualquier cáncer ginecológico que acudían a hospital de día para recibir su tratamiento de QT durante el período de estudio. Todas las pacientes que se incluyeran en el grupo que iba a recibir el protocolo nuevo debían de ser pacientes no tratadas previamente, aquellas que iniciaban el tratamiento con quimioterapia. Se excluirían aquellas pacientes con NV en quimioterapias previas, con NV por otros motivos o que presentasen intolerancia y/o alergia a los corticoides.
En cada ciclo de QT se les entregaba en el hospital de día una encuesta para que la rellenaran en su domicilio (fig. 2) para recoger, entre otros aspectos, el grado de NV presentado durante los días 1 al 5 post-QT (emesis aguda y retardada). En la siguiente consulta médica, el facultativo valoraba la tolerancia a la QT y el grado de cumplimiento del tratamiento antiemético.
La eficacia antiemética se midió en la fase aguda (día de la QT) y en fase retardada (día 2 a 5 post-QT). Esta última se evaluó considerando la peor respuesta obtenida durante los 4 días evaluados.
La respuesta antiemética medida en cada ciclo de QT, se clasificó en 4 niveles: respuesta completa (RC) si «no náuseas» y/o «no vómitos, no náuseas» y «no vómitos», no respuesta (NR) si «muchas náuseas» y/o «más 2 vómitos». Se consideró respuesta parcial mayor (RPMayor) cuando, a pesar de no vómitos, el paciente refiere «algunas náuseas» o cuando sin náuseas el paciente refiere 1-2 vómitos. La respuesta fue parcial y se consideró menor (RPMenor) cuando tuvo «algunas náuseas y 1-2 vómitos».
Se consideró la variable principal de eficacia la RC y se hizo un análisis posterior agrupando las respuestas en dos grupos: «RC» y «No RC» (RPmayor+RPmenor+NR).
Los efectos adversos se clasificaron en función del órgano afectado, usando la clasificación MedDRA14.
Se evaluó si la edad, el tipo de protocolo antiemético y el poder emetógeno de los esquemas podían llegar a influir en la RC.
Análisis estadísticoInicialmente se calculó el tamaño muestral para detectar diferencias significativas en la comparación de proporciones mediante el test de la ji cuadrado para 2 muestras independientes bilateral, teniendo en cuenta que el nivel de significación es 5% (error α) y con una potencia del 80% (1-β). En función de la literatura8 (85% RC), se estimó que en el grupo con el protocolo nuevo se podría tener un aumento en la RC de al menos 10 puntos y para ello sería necesario incluir 140 ciclos por grupo. Debido a que se consideró que durante el seguimiento se iban a producir un 20% de pérdidas, el tamaño muestral final debía ser de al menos 175 ciclos/grupo.
Se hizo un análisis de los datos, calculando frecuencias y porcentajes para variables categóricas (porcentajes de los distintos niveles de poder emetógeno) y medias y desviaciones estándares para las variables continuas (edad del paciente). En caso de que las variables continuas no siguieran una distribución normal, se expresarían en términos de medianas y rango intercuartílico. La normalidad se midió con el test de Kolmogorov-Smirnov.
Para medir la asociación entre el tipo de protocolo de profilaxis antiemética (PA y PN) y las distintas características biométricas y clínicas (poder emetógeno de los esquemas de quimioterapia) se ha utilizado el test no paramétrico de Wilcoxon para muestras independientes cuando las variables eran continuas. En el caso de que las variables eran categóricas, se hizo uso del test de la ji cuadrado.
Para medir las diferencias en ambos tipos de respuesta (aguda y retardada) según el tipo de protocolo y el poder emetógeno se aplicó el test de la ji cuadrado. En cambio, para contrastar las diferencias en las respuestas en los datos biométricos, se usó el test no paramétrico de Wilcoxon para muestras independientes.
Del mismo modo, con el fin de hallar diferencias entre la RC versus el resto de categorías (RPmayor, RPmenor, NR) de los 2 tipos de respuesta (aguda y retardada) en las variables recogidas, se utilizó el test de la ji cuadrado (poder emetógeno y tipo de protocolo) y la prueba de Wilcoxon para muestras independientes (edad y superficie corporal). Finalmente, se desarrolló un modelo de regresión logística para la determinación de factores de RC tanto en aguda como retardada. Se ha calculado el área bajo la curva para valorar el poder discriminativo de los modelos obtenidos.
Todos los procedimientos estadísticos se han realizado con el programa SAS System Institute Inc. v9.1. En todos los casos, los resultados se consideraron estadísticamente significativos cuando p<0,05, siendo todos los contrastes bilaterales.
ResultadosSe incluyeron en el estudio 180 ciclos que recibieron el PA y 342 ciclos que recibieron el PN. Hubo diferencias significativas (p<0,001) en el número de encuestas cumplimentadas de forma adecuada para el análisis, 102 ciclos de QT (52 pacientes) con el PA (56,67%) y en 293 ciclos (98 pacientes) con el PN (85,67%).
Entre ambos grupos no hubo diferencias significativas en cuanto a características de las pacientes como edad y superficie corporal o respecto al poder emetógeno de los esquemas (tabla 1). El número de ciclos recibidos tanto en un grupo como en otro fueron semejantes, con el protocolo antiguo la media de ciclos=2,75 (±1,34) y con el protocolo nuevo, 2,72 (±1,44), p =0,70.
Características biométricas y poder emetógeno de los esquemas de quimioterapia
| PA (n=102) | PN (n=293) | Total (n=395) | p | |
| Edad (x¯ ± DE) Intervalo | 55,23±10,41 (37-79 años) | 57,14±10,47 (36-85 años) | 56,66±10,47 | 0,12 |
| SC (m2) | 1,70±0,17 | 1,72±0,18 | 1,71 ±0,18 | 0,33 |
| Poder emetógenoa | ||||
| Alto | 2 (1,96%) | 5 (1,71%) | 7 (1,77%) | 0,66 |
| Moderado | 65 (63,73%) | 201 (68,60%) | 266 (67,34%) | |
| Bajo | 35 (34,31%) | 87 (29,69% | 122 (30,89%) | |
PA: protocolo antiguo; PN: protocolo nuevo; SC: superficie corporal.
Con el PN se consiguió un mayor porcentaje de RC (no náuseas, no vómitos) durante la fase de emesis aguda (tabla 2) que con el PA (83,28 vs 73,53%), aunque las diferencias no fueron estadísticamente significativas (p=0,19). También se observó un mayor control con el PN en la emesis retardada, con diferencias significativas en la RC (67,38 vs 36,27%), p < 0,0001 (tabla 3).
Diferencias en respuesta aguda en función del tipo de protocolo, poder emetógeno de los esquemas de quimioterapia y datos biométricos
| RC (n=319) | RPmayor (n=46) | RPmenor (n=12) | NR (n=18) | Total (n=395) | p valor1 | p valor2 | |
| Tipo de protocolo | |||||||
| PA | 75 (73,53%) | 16 (15,69%) | 4 (3,92%) | 7 (6,86%) | 102 (25,82%) | 0,19 | 0,04 |
| PN | 244 (83,28%) | 30 10,24%) | 8 (2,73%) | 11 (3,75% | 293 (74,18%) | ||
| Poder emetógeno | |||||||
| Alto | 3 (0,94%) | 2 (4,35%) | 0 | 2 (11,11%) | 7 | 0,008 | 0,007 |
| Moderado | 210 (65,83%) | 32 (69,57%) | 11 (91,67%) | 13 (72,22% | 266 | ||
| Bajo | 106 (33,23%) | 12 (26,09%) | 1 (8,33%) | 3(16,67%) | 122 | ||
| Total | 319 (80,76%) | 46 (11,65%) | 12 (3,04%) | 18 (4,56%) | 395 | ||
| Edad (x¯ ± DE) | 57±10,37 | 52,76±10,29 | 52±6,94 | 51,88±10,78 | 56,66±10,47 | 0,001 | < 0,001 |
| SC (m2) | 1,71±0,18 | 1,66±0,16 | 1,72±0,15 | 1,71±0,13 | 1,71 ±0,18 | 0,37 | 0,20 |
NR: sin respuesta=«muchas náuseas» y/o «más 2 vómitos»; PA: protocolo antiguo; PN: protocolo nuevo; RC: respuesta completa=si «no náuseas» y/o «no vómitos». RPmayor: respuesta parcial mayor=«no vómitos»+«algunas náuseas» o «sin náuseas»+«1-2 vómitos». RPmenor: respuesta parcial menor=«algunas náuseas+1-2 vómitos». NRC=RPmayor+RPmenor+NR.
P valor1=valor obtenido para la comparación entre el tipo de respuesta aguda y los factores estudiados; p valor 2=p valor obtenido en la respuesta aguda RC vs NRC.
Diferencias en respuesta retardada en función del tipo de protocolo, poder emetógeno de esquemas de quimioterapia y datos biométricos
| RC (n=319) | RPmayor (n=46) | RPmenor (n=12) | NR (n=18) | Total (n=395) | p valor1 | p valor2 | |
| Tipo de protocolo | |||||||
| PA | 37 (36,27%) | 42 (41,18%) | 3 (2,94%) | 20 (19,61%) | 102 (25,82%) | < 0,0001 | < 0,001 |
| PN | 198 (67,58%) | 49 (16,72%) | 10 (3,41%) | 36 (12,29% | 293 (74,18%) | ||
| Poder emetógeno de esquemas | |||||||
| Alto | 0 (0%) | 4 (4,4%) | 0 | 3 (5,36%) | 7 (1,77%) | 0,008 | 0,001 |
| Moderado | 153 (65,11%) | 61 (67,03%) | 9 (69,23%) | 43 (76,79% | 266 (67,34%) | ||
| Bajo | 82 (34,89%) | 26 (28,57%) | 4 (30,77%) | 10(17,86%) | 122 (30,89%) | ||
| Total | 235 (59,49%) | 91 (23,04%) | 13 (3,29%) | 56 (14,18%) | 395 | ||
| Datos biométricos | |||||||
| Edad (x¯ ± DE) años | 56,82 ±10,46 | 57±11 | 54,15±9,62 | 55,96±9,95 | 56,66±10,47 | 0,83 | 0,78 |
| SC (m2) | 1,70±0,17 | 1,70±0,16 | 1,71±0,15 | 1,72±0,21 | 1,71 ±0,18 | 0,94 | 0,61 |
NR: sin respuesta=«muchas náuseas» y/o «más 2 vómitos»; PA: antiguo protocolo; PN: protocolo nuevo; RC: respuesta completa=si «no náuseas» y/o «no vómitos»; RPmayor: respuesta parcial mayor=«no vómitos»+»algunas náuseas» o «sin náuseas»+«1-2 vómitos»; RPmenor: respuesta parcial menor=«algunas náuseas+1-2 vómitos». NRC=RPmayor+RPmenor+NR.
p valor1=valor obtenido para la comparación entre el tipo de respuesta retardada y los factores estudiados; p valor2=p valor obtenido en la respuesta retardada RC vs NRC.
Comparando el grupo RC vs no RC, se vio que, en la fase aguda, la edad influía con diferencias significativas en el control de emesis (tabla 2), de manera que a menor edad, peor control de náuseas y vómitos. En la fase retardada no se encontraron diferencias (p=0,72) en la edad entre el grupo que alcanzó RC vs no RC (tabla 3).
Control antiemético y poder emetógeno de los esquemasSe observó que a mayor poder emetógeno de los esquemas el grado de respuesta disminuye (p=0,008), tanto en la emesis aguda como en la retardada (tablas 2 y 3).
Análisis multivariante (tabla 4). Control antiemético en fase aguda. Las pacientes tratadas con PN tienen 2 veces más de probabilidad de obtener una RC respecto a las tratadas con PA (OR=1,85; IC 95% = 1,05-3,24; p=0,03). En esquemas con poder emetógeno alto, la probabilidad de obtener una RC en el control de emesis aguda se reduce en un 91% (OR = 0,009, IC 95% = 0,02-0,43; p=0,003) respecto a los de poder emetógeno bajo. Por cada año que aumente la edad, aumenta un 6% la probabilidad de tener una RC (OR=1,06; IC 95%=1,03-1,09; p < 0,001).
Análisis multivariante (factores que influyen en alcanzar respuesta completa en la emesis aguda y emesis retardada)
| Respuesta aguda | Respuesta retardada | |||
| OR (IC 95%) | p valor | OR (IC 95%) | p valor | |
| Edad | 1,06 (1,03-1,09) | 0,001 | 0,99 (0,98-1,02) | 0,94 |
| Tipo de protocolo | ||||
| PA | Referencia | Referencia | ||
| PN | 1,85 (1,05-3,24) | 0,03 | 3,91 (2,4-6,34) | < 0,001 |
| Poder emetógeno | ||||
| Bajo | Referencia | Referencia | ||
| Moderado | 0,58 (0,31-1,08) | 0,08 | 0,60 (0,37-0,96) | 0,03 |
| Alto | 0,09 (0,02-0,43) | 0,003 | 0,04 (0-0,313) | 0,001 |
| Área bajo la curva (ABC) | 0,70 (0,63-0,76) | 0,65 (0,60-0,71) | ||
PA: Protocolo antiguo; PN: protocolo nuevo; OR (IC 95%): odds ratio junto con el intervalo de confianza del 95%.
Control antiemético en fase retardada. Con el PN es cuatro veces más probable obtener una RC que con el PA (OR = 3,91; IC 95% =2,4-6,34; p<0,001). El poder emetógeno de los esquemas y la edad no influyen en la probabilidad de tener una RC.
Efectos adversosLas pacientes describieron un total de 27 tipos de efectos adversos. No hubo diferencias significativas entre ambos protocolos en el promedio de efectos adversos que señalaban las pacientes con el PA 2,94 efectos adversos ± 1,83 (0-7) y con el PN 2,55 ± 1,95 (0-8).
Se encontraron diferencias significativas en 2 tipos de efectos adversos. Con el PA notificaron más trastornos gastrointestinales (distintos a NV), 76,47% con el PA frente a 63,48% con el PN (p=0,02); mientras que con el PN las pacientes describieron más trastornos musculares (7,85%) que con el PA (1,96%) (p=0,0343).
DiscusiónCon el PN se ha obtenido un 31% más de RC en emesis retardada que con el PA (67 vs 36%). Se ha recuperado el elevado porcentaje de RC en fase aguda que se tenía hace 15 años (83 vs 85%) y que había disminuido hasta un 73% al inicio de este estudio. Se ha podido comprobar la importancia que tiene actualizar continuamente las prácticas clínicas y tener una buena coordinación entre profesionales para evitar tener descensos tan grandes de respuesta como sucedió en nuestro caso. Cuando se implantó el PA existía un 58,6% de RC en emesis retardada disminuyendo hasta un 36% en el momento del inicio de este estudio10.
Es difícil comparar nuestros resultados con los de otros estudios, ya que el diseño, la tipología de pacientes, incluso los fármacos utilizados en la profilaxis, difieren mucho. Nuestro estudio ha demostrado que se puede conseguir un buen control de NV durante las primeras 24 h tras la quimioterapia con la profilaxis adecuada. Con el PN se ha conseguido un 83% de RC, nivel similar de protección que el alcanzado por Lajolo PP et al.15 que obtuvieron 85% en un estudio diseñado para evaluar la diferencia en el control de NV si se omitía dar el antagonista HT3 en el día 2 post-QT. Otros estudios realizados en pacientes con cáncer de mama también alcanzaron niveles de protección próximos al 80%, como Booth et al.16 que consiguieron un 77%, en un estudio observacional, o Warr et al.17 que obtuvieron un 76% de RC en un ensayo clínico, a doble ciego, aleatorizado donde querían evaluar la eficacia del uso de aprepitant en esquemas moderadamente emetógenos.
De nuestros resultados cabría destacar el buen control de NV obtenido durante la fase retardada, ya que en un 66% ciclos se consiguió una RC (no náuseas, no vómitos durante días 2-5 post-QT). Otros autores sin embargo, no llegaron a este nivel de protección los días posteriores a la QT, un 30% en el estudio Lajolo15 y un 55% en el grupo del aprepitant en el estudio de Warr et al.17.
Es importante tener en cuenta la diferencia en las encuestas recibidas debidamente cumplimentadas con ambos protocolos, un 56,67% en los ciclos con PA y un 85,67% con el PN. Se podría estar sobreestimando los resultados obtenidos con el PA, ya que cabría pensar que una mala tolerancia de la QT podía inducir a la falta de motivación a la hora de cumplimentar la encuesta. Pero esto es una hipótesis sin demostrar.
A pesar de haber utilizado las guías de práctica clínica como base de nuestro protocolo, no seguimos una de las recomendaciones de la MASCC, que era utilizar aprepitant como antiemético de primera línea en esquemas que incluyeran antraciclinas y ciclofosfamida. La razón fue que en ese momento se consideró prioritario comprobar el motivo de que el control de emesis no fuese el adecuado, quizás porque se estaba utilizando un tratamiento inadecuado por controlar la emesis retardada un antagonista 5-HT318,19 o por hacer la misma profilaxis independientemente del poder emetógeno de los esquemas9–13. Con los resultados obtenidos consideramos que a pesar de no utilizar aprepitant en primera línea, nuestras pacientes con tumores ginecológicos toleraban bien los esquemas moderadamente emetógenos un 65% de RC en fase retardada. Warr et al.17 utilizando aprepitant de primera línea, obtuvieron un 55% de RC. En el período de estudio se ha utilizado aprepitant en 7 pacientes (5%): en 2 como terapia desde el primer ciclo por antecedentes de hiperemesis gravídica y en 5 pacientes como terapia de rescate.
Una de las limitaciones de este estudio es que solo se ha evaluado cómo influyen 3 factores en la aparición de náuseas y vómitos, la edad que, en nuestra muestra de pacientes, influye en la fase aguda pero no en la fase retardada, el tipo de protocolo (PN, PA) y el poder emetógeno de los esquemas de QT. No procedía analizar la influencia del género, dado que todas eran mujeres (condición desfavorable para la emesis).
Existen otros muchos factores que pueden influir en el control de NV4–6. Se ha estimado que si el paciente presenta ansiedad tiene una probabilidad 3 veces mayor de sufrir náuseas en fase aguda (OR 2,22; IC 95% 1,23-8,42), o si previamente ya ha presentado náuseas post-QT, también su probabilidad de tenerlas puede aumentar 3 veces (OR 3,54, 1,13 -11,14). También la adherencia al tratamiento puede influir en el control de NV, y además se ha relacionado la edad ≤ 50 años como una condición desfavorable en la adherencia y por lo tanto en el control de NV7. El consumo de alcohol (factor protector) y las expectativas de los pacientes (cuanto mayores sean éstas mayor riesgo tendrán de sufrir NV5) son otros factores que se deben tener en cuenta a la hora de desarrollar estrategias de prevención, detectando este riesgo añadido se puede actuar sobre ello en la fase de educación. No obstante, a pesar de que son muchos los factores que influyen en el control de NV, en la práctica clínica, los oncólogos a hora de prescribir antieméticos tienen en cuenta la edad, el género de los pacientes, y si presentan o no ansiedad20.
Las náuseas son un malestar persistente que puede afectar a un elevado porcentaje de pacientes. Shin et al.7 lo evaluaron y vieron que en una muestra de 108 pacientes con QT moderada/altamente emetógena, en fase aguda, presentaron vómitos el 25% de los pacientes, sin embargo las náuseas estuvieron presentes en el 68,1% de los pacientes en las primeras 24 h. La mayor incidencia de náuseas y vómitos se observó el día 2, para ir disminuyendo a lo largo de los días, aunque en el quinto día, todavía un 59% de los pacientes presentaban náuseas. En nuestro estudio se consideró que las náuseas afectan por igual que los vómitos en la calidad de vida de las pacientes, se clasificó la respuesta con ambos síntomas, pero siempre dando mayor relevancia al que aparecía con mayor intensidad.
No fue posible un diseño del estudio para que las pacientes hubiesen sido su propio control, recibiendo ambos protocolos. Esto nos habría permitido aumentar la validez de los resultados.
Al haber utilizado para el análisis solo las encuestas recibidas en el hospital, puede que se estén sobreestimando los resultados, ya que la mala tolerancia de la QT puede inducir a la falta de motivación a la hora de cumplimentar la encuesta.
La forma en la que se ha implantado y difundido este protocolo ha podido favorecer el mayor número de RC obtenidas. Ha existido una gran coordinación, todo el personal implicado ha participado en su elaboración, todas las pautas antieméticas se han incorporado a los esquemas de QT en el programa de prescripción electrónica de tratamientos oncológicos (Oncofarm®) y se pueden consultar fácilmente dentro de la Intranet del hospital. En la actualidad, una vez que ya se ha establecido el protocolo, habrá que diseñar un nuevo estudio para comprobar a lo largo del tiempo si se mantienen estos buenos resultados.
Con la implantación de este PN ha quedado demostrado el valor añadido que el farmacéutico puede aportar en el cuidado del paciente oncológico. El farmacéutico coordinó el proyecto, dando soporte técnico a facultativos y personal de enfermería ante cualquier duda en el cambio en las pautas antieméticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Urko Aguirre Larracoechea, estadístico de la Unidad de Investigación del Hospital de Galdakao-Usansolo.
Este trabajo ha sido presentado como comunicación póster con el número 3, en el XII Simposio ISOPP (international Society of Oncology Pharmacy Practitioners) celebrado en Praga del 5 al 8 de mayo de 2010.