La necesidad de obtener nuevos tratamientos antimicrobianos que funcionen alternativamente o sinérgicamente con los antibióticos con el objetivo de solventar el problema derivado de la aparición y transmisión de resistencias antimicrobianas, ha aumentado el interés por la aplicación de terapias minoritarias como es la terapia con fagos. Para poder aplicar de manera segura y generalizada esta terapia, es necesario establecer los parámetros farmacocinéticos y farmacodinámicos para su uso en humanos. En esta revisión sistemática se analizan los criterios necesarios para poder establecer la PK/PD de esta terapia, así como la forma en que esta se está aplicando actualmente, a partir de la revisión de 66 casos clínicos que recogen diversas infecciones y vías de administración de los fagos.
The need for new antimicrobial treatments that work alternatively or synergistically with antibiotics to address the problem of the emergence and transmission of antimicrobial resistance has increased interest in the use of minority therapies such as phage therapy. For safe and widespread application of this therapy, it is necessary to establish the pharmacokinetic and pharmacodynamic parameters for its use in humans. This systematic review analyzes the criteria necessary to establish the PK/PD of this therapy, as well as its current application, based on a review of 66 clinical cases that catch diverse infections and phage administration routes.
Desde la introducción del primer antibiótico en la práctica clínica, la utilidad de estos compuestos antimicrobianos ha quedado ampliamente demostrada, pero en las últimas décadas el desarrollo de resistencias antimicrobianas y la aparición y dispersión de microorganismos multirresistentes ha hecho de la búsqueda de nuevos agentes antimicrobianos una necesidad.
La necesidad de desarrollar alternativas a los antibióticos ha despertado el interés en el uso de los bacteriófagos como agentes antimicrobianos. Los bacteriófagos son virus que infectan a las bacterias, fueron descubiertos por Frederik Twort en 1915 y usados como antimicrobianos por primera vez por Félix d'Hérelle en 1917, hasta la aparición de los antibióticos en la década de los años 30 del siglo XX. En comparación con los antibióticos, la terapia con fagos ofrece: mayor especificidad, de forma que la microbiota queda protegida; baja toxicidad, los fagos forman parte del microbioma, no infectan células eucariotas y son bien tolerados; autoamplificación, los fagos se replican en el sitio de la infección, aumentando su número de manera exponencial; y sinergia en el uso combinado con antibióticos, mejorando la actividad de ambos y reduciendo, en muchos casos, la resistencia1.
La Comisión Europea de Farmacopea ha elaborado una lista de prioridades del periodo 2023–2025, donde se incluye el desarrollo de productos medicinales para terapia con fagos o PTMP (Phage Therapy Medicinal Products). Los PTMP son preparados de fagos naturales o genéticamente modificados que se usan para tratar o prevenir infecciones bacterianas en animales o en humanos. Los PTMP pueden estar constituidos por un único fago o bien por una mezcla varios, lo que también se conoce como «cóctel de fagos», combinados con excipientes2.
La aplicación de la terapia con fagos debe estar sujeta a las mismas consideraciones que otro tipo de farmacoterapias, estando sujetos a estudios de farmacocinética (PK) y farmacodinámica (PD). Tanto los nuevos tratamientos como aquellos que se tienen que optimizar, requieren del conocimiento de los mecanismos implicados en la evolución de su concentración en el organismo humano (PK), así como de los efectos que sobre él puedan tener (PD)3. A la hora de administrar un agente antimicrobiano, como un bacteriófago, a un paciente, es necesario evaluar y conocer la dosis que hay que administrar, y para ello hay que situar el comportamiento farmacocinético en el contexto de sus características farmacodinámicas4.
Para establecer la PK en la terapia con fagos, hay que tener en cuenta cómo los fagos interaccionan en el organismo, y por ello se deben evaluar la absorción, distribución, metabolismo y eliminación (ADME) de los PTMP y, por otro lado, la titulación de los PTMP durante el período de tratamiento5.
El conocimiento de la PD implica la realización de estudios farmacodinámicos primarios y secundarios. Los estudios primarios, en el caso de la terapia con fagos, analizan la relación entre la concentración de estos y la eliminación de las bacterias, mientras que los estudios secundarios analizan los efectos adversos de esta terapia6. En el caso de los estudios primarios en terapia con fagos, se debe establecer la concentración de fagos necesaria para ser eficaces, siendo capaces de eliminar, o al menos reducir, el recuento bacteriano en infecciones, con el fin de reestablecer el estado de salud previo a la enfermedad o aliviar algunos síntomas de esta.
En este artículo revisamos cuáles son los principios de la PK y la PD en fagoterapia y sintetizamos la información disponible sobre las vías de administración y dosis de fagos en diferentes tipos de infecciones.
MétodosSe realizó una revisión sistemática sobre la situación actual de la PK y la PD de la terapia con fagos.
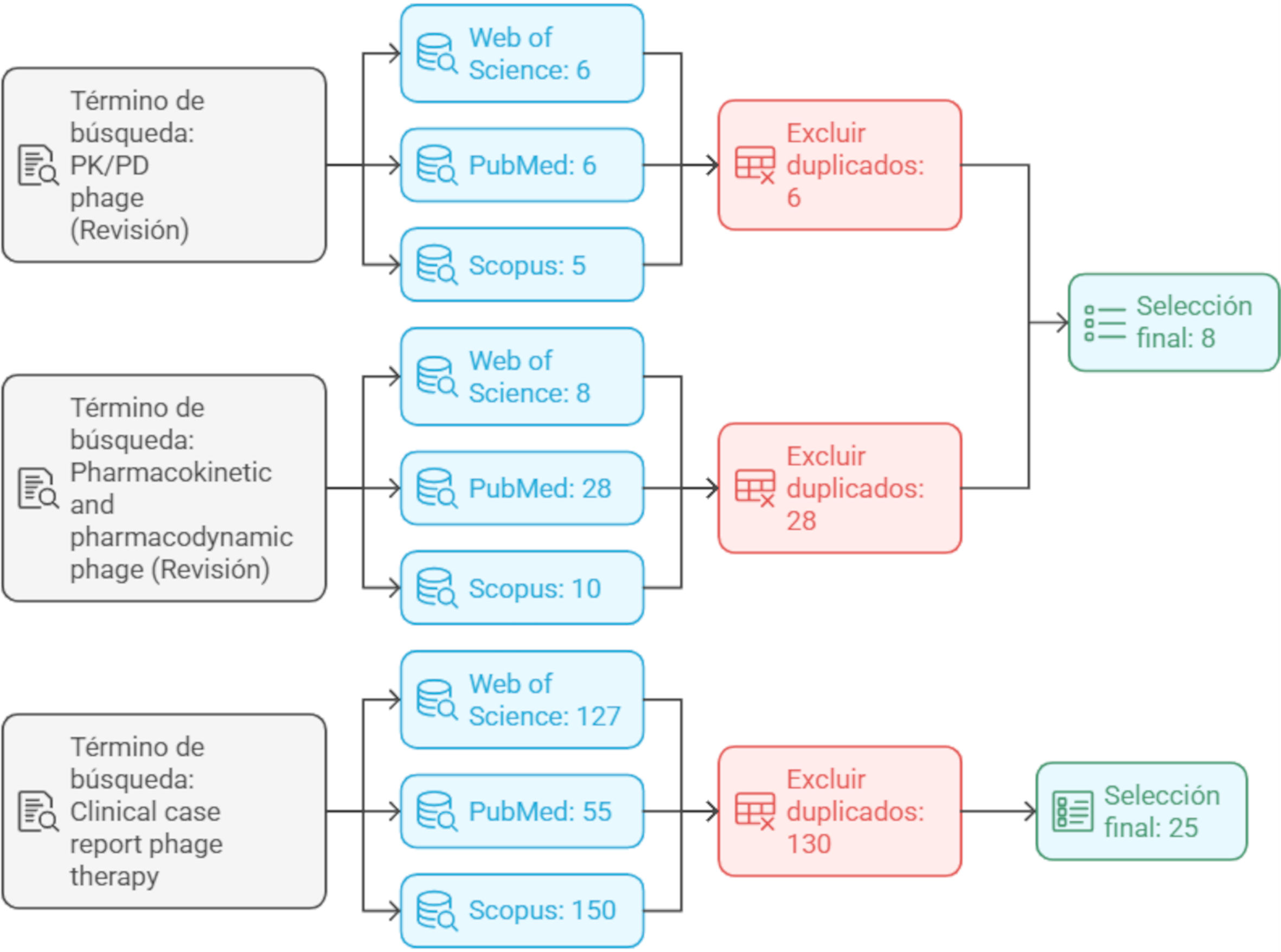
Criterios de inclusión y exclusiónEsta revisión se centró en la identificación de estudios relacionados con la PD y la PK de la terapia con fagos, y de casos clínicos con dicha terapia. La revisión se realizó a partir de artículos científicos publicados entre 2020 y 2025, en revistas recogidas en JCR (Journal Citation Reports) y SJR (Scimago Journal Rank), y en las bases de datos Web of Science7 y Scopus8, respectivamente. Como criterios de inclusión se tomaron aquellos artículos de revisión que contuviesen los términos «PK/PD» y «pharmacokinetic and pharmacodynamic». Otro término de búsqueda fue «clinical case report», y en este caso se seleccionaron los artículos dando prioridad a aquellos que revisaban múltiples casos clínicos. Los criterios de exclusión fueron: artículos anteriores a 2020 y artículos duplicados en las diferentes bases de datos utilizadas.
Estrategias de búsquedaSe realizó una revisión de la literatura en las bases de datos de PubMed (NCBI, Web of Science y Scopus) de artículos en inglés comprendidos entre 2020 y 2025 (fig. 1)7–9. La búsqueda en las bases de datos se basó en la relación de la terapia con fagos en los que se tratase la PK/PD de la misma; asimismo, se incluyeron en la búsqueda aquellos artículos basados en ensayos clínicos con fagos. Se excluyeron de la revisión aquellos artículos que estuviesen duplicados entre las bases de datos, y aquellos que no aportasen un conocimiento nuevo. En el caso de los ensayos clínicos, se eliminaron también aquellos estudios que no aportaban información sobre alguno de los criterios empleados para calcular el PK/PD. Los términos utilizados para dicha búsqueda fueron «PK/PD phage», «Pharmacokinetic/ Pharmacodynamic phage», y «Clinical case report phage». El término «PK/PD» dio como resultado 15 artículos en la Web of Science, 11 en Pubmed y 14 en Scopus; eliminando aquellos duplicados nos quedamos con 14 artículos científicos. En cuanto al término de «Pharmacokinetic and Pharmacodynamic phage», este último dio como resultado 23 resultados en la Web of Science, 103 en Pubmed y 27 en Scopus; tras la eliminación de los duplicados, seleccionamos 105 artículos. Finalmente, el término de «Clinical case report phage» mostró 127 artículos en la Web of Science, 55 artículos en Pubmed y 150 en el Scopus, tras la eliminación de los duplicados, seleccionamos 130 trabajos. Finalmente, para la elaboración de la revisión se emplearon 8 publicaciones científicas con los términos «PK/PD phage» y «Pharmacokinetic/Pharmacodynamic phage» y 25 publicaciones científicas con la búsqueda «Clinical case report phage».
ResultadosPrincipios farmacocinéticos en la terapia con fagosEl conocimiento del ADME y de la titulación de los PTMP a lo largo de la terapia es necesario para conocer las interacciones entre el cuerpo y los fagos. También es importante conocer previamente los parámetros fisicoquímicos que permiten la estabilidad durante el almacenamiento5,10.
Para poder determinar la farmacocinética de los fagos en el cuerpo, es importante saber cuál es el número inicial de fagos que se aplican en el tratamiento. Se emplea el método indirecto de recuento de placas de lisis en un cultivo de una cepa bacteriana huésped. Debe tenerse en cuenta que el número de placas no siempre representa el número total de partículas de fagos presentes en un sistema, ya que solo se tienen en cuenta aquellas con capacidad de lisar y propagarse de manera visible. La selección de la bacteria huésped es importante, ya que, dependiendo de la capacidad del fago para lisarla, se puede infravalorar el número de fagos o su actividad. Por ello, es necesario calcular la eficiencia de plaqueo en la cepa diana10.
A su vez, la estabilidad de los PTMP puede variar y debe ser controlada tanto durante su almacenamiento como durante su administración. Por este motivo, es necesario establecer y mantener los valores adecuados de pH, temperatura y fuerza iónica, en cada PTMP que se utilice en fagoterapia6,10.
Una vez conocida la concentración inicial de fagos que se administran, es importante elegir la vía de administración, ya que, en función de esta, el ADME va a ser diferente. Así, los fagos se pueden administrar por vía intravenosa (IV), intraperitoneal, intramuscular, subcutánea, oral, inhalada, intranasal, endotraqueal, intrauterina, rectal, vaginal y tópica11.
Finalmente, el metabolismo es responsable de la inactivación y eliminación de los PTMP. Los fagos se acumulan sobre todo en el hígado y en el bazo, y son estos órganos los responsables de su inactivación y de su eliminación. Las células de Kupffer del hígado son más eficaces que los macrófagos esplénicos a la hora de fagocitar los fagos. El bazo, sin embargo, tiene un papel en la inmunidad adaptativa al estimular la producción de anticuerpos para inactivar los fagos en lugar de la fagocitosis10,11. Una gran mayoría de medicamentos son excretados en la orina, sin embargo, la eliminación de los fagos a través de esta vía es baja, además de mostrar diferencias asociadas a la edad y a la enfermedad, la función renal y la variabilidad en la transcitosis del fago10,11.
Principios farmacodinámicos en terapia con fagosPara establecer la concentración de fagos que nos permita realizar estudios primarios, se debe calcular el valor de la multiplicidad de la infección (MOI)10, que se define como la ratio existente entre un agente infeccioso y su diana. En el caso de la terapia con fagos, es el número de fagos existente por célula bacteriana, aunque, en este caso, el número de fagos añadido no siempre representa el número de fagos que interactúa con las bacterias. Para salvar esta discrepancia, se propuso la siguiente fórmula:
Donde K es la tasa de adsorción constante y Ct es la concentración bacteriana.
Existen 2 modelos de fagoterapia: la pasiva y la activa, en función de la MOI aplicada para el tratamiento. En el caso de aplicar una terapia pasiva, la concentración de fagos administrados debe exceder en gran medida la carga bacteriana, de forma que la PD no dependa de la producción de progenie bacteriana. En el caso de la terapia activa, la carga bacteriana excede el umbral de proliferación (concentración bacteriana mínima para aumentar la concentración de fagos) y los fagos exceden el umbral de inundación (la concentración mínima de fagos para que descienda la carga bacteriana); de esta forma, se asegura que el producto de fagos administrado elimina la bacteria1.
En el caso de los estudios secundarios de la fagoterapia, es necesario establecer los niveles de toxicidad de los PTMP, que vienen dados por la presencia de endotoxinas derivadas del cultivo bacteriano empleado para propagar el fago. Por ello, todos los PTMP deben ser sometidos a procesos de purificación por cromatografía. Además de los estudios para evitar la toxicidad, es necesario establecer los efectos de los PTMP sobre la microbiota, así como la interacción con el sistema inmune y las células eucariotas11.
Estudios sobre la administración de terapia con fagos: vías de administración y dosisLa terapia de fagos hace referencia a la administración de fagos como tratamiento antimicrobiano para infecciones bacterianas. A pesar de que estos tienen actividad antimicrobiana por sí mismos, en muchos casos se usan en combinación con antibióticos, ya que se genera un efecto sinérgico denominado PAS (Phage-Antibiotic Synergy) y se reduce la aparición de resistencias tanto frente a los fagos como a los antibióticos.
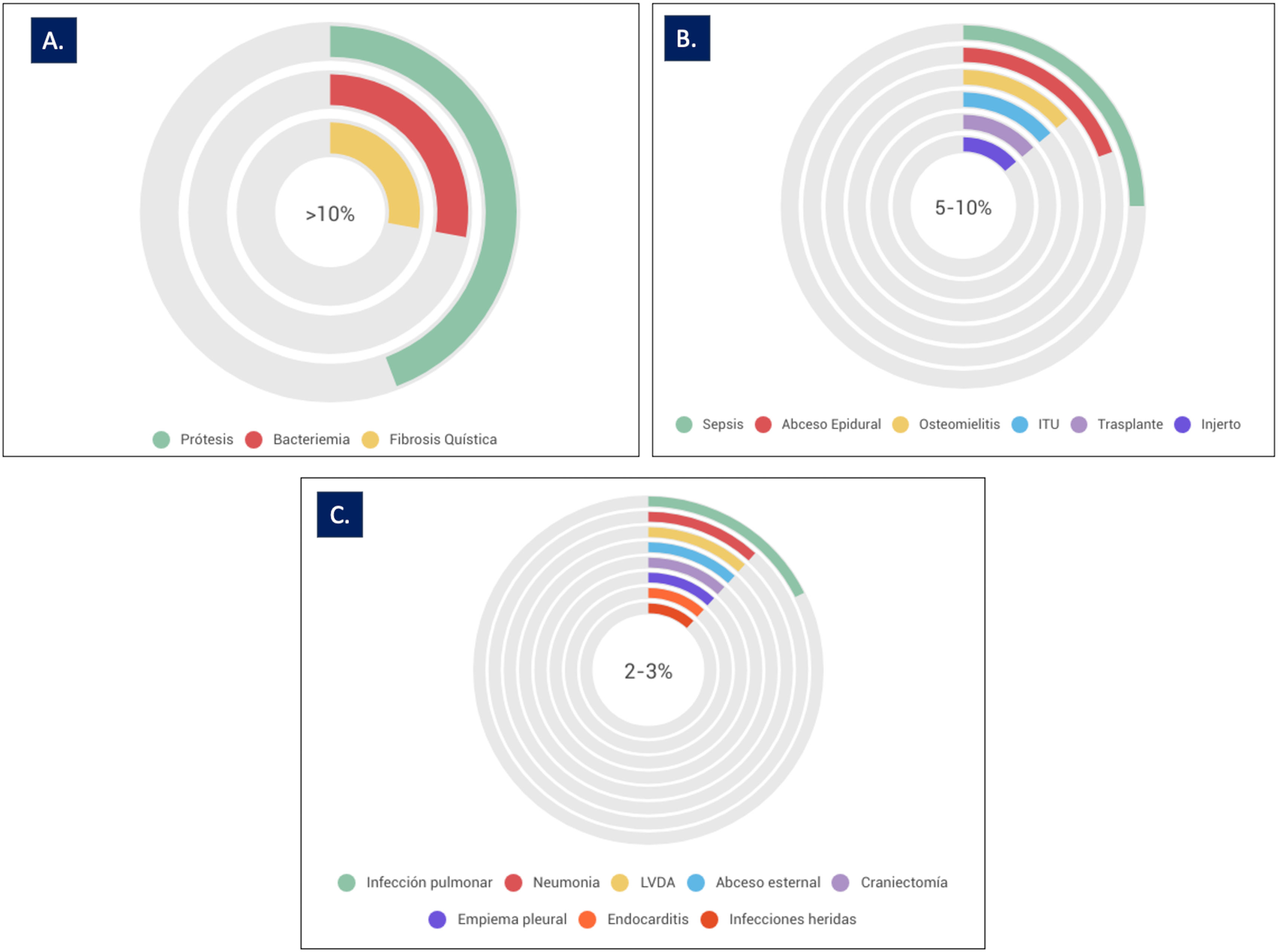
En esta revisión se han analizado 66 casos clínicos, recogidos en 25 publicaciones científicas, tratados mediante terapia con fagos combinada con terapia antibiótica (tabla 1S. Material Suplementario). En total, fueron analizados 25 tipos distintos de infecciones (fig. 2). El 69% de los estudios se centraron en casos de bacteriemia (14%) y de infecciones protésicas (14%) seguidas por el choque séptico (8%), infección en dispositivo de asistencia ventricular (LVAD) y el absceso epidural (7%), las neumonías, las osteomielitis, las infecciones de injertos y las infecciones del tracto urinario (ITU), representaron cada una un 5% del total de casos analizados. En el 31% de los estudios restantes se analizaron 16 tipos distintos de infecciones (fig. 2). En algunos casos, los estudios analizaron más de un tipo de infección en el mismo paciente12–18.
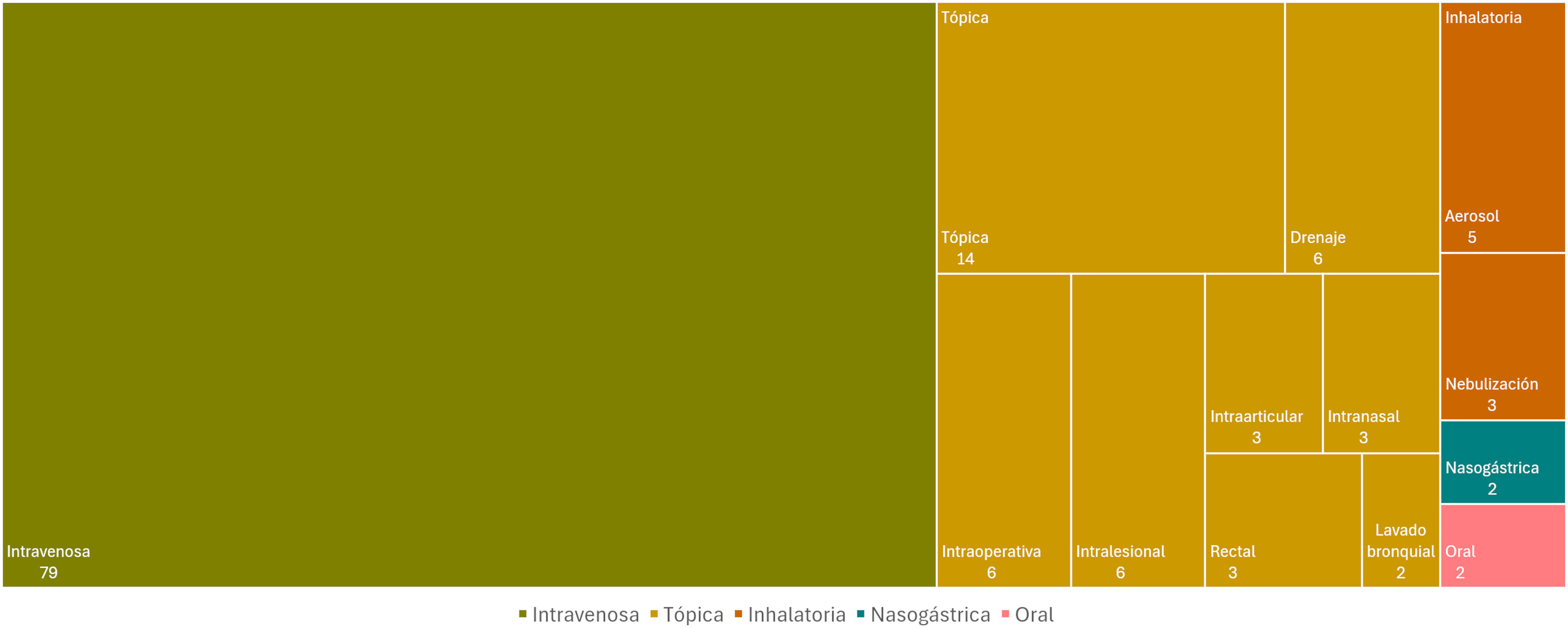
Los fagos se aplicaron a través de 9 vías de administración distintas: IV, tópica (drenaje, intraoperativa, intraarticular, intralesional, intranasal, rectal, lavado bronquial), inhalatoria (nebulización, aerosol), nasogástrica y oral. De todas ellas, la vía IV fue la más empleada (79%) seguida de la vía tópica (42%) (fig. 3).
En el caso de las bacteriemias, sepsis y osteomielitis, el tratamiento con fagos se aplicó de manera exclusiva por vía IV13,16. En otras situaciones, como en el tratamiento de la endocarditis, la vía IV se combinó con la administración por medio de drenaje, y en el caso de los abscesos se combinó con la administración local en el sitio de la infección13,16,19,20. En los estudios referentes a infecciones pulmonares, los tratamientos se aplicaron tanto por vía IV como nasogástrica, y mediante nebulización18,19,21,22. Para las ITU, los tratamientos con fagos fueron administrados por vía IV, vía vaginal y vía intrarrectal15,16,23. En los estudios en que se analizaron infecciones de la articulación protésica el tratamiento fue administrado por vía tópica local, aplicando los fagos intraarticularmente en el foco de la infección16,17,24. Finalmente, las infecciones de oídos fueron tratadas tanto por vía IV como por vía intraauricular17.
En estos estudios, las dosis de PTMP variaron en función del caso clínico, el tipo de infección y los PTMP aplicados. Las dosis analizadas oscilaron entre 106 y 1011 UFP/ml (unidades formadoras de placas/mililitro), aunque en la mayoría de los casos estudiados se aplicaron 109 UFP/ml12,13,15–19,21–29. Los tratamientos PTMP suelen prepararse en un tampón de NaCl al 0,9% y tener una posología de administración de 2 a 24 h, siendo la más común la de 6 h30,31.
DiscusiónLa Ley de garantías y uso racional de los medicamentos y productos sanitarios (29/2006, de 26 de julio) define principio activo como «aquella sustancia activa o mezcla de sustancias destinadas a la fabricación de un medicamento y que, al ser utilizadas en su producción, se convierten en un componente activo de dicho medicamento destinado a ejercer una acción farmacológica, inmunológica o metabólica con el fin de restaurar, corregir o modificar las funciones fisiológicas, o de establecer un diagnóstico», siendo una sustancia activa «toda sustancia o mezcla de sustancias destinadas a la fabricación de un medicamento y que, al ser utilizadas en su producción, se convierten en un componente activo de dicho medicamento destinado a ejercer una acción farmacológica, inmunológica o metabólica con el fin de restaurar, corregir o modificar las funciones fisiológicas, o de establecer un diagnóstico», y medicamento para uso humano como «toda sustancia o combinación de sustancias que se presente como poseedora de propiedades para el tratamiento o prevención de enfermedades en seres humanos, o que pueda usarse en seres humanos o administrarse a seres humanos con el fin de restaurar, corregir o modificar las funciones fisiológicas ejerciendo una acción farmacológica, inmunológica o metabólica, o de establecer un diagnóstico» (BOE-A-2015-8343)32.
Los fagos, al tratarse de entidades biológicas que se pueden usar para el tratamiento o prevención de infecciones, además de usarse en el diagnóstico de enfermedades, se ajustan a la definición de medicamento33, por lo que pueden enmarcarse dentro de la farmacología.
Al igual que para el resto de los medicamentos, para los PTMP es necesario establecer unos valores de PK/PD, de forma que estos se puedan aplicar de manera uniforme y segura a los pacientes. Una de las principales dificultades que surgen a la hora de establecer el PK/PD es el cálculo de la dosis de fagos que hay que aplicar, de forma que el mayor escollo con que se encuentra la terapia con fagos es el establecimiento de la PK, ya que un factor importante para su cálculo es la MOI, y para ello es necesario conocer la cantidad de fagos que se deben aplicar por bacteria, lo cual no es fácil de establecer debido a la variabilidad, tanto en el número de bacterias como de fagos, que varía en el sitio de la infección debido a su capacidad de proliferación. Hay que tener en cuenta, además, que cuanto mayor sea la MOI mayor es la velocidad a la que las bacterias desarrollan resistencia frente a los fagos, y por ello es importante encontrar el equilibrio entre bacteria y fagos. La diferencia con respecto a la administración de un antibiótico es que en este caso la exposición al fármaco es una variable independiente en la relación exposición y respuesta, mientras que, en el caso de la administración de fagos, la exposición no es una variable independiente, ya que existe una relación depredador-presa10.
Sin embargo, los estudios analizados en esta revisión demuestran que la administración de la terapia con fagos es eficaz en un 68% de los casos, con erradicación bacteriana (cultivos negativos), mientras que en el 77% de los casos hubo una mejoría clínica, dato similar al obtenido en un estudio en el que se revisaron 100 casos clínicos tratados con terapia de fagos34. Las dosis empleadas en los casos analizados en esta revisión también coincidieron con este estudio, ya que la dosis administrada con mayor frecuencia fue de 109 UFP/ml cada 12 horas. Las vías de administración de los PTMP en los casos analizados fueron múltiples, y en algunos se emplearon distintas vías de administración, fundamentalmente la vía IV en combinación con otras, y mayoritariamente cuando las infecciones afectaban a distintos órganos o tejidos. Además, en el 69% de los casos se combinó con antimicrobianos, mostrando una acción sinérgica, excepto en un caso clínico con rifampicina, que en combinación con fagos mostró una acción antagonista.
Aunque la vía oral es el modo de administración más cómodo para los medicamentos en humanos, la biodisponibilidad de los PTMP administrados por esta vía suele ser escasa. No obstante, la administración oral sigue siendo una estrategia prometedora para tratar infecciones bacterianas del tracto gastrointestinal, pero requiere de más estudios preclínicos en los que se analice la sensibilidad al pH de los PTMP, la adsorción al contenido intestinal, así como la inactivación de los fagos por el suero y sangre6,35. Del mismo modo, los PTMP administrados por vía nasal han demostrado una buena eficacia contra las infecciones respiratorias a pesar de su escasa biodisponibilidad. Los datos sobre la administración sistémica de PTMP tras la aplicación tópica sobre la piel intacta son pocos, y han demostrado tener una escasa penetración y biodisponibilidad de los PTMP. A pesar de eso, los PTMP aplicados tópicamente fueron eficaces contra las infecciones locales de heridas10. La administración IV ha demostrado una administración sistémica eficaz de los PTMP, ya que proporciona una buena penetración en los tejidos, especialmente en aquellos afectados por el proceso inflamatorio, ya que tienen aumentada la permeabilidad de las barreras endoteliales35; también se consiguió una absorción rápida por vía intraperitoneal, intramuscular y subcutánea10.
Los estudios dirigidos a analizar la distribución de los PTMP en los órganos han revelado que, tras la administración IV, los órganos en los que se encontró un mayor número de fagos fueron el hígado y el bazo, responsables de la filtración de cuerpos extraños de la sangre. También se puso de manifiesto que es importante tener en cuenta la microbiota, ya que pueden existir cepas bacterianas con receptores para los fagos empleados, de manera que actúen como quimioatrayentes afectando a la distribución de los fagos10,11.
A medida que las infecciones producidas por bacterias resistentes a múltiples antibióticos aumentan rápidamente, también lo hace la necesidad de desarrollar terapias alternativas como la fagoterapia. Cabe destacar que el ritmo de adquisición de conocimiento sobre la PK/PD de los fagos es inferior al de su creciente necesidad terapéutica. Los principales elementos farmacocinéticos y farmacodinámicos a considerar en los fagos son: las características farmacológicas de los fagos, la vía de administración, el lugar de la infección bacteriana, las concentraciones correlativas de fagos y bacterias en varios lugares y sitios (incluido aquel donde está la infección, si es posible), y la participación del sistema inmunitario del huésped. En general, la estandarización de los parámetros PK/PD de los fagos representa un paso inicial esencial hacia la introducción clínica exitosa de la terapia con fagos.
FinanciaciónEste estudio ha sido financiado con las ayudas PI19/00878 y PI22/00323, concedidas a M. Tomás dentro del Plan Estatal de I + D + i 2013–2016 (Plan Nacional de Investigación Científica, Desarrollo Tecnológico e Innovación 2008–2011) y cofinanciado por el ISCIII-Dirección General Adjunta de Evaluación y Promoción de la Investigación - Fondo Europeo de Desarrollo Regional «A Way of Making Europe» e Instituto de Salud Carlos III FEDER, CIBER de Enfermedades Infecciosas (CIBERINFEC) (CB21/13/00087 y CB21/13/00095), Instituto de Salud Carlos III FEDER y por una subvención del Instituto de Salud Carlos III (Proyecto MePRAM, PMP22/00092), Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación, financiado con fondos NextGeneration de la Unión Europea que apoyan las actuaciones del Fondo de Resiliencia y Recuperación.
Conflicto de interesesLos autores confirman la ausencia de conflictos de intereses. No se ha enviado este trabajo a ningún congreso ni revista para su publicación.
Declaración de contribución de autoría CRediTLucía Blasco: Data curation, Methodology, Writing – original draft. Inés Bleriot: Formal analysis, Methodology, Writing – original draft. Patricia Fernández-Grela: Investigation, Methodology, Visualization. José Ramón Paño-Pardo: Formal analysis, Visualization. Jesús Oteo-Iglesias: Formal analysis, Visualization, Writing – review & editing. María Tomás: Formal analysis, Funding acquisition, Supervision, Validation, Writing – review & editing.