desarrollar una herramienta de estratificación de riesgo para la atención farmacéutica de pacientes con enfermedad cardiovascular que requieran un abordaje farmacéutico integral y personalizado.
Métodoel modelo de estratificación de riesgo se desarrolló de forma colaborativa por farmacéuticos hospitalarios especializados en la atención de pacientes con riesgo cardiovascular, miembros de la Sociedad Española de Farmacia Hospitalaria. Mediante 3 talleres y un estudio piloto se definieron las variables relevantes, que se agruparon en 4 dimensiones y se les asignaron pesos relativos. En el estudio piloto se recogieron y analizaron los datos de los pacientes de los centros participantes para determinar los niveles de prioridad y evaluar la contribución de cada variable. Se siguió el modelo piramidal de Kaiser Permanente, clasificando a los pacientes en 3 niveles: prioridad 1 (atención farmacéutica intensiva, percentil 90), prioridad 2 (percentiles 60–90) y prioridad 3 (por debajo del percentil 60). Los puntos de corte se establecieron en función de esta estratificación y cada centro registró las variables en una hoja de Excel para calcular las puntuaciones medias de peso por nivel de prioridad y la puntuación total de riesgo.
Resultadoslos centros participantes completaron un cuestionario compuesto por 20 variables agrupadas en 4 dimensiones: demográfica; sociosanitaria y estado funcional; clínica y utilización de servicios sanitarios; y relacionada con el tratamiento. A partir de un estudio preprueba se definieron los siguientes puntos de corte: 23 o más puntos para la prioridad 1, de 17 a 22 puntos para la prioridad 2 y menos de 16 para la prioridad 3. Se observó que más del 80% de la puntuación total se fundamentó en las dimensiones de «utilización de servicios clínicos y sanitarios» y «relacionada con el tratamiento». En consecuencia, se recomendaron intervenciones basadas en el modelo de atención farmacéutica para los pacientes con riesgo cardiovascular, adaptadas a su nivel de priorización.
Conclusiónla herramienta permite identificar a los pacientes con enfermedad cardiovascular que requieren un mayor nivel de atención farmacéutica, facilitando el ajuste eficiente de la capacidad asistencial. Es necesaria su validación en una población representativa para establecer su efectividad y promover su adopción en la práctica clínica.
To develop a risk stratification tool for pharmaceutical care in patients with cardiovascular disease who require a comprehensive and personalized pharmaceutical approach.
MethodThe risk stratification model was collaboratively developed by hospital pharmacists specialized in managing cardiovascular risk patients, all members of the Spanish Society of Hospital Pharmacy. Through three workshops and a pilot study, relevant variables were identified, grouped into four dimensions, and assigned relative weights. In the pilot study, data from patients in the participating centers were collected and analyzed to determine priority levels and assess the contribution of each variable. The Kaiser Permanente pyramidal model was adopted, classifying patients into three priority levels: priority 1 (intensive pharmaceutical care, 90th percentile), priority 2 (60–90th percentiles), and priority 3 (below the 60th percentile). Cut-off points were established based on this stratification, and each center recorded variables in an Excel sheet to calculate mean weighted scores per priority level and total risk scores.
ResultsParticipants completed a questionnaire consisting of 20 variables grouped into four dimensions: demographic, socio-health and functional status, clinical and healthcare utilization, and treatment-related factors. Based on the tool application in a pretest study, the following cut-off points were established: 23 or more points for priority 1, 17–22 points for priority 2, and fewer than 16 points for priority 3. Over 80% of the total score was attributed to the dimensions of “clinical and healthcare utilization” and “treatment-related factors”. Consequently, interventions based on the pharmaceutical care model were recommended for cardiovascular risk patients, tailored to their prioritization level.
ConclusionThis stratification tool enables the identification of cardiovascular patients who require a higher level of pharmaceutical care, facilitating the adjustment of healthcare capacity. Validation of the model in a representative population is necessary to establish its broader applicability.
Las enfermedades cardiovasculares (ECV) son la principal causa de morbimortalidad a nivel mundial1. Según los últimos datos disponibles del estudio de la Carga Global de Enfermedades, el número de pacientes con ECV ha experimentado un aumento significativo en los últimos años, así como el número de muertes atribuidas a las ECV, que sigue en aumento2. Este incremento se atribuye a varias causas, entre las que se incluyen el envejecimiento de la población, el aumento de factores de riesgo como la hipertensión, la diabetes, el consumo de tabaco, la obesidad y el sedentarismo, así como la mejora en los métodos de diagnóstico, que permite identificar estas enfermedades en etapas más tempranas3–5. Las proyecciones demográficas sugieren que el número de casos nuevos y muertes por ECV seguirá aumentando en las próximas décadas, alcanzando cifras alarmantes si no se intensifican las estrategias de prevención y control6.
En España, en 2023, el 9,8% de la población padecía algún tipo de ECV, con una distribución de 52,6% en mujeres y 47,4% en hombres. Estas enfermedades se establecieron como la segunda causa de muerte en el país, representando el 26,5% del total de fallecimientos, detrás de los tumores (26,6%) y superando a las enfermedades respiratorias (10,8%)7.
Para enfrentar esta situación, se ha implementado la «Estrategia de Salud Cardiovascular del Sistema Nacional de Salud (ESCAV)», que responde a la necesidad de adoptar nuevas perspectivas en la atención de las ECV8. Esta estrategia no solo busca limitar el impacto de estas enfermedades, sino también prevenir su aparición a través de un enfoque integral, centrado en el paciente, que abarca todos los factores que influyen en la salud cardiovascular, incluyendo los determinantes sociales, la educación en salud, la capacitación del personal sanitario, la mejora en el diagnóstico precoz y la importancia de la prevención y la rehabilitación.
Asimismo, dentro de la «Estrategia para el Abordaje de la Cronicidad en el Sistema Nacional de Salud» se define una línea estratégica clave para reorientar la asistencia sanitaria9. Esta estrategia busca cambiar el enfoque del sistema, que pasa de estar centrado en la enfermedad a orientarse hacia las personas, teniendo en cuenta tanto las necesidades de la población en su conjunto como las de cada individuo en particular.
Para llevar a cabo esta reorientación, se recomienda el uso de modelos de estratificación y predicción como herramientas fundamentales para el manejo de la cronicidad. En este marco, se ha desarrollado el «Proyecto de Estratificación de la población en el SNS», que promueve este cambio de enfoque, garantizando una atención más personalizada y centrada en el paciente10. Al adoptar este enfoque de estratificación se logra identificar de manera precisa a los individuos con mayor riesgo dentro de la población, lo que facilita el diseño de intervenciones más efectivas para mejorar la gestión de las enfermedades crónicas, así como para implementar medidas preventivas y promover la salud.
Esta orientación se alinea con el Modelo Capacidad-Motivación-Oportunidad (CMO) de la Sociedad Española de Farmacia Hospitalaria (SEFH), impulsado desde su proyecto «Mapa Estratégico de Atención al Paciente Externo» (MAPEX), que busca mejorar la asistencia y los resultados en salud de los pacientes atendidos en consultas externas de farmacia hospitalaria (FH) y que se ha adaptado ya a diferentes perfiles de pacientes11,12. Así, en la segunda conferencia de consenso del proyecto, celebrada en 2023, se priorizaron 5 líneas estratégicas para el periodo 2024–2027, una de las cuales fue establecer e implementar nuevas adaptaciones de la metodología CMO-MAPEX a diferentes tipos de pacientes, incluyendo la recogida y análisis de datos que permitan parametrizarlos, explotarlos y valorarlos clínicamente para obtener información relacionada con la adherencia, la calidad de vida y los resultados en salud13.
Pese a que se han llevado a cabo diferentes herramientas de estratificación de la atención farmacéutica (AF) en patrones de pacientes atendidos por la FH, no existe hasta la presente ninguna centrada en ECV14–16.
El objetivo de este estudio es desarrollar una herramienta de estratificación para la AF a pacientes con ECV, así como establecer las intervenciones ajustadas a cada nivel de prioridad establecido.
MétodoEl estudio se desarrolló mediante un proceso metodológico que combinó el consenso de expertos, la revisión crítica de modelos previos y la validación empírica a través de un estudio piloto. El proyecto se inició en febrero y concluyó en diciembre de 2024, abarcando todas las fases necesarias para la definición y puesta en marcha del modelo.
En primer lugar, se estableció la fase de «organización y análisis del contexto». Para ello, se constituyó un grupo de trabajo integrado por 12 farmacéuticos hospitalarios especializados en la atención a pacientes cardiovasculares, en su mayoría miembros del Grupo de Cardio de la SEFH, con acreditación o experiencia y dedicación total o parcial a la AF avanzada en el área cardiovascular. Este equipo realizó una exhaustiva revisión de la literatura y de modelos previos, identificando las necesidades específicas de la población cardiovascular. En este contexto, se estableció la pertinencia de incluir variables cuantitativas y cualitativas que pudieran extraerse mayoritariamente de la historia clínica electrónica y complementarse mediante las propias entrevistas estructuradas con el paciente en la FH.
En la fase 2 se realizó la definición y diseño de la propia herramienta de estratificación. Para ello, durante talleres de trabajo online, el grupo de expertos definió, a partir de modelos previos de la SEFH y búsquedas bibliográficas específicas, las variables a incorporar en la herramienta, agrupándolas en 4 dimensiones: demográfica; sociosanitaria y funcional; clínica y de utilización de servicios; y relacionada con el tratamiento.
Para cada variable se acordó asignar una puntuación en una escala de 1 a 4, estableciendo que los valores más altos reflejaran una mayor importancia en la obtención de resultados en salud. La asignación de estos pesos se fundamentó en la valoración experta y en el respaldo bibliográfico existente para cada ítem, garantizando así que la relevancia clínica de cada variable estuviera debidamente ponderada.
A continuación, se desarrolló la fase de estudio preprueba y de definición de umbrales entre niveles de prioridad.
Para ello, se realizó un estudio piloto con pacientes con ECV, reclutados en 6 hospitales representativos. Este estudio tuvo como objetivo aplicar la herramienta en la práctica clínica asistencial para determinar los umbrales de clasificación en 3 niveles de riesgo: prioridad 1, 2 y 3, basándose en la distribución piramidal inspirada en el modelo de Kaiser Permanente. Los datos se recogieron de forma sistemática mediante una herramienta de Excel estandarizada, aprovechando la información disponible en la historia clínica electrónica de cada centro y complementándola con datos obtenidos de entrevistas estructuradas con los pacientes. Se calcularon las puntuaciones medias ponderadas del modelo total y de cada una de las dimensiones, y se realizó un análisis de exclusión secuencial para evaluar el impacto individual de cada variable en la clasificación de riesgo. Los hallazgos del estudio piloto permitieron definir con precisión los umbrales para los 3 niveles, lo que se ajustó a la realidad clínica del entorno cardiovascular.
En la última fase se realizó el ajuste final y la propia definición y consenso de actuaciones, así como la periodicidad de la estratificación y reestratificación para cada nivel de prioridad establecido.
ResultadosLa herramienta de estratificación de riesgo fue desarrollada, incluyéndose un total de 20 variables organizadas en 4 dimensiones: 4 demográficas, 2 sociosanitarias, 8 clínicas y 6 farmacoterapéuticas. Las variables incluidas y sus pesos específicos se observan en la tabla 1. Una característica clave de la herramienta fue que al menos 2 terceras partes de la información estuvieran disponibles previamente a la consulta presencial del paciente. Se eligió este diseño de cara a optimizar significativamente el proceso de preestratificación y la planificación de intervenciones en la dinámica habitual de trabajo y facilitar su implantación.
Variables demográficas para la medición del riesgo global del paciente con enfermedades cardiovasculares
| Variables demográficas | |
|---|---|
| Edad | |
| Inferior a 18 años | a |
| Entre 50 y 69 años | 2 |
| 70 años o más | 3 |
| Embarazo | |
| Paciente embarazada | Prioridad 1 |
| Peso/Estado nutricional | |
| Sobrepeso (IMC 25–30 kg/m2) | 1 |
| Obesidad (IMC > 30 kg/m2) | 2 |
| Obesidad grave (IMC >40 kg/m2) | 3 |
| Desnutrición (IMC <18,4 kg/m2) | 1 |
| Peso normal (IMC 18,5–24,9 kg/m2) | 0 |
| Sexo | |
Mujer con determinadas enfermedades cardiovasculares, entre las que se encuentran:
| 1 |
| Puntuación máxima de las variables demográficas | 7 |
| Variables clínicas | |
| Enfermedad cardiovascular de base | |
Pacientes que presentan una de las siguientes enfermedades CV de base, asociadas a mayor riesgo y que requieren mayor seguimiento:
| 1 |
| Comorbilidad cardiovascular | |
Paciente con presencia de, al menos, una de las siguientes enfermedades CV, además de la enfermedad CV que presente de base:
| 2 |
| Pacientes con combinación de insuficiencia cardíaca y cardiopatía isquémica | 3 |
| Pacientes con combinación de insuficiencia cardíaca y fibrilación auricular | 3 |
| Comorbilidad no cardiovascular | |
Paciente con presencia de, al menos, una de las siguientes enfermedades no CV:
| 1 |
| Dislipidemiab | |
Paciente cuyos niveles de LDL se encuentran por encima de sus objetivos:
| 2 |
| Gravedad de la afectación | |
| Paciente con fracción de eyección del ventrículo izquierdo <40% | 1 |
| Paciente con tromboembolismo venoso | 1 |
| Hipertensión arterial | |
| Paciente con PAS ≥140 mmHg/PAD ≥90 mmHgc o en tratamiento con antihipertensivos con indicación para HTA (si se desconocen estos valores) | 2 |
| Ingresos/urgencias en el último año por enfermedad | |
| Paciente que ha tenido 2 o más hospitalizaciones en los 12 meses previos y ha asistido a urgencias al menos 3 veces a lo largo del último año, siempre y cuando este uso de los servicios sanitarios esté relacionado con un mal control de la enfermedad/tratamiento | 2 |
| Paciente en el primer año tras un evento coronario | |
| Paciente con PAS ≥140 mmHg/PAD ≥90 mmHg o en tratamiento con antihipertensivos con indicación para HTA (si se desconocen estos valores) | 2 |
| Puntuación máxima de las variables clínicas | 20 |
| Variables farmacoterapéuticasd | |
| Cambios en el régimen regular de la medicación | |
| Cambios significativos en el régimen de medicación, a valorar por el profesional, desde la última visita de atención farmacéutica | 1 |
| Complejidad del régimen farmacológico | |
| El paciente toma, al menos, un medicamento con pautas complejas de administración (p. ej., dosificación, forma farmacéutica) | 1 |
| Medicamentos de alto riesgo | |
| Paciente que toma algún medicamento incluido en el listado del ISMP español de medicamentos de alto riesgo | 4 |
| Objetivos farmacoterapéuticos | |
Paciente con objetivos en relación con la farmacoterapia no alcanzados (incluye comorbilidades)
| 2 |
| Polimedicación | |
| Paciente que toma entre 7 y 10 principios activos de forma concurrente y de forma crónica | 1 |
| Paciente que toma más de10 principios activos de forma concurrente y de forma crónica | 2 |
| Sospecha o falta de adherenciae | |
| Paciente adherente | 0 |
| Paciente con riesgo de falta de adherencia y persistencia subóptima | 1 |
| Paciente con falta de adherencia | 2 |
| Puntuación máxima de las variables farmacoterapéuticas | 12 |
| Variables sociosanitarias | |
| Actividad física | |
| Pacientes con estilo de vida sedentario | 1 |
| Pacientes con actividad física intensa (p. ej., deportistas de élite)f | 1 |
| Tabaco | |
| Paciente exfumador en los últimos 5 años | 1 |
| Paciente fumador en activo | 2 |
| Puntuación máxima de las variables sociosanitarias | 3 |
CI: cardiopatía isquémica; CV: cardiovascular; EAC: Enfermedad arterial coronaria; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión; IMC: índice de masa corporal; ISMP: Instituto para el Uso Seguro de los Medicamentos; LDL: lipoproteína de baja densidad; VIH: virus de inmunodeficiencia humana, HF:hipercolesterolemia familiar, PAS, presión arterial sistólica; PAD, presión arterial diastólica.
Considerar la Lp(a) como información adicional sobre el riesgo CV (si se dispone de este biomarcador).
En el caso de que un paciente no cuente con objetivos farmacoterapéuticos específicos, se revisará de forma general el cumplimiento y el control y manejo de la enfermedad (por ejemplo, hipertensión = paciente con tensión controlada, diabetes = control del azúcar en sangre, etc.).
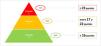
Durante el estudio piloto se incluyeron un total de 212 pacientes procedentes de 6 centros (tabla 2). Durante el mismo se permitió establecer los puntos de corte para la estratificación en 3 niveles de prioridad, siguiendo la distribución teórica del modelo de Kaiser Permanente (60–30–10). Los puntos de corte definidos fueron los siguientes: prioridad 1, pacientes con una puntuación igual o superior a 23 puntos, representando el 10,4% de la muestra; prioridad 2, puntuaciones entre 17 y 22 puntos, que abarcaron el 29,2% de los casos; y prioridad 3: con menos de 17 puntos, que constituyeron el 60,4% de la muestra.
Puntuaciones basales de los pacientes incluidos en el estudio preprueba
| G % | P1 % | P2 % | P3 % | ||
|---|---|---|---|---|---|
| Puntuación positiva/variable | Sí | Sí | Sí | Sí | |
| Variables demográficas | Edad del paciente con la enfermedad cardiovascular | 86 | 95 | 92 | 81 |
| Paciente embarazada | 0 | 0 | 0 | 0 | |
| Paciente afroamericano o paciente del sur de Asia | 0 | 0 | 2 | 0 | |
| Índice de Masa Corporal (IMC) del paciente | 56 | 68 | 63 | 50 | |
| Sexo: mujer con determinadas enfermedades cardiovasculares (FA/HP/CI) | 23 | 50 | 29 | 16 | |
| Variables clínicas | Enfermedad CV de base: FA/HP/IC/prevención secundaria/SCA/trasplante | 82 | 91 | 97 | 73 |
| Paciente que presenta, al menos, una de las enfermedades CV, además de la enfermedad de base: amiloidosis/CI/EAC/infarto de miocardio/cardiopatía valvular/EAP/FA/HP/ictus/IC | 47 | 68 | 68 | 34 | |
| Paciente con combinación de insuficiencia cardíaca y cardiopatía isquémica | 10 | 41 | 15 | 3 | |
| Paciente con combinación de insuficiencia cardíaca y fibrilación auricular | 19 | 50 | 35 | 5 | |
| Presencia de, al menos, una de las enfermedades no CV: anemia/apnea/inflamatorias/EPOC/VIH | 29 | 55 | 39 | 20 | |
| Paciente cuyos niveles de LDL se encuentran por encima de sus objetivos | 49 | 73 | 45 | 46 | |
| Paciente con fracción de eyección del ventrículo izquierdo <40 | 5 | 23 | 10 | 0 | |
| Paciente con tromboembolismo venoso | 4 | 5 | 10 | 1 | |
| Paciente con PAS ≥140 mmHg/PAD ≥90 mmHg y tratamiento antihipertensivo | 58 | 91 | 74 | 45 | |
| Paciente que ha tenido 2 o más hospitalizaciones en los 12 meses previos o ha asistido a urgencias al menos 3 veces a lo largo del último año | 15 | 32 | 23 | 9 | |
| Paciente con evento agudo o cuyo último evento se produjo en los últimos 12 meses | 16 | 55 | 19 | 7 | |
| Variables farmacoterapéuticas | Cambios significativos en el régimen de la medicación | 28 | 59 | 42 | 16 |
| Paciente que toma, al menos, un medicamento con pautas complejas de administración | 34 | 68 | 40 | 26 | |
| Paciente que toma algún medicamento incluido en el listado del ISMP español | 49 | 91 | 76 | 29 | |
| Paciente con objetivos en relación a la farmacoterapia no alcanzados | 45 | 95 | 71 | 38 | |
| Número de principios activos que el paciente toma de forma concurrente y crónica | 72 | 91 | 90 | 70 | |
| Paciente con sospecha o falta de adherencia | 29 | 41 | 42 | 21 | |
| Variables sociosanitarias | Paciente con estilo de vida sedentario o actividad física intensa | 49 | 82 | 58 | 40 |
| Paciente fumador o exfumador | 25 | 36 | 24 | 24 |
CI: cardiopatía isquémica; CV: cardiovascular; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; HP: hipertensión pulmonar; LDL: lipoproteína de baja densidad; ISMP: Instituto para el Uso Seguro de los Medicamentos; G: Global; P1: Prioridad 1; P2: Prioridad 2; P3: Prioridad 3; SCA: síndrome coronario agudo; VIH: virus de la inmunodeficiencia humana, IMC: índice de masa corporal; EAC: enfermedad arterial coronaria; PAS: presión arterial sistólica; PAD: presión arterial diastólica; EAP: enfermedad arterial periférica.
La distribución obtenida mostró una alineación adecuada con el modelo piramidal esperado, permitiendo priorizar los recursos hacia los pacientes con mayor riesgo y garantizando una atención eficiente para los restantes (fig. 1).
Por último, se establecieron también las intervenciones específicas para la AF en función del nivel de estratificación (tablas 3–5).
Definición de las actuaciones de atención farmacéutica en pacientes de nivel de prioridad 3
| Seguimiento farmacoterapéutico |
|
| Educación, formación y seguimiento del paciente |
|
| Coordinación con el equipo asistencial |
|
Definición de las actuaciones de atención farmacéutica en pacientes de prioridad 2
| Seguimiento farmacoterapéutico |
|
| Educación, formación y seguimiento del paciente |
|
| Coordinación con el equipo asistencial |
|
Definición de las actuaciones de atención farmacéutica en pacientes de prioridad 1
| Seguimiento farmacoterapéutico |
|
| Educación, formación y seguimiento del paciente |
|
| Coordinación con el equipo asistencial |
|
Prioridad 1: los pacientes de este nivel requirieron seguimiento intensivo, incluyendo visitas presenciales cada 3–6 meses, revisión exhaustiva de los objetivos farmacoterapéuticos y coordinación estrecha con el equipo multidisciplinar.
Prioridad 2: las intervenciones se enfocaron en un seguimiento intermedio, con revisiones anuales y acciones orientadas a consolidar la adherencia terapéutica y ajustar tratamientos según las necesidades clínicas.
Prioridad 3: los pacientes de menor riesgo recibieron un seguimiento estándar, centrado en la educación sanitaria, la prevención y la monitorización general de su situación clínica.
Finalmente, las actuaciones definidas se dividieron en: intervenciones de seguimiento farmacoterapéutico; educación, formación y seguimiento del paciente; y, por último, de coordinación con el equipo asistencial. Se acordó, igualmente, que estas intervenciones fueran acumulativas. De este modo, los pacientes de «prioridad 1» también recibieron las intervenciones planificadas para los niveles 2 y 3, mientras que, los de prioridad 2 también incluyeron las de prioridad 3. Este enfoque aseguró una atención integral y adaptada a las necesidades de cada paciente.
DiscusiónEl presente estudio introduce una herramienta de estratificación para la AF, diseñada para identificar de manera temprana y precisa a los pacientes con un mayor riesgo de desarrollar peores resultados y más necesidades asistenciales en el entorno de las ECV, desde la perspectiva de la FH. De esta manera, permite personalizar el seguimiento farmacoterapéutico, lo que posibilita individualizar las intervenciones y establecer intervalos de reevaluación adaptados al perfil de riesgo individual. Al recopilar un elevado número de datos integrados en la historia clínica electrónica, con información obtenida de entrevistas estructuradas, el modelo permite una evaluación multidimensional que abarca variables demográficas, sociosanitarias, clínicas y farmacoterapéuticas.
Esta aproximación integral no solo optimiza la asignación de recursos, al focalizar las intervenciones en aquellos pacientes que realmente lo requieren, sino que también sienta las bases para el diseño de intervenciones educativas que empoderen al paciente y mejoren el control de factores clave como la hipertensión, los niveles de colesterol y el tabaquismo. En este sentido, la herramienta se alinea con el cambio de paradigma propuesto en estrategias nacionales7,9 que buscan reorientar la asistencia sanitaria desde un modelo centrado en la enfermedad hacia uno centrado en la persona.
La herramienta desarrollada se distingue de otros enfoques tradicionales y tecnológicos que han intentado abordar la complejidad del riesgo cardiovascular. Por ejemplo, herramientas como el Índice de Complejidad del Tratamiento Farmacológico (MRCI)17 o el índice LACE18 se centran en aspectos unidimensionales, ya sea la complejidad del régimen terapéutico o la predicción de reingresos hospitalarios, sin integrar de forma sistemática variables clínicas, sociodemográficas y de comportamiento que resultan cruciales en la práctica clínica de pacientes con ECV.
Esta diferencia es especialmente relevante a la luz de los planteamientos de las sociedades científicas como la Sociedad Europea de Cardiología (ESC) que, en sus guías sobre la prevención de la enfermedad cardiovascular, enfatiza la importancia de una estratificación del riesgo que permita adaptar las intervenciones preventivas y terapéuticas a las características individuales de cada paciente19–21. De forma similar, el consenso del American College of Cardiology (ACC) y la American Heart Association (AHA), en sus directrices para la prevención primaria22, destacan la necesidad de evaluar de forma integral el riesgo cardiovascular para guiar estrategias personalizadas que aborden tanto factores clínicos como comportamentales. Estos organismos coinciden en que la personalización de la intervención es fundamental para reducir la incidencia de eventos adversos, lo que respalda la implementación de modelos como el propuesto en este estudio.
Adicionalmente, a nivel nacional, la SEFH ha impulsado iniciativas dentro del proyecto MAPEX, con planteamientos similares al propuesto, que han demostrado mejorar los resultados en salud de los pacientes, frente al enfoque más tradicional23–25.
Una de las principales ventajas de este modelo radica, entre otros aspectos, en la capacidad de la herramienta para equilibrar la sofisticación técnica con la operatividad clínica. En contraposición, los modelos emergentes basados en inteligencia artificial y machine learning alcanzan altos niveles de precisión, pero suelen requerir infraestructuras complejas y grandes volúmenes de datos, lo que limita su aplicabilidad en entornos con recursos restringidos. En contraste, el enfoque aquí presentado se apoya en información ya integrada en los sistemas clínicos, lo que permite su implementación inmediata y escalable sin sacrificar la precisión en la predicción del riesgo. Este balance entre complejidad y viabilidad operativa es una de las principales fortalezas del modelo y se posiciona como una alternativa consistente para transformar la práctica clínica en la prevención y manejo de las ECV26–28.
La integración de intervenciones educativas y la promoción de la colaboración interdisciplinaria son otros puntos de distinción. Mientras que algunos modelos se centran únicamente en la predicción numérica del riesgo, la herramienta de estratificación propuesta impulsa la coordinación entre farmacéuticos, médicos y otros profesionales de la salud, fomentando un intercambio de información que enriquece la toma de decisiones clínicas. Este enfoque colaborativo es consistentemente recomendado por organismos internacionales, los cuales destacan que una estrategia de atención integral y multidisciplinaria es esencial para abordar la heterogeneidad de los pacientes y mejorar los resultados en salud.
La estratificación es solo un pilar de la metodología CMO propuesta y contrastada en otras enfermedades; por tanto, es necesario complementar esta actividad con la del alineamiento de objetivos farmacoterapéuticos a corto y medio-largo plazo, y el seguimiento longitudinal de los pacientes, dando respuestas en tiempo real o en tiempo útil a las necesidades de los mismos. Este paradigma, al combinar precisión, operatividad y facilidad de implementación, se perfila como una herramienta de gran potencial para orientar futuras estrategias de AF y prevención cardiovascular, adaptándose a las exigencias de un sistema de salud cada vez más orientado hacia la personalización del cuidado.
Entre las limitaciones del estudio destaca la dependencia de datos cualitativos obtenidos a través de entrevistas estructuradas, lo que podría introducir sesgos en la evaluación de la adherencia y otros comportamientos del paciente. Asimismo, el tamaño de la muestra del estudio piloto limita la generalización de los resultados a poblaciones más heterogéneas. Sin embargo, la estandarización de los instrumentos de recolección y el uso de datos preexistentes de la historia clínica han contribuido a reducir estas limitaciones y favorecer la reproducibilidad de la herramienta.
Aunque el diseño del modelo permite que aproximadamente 2/3 partes de los datos requeridos ya estén registrados en la historia clínica electrónica, lo que, en nuestra experiencia, facilita la cumplimentación, el intervalo de tiempo invertido no se midió de forma sistemática. Investigaciones futuras deberían centrarse en desarrollar procesos automatizados que disminuyan la carga asistencial.
Por otro lado, la principal fortaleza del modelo reside en su enfoque multidimensional y en la capacidad para integrar variables objetivas y subjetivas, lo que permite una evaluación integral del riesgo cardiovascular. La posibilidad de preestratificar a los pacientes utilizando información ya disponible en los sistemas clínicos optimiza la asignación de recursos, permitiendo que aquellos con mayor necesidad reciban intervenciones intensivas y personalizadas. Además, la facilidad de integración del modelo en la práctica clínica –sin requerir infraestructuras tecnológicas excesivamente complejas– respalda su viabilidad operativa en entornos con diferentes niveles de recursos, lo cual es fundamental en la actualidad.
Para consolidar la validez y ampliar la aplicabilidad del modelo, es necesaria la realización de estudios prospectivos multicéntricos que incorporen una mayor diversidad poblacional y de centros asistenciales. En este marco, la integración de herramientas tecnológicas podría ayudar también a optimizar la ponderación de las variables, permitiendo identificar patrones de riesgo no captados mediante métodos tradicionales. Asimismo, el desarrollo de protocolos de seguimiento automatizados que posibiliten la reestratificación en tiempo real podría ajustar de manera dinámica las intervenciones según la evolución clínica del paciente.
Además de su viabilidad operativa en la atención especializada, el modelo presenta un alto potencial de escalabilidad a otros ámbitos asistenciales, en particular a la atención primaria, donde la detección precoz y la gestión longitudinal del riesgo cardiovascular resultan cruciales.
Otra línea de investigación prometedora podría ser la extensión del modelo a otros entornos asistenciales fuera del ámbito de la atención especializada, lo cual permitiría implementar estrategias integrales de AF interniveles y en diversos contextos terapéuticos. Finalmente, se hace necesario evaluar de forma sistemática el impacto de las intervenciones educativas y colaborativas en la adherencia y en los resultados clínicos, cuantificando la reducción de eventos adversos y el ahorro en recursos asistenciales, lo que reforzaría el valor añadido de la metodología de estratificación adoptada.
En conclusión, la herramienta de estratificación propuesta constituye una innovación significativa en la AF, al posibilitar un seguimiento personalizado y una asignación óptima de recursos. Su implantación coordinada entre los servicios de farmacia hospitalarios generaría un conjunto homogéneo de indicadores comparables que, integrados en los cuadros de mando institucionales, aportarían un valor estratégico añadido: detectar brechas asistenciales, orientar la distribución de recursos y diseñar programas formativos comunes basados en necesidades reales. El enfoque multidimensional del modelo, respaldado por los planteamientos de sociedades científicas, favorece la puesta en marcha de intervenciones educativas y colaborativas entre profesionales. Aplicada en el entorno de la metodología CMO y, tras una futura validación multicéntrica y automatización, esta herramienta podría contribuir a transformar la práctica clínica hacia una AF más multidimensional, precisa y eficiente, plenamente alineada con las estrategias nacionales de salud.
Aportación a la literatura científicaEsta investigación aporta una herramienta de estratificación de riesgo innovadora en el ámbito de la AF para pacientes con riesgo cardiovascular. La herramienta, compuesta por 20 variables agrupadas en 4 dimensiones (demográfica, sociosanitaria y funcional, clínica y de utilización de servicios, y relacionada con el tratamiento) permite clasificar a los pacientes en 3 niveles de prioridad. Esta clasificación facilita la adopción de intervenciones diferenciadas según la intensidad de las necesidades, optimizando así la asignación de recursos asistenciales.
Los resultados del estudio piloto evidenciaron que las dimensiones clínicas y de utilización de servicios aportaron más del 80% de la puntuación total, lo que respalda la focalización de las intervenciones en estos ámbitos críticos. En función de los puntos de corte definidos, se establecieron estrategias específicas: los pacientes clasificados en prioridad 1 reciben una AF intensiva, que incluye un seguimiento más frecuente, revisiones detalladas del régimen terapéutico y una estrecha coordinación multidisciplinaria; mientras que aquellos en prioridades 2 y 3 son gestionados con intervenciones de menor intensidad, adaptadas a la complejidad de su situación clínica y al uso optimizado de los recursos disponibles.
Esta aportación a la literatura destaca la relevancia de contar con una herramienta de estratificación que permita identificar de manera objetiva el nivel de riesgo de cada paciente y ajustar las intervenciones de manera personalizada. Además, los datos generados ofrecen un marco de referencia útil para la planificación estratégica y la implementación de políticas asistenciales orientadas a mejorar la eficiencia y la calidad de la AF en el contexto cardiovascular.
FinanciaciónLos autores declaran que el estudio no ha necesitado ningún tipo de financiación externa. Se ha realizado con fondos propios de la Sociedad Española de Farmacia Hospitalaria.
Declaración de autoríaTodos los autores contribuyeron al desarrollo de la idea original y al diseño del estudio. Ramón Morillo-Verdugo, se encargó de la redacción del manuscrito siendo revisado por todos los autores, aprobando la versión final para su publicación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosA todos los participantes en esta iniciativa y a la consultora Silo S.A, especialmente a Leticia Sánchez Martin y Daniel Lucas Fernández, por su apoyo metodológico al desarrollo de esta iniciativa.
Declaración de contribución de autoría CRediTAnna de Dios Lopez: Validation, Supervision, Methodology, Formal analysis. Esther Vicente Escrig: Validation, Supervision, Methodology. Paloma Sempere Serrano: Validation, Supervision, Methodology. Ramón Morillo-Verdugo: Writing – review & editing, Writing – original draft, Validation, Supervision, Methodology. Cristina Díez Vallejo: Validation, Supervision, Conceptualization. Sara Guijarro Herrera: Validation, Supervision, Conceptualization. Sara Ibáñez García: Validation, Supervision, Conceptualization. Aránzazu Linares Alarcón: Validation, Supervision, Conceptualization. José Antonio Martín Conde: Validation, Supervision, Conceptualization. María José Mauriz Montero: Validation, Supervision, Conceptualization. Nuria Martínez Casanova: Validation, Supervision, Conceptualization. Rebeca Pelegrín Cruz: Validation, Supervision, Conceptualization.
1 Miembros en representación de MAPEX-SEFH.
Cristina Díez Vallejo, Sara Guijarro Herrera, Aránzazu Linares Alarcón y Rebeca Pelegrín Cruz.
2 Grupo Cardio de la Sociedad Española de Farmacia Hospitalaria.
Sara Ibáñez García, José Antonio Martín Conde, María José Mauriz Montero y Nuria Martínez Casanova.