La combinación de platinos y etopósido es el tratamiento de primera línea del cáncer microcítico de pulmón. Aproximadamente, entre el 1 y el 3% de los pacientes que reciben etopósido por vía intravenosa desarrollan alguna reacción de hipersensibilidad (RH) a los pocos minutos de iniciar la infusión del fármaco1.
El mecanismo preciso que desencadena la RH tras la administración de etopósido no está dilucidado, pudiendo estar relacionado con el propio principio activo o con el polisorbato 802, excipiente utilizado como disolvente. El polisorbato 80, por sí mismo, ha demostrado producir hipotensión, taquicardia y liberación de histamina3.
Las RH a etopósido intravenoso, generalmente, remiten al interrumpir la infusión intravenosa y con la administración de glucocorticoides y anti- histamínicos4. Ante la necesidad de continuación del tratamiento, se han descrito varias estrategias que permiten su administración:
- 1.
Disminuir la velocidad de infusión y/o concentración de la preparación junto con la administración de premedicación con corticoides y antihis- tamínicos.
- 2.
Sustitución del etopósido por fosfato de etopósido, profármaco hidro- soluble del mismo, que no contiene polisorbato como excipiente en su formulación. Sin embargo, no está comercializado en España.
- 3.
Aplicación de un protocolo de desensibilización a etopósido basándose en la reintroducción gradual de pequeñas cantidades del medicamento causante de la RH, administrándolo en periodos de tiempo prolongados (4-12 horas), hasta alcanzar la dosis terapéutica. De estos protocolos, destaca la desensibilización rápida en 12 pasos de Castells5. Se trata de un esquema con tres soluciones del fármaco, las cuales se administran en 12 pasos en las que se va aumentado de forma progresiva la velocidad de infusión y la concentración del fármaco, administrando la dosis total en un periodo de 6 a 8 horas.
- 4.
Emplear etopósido oral, una formulación de etopósido que no contiene el disolvente polisorbato 80 y con el que no se han descrito RH.
Mujer de 62 años, raza blanca, exfumadora (índice paquetes año: 12) e hipertensión arterial en tratamiento con inhibidores de la enzima convertidora de angiotensina. Es diagnosticada en agosto de 2016 de carcinoma microcítico pulmonar izquierdo (TNM: T1bN3M1b, estadio IV) a raíz de estudio por clínica constitucional. Recibió el primer ciclo de tratamiento quimioterápico, con esquema cisplatino 80 mg/m2 día 1 y eto- pósido 100 mg/m2 días 1-3 cada 21 días sin incidencias. Posteriormente, se inició la administración de 150 mg de etopósido Sandoz® el primer día del segundo ciclo a una concentración de la dilución de 0,15 mg/ml en una perfusión de 60 minutos de forma análoga al primer ciclo. Tras la administración de 30 ml, la paciente presentó una erupción urticariforme y pruriginosa generalizada. Se objetivó hipoxemia sin broncoespasmo y tensión arterial de 182/90 mmHg. Se suspendió inmediatamente la infusión de etopósido y se administró dexclorfeniramina 5 mg, hidrocortisona 100 mg y oxigenoterapia, con remisión del cuadro. Se decidió no administrar el etopósido y unas horas más tarde se administró el cisplatino con buena tolerancia. La reacción adversa fue comunicada al Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano.
Fue valorada por el servicio de alergología un día después, realizándose estudio alergológico en el que, debido a la relativamente baja incidencia de RH a etopósido (1-3%), se consideró la posibilidad de que la reacción fuera mediada por el polisorbato 80. Ante la necesidad de no retrasar la administración de la quimioterapia y la no disponibilidad de polisorbato 80, se planificó un estudio alergológico en el que de forma indirecta se pudiera determinar la posible causalidad de dicho excipiente en la RH.
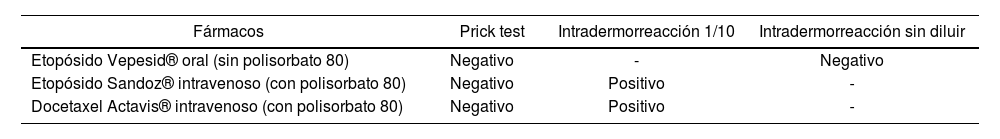
Para ello, se realizaron las pruebas cutáneas (PC) habituales según protocolo de alergología. Se llevaron a cabo PC en prick test e intradermorrea- ción con Etopósido Vepesid®, Etopósido Sandoz® y Docetaxel Actavis®. Este último fármaco contiene el polisorbato 80 y la paciente no se había expuesto a él previamente.
Los resultados obtenidos en las PC se muestran en la tabla 1.
Resultado de las PC
| Fármacos | Prick test | Intradermorreacción 1/10 | Intradermorreacción sin diluir |
|---|---|---|---|
| Etopósido Vepesid® oral (sin polisorbato 80) | Negativo | - | Negativo |
| Etopósido Sandoz® intravenoso (con polisorbato 80) | Negativo | Positivo | - |
| Docetaxel Actavis® intravenoso (con polisorbato 80) | Negativo | Positivo | - |
Al obtener un resultado negativo en prick test, se realizó la PC en intra- dermorreación con los mismos fármacos. Se obtuvo un resultado positivo para los fármacos que contienen polisorbato 80 y un resultado negativo para Etopósido Vepesid® que no contiene dicho excipiente.
Por ello, se puede inferir que la RH pudiera estar mediada por polisor- bato 80 y no por el propio principio activo. Así pues, se decidió continuar la administración de los ciclos de quimioterapia sustituyendo etopósido intravenoso por dosis equivalentes de etopósido oral, puesto que la paciente no estaba sensibilizada a dicho fármaco.
En total, ha recibido tratamiento quimioterápico con cinco ciclos de cisplatino y etopósido oral, y radioterapia adyuvante (dosis total 30 Gy), con datos de respuesta parcial en las pruebas de imagen y excelente tolerancia al cambio.
DiscusiónEn el caso que nos ocupa, se describe la posibilidad de una detección indirecta de la RH debida a polisorbato 80, ante la falta de materia prima para la realización de PC en prick test e intradermoreacción.
La determinación del polisorbato 80 como agente etiológico de la RH, ha permitido continuar el tratamiento quimioterápico con etopósido oral con un régimen con evidencia que respalda su uso en el tratamiento del cáncer microcítico de pulmón6.
La falta de identificación del agente causal hubiese generado la aplicación de un protocolo de desensibilización en 12 pasos, suponiendo un posible perjuicio en la calidad de vida por la mayor estancia en hospital de día, o el cambio de esquema terapéutico a protocolos con menor evidencia o eficacia. La utilización de estos protocolos estaría justificada en aquellos pacientes en los que prescindir de ese tratamiento podría suponer un importante detrimento en su expectativa de vida.
FinanciaciónSin financiación.
Presentación en congresosNo ha sido presentado anterioremente en ningún congreso o cualquier otro medio de difusión.
Conflicto de interesesSin conflictos de interés.
La administración de etopósido presenta una incidencia de reacciones infusionales situada entre el 1 y el 3% de las administraciones. En el caso que se presenta, se realiza una identificación de polisorbato 80 como agente causal de la reacción infusional durante la administración de etopósido en el contexto de una paciente diagnosticada de cancer de pulmón microcítico. La identificación de este excipiente como origen de la reacción ha permitido seleccionar presentaciones y formas farmacéuticas que carezcan de dicho componente manteniendo el etopósido como principio activo. La paciente ha podido continuar con el tratamiento de elección para su patología sin consecuencias relevantes en eficacia y calidad de vida.