analizar las diferencias en los parámetros farmacocinéticos y clínicos (tasas de sangrado y salud articular) antes y después del intercambio de factores VIII (FVIII) de vida media estándar a FVIII de vida media extendida pegilados en pacientes con hemofilia A grave/moderada en profilaxis, un año antes y después del intercambio en vida real.
Métodoestudio unicéntrico comparativo, observacional, secuencial, retrospectivo y multidisciplinar. Se emplearon los modelos farmacocinéticos poblacionales de la aplicación WAPPS-Hemo® para calcular los parámetros farmacocinéticos e individualizar la profilaxis. Se analizó la tasa anual de sangrados totales y articulares, la salud articular (Hemophilia Joint Health Score), la ratio semivida plasmática y área bajo la curva, el consumo de FVIII, la frecuencia de administración y el coste.
Resultadosse analizaron 38 pacientes adultos con hemofilia A que cambiaron de tratamiento de FVIII de vida media estándar a FVIII de vida media extendida pegilados. Mejoraron significativamente (p < 0,05) todos los parámetros farmacocinéticos, con ratios de mejora de semivida plasmática y área bajo la curva de 1,5 y 1,9; se registraron reducciones en la tasa anual de sangrados totales y articulares, y un mayor número de pacientes con cero sangrados totales (16,0 vs. 29,0) y articulares (23,0 vs. 33,0). Las medianas de reducción en frecuencia de administración y dosis/kg/semana fueron de un 30,0 y 19,7%, respectivamente, evitando 44,3 infusiones/paciente/año, lo que supuso un ahorro de 20.843 €/paciente/año. Además, se observaron mejoras en la salud articular (23,0 vs. 21,0; p = 0,017) y se resolvieron las articulaciones diana tras el intercambio.
Conclusionesel intercambio guiado por farmacocinética de FVIII de vida media estándar a FVIII pegilados ha demostrado un beneficio clínico significativo con tasas reducidas de sangrado y mejoras en la salud articular. Así mismo, también se observaron mejoras en los parámetros farmacocinéticos, lo que permitió disminuir tanto la carga de tratamiento, al reducir la frecuencia de administración en los pacientes, como el consumo y el coste.
To analyze the differences in pharmacokinetic and clinical parameters (bleeding rates and joint health) before and after switching from standard half-life factor VIII (FVIII) to extended half-life pegylated FVIII in patients with severe/moderate hemophilia A on prophylaxis, one year before and after the switch in real-life.
MethodThis is a single-center, comparative, observational, sequential, retrospective, and multidisciplinary study. Population pharmacokinetic models from the WAPPS-Hemo® application were used to calculate pharmacokinetic parameters and individualize prophylaxis. The annual rate of total and joint bleeds, joint health (Hemophilia Joint Health Score), plasma half-life and area under the curve ratios, FVIII consumption, administration frequency, and cost were analyzed.
ResultsThirty-eight adult patients with hemophilia A who switched from standard half-life FVIII to extended half-life pegylated FVIII were analyzed. Significant improvements (p < 0.05) were observed in all pharmacokinetic parameters, with plasma half-life and area under the curve improvement ratios of 1.5 and 1.9, respectively, as well as reductions in annual total and joint bleeding rates were registered. A higher number of patients with zero total (16.0 vs. 29.0) and joint bleeds (23.0 vs. 33.0) was also observed. The median reductions in administration frequency and dose/kg/week were 30.0% and 19.7%, respectively, avoiding 44.3 infusions/patient/year, resulting in savings of 20,843 €/patient/year. Furthermore, joint health improved (23.0 vs. 21.0; p = 0.017), and target joints resolved after the switch.
ConclusionsThe pharmacokinetically guided switch from standard half-life FVIII to pegylated FVIII demonstrated significant clinical benefits with reduced bleeding rates and improvements in joint health. Additionally, improvements in pharmacokinetic parameters were observed, allowing for reduced treatment burden by decreasing administration frequency, as well as lower consumption and costs.
La hemofilia A (HA) es un trastorno hemorrágico hereditario ligado al cromosoma X, caracterizado por una deficiencia del factor de coagulación VIII (FVIII). Los pacientes con HA tienen un riesgo elevado de episodios de sangrado espontáneos, que pueden llevar a complicaciones graves como hemartrosis, daño articular crónico y otras secuelas discapacitantes1.
La profilaxis en la HA consiste en la administración regular de tratamientos destinados a prevenir los sangrados a través del mantenimiento de unos niveles mínimos de FVIII ≥1%, si bien en los últimos años se han preferido alcanzar niveles entre el 3 y 5% o superiores. Prolongar la semivida (t1/2) del FVIII ha sido el propósito que llevó al diseño de los FVIII de vida media extendida (FVIII-EHL) que utilizan diversas estrategias como la fusión a proteínas (región Fc de IgG1 o la albúmina) o bien la conjugación del FVIII con polietilenglicol (PEG)2. La unión del polímero hidrofílico PEG al FVIII altera sus propiedades fisicoquímicas y, con ello, modifica la interacción proteína-receptores de eliminación celular, prolongando el tiempo en circulación sanguínea del factor3.
Los FVIII-EHL han demostrado mejorar los resultados clínicos, así como reducir la carga de tratamiento de los pacientes con HA4,5. El objetivo principal del presente estudio fue analizar las diferencias en los parámetros farmacocinéticos (PK) y clínicos (tasas de sangrado y salud articular) antes y después del intercambio de FVIII de vida media estándar (SHL) a FVIII-EHL pegilados (PEG-FVIII) en pacientes con hemofilia A grave/moderada en profilaxis, mediante el empleo de WAPPS-Hemo®6. Los objetivos secundarios fueron analizar las ratios t1/2 y área bajo la curva (AUC), la frecuencia y consumo de FVIII, y el coste económico evitado tras el intercambio, así como realizar una comparación indirecta entre los PEG-FVIII estudiados.
MétodosDiseño del estudio y poblaciónEstudio unicéntrico comparativo, observacional, secuencial, retrospectivo y multidisciplinar, aprobado por el Comité de Ética en Investigación Clínica local el 26/01/2022, de acuerdo con los principios de la Declaración de Helsinki (HUF-PKFVIII-2022-01). Este estudio se realizó siguiendo los criterios de la práctica clínica habitual de enero de 2022 a diciembre de 2023 y no fue necesaria ninguna intervención especial en el tratamiento.
Los criterios de inclusión fueron los siguientes: 1) pacientes con HA grave (menor que 1 UI/dl) o moderada (1–5 UI/dl) en tratamiento profiláctico con FVIII-SHL que cambiaron a PEG-FVIII; 2) pacientes incluidos en la base de datos de la aplicación WAPPS-Hemo®7 con intercambio de FVIII-SHL a PEG-FVIII, con registros de al menos 3–4 muestras de niveles de FVIII y perfil PK individualizado. Se excluyeron los pacientes con datos de seguimiento inferiores a un año antes y después del intercambio o sin datos registrados.
ProcedimientoSe analizaron 2 periodos de un año: un año de tratamiento con FVIII-SHL antes del intercambio y uno después del cambio al tratamiento con PEG-FVIII. El cambio de FVIII-SHL a PEG-FVIII tuvo como objetivo mejorar el control de los sangrados y la calidad de vida de los pacientes. Para seleccionar el cambio de un concentrado a otro se tuvieron en cuenta diversos factores (disponibilidad, factor previo, características clínicas del paciente, condiciones de conservación y coste), siendo responsabilidad del clínico. Los FVIII-SHL incluidos fueron: moroctocog alfa, octocog alfa (3 presentaciones comerciales), turoctocog alfa, lonoctocog alfa y la combinación FVIII/FVW. Los factores PEG-FVIII incluidos fueron: rurioctocog alfa pegol, turoctocog alfa pegol y damoctocog alfa pegol.
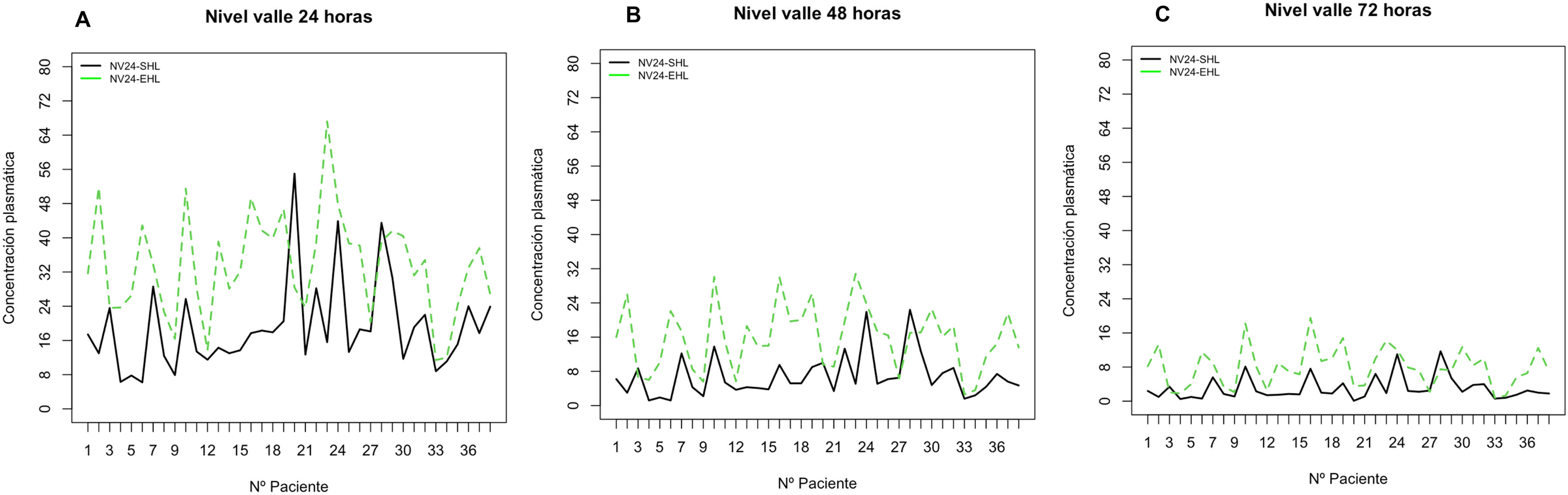
Los niveles de FVIII se analizaron con el método coagulativo en una etapa COA (Actin FS activador y plasma deficiente de Siemens®). Se empleó WAPPS-Hemo® con 3–4 muestras siguiendo las recomendaciones de la ISTH6 para realizar la estimación Bayesiana del perfil PK individualizado (predosis, 4–8 h, 16–28 h y 40–60 h posinfusión para FVIII SHL, y las mismas muestras añadiendo un nivel a las 60–84 h para PEG-FVIII). Las variables PK y clínicas analizadas fueron: t1/2, AUC, nivel pico (NP), nivel valle a las 24, 48 y 72 h (NV24/NV48/NV72), nivel valle objetivo (NV objetivo) y tiempo para alcanzar niveles de FVIII del 5, 2 y 1% (T5%/T2%/T1%). Se calcularon las ratios de t1/2 y AUC. El AUC se obtuvo a partir de los datos proporcionados por la McMaster University. Todos los parámetros PK fueron calculados con la aplicación WAPPS-Hemo®7, utilizándose la calculadora clínica de la aplicación para obtener los NP, NV y NV objetivo a partir del perfil PK individualizado.
La efectividad del tratamiento se evaluó mediante la tasa anual de sangrados totales (ABR) y articulares (AJBR). También se determinó el porcentaje de pacientes con cero sangrados durante el periodo estudiado, las articulaciones diana y la puntuación de salud articular Hemophilia Joint Health Score (HJHS). Para estimar el consumo de FVIII, se determinó el número de dosis semanales, así como la dosis/kg/semana, lo que permitió calcular el coste/año/paciente para obtener datos económicos y estimar la utilización de recursos con el uso de los factores pegilados.
Análisis estadísticoEl análisis estadístico se llevó a cabo con R Statistical Software versión 4.3.3 (2024-02-29). Para comparar las variables entre ambos periodos se empleó el test de Wilcoxon, y para la comparación entre grupos PEG-FVIII se utilizó el test de Kruskal Wallis y la prueba post hoc test Wilcoxon (2 a 2) para comprobar los pares entre los cuales existían diferencias. Se consideró estadísticamente significativo un valor de p < 0,05. Los resultados se expresaron como mediana y rango intercuartílico (RIC).
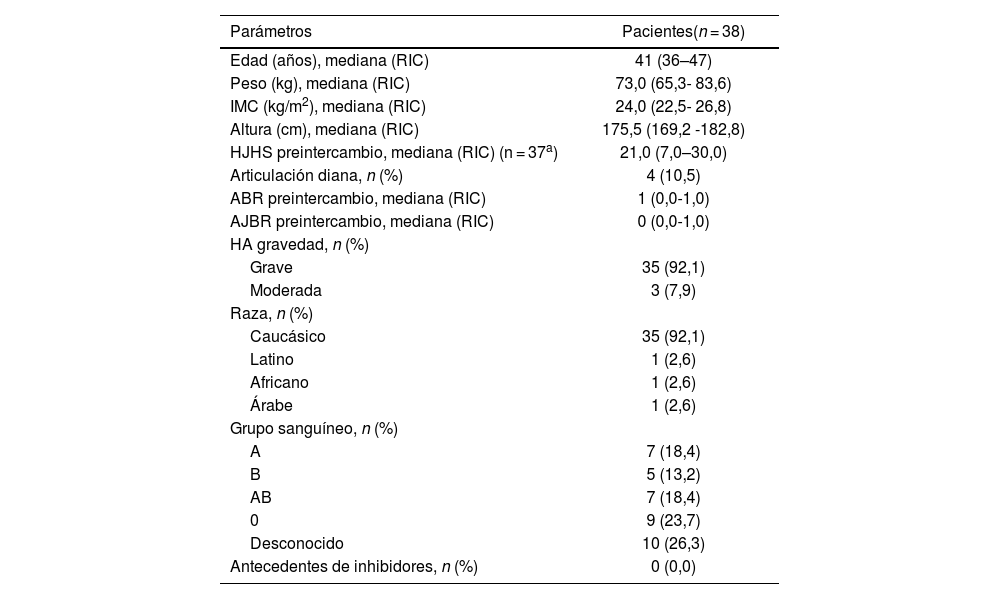
ResultadosSe analizaron 38 pacientes adultos con HA que cambiaron de tratamiento con FVIII-SHL (moroctocog alfa [n = 5]; octocog alfa [n = 25]; turoctocog alfa [n = 5]; lonoctocog alfa [n = 1]; combinación FVIII/FVW [n = 2]) a PEG-FVIII (rurioctocog alfa pegol [n = 21]; turoctocog alfa pegol [n = 8]; damoctocog alfa pegol [n = 9]). La mediana de edad fue de 41 años (RIC: 36–47), y la mediana de peso de 73,0 kg (RIC: 65,3-83,6), sin diferencias de peso entre períodos (p = 0,084). En cuanto a la relación entre la gravedad, 3 pacientes (7,9%) presentaban HA moderada y 35 pacientes (92,1%) HA grave. La tabla 1 recoge las características basales de los pacientes.
Características basales de los pacientes incluidos en el estudio
| Parámetros | Pacientes(n = 38) |
|---|---|
| Edad (años), mediana (RIC) | 41 (36–47) |
| Peso (kg), mediana (RIC) | 73,0 (65,3- 83,6) |
| IMC (kg/m2), mediana (RIC) | 24,0 (22,5- 26,8) |
| Altura (cm), mediana (RIC) | 175,5 (169,2 -182,8) |
| HJHS preintercambio, mediana (RIC) (n = 37a) | 21,0 (7,0–30,0) |
| Articulación diana, n (%) | 4 (10,5) |
| ABR preintercambio, mediana (RIC) | 1 (0,0-1,0) |
| AJBR preintercambio, mediana (RIC) | 0 (0,0-1,0) |
| HA gravedad, n (%) | |
| Grave | 35 (92,1) |
| Moderada | 3 (7,9) |
| Raza, n (%) | |
| Caucásico | 35 (92,1) |
| Latino | 1 (2,6) |
| Africano | 1 (2,6) |
| Árabe | 1 (2,6) |
| Grupo sanguíneo, n (%) | |
| A | 7 (18,4) |
| B | 5 (13,2) |
| AB | 7 (18,4) |
| 0 | 9 (23,7) |
| Desconocido | 10 (26,3) |
| Antecedentes de inhibidores, n (%) | 0 (0,0) |
ABR: tasa anual de sangrados; AJBR: tasa anual de sangrados articulares; HJHS: Hemophilia Joint Health Score; IMC: índice de masa corporal; RIC: rango intercuartílico.
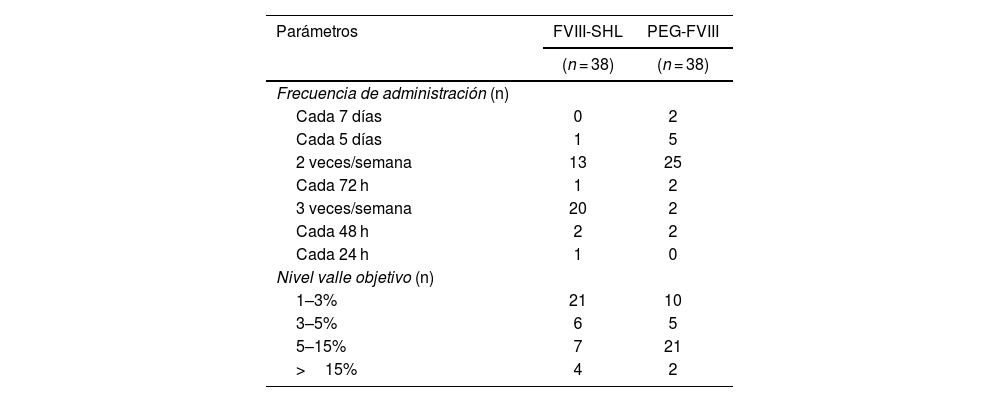
Las medianas de la frecuencia de administración y de la dosis de FVIII/kg/semana para los FVIII-SHL fueron de 3,0 (RIC: 2,0-3,0) y 70,2 (RIC: 55,1-82,7) UI/kg/semana, respectivamente. En el caso de los PEG-FVIII, la mediana de la frecuencia fue de 2,0 (RIC: 2,0-2,0) y la mediana de la dosis de FVIII/kg/semana de 52,2 (RIC: 45,1-66,5) UI/kg/semana. Tras el intercambio, se redujo la frecuencia de dosis (p < 0,001) y la dosis/kg/semana (p < 0,001). Las medianas de reducción fueron de un 30,0% en frecuencia (RIC: 0,0–33,3%) y de un 19,7% en dosis/kg/semana (RIC: 4,1-35,8%) UI/kg/semana, evitando 44,3 infusiones/paciente/año (RIC: 0,0–52,1). Los regímenes de profilaxis y NV objetivo para los FVIII-SHL y PEG-FVIII, se detallan en la tabla 2.
Comparación entre factor VIII de vida media estándar y factor VIII de vida media extendida pegilado de la frecuencia de administración y del nivel valle objetivo alcanzado
| Parámetros | FVIII-SHL | PEG-FVIII |
|---|---|---|
| (n = 38) | (n = 38) | |
| Frecuencia de administración (n) | ||
| Cada 7 días | 0 | 2 |
| Cada 5 días | 1 | 5 |
| 2 veces/semana | 13 | 25 |
| Cada 72 h | 1 | 2 |
| 3 veces/semana | 20 | 2 |
| Cada 48 h | 2 | 2 |
| Cada 24 h | 1 | 0 |
| Nivel valle objetivo (n) | ||
| 1–3% | 21 | 10 |
| 3–5% | 6 | 5 |
| 5–15% | 7 | 21 |
| >15% | 4 | 2 |
FVIII-SHL; factor VIII de vida media estándar; PEG-FVIII: factor VIII de vida media extendida pegilado.
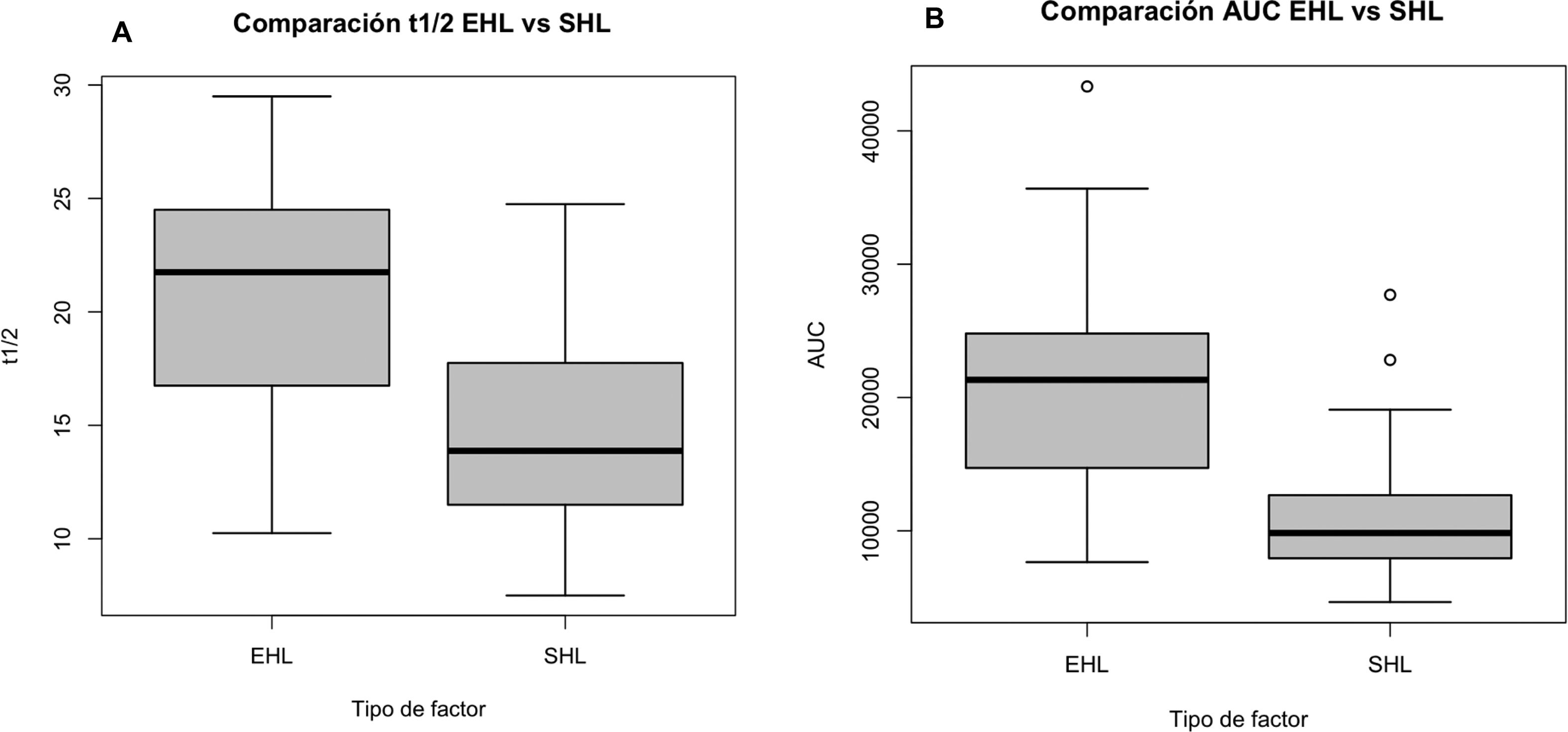
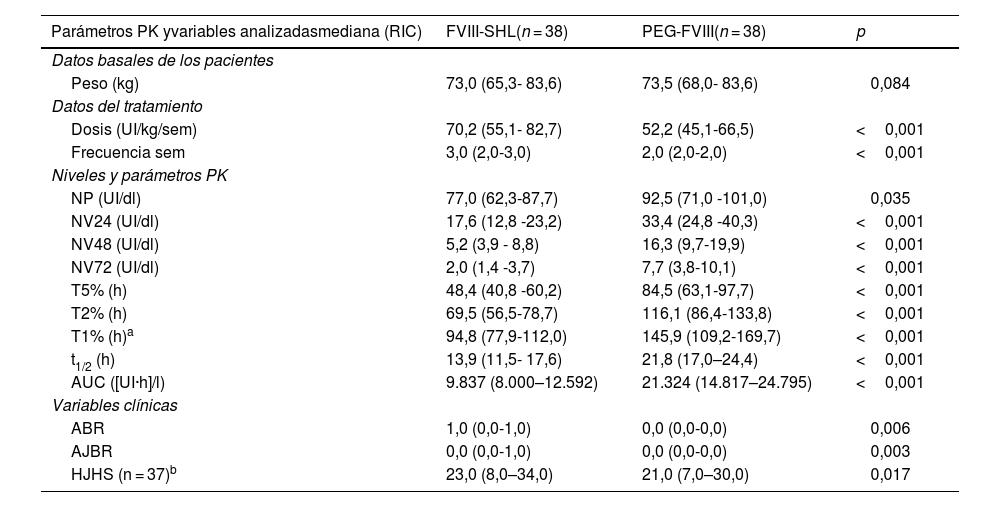
Tras el intercambio a PEG-FVIII mejoraron significativamente todos los parámetros PK y se obtuvieron medianas en las ratios t1/2 y AUC de 1,5 y 1,9 (tabla 3 y figs. 1 y 2). También se obtuvieron mejoras clínicas con PEG-FVIII, con menor ABR (p = 0,006) y AJBR (p = 0,003), y mayor número de pacientes con cero sangrados totales (42,1% vs. 76,3%) y articulares (60,5% vs. 86,8%). Se obtuvieron mejoras en la salud articular en HJHS (23,0 vs. 21,0; p = 0,017) y los pacientes que presentaron articulaciones diana (10,5%) las resolvieron tras el intercambio.
Comparación de los parámetros parámetros farmacocinéticos y variables analizadas después del intercambio de factor VIII de vida media estándar a factor VIII de vida media extendida pegilado
| Parámetros PK yvariables analizadasmediana (RIC) | FVIII-SHL(n = 38) | PEG-FVIII(n = 38) | p |
|---|---|---|---|
| Datos basales de los pacientes | |||
| Peso (kg) | 73,0 (65,3- 83,6) | 73,5 (68,0- 83,6) | 0,084 |
| Datos del tratamiento | |||
| Dosis (UI/kg/sem) | 70,2 (55,1- 82,7) | 52,2 (45,1-66,5) | <0,001 |
| Frecuencia sem | 3,0 (2,0-3,0) | 2,0 (2,0-2,0) | <0,001 |
| Niveles y parámetros PK | |||
| NP (UI/dl) | 77,0 (62,3-87,7) | 92,5 (71,0 -101,0) | 0,035 |
| NV24 (UI/dl) | 17,6 (12,8 -23,2) | 33,4 (24,8 -40,3) | <0,001 |
| NV48 (UI/dl) | 5,2 (3,9 - 8,8) | 16,3 (9,7-19,9) | <0,001 |
| NV72 (UI/dl) | 2,0 (1,4 -3,7) | 7,7 (3,8-10,1) | <0,001 |
| T5% (h) | 48,4 (40,8 -60,2) | 84,5 (63,1-97,7) | <0,001 |
| T2% (h) | 69,5 (56,5-78,7) | 116,1 (86,4-133,8) | <0,001 |
| T1% (h)a | 94,8 (77,9-112,0) | 145,9 (109,2-169,7) | <0,001 |
| t1/2 (h) | 13,9 (11,5- 17,6) | 21,8 (17,0–24,4) | <0,001 |
| AUC ([UI·h]/l) | 9.837 (8.000–12.592) | 21.324 (14.817–24.795) | <0,001 |
| Variables clínicas | |||
| ABR | 1,0 (0,0-1,0) | 0,0 (0,0-0,0) | 0,006 |
| AJBR | 0,0 (0,0-1,0) | 0,0 (0,0-0,0) | 0,003 |
| HJHS (n = 37)b | 23,0 (8,0–34,0) | 21,0 (7,0–30,0) | 0,017 |
ABR: tasa anual de sangrados; AJBR: tasa anual de sangrados articulares; AUC: área bajo la curva; FVIII-SH; factor VIII de vida media estándar; HJHS: Hemophilia Joint Health Score; NP: nivel pico; NV24, NV48, NV72: nivel valle a las 24, 48 y 72 horas; PEG-FVIII: factor VIII de vida media extendida pegilado; PK: farmacocinética; RIC: rango intercuartílico; Sem: semana; t1/2: semivida de eliminación; T5%, T2%, T1%: tiempo para alcanzar niveles de FVIII del 5%, 2% y 1%; UI: unidades internacionales. Test estadístico: test de Wilcoxon; nivel de significación: p < 0,05.
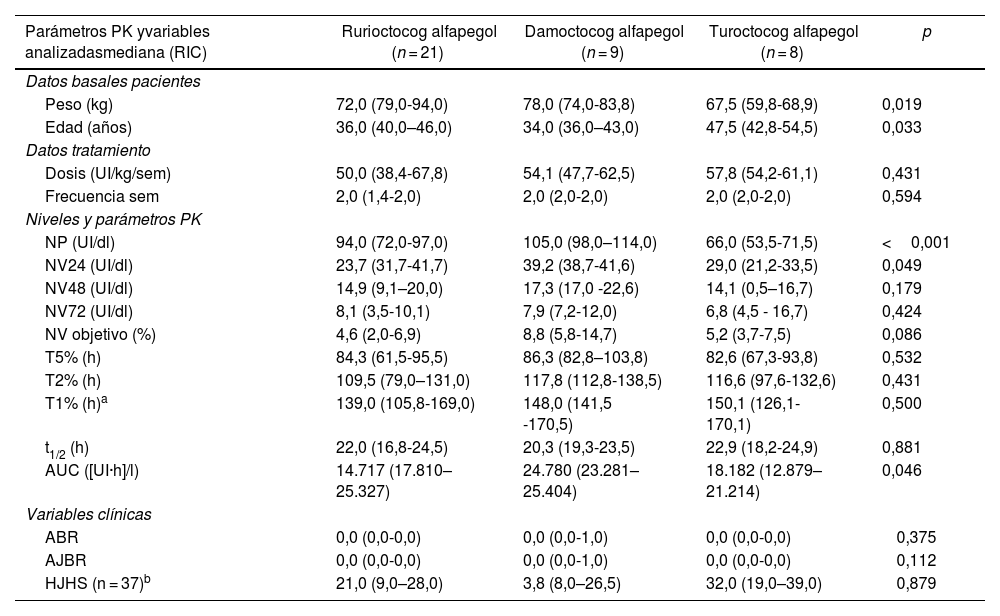
Al analizar los resultados obtenidos con los diferentes PEG-FVIII (tabla 4), se observaron diferencias significativas entre los PEG-FVIII en algunos parámetros PK, como el NV24 (p = 0,049), AUC (p = 0,046) y NP (p < 0,001), pero no se encontraron diferencias en la t1/2, la dosificación (dosis/kg/semana y frecuencia) y en la efectividad (ABR, AJBR).
Comparación entre los PEG-FVIII administrados
| Parámetros PK yvariables analizadasmediana (RIC) | Rurioctocog alfapegol (n = 21) | Damoctocog alfapegol (n = 9) | Turoctocog alfapegol (n = 8) | p |
|---|---|---|---|---|
| Datos basales pacientes | ||||
| Peso (kg) | 72,0 (79,0-94,0) | 78,0 (74,0-83,8) | 67,5 (59,8-68,9) | 0,019 |
| Edad (años) | 36,0 (40,0–46,0) | 34,0 (36,0–43,0) | 47,5 (42,8-54,5) | 0,033 |
| Datos tratamiento | ||||
| Dosis (UI/kg/sem) | 50,0 (38,4-67,8) | 54,1 (47,7-62,5) | 57,8 (54,2-61,1) | 0,431 |
| Frecuencia sem | 2,0 (1,4-2,0) | 2,0 (2,0-2,0) | 2,0 (2,0-2,0) | 0,594 |
| Niveles y parámetros PK | ||||
| NP (UI/dl) | 94,0 (72,0-97,0) | 105,0 (98,0–114,0) | 66,0 (53,5-71,5) | <0,001 |
| NV24 (UI/dl) | 23,7 (31,7-41,7) | 39,2 (38,7-41,6) | 29,0 (21,2-33,5) | 0,049 |
| NV48 (UI/dl) | 14,9 (9,1–20,0) | 17,3 (17,0 -22,6) | 14,1 (0,5–16,7) | 0,179 |
| NV72 (UI/dl) | 8,1 (3,5-10,1) | 7,9 (7,2-12,0) | 6,8 (4,5 - 16,7) | 0,424 |
| NV objetivo (%) | 4,6 (2,0-6,9) | 8,8 (5,8-14,7) | 5,2 (3,7-7,5) | 0,086 |
| T5% (h) | 84,3 (61,5-95,5) | 86,3 (82,8–103,8) | 82,6 (67,3-93,8) | 0,532 |
| T2% (h) | 109,5 (79,0–131,0) | 117,8 (112,8-138,5) | 116,6 (97,6-132,6) | 0,431 |
| T1% (h)a | 139,0 (105,8-169,0) | 148,0 (141,5 -170,5) | 150,1 (126,1-170,1) | 0,500 |
| t1/2 (h) | 22,0 (16,8-24,5) | 20,3 (19,3-23,5) | 22,9 (18,2-24,9) | 0,881 |
| AUC ([UI·h]/l) | 14.717 (17.810–25.327) | 24.780 (23.281–25.404) | 18.182 (12.879–21.214) | 0,046 |
| Variables clínicas | ||||
| ABR | 0,0 (0,0-0,0) | 0,0 (0,0-1,0) | 0,0 (0,0-0,0) | 0,375 |
| AJBR | 0,0 (0,0-0,0) | 0,0 (0,0-1,0) | 0,0 (0,0-0,0) | 0,112 |
| HJHS (n = 37)b | 21,0 (9,0–28,0) | 3,8 (8,0–26,5) | 32,0 (19,0–39,0) | 0,879 |
ABR: tasa anual de sangrados; AJBR: tasa anual de sangrados articulares; AUC: área bajo la curva; HJHS: Hemophilia Joint Health Score; NP: nivel pico; NV objetivo: nivel valle objetivo; NV24, NV48, NV72: nivel valle a las 24, 48 y 72 horas; PK: farmacocinética; RIC: rango intercuartílico; Sem: semana; t1/2: Semivida de eliminación; T5%, T2%, T1%: tiempo para alcanzar niveles de FVIII del 5%, 2% y 1%; UI: unidades internacionales. Test estadístico: test de Kruskal Wallis; nivel de significación: p < 0,05.
En términos de costes, la reducción en la administración del FVIII (2.378.068,73 UI de FVIII evitadas), se tradujo en un ahorro de 20.843 €/paciente/año (RIC: 8.239–52.419), y un total de 1.822.460 € evitados en toda la cohorte de estudio (cálculo a partir del coste/UI de cada factor). Se calculó un ahorro de 37.967,9 €/sangrado evitado (43 sangrados ABR evitados en los 38 pacientes). El mayor coste evitado/paciente/año se registró con el intercambio a turoctocog alfa pegol (n = 8; 23.408 [RIC: 15.096–168.544] €), frente a rurioctocog alfa pegol (n = 8; 21.355,3 [RIC: 890,8-55.011,1] €) y damoctocog alfa pegol, (n = 9; 11.018 [RIC: 7.762–37.015] €).
DiscusiónEn este análisis exploratorio de datos en vida real, se ha demostrado la efectividad de los PEG-FVIII en la práctica clínica mediante una mejoría en los parámetros PK y clínicos, con menor ABR y AJBR, mayor número de pacientes con cero sangrados totales y articulares, y una reducción de la carga del tratamiento al disminuir tanto la dosis/kg/semana como la frecuencia de las infusiones.
Los PEG-FVIII presentan ciertas ventajas, como una administración más espaciada que los FVIII-SHL8. En nuestro estudio, aproximadamente la mitad de los pacientes (n = 20; 52,6%) siguieron un régimen de profilaxis con SHL de 3 veces por semana 3,0 (RIC: 2,0-3,0), mientras que después del intercambio se redujo la frecuencia de administración, siendo el principal régimen (n = 25, 65,8%) de 2 veces por semana (2,0 [RIC: 2,0-2,0]) (p < 0,001). En 5 cohortes similares con intercambio de FVIII-SHL a PEG-FVIII, se observaron reducciones en la carga de tratamiento al reducir la frecuencia de administración y la dosis/kg/semana, en la misma línea que los resultados obtenidos en nuestra cohorte9–13. Un estudio canadiense unicéntrico con 25 pacientes reportó una reducción en la mediana de infusiones/semana de 2,7 (RIC: 2,1-2,9) a 2,2 (RIC: 2,0-3,0), así como una reducción de la mediana del 12,2% del consumo anual de FVIII (UI/kg/año)9. Datos de práctica clínica en 3 centros de EE. UU. informaron de una reducción del 19% en el consumo semanal de FVIII y una disminución del 86,7% en la frecuencia10. Nummi et al. reportaron un descenso del 29% en la mediana de infusiones semanales y el consumo del factor descendió en un 17%11. Un estudio estadounidense obtuvo una reducción significativa del 25,2% en la frecuencia (2,8 vs. 2,1 días/semana) y menor consumo FVIII, aunque no significativo12. Del mismo modo, en el estudio multicéntrico de Megías-Vericat JE et al., la frecuencia de infusión semanal y la dosis/kg/semana disminuyeron en un 33,3 y 20,4%13.
Los regímenes de tratamiento menos intensivos han demostrado mantener o mejorar la protección frente a sangrados9–15. En nuestro estudio, con una reducción en la dosis/kg/semana, se evitaron 44,3 infusiones/paciente/año y se obtuvo un NV objetivo mayor tras el intercambio, pues más de la mitad de los pacientes (55,2%) se encontraban entre un NV objetivo de 5–15%, mientras que con los FVIII-SHL este mismo porcentaje de pacientes se situó en NV objetivo entre 1 y 3%, asociándose estos niveles más elevados con mayor protección frente a sangrados (ABR; p = 0,006 y AJBR; p = 0,003). Del mismo modo, se controlaron los sangrados, alcanzando mejoras en la salud articular en términos de HJHS (p = 0,017) y reproduciendo los resultados observados previamente en cohortes similares (5,5 vs. 5,0; p = 0,003)13 y reducción en 2,5 puntos14, o reduciendo un 91% las articulaciones diana15 tras el intercambio a PEG-FVIII.
Con los factores EHL se ha conseguido extender la t1/2 mediante diferentes mecanismos; en el caso de los PEG-FVIII, la estrategia consiste en la conjugación con PEG2. Con rurioctocog alfa pegol, se recogen en la bibliografía unas tasas de incremento de la t1/2 entre 1,3 y 1,5 veces respecto al producto SHL de referencia (octocog alfa)16. En nuestra cohorte, se obtuvo una ratio de 1,56 (RIC: 1,46- 1,86) y una t1/2 de 22,0 (RIC:16,8-24,5) h. En el caso de damoctocog alfa pegol, se consiguen incrementos en la t1/2 de 1,4 veces17, si bien en nuestra cohorte se obtuvo una ratio inferior de 1,12 (RIC: 1,00–1,33). Y en lo que concierne a turoctocog alfa pegol, alcanza incrementos en t1/2 de 1,61 veces respecto al comparador estándar5,18, y en nuestra cohorte una ratio de 1,44 (RIC: 1,28-1,67). En el análisis conjunto de los 3 PEG-FVIII se obtuvo una ratio de t1/2 de 1,5 (RIC: 1,3-1,7), alcanzando la ratio que por definición debe cumplir el FVIII para considerarse como EHL (mayor que 1,3)19.
El ensayo first-in-human de turoctocog alfa pegol, en 26 pacientes pretratados con HA grave (84,6% caucásicos), obtuvo para una dosis de 50 UI/kg un T1% de 6,5 días (RIC: 3,6–7,9 días) y una t1/2 de 19,0 h (RIC: 11,6–27,3 h)20. Resultados similares obtuvimos en nuestra cohorte, con dosis de 57,8UI/kg/sem (RIC: 54,2-61,1), presentando una mediana de T1% de 6,3 días (RIC: 5,3- 7,1) y una t1/2 de 22,9 h (RIC: 18,2-24,9). Cabe considerar que los resultados del ensayo anterior se determinaron con el método cromogénico frente al COA utilizado en nuestro estudio.
En el estudio de extensión del ensayo pivotal PATHFINDER 2, se estudió la seguridad y eficacia de la profilaxis con 75 UI/kg de turoctocog alfa pegol administrado semanalmente, en comparación con 50 UI/kg cada 4 días en el ensayo pivotal. La ABR fue similar en ambos 0,0 (RIC: 0,0-2,4) y 0,0 (RIC: 0,0-2,2), y el número de pacientes que presentaron sangrados también fue similar para ambas pautas 47,1% vs. 42,1%, respectivamente21. La pauta de turoctocog alfa pegol en los pacientes en nuestra cohorte fue de 57,8 (RIC: 54,2-61,1) UI/kg/sem 2 veces a la semana, con una mediana de 0,0 (RIC: 0,0-0,0) ABR y AJBR. Por lo tanto, con la pauta semanal de profilaxis se obtienen tasas de sangrados similares, evitando un 43% de inyecciones/año (de 91,3 a 52,0) en pacientes que previamente habían recibido dosis de turoctocog alfa pegol cada 4 días, lo que representa una ventaja clínica y mayor comodidad para los pacientes21.
En términos de eficacia, los factores damoctocog alfa pegol, rurioctocog alfa pegol y turoctocog alfa pegol se estudiaron en los ensayos pivotales PROTECT VIII (NCT01580293)22, PROLONG-ATE (NCT01736475)23 y PATHFINDER 2 (NCT01480180)21, respectivamente. La ABR registrada en los ensayos fue 1,3 (RIC: 0,0-4,6) turoctocog alfa pegol (21), 1,9 (RIC: 0,0-5,8) rurioctocog alfa pegol (23) y 1,9 (RIC: 0,0-4,2) damoctocog alfa pegol22. Datos comparables a los obtenidos en nuestra cohorte, con una mediana ABR de 0,0 (RIC: 0,0-0,0) rurioctocog alfa pegol, turoctocog alfa pegol y 0,0 (RIC: 0,0-1,0) damoctocog alfa pegol, obteniendo, por lo tanto, menos sangrados en comparación con los ensayos pivotales. Las diferencias observadas entre ensayo clínico y la vida real podrían justificarse por el alto porcentaje de pacientes que presentaban articulaciones diana en los ensayos clínicos, mientras que en nuestro estudio solamente 4 pacientes (10,5%) presentaron articulaciones diana, resolviéndolas todas tras el intercambio24.
En cuanto al análisis entre los PEG-FVIII, en nuestro estudio se observó la existencia de diferencias significativas entre rurioctocog alfa pegol, damoctocog alfa pegol y turoctocog alfa pegol en algunas variables PK, como el NV24, AUC y NP. En el análisis post hoc 2 a 2, las diferencias se atribuyeron en mayor medida al par damoctocog alfa pegol-turoctocog alfa pegol, si bien estas diferencias podrían justificarse por la disparidad entre el peso (p = 0,042) y la edad (p = 0,047) del par. Asimismo, el par rurioctocog alfa pegol- damoctocog alfa pegol también presentó diferencias en el NP, que podrían atribuirse a las diferencias en el peso de los pacientes (p = 0,027). Solms et al. compararon la PK de rurioctocog alfa pegol y de damoctocog alfa pegol a dosis similares a las utilizadas en nuestro estudio, asociándose un AUC superior a damoctocog alfa pegol frente a rurioctocog alfa pegol[25].
En términos de costes, el cambio a PEG-FVIII produjo un ahorro de 20.843 €/paciente/año, y un total de 1.822.460 € evitados en toda la cohorte. Un estudio italiano sobre el impacto económico derivado del uso de herramientas PK como MyPKFit® en 13 pacientes con HA en profilaxis, la cual demostró ser una estrategia coste-efectiva al disminuir de forma significativa ABR y AJBR, aunque con un aumento de gasto de 7.394,8 €/sangrado26. Sin embargo, cabe considerar que en este estudio no hubo intercambio como en nuestra cohorte, en la que el intercambio PK-guiado a FVIII-PEG resultó en un ahorro de 37.967,9 €/sangrado evitado.
En cuanto a las limitaciones del estudio, cabe mencionar, en primer lugar, que el tamaño de la muestra fue relativamente pequeño (especialmente para los grupos de turoctocog alfa pegol y damoctocog alfa pegol), pero este tamaño podría ser relevante, considerando otros estudios publicados y que la HA es una enfermedad rara. En segundo lugar, la validez externa de los resultados de este estudio unicéntrico es limitada y su aplicabilidad en diferentes cohortes de HA podría no ser apropiada. En tercer lugar, a pesar del uso de un diseño secuencial en el que cada paciente es su propio control, la heterogeneidad de los pacientes con HA (edad, peso, estado de las articulaciones, factor de von Willebrand, etc.) podría influir en las puntuaciones de hemorragia y las estimaciones de PK, así como la comparación entre factores PEG-FVIII en la que no se realizó un estudio secuencial.
Los resultados del estudio muestran que el cambio a PEG-FVIII resulta en un beneficio clínico significativo, con reducción de las tasas de sangrado totales y articulares, aumentando el porcentaje de pacientes sin sangrados y mejorando la salud articular. A nivel de PK, se ha alcanzado una mejoría en t1/2 (>1,3) y AUC (>1,25), cumpliendo las ratios establecidas para FVIII-EHL. Se ha reducido la frecuencia semanal y la dosis/kg/semana, permitiendo adaptar las infusiones a las necesidades y estilo de vida de cada paciente, consiguiendo además un ahorro muy significativo en costes evitados. Por todo ello, la monitorización PK del intercambio ha permitido mejorar la efectividad y reducir los costes al sistema sanitario.
Aportación a la literatura científicaEste estudio aborda el cambio de factores VIII de vida media convencional a factores VIII pegilados guiado por farmacocinética, en la práctica clínica, destacando los beneficios asociados a este enfoque. Los ensayos clínicos han demostrado la eficacia y seguridad de los factores de vida media extendida, pero solo unos pocos estudios han analizado el impacto de estos factores en la práctica clínica, especialmente en cohortes españolas. Los resultados obtenidos en este estudio confirman las ventajas en términos clínicos y económicos de los factores VIII pegilados en la terapia de la hemofilia.
FinanciaciónLos autores declaran que este trabajo se ha realizado sin ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no tienen intereses que pudieran percibirse como un conflicto o sesgo.
AgradecimientosAgradecemos la colaboración de Emma Iserman y Alfonso Lorio de McMaster Universtity, de todos los profesionales de la Unidad de Hemostasia y Trombosis del Hospital Universitari i Politècnic La Fe, y de todos los pacientes incluidos en el estudio.
Presentación en congresosSe ha enviado un póster al congreso de la Sociedad Española de Farmacia Hospitalaria (SEFH) 2024 relacionado con el presente trabajo. El póster ha sido aceptado (localizador mmf4381687). Organización: Sociedad Española de Farmacia Hospitalaria (SEFH). Lugar: A Coruña. Fecha: 17–19 octubre 2024.
Declaración de contribución de autoría CRediTMaria Choví-Trull: Writing – review & editing, Writing – original draft, Validation, Software, Methodology, Formal analysis, Data curation, Conceptualization. Juan Eduardo Megías-Vericat: Writing – review & editing, Supervision, Methodology, Investigation, Data curation. Santiago Bonanad Boix: Writing – review & editing, Supervision, Methodology, Conceptualization. Saturnino Haya Guaita: Writing – review & editing, Supervision, Methodology, Data curation, Conceptualization. Ana Rosa Cid Haro: Writing – review & editing, Supervision, Methodology, Conceptualization. Marta Aguilar Rodriguez: Writing – review & editing, Supervision, Methodology, Data curation, Conceptualization. Jose Luis Poveda Andrés: Writing – review & editing, Supervision, Methodology, Data curation, Conceptualization.