el uso off-label en la práctica clínica de jeringas no homologadas para la administración de fármacos por vía intravítrea ha tenido como consecuencia la detección de gotas de aceite de silicona en el vítreo de algunos pacientes. Esta situación deriva de la falta de jeringas aprobadas para la indicación de uso intraocular en el mercado español. El objetivo de este trabajo es realizar una revisión sobre el uso de las jeringas para administración intraocular, además de la búsqueda de alternativas comercializadas que cumplan la legalidad para estas necesidades no cubiertas.
Métodose realizó una revisión sistemática siguiendo la guía PRISMA 2020 mediante la búsqueda en PubMed con los descriptores: «silicone» AND «syringes» AND («intraocular» OR «intravitreal») y se filtraron todas las publicaciones existentes desde enero de 2006 hasta diciembre de 2023, incluyendo todos aquellos artículos que tratasen sobre la liberación de aceite de silicona en inyecciones intravítreas y que analizasen las posibles consecuencias.
Resultadosse encontraron 68 resultados de los que se excluyeron 23 por no tratar sobre el tema objeto de estudio, quedando para la revisión sistemática un total de 45 artículos. Estos se clasificaron en función de las conclusiones obtenidas en 4 grupos: las reacciones adversas producidas por la silicona, la técnica de administración, los aspectos físico-químicos de liberación de silicona y las características del producto sanitario. Tras la revisión de los actuales fabricantes y fichas técnicas de jeringas comercializadas, se han recogido las jeringas existentes para este uso encontrando 2 que serán probablemente comercializadas es España a principios de 2024: Zero Residual™ 0,2 ml SiO-free y la VitreJect® Ophthalmic.
Conclusionesde los resultados obtenidos, se puede interpretar que el uso de jeringas y agujas con silicona para uso intravítreo es una preocupación para los profesionales sanitarios por las implicaciones y consecuencias que pueden derivar en los pacientes, siendo la más importante las reacciones adversas, por lo que es necesario que existan en el mercado jeringas libres de silicona y específicas para uso intraocular. La seguridad y legalidad en el uso de jeringas y agujas intraoculares es fundamental para garantizar la integridad ocular y la salud del paciente.
The off-label use in clinical practice of non-approved syringes for intravitreal drug administration has resulted in the detection of silicone oil drops in the vitreous of some patients. This situation derives from the lack of approved syringes for intraocular use in the Spanish market.
The aim of this work is to review the use of syringes for intraocular administration, as well as to search for alternatives that meet the legal requirements for these unmet needs.
MethodA systematic review was performed following the PRISMA 2020 Guidelines by searching PubMed with the descriptors: “silicone” AND “syringes” AND (“intraocular” OR “intravitreal”) and filtering all existing publications from January 2006 to December 2023, including all those articles dealing with silicone oil release in intravitreal injections and analysing the possible consequences.
ResultsSixty-eight results were found, 23 of which were excluded because they did not deal with the subject under study, leaving a total of 45 articles for the systematic review. These were classified according to the conclusions obtained in 4 groups: the adverse reactions produced by silicone, the administration technique, the physicochemical aspects of silicone release, and the characteristics of the medical device. After reviewing the current manufacturers and technical data sheets of commercialized syringes, the existing syringes for this use have been collected, finding two that will probably be commercialized in Spain at the beginning of 2024: Zero Residual™ 0.2 ml SiO-free and VitreJect® Ophthalmic.
ConclusionsFrom the results obtained, it can be interpreted that the use of syringes and needles with silicone for intravitreal use is a concern for health professionals due to the implications and consequences that may arise in patients, the most important being adverse reactions, so it is necessary to have silicone-free syringes on the market that are specific for intraocular use.
Safety and legality in the use of intraocular syringes and needles is essential to guarantee ocular integrity and patient health.
La administración intraocular de fármacos, representa un papel importante en el tratamiento de enfermedades oculares frecuentes como son el glaucoma, la degeneración macular, la retinopatía diabética, las infecciones (conjuntivitis, queratitis, endoftalmitis, etc.) y los trastornos autoinmunes (síndrome de Sjögren, uveítis, etc.)1.
En los últimos 20 años el uso de medicamentos administrados por vía intravítrea se ha extendido como tratamiento de elección en muchas enfermedades intraoculares. La vía intravítrea se trata de una administración intraocular más concreta, en la que se administran diversos agentes farmacológicos directamente al ojo a través de la esclera y hacia la región posterior al cristalino, llamada cavidad vítrea. Esta técnica la lleva a cabo en España un especialista en oftalmología debido al riesgo e importancia de la zona ocular2.
Algunos de los medicamentos administrados por vía intravítrea como los anti-VEGF, corticoides o antifúngicos se presentan en el mercado en jeringas precargadas listas para administrar3, pero otros se comercializan como viales/ampollas que pueden ser utilizados como multidosis debido al pequeño volumen que se administra y deben ser manipulados con total seguridad para trasvasar su contenido a jeringas antes de ser administrados por vía intravítrea4.
El problema radica en que en la práctica clínica se han estado utilizando jeringas de forma off-label, puesto que no cumplían la indicación de uso intraocular5 al no existir en el mercado español jeringas homologadas para esta vía de administración.
Como consecuencia de este uso off-label, en enero de 2021 la compañía Becton Dickinson (BD) emitió un aviso de seguridad a través del cual no validaba ni se responsabilizaba de la aplicación de sus jeringas y agujas para el uso intraocular. Según el comunicado, «cuando se utilizan jeringas y agujas que no tienen la indicación para inyecciones intraoculares, existe la posibilidad de que aparezcan «cuerpos flotantes» en los ojos de los pacientes. Se considera que tienen origen en el aceite de silicona utilizado como lubricante en el interior de los cilindros de las jeringas, para que el émbolo (pistón) deslice con mayor facilidad y reducir así la fuerza necesaria al manipular las jeringas. Estos cuerpos flotantes son molestos, llegando en ocasiones a perjudicar la visión, pudiendo llegar a necesitar la extirpación mediante vitrectomía»6.
Esta notificación fue recogida por los Grupos de Trabajo de Productos Sanitarios (GPS) y Farmacotecnia de la Sociedad Española de Farmacia Hospitalaria (SEFH) y en febrero de 2021 emitieron una nota informativa en la que se reconocía que no existía comercializada en España una jeringa que cumpliera las características necesarias para la administración intravítrea de fármacos. El documento recomendaba jeringas que no contuvieran aceite de silicona o similares como lubricante o que tuvieran una baja concentración del mismo, a pesar de no tener indicación de uso oftálmico7.
En 2006, se publicaron los primeros casos de la presencia de cuerpos flotantes en la cavidad vítrea de pacientes tratados con pegaptanib (Macugen®) y se apuntó al aceite de silicona que recubría el interior de las jeringas (émbolos) como causante del problema8.
Actualmente, sigue siendo un tema recurrente recogido en la bibliografía y sin solucionar, al seguirse utilizando en muchos casos jeringas siliconadas no homologadas para las inyecciones intravítreas9,10.
Además de las consecuencias a nivel clínico, este hecho también puede tener implicaciones a nivel legal, ya que según el RD 1/2015 de 24 de julio, por el que se aprueba el texto refundido de la Ley de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios, dentro del artículo 112 Infracciones en materia de productos sanitarios, en el punto 26, «constituirá una infracción grave utilizar un profesional productos en condiciones y para usos distintos de los indicados por el fabricante, o por personal no cualificado o debidamente adiestrado»11.
Es por ello que las jeringas y agujas utilizadas para la administración de medicamentos vía intraocular deben tener aprobado legalmente este uso por el fabricante.
Dada la elevada trascendencia del tema, el objetivo de este trabajo es realizar una revisión sobre el conocimiento disponible hasta la actualidad sobre el uso de las jeringas con aceite de silicona utilizadas en administración de medicamentos por vía intraocular, además de la búsqueda de alternativas que se encuentren comercializadas y que cumplan la legalidad para mejorar la seguridad y eficacia del tratamiento en los pacientes.
MétodosSe realizó una revisión sistemática siguiendo la guía PRISMA 202012 mediante una búsqueda bibliográfica de la literatura científica publicada en PubMed. Los descriptores que se emplearon en la búsqueda fueron: «silicone» AND «syringe» AND («intraocular» OR «intravitreal») y se filtraron todas las publicaciones existentes desde enero de 2006 hasta diciembre de 2023 incluido.
Otras fuentes de información consultadas fueron las diferentes sociedades científicas españolas, en concreto los documentos publicados por la Sociedad Española de Farmacia Hospitalaria7 y la revista del Club Español de la Mácula-Retina13.
El tema central del estudio se enfocó en encontrar qué factores influyen y qué consecuencias tiene el uso de silicona como lubricante en las jeringas utilizadas para la administración intravítrea.
Los criterios de inclusión fueron todos aquellos artículos que tratasen sobre la liberación de aceite de silicona en las inyecciones intravítreas a través de las jeringas utilizadas y que analizasen las posibles consecuencias, ya fuesen en cuanto a reacciones adversas, la técnica de administración empleada por el oftalmólogo, la estabilidad del fármaco o las características del producto sanitario. El criterio de exclusión fue descartar los artículos que no tuvieran como objetivo principal el estudio o análisis del uso de jeringas con aceite de silicona para administración intravítrea.
Cuatro revisores evaluaron de forma independiente todos los títulos y resúmenes basados en los criterios de elegibilidad definidos y las diferencias en las opiniones de los revisores se resolvieron mediante discusión y consenso.
La información general y detallada se registró y tabuló en un formato diseñado en Microsoft Excel:
- -
Información general: título, autores y año de publicación
- -
Información específica: resultados de cada artículo y agrupación según conclusiones de cada estudio
Además, se revisaron especificaciones técnicas proporcionadas por los diferentes fabricantes de jeringas (homologadas y no homologadas) existentes en el mercado14–23.
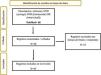
ResultadosEn PubMed se encontraron 68 resultados, entre los cuales se excluyeron 23 por no tratar sobre el tema objeto de estudio, quedando para la revisión sistemática un total de 45 artículos (fig. 1).
Diagrama de flujo (guía PRISMA 202012) que describe la búsqueda sistemática de los artículos revisados.
Se realizó una clasificación de los 45 artículos en función de los objetivos estudiados y las conclusiones obtenidas en 4 grupos.
El tema más estudiado y que mayor preocupación concierne a los investigadores en el que se obtuvieron 20 artículos, fueron las reacciones adversas producidas por la silicona (tabla 1), seguido de estudios que afectan a la liberación de silicona como es la técnica de administración con 7 artículos (tabla 2), los aspectos físico-químicos de liberación de silicona, como la estabilidad y conservación de los fármacos en jeringas precargadas con 10 artículos (tabla 3) y las características del producto sanitario en la liberación de silicona con 8 artículos (tabla 4).
Artículos que estudian los posibles síntomas asociados a las jeringas con silicona
| Artículo | Año | Conclusiones |
|---|---|---|
| Intravitreal silicone oil droplets after intravitreal drug injections. Bakri SJ, et al.24 | 2008 | Las jeringas con aceite de silicona como lubricante pueden ceder partículas de silicona al interior ocular y ser responsables de reacciones adversas.A mayor número de inyecciones intravítreas con jeringas siliconadas, mayor probabilidad de encontrar aceite de silicona en el vítreo y mayor probabilidad de reacciones adversas.Las reacciones adversas más comunes producidas por silicona son: alteraciones visuales (cuerpos flotantes), reacciones inflamatorias, endoftalmitis y aumento de la presión intraocular.Los síntomas causados por aceite de silicona suelen ser transitorios y reversibles, aunque existe un número de pacientes que han de tratarse farmacológicamente o retirarse mediante vitrectomía.Se recomienda el uso de jeringas sin silicona para evitar reacciones adversas |
| Toxic vitreitis outbreak after intravitreal injection. Ness T, et al.25 | 2010 | |
| Silicone oil droplets following intravitreal bevacizumab injections. Yu JH, et al.26 | 2017 | |
| Incidence of presumed silicone oil droplets in the vitreous cavity after intravitreal bevacizumab injection with insulin syringes. Khurana RN, et al.27 | 2017 | |
| Can anti-VEGF injections cause glaucoma or ocular hypertension? Lanzl I, et al.28 | 2017 | |
| Silicone oil droplets following intravitreal injection. Yu JH, et al.29 | 2017 | |
| Prevalence of silicone oil droplets in eyes treated with intravitreal injection. Melo GB, et al.30 | 2019 | |
| Large silicone droplets after intravitreal bevacizumab (avastin). Avery RL, et al.31 | 2019 | |
| Inflammatory reaction after aflibercept intravitreal injections associated with silicone oil droplets released from syringes: a case-control study. Melo GB, et al.32 | 2019 | |
| Silicone oil droplets after intravitreal injections: An uncomfortable adverse effect in our consultations. Gómez-Mariscal M, et al.33 | 2020 | |
| Silicone oil droplets in repackaged anti-vascular endothelial growth factors for intravitreal injections: In search of the main source of contamination. Olea JL, et al.34 | 2020 | |
| Silicone oil droplets after intravitreal bevacizumab injection in two patients. Caroca JO, et al.35 | 2020 | |
| Survey among retina specialists in Brazil about inflammatory reactions after intravitreal antiangiogenic therapy. Melo GB, et al.36 | 2020 | |
| Mechanisms of sterile inflammation after intravitreal injection of antiangiogenic drugs: a narrative review. Anderson WJ, et al.37 | 2021 | |
| Cluster of symptomatic silicone oil droplets following intravitreal injections: a one-year observational study. Sivertsen MS, et al.38 | 2021 | |
| Prospective study of silicone oil microdroplets in eyes receiving intravitreal anti-vascular endothelial growth factor therapy in 3 different syringes. Thompson JT39 | 2021 | |
| Frequency and symptoms of intravitreal silicone oil droplets following becton dickinson and norm-ject bevacizumab injections. Miller CW, et al.40 | 2022 | |
| Differences in the incidence of aflibercept-related sterile endophthalmitis according to types of disposable syringes used. Kim M, et al.41 | 2022 | |
| Presumed silicone oil droplets after intravitreal pegcetacoplan injections. Dessouki A, et al.42 | 2023 | |
| Incidence of ocular hypertension after anti-VEGF injections: examining the effect of drug filtration and silicone-free syringes. Bae SS, et al.43 | 2023 |
Artículos que describen cómo afecta la técnica de administración a la liberación de silicona
| Artículo | Año | conclusiones |
|---|---|---|
| Release of silicone oil droplets from syringes. Melo GB, et al.44 | 2019 | El uso Off-Label de jeringas y agujas con silicona en oftalmología puede liberar gotas de silicona al vítreo de los pacientes cuando se agita la jeringa durante su manipulación previa a la inyección intravítrea.A mayor agitación, mayor liberación de silicona al interior ocular.Recomiendan usar jeringas sin silicona, aprobadas en oftalmología y evitar movimientos bruscos y agitarlas durante su manipulación |
| Agitation of the syringe and release of silicone oil. Dias Júnior CS, et al.45 | 2020 | |
| Release of silicone oil and the off-label use of syringes in ophthalmology. Melo GB, et al.46 | 2020 | |
| Silicone oil-free syringes, siliconized syringes and needles: quantitative assessment of silicone oil release with drugs used for intravitreal injection. Melo GB, et al.47 | 2021 | |
| The risks behind the widespread use of siliconized syringes in the healthcare practice. Melo GB, et al.48 | 2021 | |
| Quantitative assessment of silicone oil release with siliconized and silicone oil-free syringes by microflow imaging microscopy. Agra LLDM, et al.49 | 2022 | |
| Ocular inflammation after agitation of siliconized and silicone oil-free syringes: a randomized, double-blind, controlled clinical trial. da Cruz NFS, et al.50 | 2022 |
Artículos relacionados con estudios físico-químicos de liberación de silicona, estabilidad y conservación de los fármacos en jeringas precargadas
| Artículo | Año | Conclusiones |
|---|---|---|
| Long-term stability of bevacizumab repackaged in 1 mL polypropylene syringes for intravitreal administration. Paul M, et al.51 | 2012 | No hay asociación entre el calibre de la aguja y la cantidad de aceite de silicona. Alta variabilidad en contenido de aceite de silicona entre jeringas del mismo lote.Diferentes factores afectan en los efectos secundarios tras inyecciones intravítreas: fármaco, almacenamiento, variaciones en la temperatura y diseño de jeringas.Los fármacos anti-VEGF fraccionados en jeringas de plástico sin aceite de silicona no ven afectados la estabilidad, integridad molecular o propiedades funcionales del fármaco, siempre que se preparen en la cabina de bioseguridad, se utilicen acondicionamiento 1.° y 2.° estéril y se almacenen a 4-8 °C protegidos de la luz hasta 7 días52.No existen diferencias en la carga de partículas de silicona entre las jeringas de cristal anti-VEGF precargadas comercializadas y las jeringas de plástico con aceite de silicona precargadas en cabina de bioseguridad53. Existe gran variabilidad de partículas de silicona procedentes de jeringas y agujas en el vítreo de los pacientes |
| Contamination of anti-VEGF drugs for intravitreal injection: How do repackaging and newly developed syringes affect the amount of silicone oil droplets and protein aggregates? Schargus M, et al.53 | 2018 | |
| A new method for pharmaceutical compounding and storage of anti-VEGF biologics for intravitreal use in silicone oil-free prefilled plastic siringes. Lode HE, et al.52 | 2019 | |
| Silicone oil found in syringes commonly used for intravitreal injections. Agra LLDM, et al.54 | 2019 | |
| Issues with intravitreal administration of anti-VEGF drugs. Schargus M, et al.55 | 2020 | |
| In-vitro assessment of release of silicone oil droplets with the use of variety of syringes and needles used in intravitreal injections. da Cruz NFS, et al.56 | 2021 | |
| Comparison of syringes with intravitreal Anti-VEGF drugs: particle burden and protein aggregates in brolucizumab, aflibercept and bevacizumab. Schargus M, et al.57 | 2021 | |
| High particle variability across siliconized and oil-free syringes and needles from the same lots. do Monte Agra LL, et al.58 | 2021 | |
| Particulate matter from syringes used for intravitreal injections. Dounce SM, et al.59 | 2021 | |
| Pharmaceutical compounding and storage of faricimab in a syringe for intravitreal injection do not impair stability and bi-specific binding properties. Jørstad ØK, et al.60 | 2023 |
Artículos relacionados con las especificaciones técnicas de las jeringas
| Artículo | Año | Conclusiones |
|---|---|---|
| SCORE Study Report 7: incidence of intravitreal silicone oil droplets associated with staked-on vs luer cone syringe design. Scott IU, et al.61 | 2009 | Recomendaciones: elección de jeringa sin siliconas, exactitud en la dosificación, compatibilidad de los materiales del envase primario, estabilidad de la formulación, evitar variaciones de temperatura.Características beneficiosas de las jeringas precargadas en ambiente estéril: disminución de burbujas, mayor precisión de dosis, menor liberación de silicona y menor riesgo de endoftalmitis.Se recomienda optimizar el transporte, el almacenamiento y la selección de jeringas para reducir los depósitos de silicona en el ojo.Importancia del espacio residual y cono en la elección de la jeringa para disminuir la frecuencia de aparición de gotas de silicona |
| Prefilled syringes for intravitreal drug delivery. Sassalos TM, et al.62 | 2019 | |
| Characterization of polymeric syringes used for intravitreal injection. Peláez SS, et al.63 | 2020 | |
| Critical analysis of techniques and materials used in devices, syringes, and needles used for intravitreal injections. Melo GB, et al.64 | 2021 | |
| Container closure and delivery considerations for intravitreal drug administration. Parenky AC, et al.65 | 2021 | |
| Observation of silicone oil within the vitreous and sclera following intravitreal administration of biotherapeutics using insulin syringes in cynomolgus monkeys. Huet F, et al.66 | 2021 | |
| Evaluation of a novel prefilled syringe concept for ophthalmic applications: a formative human factors study. Franzese C, et al.67 | 2022 | |
| Accuracy, precision, and residual volume of commonly used syringes for intravitreal injections and the impact on intraocular pressure. Agra LLM, et al.68 | 2023 |
La mayoría de los artículos concluyen poniendo de manifiesto la necesidad de que existan en el mercado jeringas y agujas libres de silicona y específicas para uso intraocular.
Tras la revisión de los actuales fabricantes y fichas técnicas de jeringas comercializadas a nivel nacional e internacional, se han recogido en la tabla 5, las jeringas que mejor pueden adaptarse para este uso ya sea por tener la indicación aprobada en vía intraocular o por estar exentas de silicona como lubricante y algunas de las que se están usando sin indicación actualmente.
Listado de las actuales jeringas utilizadas en práctica clínica con o sin indicación intraocular
| Denominación(Fabricante/Distribuidor) | Indicación intraocular | Volumen total Graduación | Silicona | Marcado CE | Espacio muerto | Luer lock | Cuerpos |
|---|---|---|---|---|---|---|---|
| VitreJect®14(Ocuject LLC) | SI | Jeringa de 1mlEscala: 0,05 ml | NO | SI | ≤0,02 ml | SI | 2 |
| Zero Residual™ 0,2 ml Silicone Oil-free15(SJJ Solutions) | SI | Jeringa de 0,2 mlEscala: 0,05 ml | NO | SI | ≤0,01 ml | SI | 2 |
| Zero Residual™ 0,3 ml low silicone oil16(SJJ Solutions) | SI | Jeringa de 0,3 mlEscala: 0,05 ml | SI | SI | ≤0,01 ml | NO | 3 |
| StaClear SC250 y SC250-LS17(Tribofilm Research) | SI | Jeringa de 0,25 mlEscala: 0,01 ml | SI | En proceso | ≤0,07 ml | SI | 3 |
| Daikyo Crystal Zenith Ophthalmic®18(West Pharmaceutical) | SI | Jeringa de 0,5 mlEscala: 0,05 ml | NO | NO | ≤0,07 ml | SI | 2 |
| PLAJEX™ 0,5 ml19(Terumo) | SI | Jeringa de 0,5 mlEscala: - | NO | NO | ≤0,07 ml | SI | 3 |
| HSW® Norm-Ject®20(VWR – Air Tite) | NO | Jeringa de 1mlEscala: 0,01 ml | NO | SI | ≤0,07 ml | SI | 2 |
| Injekt-F21(B. Braun® - Fisher) | NO | Jeringa de 1 mlEscala: 0,01 ml | NO | SI | ≤0,01 ml | NO | 2 |
| BD Plastipak®22(Becton Dickinson) | NO | Jeringa de 1mlEscala: 0,01 ml | SI | SI | 0,07 ml | SI | 3 |
| Jeringa Caress tuberculina 1 ml23(Nacatur 2 S.L.U) | NO | Jeringa de 1mlEscala: 0,01 ml | SI | SI | SI | NO | 3 |
Esta revisión sistemática identifica y sintetiza las consecuencias tanto clínicas, como técnicas y físico-químicas del uso de jeringas con o sin aceite de silicona como lubricante en la administración de fármacos por vía intraocular.
El uso de jeringas y agujas con silicona para uso intravítreo es una preocupación para los profesionales sanitarios por las implicaciones y consecuencias que pueden derivar en los pacientes, siendo la más importante las reacciones adversas.
En 2019 (7) y 2020 (8) se publicaron varios artículos que trataban la problemática que existía sobre las gotas de silicona que encontraban en el vítreo de los pacientes tras inyectarse fármaco vía intraocular. Fue a raíz de estas publicaciones cuando en enero de 2021, la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) emitió la notificación alertando de estos casos6, aunque posteriormente ha ido disminuyendo el número de publicaciones al respecto en 2022 (5) y 2023 (4).
En todos los artículos revisados, es el aceite de silicona el principal protagonista del estudio por las diferentes consecuencias que produce en la práctica clínica. Dentro de estas consecuencias, la que más se ha estudiado son las reacciones adversas por las molestias que suponen para los pacientes y por el aumento de la carga asistencial que esto supone, ya sea por aumento del número de pacientes que deben acudir a consultas y revisiones, como de intervenciones para la retirada de partículas de silicona en el caso de algunos pacientes24–43.
Otros autores se centran en estudiar cómo disminuir o evitar esta liberación de silicona en caso de no disponer de jeringas adecuadas, llegando a demostrar que la manipulación y la destreza del profesional sanitario son claves en este aspecto, debido a que movimientos bruscos o la agitación durante el transporte, almacenamiento y/o durante la intervención, aumentan el número de gotas de silicona presentes en la cavidad vítrea de los pacientes44–50.
Es necesario también destacar de los resultados de esta revisión que aspectos como las variaciones de temperatura pueden generar agregados o desnaturalización de proteínas. Otro aspecto es el tiempo de almacenamiento, según los estudios de estabilidad realizados para cada fármaco, los movimientos bruscos en el transporte de jeringas precargadas y el propio diseño de la jeringa, pueden afectar a la cesión de silicona51–68.
Debido a la responsabilidad legal que conlleva el uso off-label de este producto sanitario, el gran volumen de preparaciones y que es una técnica delicada al presentar un alto riesgo de complicaciones oculares, es necesario la comercialización de jeringas y agujas específicas y seguras con la indicación aprobada para este uso concreto por cumplir unos estándares de calidad adecuados y evitar así el uso off-label.
Ante esta preocupación clínica y todo lo anteriormente expuesto, es necesario establecer unas recomendaciones técnicas de las jeringas y agujas para uso intravítreo, alcanzando de esta forma una punción intraocular idónea. Estas recomendaciones se han extraído de la literatura científica revisada, además de basarse en la legalidad sobre productos sanitarios69,70 y en la experiencia clínica, y podrían resumirse en las siguientes:
- •
Marcado CE, necesario para su uso en Europa.
- •
Aprobación para uso intraocular.
- •
Jeringa preferentemente ≤ 1 ml, exenta de lubricante y de 3 cuerpos (pistón que favorece la estanqueidad y el deslizamiento uniforme).
- •
Cuerpo de la jeringa preferentemente de vidrio.
- •
Cono de la jeringa preferentemente luer lock para mayor seguridad en la conexión con la aguja.
- •
Espacio muerto mínimo o cero para evitar pérdida de dosis.
- •
Cuerpo de jeringa con serigrafía imborrable, clara, visible, numerada y en décimas de mililitro.
- •
Agujas preferentemente sin silicona, con cono luer y bisel atraumático.
- •
Aguja de inyección preferentemente de calibre 30G x ½ pulgada (0,3 mm x 12,7 mm)3.
Aparte de la adecuada selección de la jeringa para uso intraocular, es de suma importancia tener en cuenta otros aspectos para evitar complicaciones y garantizar la eficacia de los tratamientos oftalmológicos tan importantes como:
- •
Asegurar una técnica aséptica en el fraccionamiento de viales y un ambiente estéril en el procedimiento de administración.
- •
Debe ser administrado únicamente por médicos cualificados y formados en la administración de inyecciones intravítreas71.
- •
Manipulación cuidadosa, evitando la agitación enérgica de la jeringa precargada que conduce a un aumento sustancial en el número de partículas de silicona72.
- •
Asegurar un correcto almacenamiento alejado de la luz y evitar variaciones de temperatura.
- •
Mantener un registro detallado de todos los procedimientos, incluyendo el tipo de sustancia inyectada, la cantidad, la fecha y la hora del procedimiento, así como cualquier observación relevante.
En España se han estado utilizando jeringas que no cumplían con la legislación, ya que en el mejor de los casos, se usan jeringas libres de siliconas o con trazas, pero sin indicación para uso intraocular. Debido a las consecuencias clínicas y legales que conlleva esto, de todas las recomendaciones expuestas anteriormente se ha priorizado la ausencia de silicona como lubricante frente al resto de características como ocurre con la jeringa HSW® Norm-Ject®20 y la Injekt-F21 ampliamente utilizadas hasta el momento. Este uso off-label ha sido motivado por la falta de jeringas en el mercado autorizadas para dicha indicación.
Actualmente se está tratando de llegar a acuerdos para introducir en España 2 jeringas que cumplen con todos los requisitos de uso intraocular: la jeringa Zero Residual™ 0,2 ml SiO-free15 fabricada en Holanda y la VitreJect® Ophthalmic Syringe14 de fabricación americana. Si esto se hace posible, a principios de 2024 se podría disponer de ellas mediante 2 distribuidoras nacionales: Dextromedica S.L. distribuirá las jeringas Zero Residual™ 0,2 ml SiO-free e Izasa Medical, las jeringas VitreJect® Ophthalmic.
Estas 2 jeringas mencionadas se posicionarían en el mercado español como excelentes alternativas a las jeringas no homologadas utilizadas hasta el momento, ya que ambas tienen la indicación para uso intraocular, el marcado CE necesario para su uso en Europa, están libres de aceite de silicona y presentan un bajo o nulo espacio muerto, además del cono luer lock. Los componentes de estas jeringas son el polietileno y polipropileno y en el caso de las jeringas VitreJect® Ophthalmic han sustituido el aceite de silicona por ácido oleico como lubricante73.
Al utilizar jeringas sin aceite de silicona se minimizaría el riesgo de sedimentación de silicona en la cavidad vítrea de los pacientes, pero hay que tener en cuenta que las agujas para uso intraocular sí continúan utilizando aceite de silicona como lubricante (<0,25 mg/cm2)74. Algunos autores ponen de manifiesto que las agujas también liberarían cierto número de gotas de silicona (aunque en menor cantidad que las jeringas)47. No está claro si esto sería un factor determinante, puesto que la cantidad de silicona en las agujas es baja y externa, por lo que no entraría en contacto con el medicamento. Una vez estén implantadas en la práctica clínica asistencial estas nuevas jeringas, una línea futura de investigación sería comprobar si esta cantidad de silicona presente en las agujas es capaz de causar problemas relacionados con la liberación de silicona.
Otra posible vía de estudio sería comprobar si los lubricantes usados en las nuevas jeringas producen inconvenientes no estudiados hasta el momento, ya sean repercusiones en el paciente, como dificultades por parte del oftalmólogo para realizar la técnica.
Las limitaciones de este estudio se basan en la falta de revisión de otras bases de datos científicas o de artículos no indexados en ellas.
En conclusión, el uso de jeringas con aceite de silicona y sin aprobación para uso intraocular produce consecuencias no deseadas en la práctica clínica y puede ser sancionado a nivel legal. El uso off-label de estas jeringas ha sido una preocupación para los profesionales sanitarios durante años. Por esto, la inclusión de las jeringas Zero Residual™ 0,2 ml SiO-free y VitreJect® Ophthalmic Syringe en el mercado español supone un gran avance y una posible solución a los problemas estudiados en esta revisión.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Responsabilidad y cesión de derechosTodos los autores aceptamos la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (disponible en http://www.icmje.org/).
Los autores cedemos, en el supuesto de publicación, de forma exclusiva los derechos de reproducción, distribución, traducción y comunicación pública (por cualquier medio o soporte sonoro, audiovisual o electrónico) de nuestro trabajo a Farmacia Hospitalaria y por extensión ala SEFH. Para ello se firmará una carta de cesión de derechos en el momento del envío del trabajo a través del sistema online de gestión de manuscritos.
Declaración de contribución de autoría CRediTÁngela Pascual Carrasco: Conceptualización, Investigación, Metodología, Administración del proyecto, Supervisión, Validación, Redacción - borrador original. Isabel Espadas García: Conceptualización, Curación de datos, Análisis formal, Metodología, Validación, Redacción - borrador original. Ana Ramírez López: Conceptualización, Curación de datos, Validación, Visualización, Redacción - borrador original. Juan Selva Otaolaurruchi: Conceptualización, Metodología, Administración del proyecto, Recursos, Supervisión, Validación.