evaluar en pacientes con antecedentes de queratitis por el virus herpes simple las recurrencias oculares, agudeza visual, recurrencias no oculares, la queratitis estromal y los efectos adversos tras el tratamiento prolongado con agentes antivirales. Registrada en Prospero CRD42024556228.
Métodorevisión sistemática de ensayos identificados en CENTRAL, Embase, Medline, www.ClinicalTrials.gov y World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP) (www.who.int/ictrp). Se incluyeron ensayos de pacientes con antecedentes de al menos un episodio de queratitis por herpes simple. Los participantes debían estar libres de enfermedad herpética activa en el momento de inscribirse en el ensayo. Los ensayos debían incluir agentes antivirales orales y tópicos versus placebo u otros antivirales, administrados durante al menos 4 semanas. Se realizó una extracción de datos por pares con evaluación de riesgo de sesgo para cada ensayo usando Riesgo de Sesgo de Cochrane; se usó GRADE para proporcionar la certeza de evidencia de cada resultado.
Resultadosse encontraron 4 ensayos que incluyeron a 1.017 pacientes. Los antivirales en uso prolongado protegieron de las recurrencias de la enfermedad herpética ocular mejor que el placebo (RR 0,56; IC 95% 0,45-0,70) NNT 6 (4–11); aciclovir fue mejor que el placebo en esta misma acción (RR 0,59; IC 95% 0,46-0,74) NNT 8 (5–14), pero no diferente de valaciclovir (RR 1,0; IC 95% 0,37-2,70) NNT no calculado. El uso prolongado de antivirales disminuyó también las recurrencias de enfermedad herpética no ocular (RR 0,56; IC 95% 0,44-0,71) NNT 6 (5–11) y de recurrencias con queratitis estromal (RR 0,55; IC 95% 0,35-0,85) NNT 17 (10–50). No se encontraron datos sobre agudeza visual. En cuanto a los efectos adversos, no hubo diferencias entre intervenciones (RR 0,96; IC 95% 0,60-1,54) NNT no calculado. La certeza de evidencia fue alta para las recurrencias oculares y no oculares, y baja para efectos adversos, por imprecisión e inconsistencia de los hallazgos.
Conclusionesel uso prolongado de antivirales protege de recurrencias oculares, no oculares y queratitis estromal de forma segura. No se conocen los efectos sobre la agudeza visual.
To evaluate in patients with a history of keratitis by herpes simplex virus, ocular recurrences, visual acuity, non-ocular recurrences, stromal keratitis and adverse effects after prolonged treatment with antiviral agents. Registered in Prospero CRD42024556228.
MethodsSystematic review of trials identified in CENTRAL, Embase, Medline, www.ClinicalTrials.gov and World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP) (www.who.int/ictrp). Trials of patients with a history of at least one episode of herpes simplex keratitis were included. Participants had to be free of active herpetic disease at the time of enrollment in the trial. Trials had to include oral and/or topical antiviral agents versus placebo or other antivirals, administered for at least 4 weeks. A data extraction was performed by pairs with risk of bias assessment for each trial using Cochrane Risk of Bias; GRADE was used to provide the certainty of evidence for each outcome.
ResultsFour trials were found that included 1,017 patients. Antivirals in prolonged use protected from recurrences of ocular herpetic disease better than placebo (RR 0.56; 95% CI 0.45–0.70) NNT 6 (4–11); acyclovir was better than placebo in this same action (RR 0.59; 95% CI 0.46–0.74) NNT 8 (5–14), but not different from valacyclovir (RR 1.0; 95% CI 0.37–2.70) NNT not calculated. Prolonged use of antivirals also decreased recurrences of non-ocular herpetic disease (RR 0.56; 95% CI 0.44–0.71) NNT 6 (5–11) and recurrences with stromal keratitis (RR 0.55; 95% CI 0.35–0.85) NNT 17 (10–50). No data were found on visual acuity. Regarding adverse effects, there were no differences between interventions (RR 0.96; 95% CI 0.60–1.54) NNT not calculated. The certainty of evidence was high for ocular and non-ocular recurrences, and low for adverse effects, due to imprecision and inconsistency of the findings.
ConclusionsProlonged use of antivirals protects from ocular, non-ocular recurrences and stromal keratitis safely. The effects on visual acuity are not known.
El virus del herpes simple (VHS) es una de las principales causas de opacificación corneal y pérdida de visión relacionada con infecciones en EE. UU. y otros países de altos ingresos1. Después de la exposición inicial y primaria al VHS oftálmico, a menudo se produce una infección ocular asintomática y se establece una infección latente.
La queratitis por herpes simple (QHS) es una infección corneal por reactivación del VHS latente2. La QHS está causada principalmente por el VHS-1, siendo raramente el VHS-2 el causante3. La mayoría de los casos de QHS son recurrentes y pueden terminar en opacificación corneal4. La incidencia/prevalencia de la QHS se estima en aproximadamente 500.000 nuevos casos reportados anualmente en los EE. UU. y 1,5 millones de casos reportados a nivel mundial, incluidos 40.000 nuevos casos de discapacidad visual grave o ceguera5.
Las complicaciones del QHS recurrente incluyen principalmente la ceguera corneal debida a cualquier tipo de cicatrización o perforación, y el ojo seco6.
El manejo de la QHS recurrente incluye desde ningún tratamiento activo (antiviral), ya que los episodios son autolimitados incluso sin tratamiento farmacológico, hasta medicamentos antivirales que pueden mejorar los síntomas, pero no curar la infección («latencia de por vida»)2. Las opciones antivirales orales incluyen aciclovir, famciclovir y valaciclovir; y las opciones antivirales oftálmicas tópicas incluyen trifluridina (más comúnmente prescrita en los EE. UU.), ganciclovir y aciclovir (tratamiento de primera línea en Europa, pero no disponible en los EE. UU.).
Evaluar sistemáticamente la eficacia y seguridad de las opciones antivirales disponibles ayudaría a prevenir una de las principales causas de ceguera, mejorando la calidad de vida de los pacientes. Las guías recomiendan el uso de agentes antivirales (orales, oftálmicos tópicos o combinaciones de estos) para la prevención del herpes oftálmico recurrente7. Sin embargo, las guías están desactualizadas y, además, se basan en ensayos clínicos, no en una revisión sistemática.
El objetivo de esta revisión es examinar si los pacientes que han tenido un herpes simple ocular y que están en tratamiento antiviral prolongado, en comparación con placebo o con otros fármacos (incluidos diferentes antivirales) disminuyen las recurrencias de enfermedad ocular o no ocular por VHS, ven afectada su agudeza visual, tienen menos recurrencias de queratitis estromal y presentan más efectos adversos que con el comparador.
MétodosEl protocolo de esta revisión sistemática y metaanálisis se registró prospectivamente en PROSPERO (CRD42024556228)8. Los resultados se presentan de acuerdo con la guía de presentación de informes PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-analyses)9.
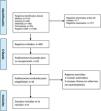
Tipos de estudiosSe incluyeron ensayos clínicos aleatorizados que incluyeron pacientes con antecedentes de al menos un episodio de infección ocular por VHS en uno o ambos ojos, sin diferencias de edad o sexo. No se consideró el primer episodio como enfermedad ocular por VHS recurrente, sino solo el(los) episodio(s) subsiguiente(s) de enfermedad ocular por VHS. Sin embargo, los participantes debían estar libres de enfermedad herpética activa antes y al momento de inscribirse en el ensayo. Los ensayos debían incluir agentes antivirales orales y tópicos frente a un agente antiviral oral y tópico oftálmico diferente de los utilizados en la intervención, placebo (oral o tópico) y ningún tratamiento activo. En el caso de ensayos con más de 2 brazos de intervención, no se utilizaron los brazos que no eran relevantes para la comparación realizada. No se incluyeron ensayos clínicos cruzados porque el resultado crítico puede aparecer mucho tiempo después de la finalización de la intervención, y porque no es posible evaluar si la prevención de la recurrencia se debió al primer o al segundo periodo de intervención (es decir, efecto de arrastre). Se incluyeron ensayos con una duración del tratamiento de al menos 4 semanas y al menos 3 meses de seguimiento.
Búsqueda de informaciónRegistro Cochrane de Ensayos Controlados (CENTRAL) en la Biblioteca Cochrane (último número); Embase.com (1947 hasta el 1 de junio 2024); Medline a través de PubMed (1948 hasta el 1 de junio 2024); Registro de Ensayos Clínicos en Curso de los Institutos Nacionales de Salud de EE. UU. ClinicalTrials.gov (www.ClinicalTrials.gov) y Plataforma de Registro Internacional de Ensayos Clínicos de la Organización Mundial de la Salud (OMS) (www.who.int/ictrp). Todos los registros se consultaron hasta el 1 de junio de 2024.
A fin de identificar la mayor cantidad de evidencia relevante posible, se hizo seguimiento de referencias de los estudios recuperados y de cualquier revisión sistemática identificada, para encontrar estudios adicionales que no se identificaron mediante las búsquedas electrónicas.
Palabras clave utilizadas en las búsquedasSe han realizado búsquedas con descriptores MESH y a texto libre, con diferentes combinaciones booleanas: [Keratitis, Herpetic], [Keratitis, Dendritic] [Herpes Simplex] [Eye Diseases] [Acyclovir] [Gancyclovir] [Valaciclovir] [Famciclovir]. [Randomized Controlled Trial]. Se adjunta como material adicional (Apéndice 1), diferentes estrategias de cada búsqueda con los filtros correspondientes y características de los estudios (Apéndice 2).
Selección de estudios y extracción de datosLa selección de los posibles estudios a incluir se realizó por 2 revisores de manera independiente utilizando el software Rayyan®. Tras revisar de forma independiente todos los títulos y resúmenes, se seleccionaron los estudios elegibles para revisar con lectura del texto completo, realizada nuevamente por 2 revisores, que decidieron si se incluían en la revisión, realizándose la extracción de los datos de estos por pares, así como la evaluación de los sesgos de cada estudio incluido. Los revisores extrajeron de forma independiente los datos de los estudios incluidos mediante una tabla de extracción de datos. Cuando hubo desacuerdos se resolvieron por consenso con un tercer revisor.
Resultados principalesLos resultados principales considerados fueron la proporción de participantes con VHS recurrente activa, el deterioro (reducción) de la mejor agudeza visual con corrección de gafas (BCVA), expresado como diferencias medias en la BCVA desde el inicio de 0.2LogMAR o 2 líneas en la tabla de Snellen, o proporción de participantes con reducción de la BCVA de al menos 0.2LogMAR o 2 líneas en la tabla de Snellen desde el inicio.
Resultados secundariosSe consideró la proporción de participantes con recurrencias de enfermedad por VHS no ocular, incluyendo, sin limitación, infección por herpes simple genital y orofacial; la proporción de participantes con enfermedad ocular por VHS recurrente que desarrollan queratitis estromal y la frecuencia de eventos adversos y de eventos adversos graves.
Riesgo de sesgo de los ensayosSe valoró el riesgo de sesgo de los ensayos incluidos, de acuerdo al consenso de ROB1 de Cochrane que incluye: generación de secuencia de aleatorización, ocultación de la misma, cegamiento de los participantes y del personal, cegamiento del evaluador del resultado, datos incompletos de los resultados, reporte selectivo de resultados y otros sesgos10,11.
Medidas de efectoPara medir el efecto de la intervención en las variables dicotómicas, se utilizó el riesgo relativo (RR) con intervalos de confianza del 95% (IC 95%). Se calculó el número necesario para tratar para un resultado beneficioso adicional (NNTB) a partir del RR. El NNT se calculó utilizando la fórmula NNT = 1/ACR*(1-RR), donde ACR, también conocido como riesgo basal o riesgo de que se produzca un evento, es el resultado de interés con la intervención comparadora. Para los resultados continuos, usamos las diferencias de medias con su respectivo IC del 95%11. Se usó el software Revman 5.4® para el cálculo de los estimadores.
Análisis de subgruposSe planteó la exploración de posibles fuentes de diferencias (si se disponía de más de 10 ensayos clínicos) en el efecto de la intervención sobre los resultados principales mediante los siguientes factores:
- •
Duración del tratamiento, considerando corto plazo menor de 6 meses; plazo medio 6–12 meses y largo plazo mayor de 12 meses.
- •
Punto temporal de análisis de resultados, considerando corto plazo, menor de 6 meses; plazo medio 6–12 meses y largo plazo mayor de 12 meses.
- •
Tipo de intervención, según si se usó solo agente antiviral oral; solo agente antiviral oftálmico tópico; o combinaciones de estos.
- •
Dosis del agente antiviral.
Realizamos una evaluación de la certeza general de la evidencia de acuerdo a GRADE12. Dos autores de la revisión evaluaron de forma independiente la certeza del conjunto de evidencia que incluía el riesgo de sesgo de los estudios, la imprecisión, efectos indirectos, inconsistencia y el posible riesgo de sesgo de publicación.
Tabla de resumen de resultadosSe prepararon tablas de resumen de hallazgos para cada resultado que presentaron los RR y el NNT con sus IC al 95% para los resultados predefinidos con la certeza de la evidencia de acuerdo a resumen global de resultados13.
ResultadosSe incluyeron 4 ensayos14–17 que agruparon un total de 1.017 pacientes con tamaños muestrales desde 5215 hasta 703 pacientes14. Las características de los estudios pueden verse en el anexo de información adicional. Todos los estudios proporcionaron datos de efectividad y de efectos adversos. Los pacientes de los ensayos estaban sin enfermedad activa herpética en el inicio de los ensayos, pero habían padecido uno o más episodios de queratitis herpética. La edad de los participantes no fue una limitación para esta revisión. Se excluyó una revisión sistemática18 y 5 ensayos19–23, pues todos ellos hacían referencia a pacientes con queratoplastia previa. En el Apéndice 1 pueden verse resumidas las características de los estudios incluidos y en el Apéndice 2 los perfiles de búsqueda para las diferentes bases de datos que se usaron.
Los estudios se realizaron en EE. UU., Italia y China, y fueron publicados entre 199414 y 201516. El seguimiento de los pacientes fue desde 12 hasta 32 meses16.
La tabla 1 recoge el riesgo de sesgo de los ensayos incluidos. No se declaró conflicto de intereses en 3 estudios15–17 y sí en uno14, que resultó ser el de menor riesgo de sesgo por su diseño y tamaño muestral.
Riesgo de sesgo de los ensayos incluidos
(a) Generación de secuencia de aleatorización (sesgo de selección).
(b) Ocultación de la secuencia (sesgo de selección).
(c) Cegamiento de los participantes y del personal (sesgo de intervención).
(d) Cegamiento del evaluador del resultado (sesgo de detección).
(e) Datos incompletos de los resultados.
(f) Reporte selectivo de resultados.
(g) Otros sesgos.
Las figuras 2 y 3 recogen respectivamente los resultados de eficacia y de seguridad, mientras que la tabla 2 presenta el perfil de evidencia de GRADE.
Perfil de evidencia de GRADE
| Número Ensayos(n) | ROB | Inc | Evi Ind | Imp | OC | nAntiv | nPlac | RR (IC 95%) | MD(IC 95%) | NNT | Cer |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Recurrencias de queratitis herpéticas: antivirales vs. placebo | |||||||||||
| 3 | Bajo | Bajo | Bajo | Bajo | Bajo | 97/523 | 144/449 | 0,56 (0,45–0,70) | −0,16 (−0,23−0,09) | 6 (4–11) | Alta |
| Recurrencias de queratitis herpéticas: aciclovir vs. placebo | |||||||||||
| 3 | Bajo | Bajo | Bajo | Bajo | Bajo | 87/465 | 131/422 | −0,59 (0,46–0,74) | −0,13 (0,19–0,07) | 8 (5–14) | Alta |
| Aciclovir vs. valaciclovir | |||||||||||
| 1 | Bajo | Bajo | Bajo | Serio | Bajo | 6/26 | 6/26 | 1,00 (0,37–2,7) | 0,00 (−0,23–0,23) | No se calcula | Mod |
| Recurrencias no oculares | |||||||||||
| 2 | Bajo | Bajo | Bajo | Bajo | Bajo | 80/405 | 139/394 | 0,56 (0,44–0,71) | −0,16 (−0,22−0,09) | 6 (5–11) | Alta |
| Recurrencias de queratitis estromal | |||||||||||
| 2 | Bajo | Bajo | Bajo | Bajo | Bajo | 28/405 | 50/394 | 0,55 (0,35–0,85) | −0,06 (−0,10−0,02) | 17 (10–50) | Alta |
| Cualquier efecto adverso | |||||||||||
| 4 | Bajo | Mod | Bajo | Bajo | Bajo | 31/549 | 27/468 | 0,96 (0,60–1,54) | 0,01 (−0,02−0,04) | No se calcula | Baja |
| Efectos adversos graves | |||||||||||
| 3 | Bajo | Mod | Bajo | Moderado | Bajo | 6/465 | 3/442 | 1,24 (0,31–4,88) | 0,01 (−0,03−0,05) | No se calcula | Baja |
Cer: Certidumbre; Evi Ind: Evidencia indirecta; Imp: Imprecisión; Inc: Inconsistencia; Mod: Moderado; OC: Otras consideraciones; ROB: Riesgo de sesgo de los ensayos.
Para la recurrencia de herpes simple ocular, se encontraron 3 estudios con 972 participantes13,15,16. Hubo una disminución en las recurrencias de herpes simple ocular en el grupo de los antivirales (RR 0,56; IC 95% 0,45-0,70; I2 = 0%; NNT 6; IC95% 4–11) (fig. 1A). La certeza de la evidencia para este resultado fue alta. Dentro de los antivirales, aciclovir fue el más estudiado, analizándose en 3 estudios con 887 pacientes13,15,16 y disminuyendo también las recaídas de herpes simple ocular (RR 0,59; IC 95% 0,46-0,74; I2 = 0%; NNT 8; IC 95% 5–14). Certeza de la evidencia alta (fig. 1B).
Solo se encontró un artículo comparando 2 antivirales entre sí (aciclovir vs. valaciclovir)15 con 52 pacientes, con certeza de evidencia moderada (tras bajar un escalón por imprecisión), en la que no se encontraron diferencias significativas en la disminución de la tasa de recurrencias oculares entre ambos (RR 1; IC 95% 0,37-2,70; I2 no aplicable) (fig. 1C).
El otro resultado principal previsto fue la disminución de la agudeza visual pero no se encontraron datos al respecto en ningún ensayo.
Resultados secundariosRespecto a las recurrencias herpéticas distintas a la ocular, también se mostró un efecto protector del tratamiento del aciclovir respecto del placebo con una certeza de evidencia alta: 2 estudios con 799 participantes14,17; RR 0,56; IC 95% 0,44-0,71; I2 = 0%; NNT 6 (IC95% 5–11) (fig. 1D). Certeza de la evidencia alta. Los NNT bajos sugieren que su administración es muy efectiva y que con pocos enfermos tratados (5–10) tendremos una recurrencia menor que si no hubiéramos tratado con antivirales.
Dado que la queratitis estromal es la que más probabilidad tiene de desarrollar lesiones que produzcan disminución visual permanente, esta se examinó también y se apreció en 2 estudios con 799 participantes14,17, coincidiendo con los resultados generales, una disminución de riesgo de este tipo de afectación: RR 0,55; IC 95% 0,35-0,85; I2 = 0%; NNT 17; IC 95% 10–50 (fig. 1E). Certeza de la evidencia alta.
Los tratamientos fueron bien tolerados, y no hubo diferencias entre grupos ni en la aparición de cualquier efecto adverso14–17 (4 estudios con 1.017 participantes, RR 0,96; IC 95% 0,60-1,54; I2 = 0%; certeza de la evidencia moderada ya que se bajaron 2 escalones, uno por imprecisión y otro escalón por inconsistencia) ni en efectos adversos graves (3 estudios14,16,17 con 907 participantes, RR 1,24; IC 95% 0,31-4,88; I2 0%; certeza de la evidencia baja; se bajó un escalón por imprecisión y otro por inconsistencia) (fig. 2A y 2B, respectivamente).
Se realizó análisis de sensibilidad para el resultado principal (antivirales vs. placebo). Tras eliminar el estudio de mayor tamaño muestral11, se obtuvo un RR 0,40 con IC 95% 0,27-0,58; I2 = 0%, lo que no cambia el sentido de la asociación y habla de la consistencia del análisis.
No se pudo realizar análisis de subgrupos ni se usaron instrumentos para descartar sesgo de publicación, por el limitado número de estudios.
DiscusiónExhaustividadNo en todos los ensayos se reportaron todos los resultados objeto del protocolo. Es llamativo que la agudeza visual no se reportara en ningún ensayo.
Certeza de la evidenciaLa certeza del conjunto de evidencia fue alta para los resultados de efectividad clínica y baja para los efectos adversos. Dentro del riesgo de sesgo que se produce en los ensayos por su diseño, las limitaciones del cegamiento en 3 de los 4 estudios no conllevaron una penalización en el mismo, dado que en la mayoría de las variables no afectaban al resultado. En la comparación de aciclovir frente a valaciclovir se bajó un escalón por imprecisión. En los 2 resultados de seguridad, se bajaron 2 escalones por imprecisión e inconsistencia, quedando en certeza baja.
Análisis de sensibilidadLa eliminación del estudio de más tamaño muestral y mejor diseño, no produce cambios en el resultado, manteniéndose el efecto protector de los antivirales frente a las recurrencias.
Concordancia y discordancia con otros estudios y revisionesEn el proceso de la búsqueda se ha encontrado una revisión sistemática Cochrane del año 2016 valorando las recurrencias con aciclovir frente a placebo en pacientes con queratoplastia18. La presente revisión apoya las conclusiones de la revisión Cochrane de 2016 que recomendaba el uso de antivirales para prevenir las recurrencias en pacientes con queratoplastia.
Discusión clínicaNo ha sido posible aclarar qué dosis ni cuánto tiempo deben administrarse estos fármacos para evitar recurrencias. Sin embargo, dado que la mayoría de los seguimientos son de un año como mínimo, parece prudente la administración de aciclovir (400 mg/12 h), ya que ha sido el fármaco más estudiado y prescrito en los ensayos durante al menos un año.
Por otro lado, también es interesante saber si interrumpir el antiviral se asocia a un aumento en las recurrencias. Los resultados obtenidos no permiten concluir nada a este respecto.
Planteamiento de la investigación futuraSería deseable diseñar ensayos clínicos con diferentes antivirales, a diferentes dosis y diferentes tiempos de seguimiento que además incluyeran resultados de la agudeza visual.
Con la información disponible podemos concluir que los antivirales protegen de recurrencias herpéticas oculares (y no oculares). El efecto protector se ha visto tanto para aciclovir como para otros antivirales (valaciclovir/ganciclovir). Parece prudente la administración de aciclovir (400 mg/12 h), ya que ha sido el fármaco más estudiado y prescrito en los ensayos durante al menos un año.
También podemos concluir que los efectos adversos de los antivirales son similares a los reportados en el grupo placebo.
Lo conocidoEl virus del herpes simple suele permanecer latente causando recurrencias frecuentes. La queratitis herpética es la principal causa de disminución de agudeza visual y ceguera en el mundo desarrollado.
Mas allá del tratamiento en la fase aguda no se administra tratamiento antiviral.
Aportación a la literatura científicaEl original es una revisión exhaustiva de la evidencia sobre la prevención de recurrencia de enfermedad herpética ocular con el uso de antivirales.
Este estudio revela que el uso prolongado de antivirales después de la fase aguda, reduce significativamente las recurrencias a la mitad.
No se han identificado efectos secundarios adicionales en los pacientes tratados. Está en consonancia con otros estudios que implicaban a enfermos con trasplantes de córnea.
FinanciaciónLos autores declaran que no recibieron financiación para la elaboración de este manuscrito.
Declaración de autoríaTodos los participantes han colaborado en las diferentes partes del desarrollo del mismo, desde la idea original a la búsqueda, selección de artículos, la extracción de datos y la evaluación de la calidad de cada estudio seleccionado. Todos los autores han participado de las versiones previas y de la versión final y cumplen requisitos de autoría.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.
Cesión de derechosTodos los autores ceden los derechos a Farmacia Hospitalaria.
Declaración de contribución de autoría CRediTLaura Ruiz Sifre: Writing – review & editing, Writing – original draft, Validation, Methodology, Formal analysis, Conceptualization. Sylvia Bort Martí: Writing – review & editing, Writing – original draft, Data curation, Conceptualization. Vicente Ruiz García: Writing – review & editing, Writing – original draft, Validation, Supervision, Formal analysis, Data curation, Conceptualization. Ángeles Ruth Bort Martí: Writing – review & editing, Writing – original draft, Validation, Methodology, Formal analysis, Conceptualization.