desarrollar un modelo de estratificación de riesgo para la atención farmacéutica (AF) de pacientes con tumores sólidos o hematológicos que requieran agentes antineoplásicos o tratamientos de soporte.
Métodoel modelo de estratificación de riesgo fue desarrollado de forma colaborativa por farmacéuticos oncológicos de la Sociedad Española de Farmacia Hospitalaria (SEFH). Se realizó mediante 3 talleres y un estudio piloto. Se definieron las variables, se agruparon en 4 dimensiones y se asignaron pesos relativos. En el estudio piloto se recogieron y analizaron los datos de los centros participantes para determinar los niveles de prioridad y evaluar las contribuciones de las variables. En el estudio se siguió el modelo piramidal de Kaiser Permanente, clasificando a los pacientes en 3 niveles de prioridad: prioridad 1 (AF intensiva, percentil 90), prioridad 2 (percentiles 60-90) y prioridad 3 (percentil 60). Los puntos de corte se determinaron en función de esta estratificación. Los centros participantes registraron las variables en una hoja de Excel, calculando las puntuaciones medias de peso para cada nivel de prioridad y la puntuación total de riesgo.
Resultadoslos participantes accedieron a cumplimentar un cuestionario que comprendía 22 variables agrupadas en 4 dimensiones: demográfica (puntuación máxima = 11); variables sociosanitarias y estado cognitivo y funcional (máximo = 19); clínica y utilización de servicios sanitarios (máximo = 25); y relacionada con el tratamiento (máximo = 41). A partir de los resultados de la aplicación del modelo a los 199 pacientes seleccionados, los puntos de corte para la categorización fueron 28 o más puntos para la prioridad 1, de 16 a 27 puntos para la prioridad 2 y menos de 16 para la prioridad 3; más del 80% de la puntuación total se basó en las dimensiones de «utilización de servicios clínicos y sanitarios» y «relacionada con el tratamiento». Se recomendaron intervenciones basadas en el modelo de AF para los pacientes con neoplasias sólidas o hematológicas, según su nivel de priorización.
Conclusióneste modelo de estratificación permite identificar a los pacientes oncológicos que requieren un mayor nivel de AF y favorece el ajuste de la capacidad asistencial. Es necesaria la validación del modelo en una población representativa para establecer su efectividad.
We aimed to develop of a risk stratification model for the pharmaceutical care (PC) of patients with solid or hematologic neoplasms who required antineoplastic agents or supportive treatments.
MethodThe risk stratification model was collaboratively developed by oncology pharmacists from the Spanish Society of Hospital Pharmacy (SEFH). It underwent refinement through three workshops and a pilot study. Variables were defined, grouped into four dimensions, and assigned relative weights. The pilot study collected and analyzed data from participating centers to determine priority levels and evaluate variable contributions. The study followed the Kaiser Permanente pyramid model, categorizing patients into three priority levels: Priority 1 (intensive PC, 90th percentile), Priority 2 (60th-90th percentiles), and Priority 3 (60th percentile). Cut-off points were determined based on this stratification. Participating centers recorded variables in an Excel sheet, calculating mean weight scores for each priority level and the total risk score.
ResultsThe participants agreed to complete a questionnaire that comprised 22 variables grouped into 4 dimensions: demographic (maximum score =11); social and health variables and cognitive and functional status (maximum = 19); clinical and health services utilization (maximum = 25); and treatment-related (maximum = 41). From the results of applying the model to the 199 patients enrolled, the cutoff points for categorization were 28 or more points for priority 1, 16 to 27 points for priority 2 and less than 16 for priority 3; more than 80% of the total score was based on the dimensions of ‘clinical and health services utilization’ and ‘treatment-related’. Interventions based on the pharmaceutical care model were recommended for patients with solid or hematological neoplasms, according to their prioritization level.
ConclusionThis stratification model enables the identification of cancer patients requiring a higher level of pharmaceutical care and facilitates the adjustment of care capacity. Validation of the model in a representative population is necessary to establish its effectiveness.
El cáncer está asociado a una creciente e importante carga debido al aumento de su incidencia, la mejora de la supervivencia y la rápida disponibilidad de nuevos tratamientos como los fármacos con dianas específicas (targeted molecules), la inmunoterapia o la terapia celular, que hacen su abordaje cada vez más complejo1. Al igual que ocurre con otras enfermedades crónicas, esta carga creciente, junto con las limitaciones de los recursos humanos y económicos, ha conducido a cambios en la prestación de la atención sanitaria y se ha pasado de un modelo de servicios sanitarios fragmentados a una atención más integrada2. Este modelo integral mejorará los resultados en salud, la efectividad y la sostenibilidad de los sistemas sanitarios2.
La atención sanitaria integral puede definirse como un enfoque que pretende reforzar sistemas sanitarios centrados en las personas mediante el fomento de una prestación integral de servicios de calidad a lo largo de la vida del individuo, diseñados de acuerdo con las necesidades multidimensionales de la población y de los individuos y prestados por un equipo multidisciplinar coordinado de profesionales que trabajan en distintos entornos y niveles de la atención sanitaria3. Los farmacéuticos oncológicos son una parte esencial del equipo multidisciplinar implicado en todos los aspectos de la atención a los pacientes con cáncer4. La evidencia demuestra que los pacientes se benefician de la participación del farmacéutico oncológico en términos de atención clínica, porque se mejora el cumplimiento terapéutico en los cuidados de soporte, se reducen los problemas relacionados con la medicación y se disminuye el riesgo de morbilidad relacionada con los medicamentos5. También benefician a los pacientes con las tareas de información, el aumento del uso de tecnologías y el ahorro de las costes5. Además de sus funciones tradicionales6, los farmacéuticos oncológicos, en España, son responsables de la preparación de los fármacos antineoplásicos parenterales, y de dispensar la mayoría de los antineoplásicos orales y algunos de los tratamientos de soporte.
Entre los modelos de atención integral, el modelo de Kaiser Permanente representa un modelo basado en poblaciones y consiste en la estratificación de la población y la prestación de servicios en función de las necesidades de los pacientes7. En este contexto, y con el objetivo de mejorar la atención farmacéutica (AF) de los pacientes crónicos, la Sociedad Española de Farmacia Hospitalaria (SEFH) publicó en 2012 el Plan estratégico de la Sociedad Española de Farmacia Hospitalaria sobre laAFal paciente crónico8. Se establecieron 6 grandes líneas de actuación, entre ellas, el «abordaje centrado en el paciente: la estratificación como herramienta del nuevo modelo asistencial», como un modo fundamental para mejorar la AF. En 2014, la SEFH estableció el Mapa Estratégico de la Atención Farmacéutica al Paciente Externo (MAPEX) con el objetivo de «contribuir a la mejora de la salud del paciente desde la dispensación y/o seguimiento farmacoterapéutico mediante una atención farmacéutica que añada valor al proceso asistencial y que promueva/permita la utilización efectiva, segura y eficiente de los medicamentos en el marco de una asistencia integral y continua»9. Estas iniciativas han llevado a la SEFH a desarrollar modelos de estratificación (ME) del riesgo para enfermedades específicas, como el ME de riesgo para pacientes crónicos pediátricos10 y para la AF de pacientes con VIH11.
La estratificación de los pacientes con neoplasias sólidas o hematológicas se estableció como una de las iniciativas estratégicas del proyecto MAPEX para la mejora de la AF en el contexto del aumento en el número de pacientes y la complejidad de los tratamientos.
Aquí presentamos el estudio piloto para el desarrollo de un ME de riesgo para la AF de los pacientes con neoplasias sólidas o hematológicas que requieren agentes antineoplásicos o tratamientos de soporte. El objetivo es identificar a aquellos pacientes que requieren el mayor nivel de AF para optimizar su tratamiento oncológico. El nivel de AF ofrecido debe ser proporcional a las necesidades de cada paciente.
MétodosEl ME de riesgo se desarrolló con la participación de un grupo de trabajo formado por 7 farmacéuticos oncológicos de centros de toda España con experiencia en la AF a pacientes con cáncer. La mayoría de ellos son miembros del Grupo Español de Farmacia Oncológica y Hematológica (GEDEFO), grupo de trabajo de la SEFH, y están acreditados por la Board Certified Oncology Pharmacist®,
El ME de riesgo se desarrolló a lo largo de un año aproximadamente, mediante 3 jornadas de trabajo presenciales y un trabajo de campo: estudio piloto.
La primera jornada tuvo lugar en junio de 2017 y se dedicó a definir las variables que se incluirían en el ME de riesgo a partir de las incluidas en modelos anteriores de la SEFH. Las variables se agruparon en 4 dimensiones: demográficas; sociosanitarias (estado cognitivo y funcional); clínicas y de uso de servicios sanitarios; y las relacionadas con la medicación. Se asignó a cada variable un peso relativo para medir el riesgo de acuerdo con la opinión experta de los participantes. El peso se puntuó de 1 a 4, en función de la relevancia estimada para evaluar el riesgo total del paciente, y las puntuaciones más altas expresaban una mayor relevancia.
El trabajo de campo, que hemos denominado estudio piloto, sirvió de base para la redefinición final del modelo que se estableció en la segunda jornada de trabajo en abril de 2018. Se debatieron cada una de las variables, su impacto y resultados. Se añadieron aclaraciones que favoreciesen su aplicación en el ámbito asistencial. Todas las decisiones se tomaron por unanimidad.
En mayo de 2018 se realizó la tercera jornada para definir las actuaciones del modelo de AF para pacientes ambulatorios con neoplasias malignas sólidas o hematológicas según los 3 niveles de prioridad y el diseño del estudio de validación. Las actuaciones en línea con los demás modelos de la SEFH implican un nivel de AF mucho más integral, con un elevado nivel de coordinación asistencial para los pacientes con un nivel de riesgo 1.
El estudio piloto es el núcleo de este trabajo, y la parte experimental del desarrollo de este modelo.
Entre noviembre de 2017 y febrero de 2018, se realizó este estudio de investigación con el objetivo de seguir el modelo piramidal de Kaiser Permanente y se establecieron 3 niveles de prioridad: prioridad 1, es decir, pacientes que requieren una AF más intensiva, incluidos los pacientes en el percentil 90; prioridad 2, pacientes entre los percentiles 60 y 90; y prioridad 3, pacientes en el percentil 60. Con base en dicha estratificación se establecieron los puntos de corte. Los centros participantes registraron la información sobre las variables incluidas en el modelo en una hoja de MS Excel. Se obtuvieron las puntuaciones medias ponderadas de cada nivel de prioridad para la puntuación total del ME de riesgo, así como para las puntuaciones de las 4 dimensiones del modelo. Se analizó la contribución de cada variable al ME mediante la exclusión de la variable del modelo y la evaluación del impacto de dicha exclusión en el número de pacientes que cambiarían de nivel de prioridad.
Dado que no existen referencias bibliográficas previas para determinar la muestra de pacientes necesaria en una poblacional total para establecer una seguridad y potencia dadas, que permitiría estimar el tamaño muestral del estudio de validación, se consideró el número de pacientes oncológicos y oncohematológicos atendidos en las consultas de farmacia hospitalaria. El grupo GEDEFO estimó 1.769 pacientes al año por hospital basándose en una encuesta12 realizada en 2016 en 95 centros, totalizando 168.055 pacientes al año. Con un margen de error del 5% y un nivel de confianza del 95%, el tamaño mínimo de la muestra para el estudio de validación debería ser de 664 pacientes.
Este estudio piloto se realizó como un estudio intermedio para determinar su posible futilidad. Se consideró suficiente incluir al menos al 10% del número total estimado de pacientes. Finalmente, con la participación de 7 hospitales, el análisis se realizó con el 25% del total estimado.
ResultadosEl modelo de estratificación de riesgoLos participantes aceptaron rellenar un cuestionario que incluía 22 variables. Las variables demográficas eran la edad, el peso y el estado de gestación; sumaban una puntuación máxima de 11. Las variables sociosanitarias incluían el estado cognitivo y funcional, así como información sobre hábitos de vida poco saludables, relaciones entre los profesionales sanitarios y el paciente, trastornos mentales, deterioro cognitivo y dependencia funcional. Para ello se recopiló información sobre los antecedentes de salud mental y síntomas psiquiátricos del paciente mediante herramientas como la Escala hospitalaria de ansiedad y depresión (HADS), la Escala visual analógica (EVA) de distrés de la NCCN (National Comprehensive Cancer Network) y la Escala ECOG (estado funcional y calidad de vida). Dichas variables sociales y de salud también incluían el grado de apoyo social y/o el estado socioeconómico; la puntuación máxima era de 19 puntos. Las variables clínicas y de uso de los servicios sanitarios incluían pluripatología y comorbilidades, variables analíticas u otros parámetros que pudieran tener un efecto en el ajuste de la dosis, un dolor mal controlado, ingresos hospitalarios, visitas al servicio de urgencias en el mes anterior, dificultades para tragar y número de líneas de tratamiento antineoplásico; la puntuación máxima era de 25 puntos. Las variables relacionadas con el tratamiento incluían la polifarmacia, los cambios en la vía de administración, la forma farmacéutica o hacia un genérico o biosimilar, modificaciones de la pauta de medicación habitual, el riesgo de la medicación, la complejidad de la pauta posológica, las interacciones, la toxicidad asociada al tratamiento, el cumplimiento terapéutico y el tratamiento en condiciones especiales; la puntuación máxima era de 44. Tras la segunda reunión, se decidió que los pacientes pediátricos, las pacientes embarazadas o los pacientes en situaciones sociales o económicas que no les permitiesen llevar a cabo el tratamiento de forma adecuada deberían categorizarse como prioridad 1, independientemente de la puntuación total en la herramienta. Las preguntas y los criterios para puntuar cada variable se muestran en la tabla 1.
Variables y pesos relativos del modelo de estratificación de la Sociedad Española de Farmacia Hospitalaria (SEFH) para pacientes con neoplasias malignas sólidas o hematológicas
| Ámbito de la variable | Variable | Definición | Pesoa | ||
|---|---|---|---|---|---|
| BLOQUE 1. Variables demográficas | Edad | Paciente pediátrico (0-18 años)b | 4 | ||
| Peso: riesgo nutricional | Determinación del porcentaje de pérdida de peso del paciente: el paciente presenta una pérdida de peso involuntaria >5% en los últimos 3 meses.(se registrará el peso actual del paciente y el peso de hace 3 meses. La herramienta calcula automáticamente el porcentaje de pérdida de peso) | 3 | |||
| Paciente embarazadab | 4 | ||||
| Puntuación máxima del bloque 1 | 11 puntos | ||||
| BLOQUE 2. Variables sociosanitarias y estado cognitivo y funcional | Estilo de vida poco saludable | Consumo de drogas y/o alcohol >17 DE/semana en las mujeres y >28 DE/semana en los hombres | 3 | ||
| Factores relacionados con la relación paciente-profesional sanitario | Paciente con barreras culturales y/o de comunicación | 2 | |||
| Trastornos mentales, deterioro cognitivo y dependencia funcional | Paciente con antecedentes psiquiátricos, incluida la depresión | 2 | |||
| Paciente con síntomas de ansiedad, depresión y/o distrés (tristeza, preocupación y angustia)c | |||||
| Cuestionario HADS(Con fines informativos, se registrará la puntuación del cuestionario HADS) | Puntuación del cuestionario ≥15. Puntuaciones de depresión (ítems pares) o ansiedad (ítems impares) >10 | 3 | |||
| Puntuación del cuestionario ≥15. Puntuaciones de depresión (ítems pares) o ansiedad (ítems impares) <10 | 2 | ||||
| Escala visual analógica (EVA) de distrés de la NCCN (Con fines informativos, se registrará la puntuación de la EVA de distrés) | EVA de distrés = 7-10 | 3 | |||
| EVA de distrés = 5-6 | 2 | ||||
| Deterioro cognitivo: en caso de sospecha de dificultad para comprender, la determinación del deterioro cognitivo se realizará mediante el Índice de Pfeiffer (SPMSQ, Short Portable Mental Status Questionnaire).(Para efectos informativos, se registrará la puntuación del Índice de Pfeiffer) | El paciente puede leer y escribir | Errores del cuestionario ≥3 | 2 | ||
| El paciente no sabe leer ni escribir | Errores en el cuestionario ≥4 | 2 | |||
| Dependencia funcional: ECOG-PS (A efectos informativos, se registrará la puntuación ECOG-PS) | ECOG-PS = 3 | 3 | |||
| ECOG-PS = 2 | 2 | ||||
| Apoyo social y condiciones socioeconómicas | Paciente sin apoyo social y/o con condiciones socioeconómicas que no le permiten llevar a cabo el tratamiento adecuadamenteb | 4 | |||
| Puntuación máxima del bloque 2 | 19 puntos | ||||
| BLOQUE 3. Variables clínicas y de utilización de servicios sanitarios | Pluripatología/comorbilidades | El paciente padece 2 o más enfermedades crónicas (excluidas las neoplasias malignas) | 4 | ||
| Variables analíticas y otros parámetros que influyen en el ajuste de la dosis | El paciente tiene alteradas las variables analíticas y otros parámetros que afectan al ajuste de la dosis (por ejemplo, alteraciones hepáticas, alteraciones renales, FEV1 y toxicidad asociada al fármaco) | 4 | |||
| Paciente con un mal control del dolor | Determinación de la intensidad del dolor mediante la escala EVA. Un mal control se define por una puntuación de la EVA del dolor ≥7.(Con fines informativos, se registrará la puntuación de la EVA del dolor) | 4 | |||
| Número de hospitalizaciones y visitas a urgencias | El paciente ha tenido al menos un ingreso/visita a urgencias en el último mes | 1 | |||
| Dificultad para tragar | El paciente presenta dificultades para tragar | 4 | |||
| Líneas de tratamiento | Primera línea de tratamientob o cambio de tratamiento | 4 | |||
| Tercera línea de tratamiento o posterior | 4 | ||||
| Puntuación máxima del bloque 3 | 25 puntos | ||||
| BLOQUE 4. Variables relacionadas con el tratamiento | Polifarmacia | El paciente toma 6 o más medicamentos (tratamiento domiciliario), entendiendo como medicamento la forma farmacéutica acompañada de dosis y vía (excluyendo el tratamiento que forma parte del proceso oncológico) | 3 | ||
| Cambio de la vía de administración o forma farmacéutica, cambio a un genérico o biosimilar | 1 | ||||
| Modificación del régimen de medicación habitual | El paciente, debido a su situación clínica, ha precisado un ajuste o retraso de las dosis de medicación antineoplásica en los últimos 2 meses | 4 | |||
| Riesgo de medicación | Además del tratamiento antineoplásico, el paciente toma algún otro fármaco de alto riesgo (incluido en la lista española ISMP de medicamentos de alto riesgo en pacientes crónicos y/o en la lista americana ISMP de fármacos ambulatorios de alto riesgo) | 3 | |||
| El paciente toma medicamentos con condiciones especiales de almacenamiento/conservación (por ejemplo, medicamentos que requieren una determinada temperatura, protección frente a la luz, condiciones de humedad, etc.) | 1 | ||||
| Complejidad del régimen posológico | El paciente toma un medicamento antineoplásico oral (excluidos los cuidados de soporte) en un régimen discontinuo. Por ejemplo, capecitabina, sunitinib. | 2 | |||
| El paciente toma 2 o más fármacos antineoplásicos orales (excluidos los cuidados de soporte) con horarios discontinuos y/o diferentes horarios de administración. Por ejemplo: lapatinib + capecitabina; MPV, KRD; lena + dexa; palbociclib + letrozol; palbociclib + fulvestrant; abiraterona + prednisona | 4 | ||||
| Interacciones.Se utilizará la base de datos Lexicomp o Medinteract | Consulta de interacciones con productos de MCA | 3 | |||
| Inicio de tratamiento oncológico con un perfil farmacocinético complejo | 3 | ||||
| Interacciones de nivel C | 3 | ||||
| Interacciones de nivel D o X | 4 | ||||
| Toxicidad asociada al tratamiento | El paciente ha presentado/presenta toxicidad asociada al tratamiento de grado ≥2 en los últimos 3 ciclos.Evaluación de la toxicidad mediante la Escala de Criterios Comunes de Toxicidad (CTC) del Instituto Nacional del Cáncer (NCI) estadounidense | 4 | |||
| Cumplimiento del tratamiento | Si existe sospecha o evidencia de que el paciente no cumple con su tratamiento oncológico, determinación del cumplimiento terapéutico mediante 2 métodos de validación indirecta: registros de dispensación informatizados + Cuestionario Morinsky-Green-Levine | Paciente sin cumplimiento terapéutico: registro de dispensación ≤90% y en cuestionario no responde correctamente a ninguna de las 4 preguntas | 4 | ||
| Tratamiento en condiciones especiales | Paciente en ensayo clínico | 4 | |||
| Paciente con tratamiento de uso especial | 3 | ||||
| Paciente con tratamiento comercializado recientemente (primer año de autorización) | 2 | ||||
| Puntuación máxima del bloque 4 | 41 puntos | ||||
EVA: escala analógica visual; ECOG-PS: Escala ECOGS sobre el estado funcional; HADS: Hospital Anxiety Depression Scale; MCA: Medicina complementaria y alternativa; NIMF: Institute for Safe Medication Practices; SEFH: Sociedad Española de Farmacia Hospitalaria.
Nota: La herramienta también está disponible para socios de la SEFH en: https://www.sefh.es/mapex/documentacion.php.
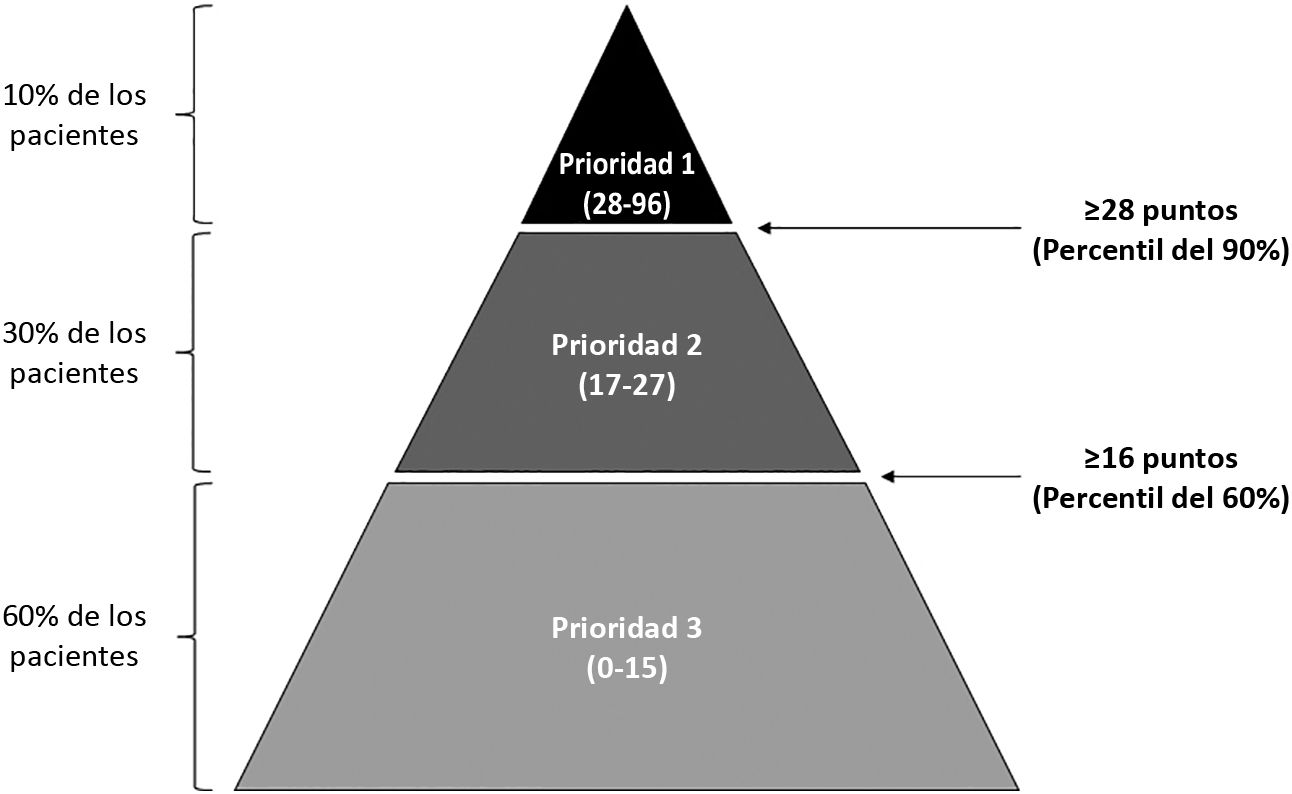
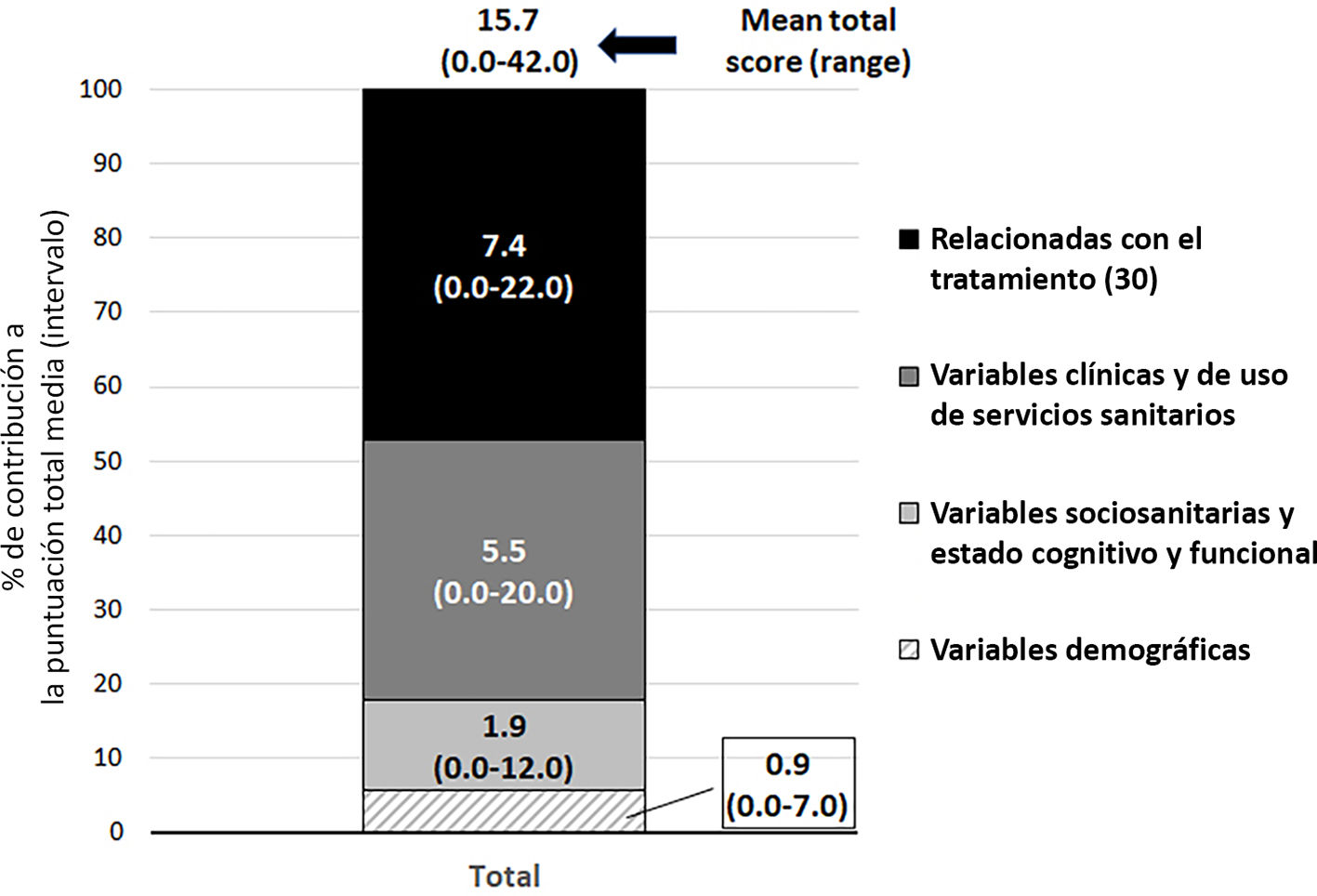
Los 7 centros participantes incluyeron a 199 pacientes cuyas características se presentan en la tabla suplementaria 1. La mayoría de los pacientes tenían más de 50 años y estaban distribuidos por igual en cuanto al sexo. Las neoplasias malignas más frecuentes fueron el cáncer colorrectal (n = 44; 22%), el cáncer de mama (n = 33; 16,5%), el cáncer de pulmón (n = 20; 10%), el cáncer de próstata (n = 13; 6,5%) y el mieloma múltiple (n = 10; 5%). De los 199 pacientes, 18 se categorizaron como prioridad 1, 59 como prioridad 2 y 122 como prioridad 3. Los puntos de corte resultantes para dicha categorización fueron 28 puntos como mínimo para la prioridad 1, entre 16 y 27 puntos para la prioridad 2 y menos de 16 puntos para la prioridad 3 (fig. 1). La puntuación media total y las puntuaciones medias de las 4 dimensiones de la herramienta para la muestra total se presentan en la figura 2; más del 80% de la puntuación total de riesgo se basó en las dimensiones de «variables clínicas y de uso de servicios sanitarios» y «variables relacionadas con el tratamiento» (fig. 2).
Distribución de las puntuaciones ponderadas para la muestra total.
Los números dentro de las columnas representan las puntuaciones medias ponderadas y entre paréntesis, el rango de puntuación. La altura de la columna representa el porcentaje de la contribución de la dimensión correspondiente a la puntuación media total. En las leyendas, entre paréntesis, aparece la puntuación máxima para cada dimensión de la herramienta de estratificación del riesgo.
Nota del traductor. Punto decimal debe cambiarse a coma decimal en todos los números.
En la tabla 1 se muestra la distribución de los pacientes de acuerdo con la puntuación de cada variable y el impacto de la exclusión de una variable en la categorización del nivel de prioridad, tal y como se definió anteriormente. Hubo variables que puntuaron en una minoría de pacientes (es decir, <5%), a saber, «embarazo», «estilo de vida poco saludable», «factores relacionados con la relación paciente-profesional sanitario», «deterioro cognitivo» y «adhesión al tratamiento» (tabla 2 complementaria). Las variables que tuvieron mayor impacto en la categorización de la prioridad (es decir, cuya exclusión cambió el nivel de prioridad en ≥3% de los pacientes) fueron: «pluripatología/comorbilidades» (n = 24; 12,1%), «variables analíticas y otros parámetros que repercuten en el ajuste de la dosis» (n = 20; 10,1%), «modificación del régimen de medicación habitual» (n = 18; 9,0%), «fármacos de alto riesgo» (n = 18; 9,0%), «toxicidad asociada al tratamiento» (n = 18; 9,0%), «polifarmacia» (n = 17; 8,5%), «interacciones» (n = 15; 7,5%), «primer ciclo de tratamiento o cambio de tratamiento» (n = 14; 7,0%), «tercera línea de tratamiento o posterior» (n = 13; 6,5%), «fármacos antineoplásicos con pauta discontinua» (n = 10; 5,0%), «dificultad para tragar» (n = 8; 4,0%) y «riesgo nutricional» (n = 8; 4,0%).
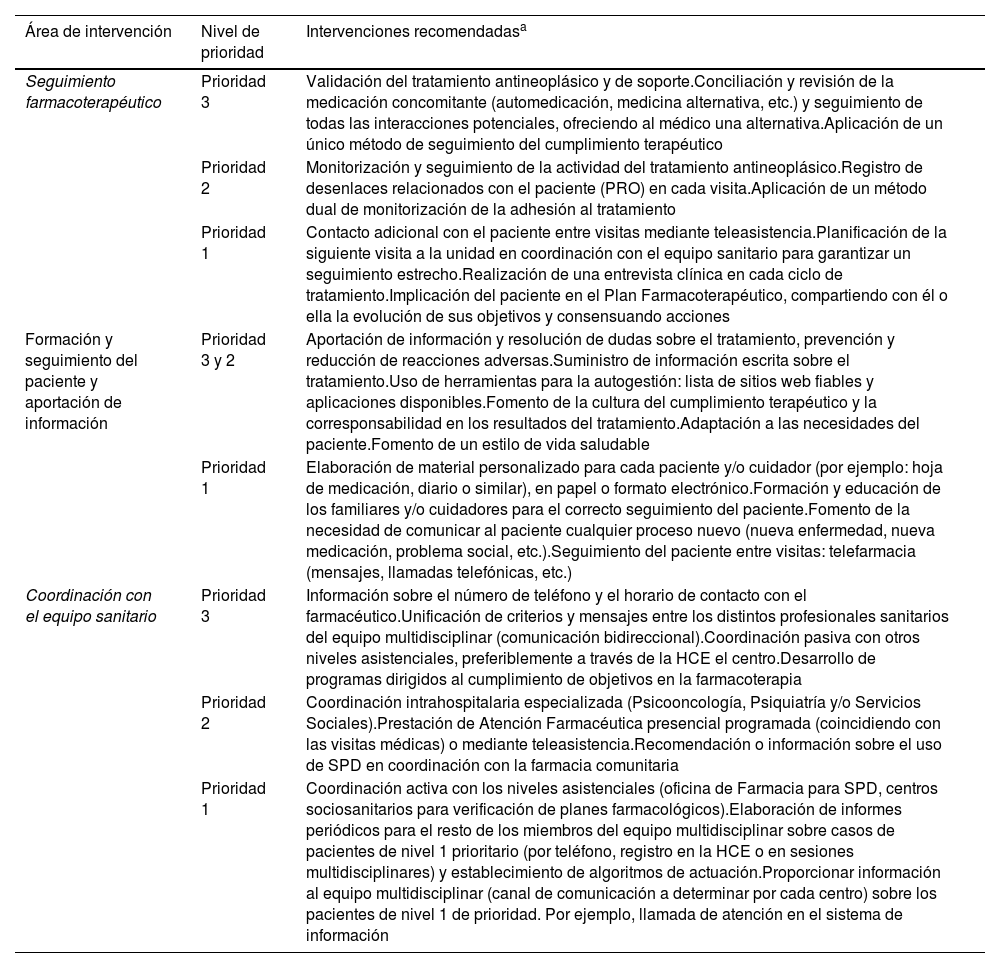
Intervención principal de atención farmacéutica según el área de intervención y el nivel de prioridad
| Área de intervención | Nivel de prioridad | Intervenciones recomendadasa |
|---|---|---|
| Seguimiento farmacoterapéutico | Prioridad 3 | Validación del tratamiento antineoplásico y de soporte.Conciliación y revisión de la medicación concomitante (automedicación, medicina alternativa, etc.) y seguimiento de todas las interacciones potenciales, ofreciendo al médico una alternativa.Aplicación de un único método de seguimiento del cumplimiento terapéutico |
| Prioridad 2 | Monitorización y seguimiento de la actividad del tratamiento antineoplásico.Registro de desenlaces relacionados con el paciente (PRO) en cada visita.Aplicación de un método dual de monitorización de la adhesión al tratamiento | |
| Prioridad 1 | Contacto adicional con el paciente entre visitas mediante teleasistencia.Planificación de la siguiente visita a la unidad en coordinación con el equipo sanitario para garantizar un seguimiento estrecho.Realización de una entrevista clínica en cada ciclo de tratamiento.Implicación del paciente en el Plan Farmacoterapéutico, compartiendo con él o ella la evolución de sus objetivos y consensuando acciones | |
| Formación y seguimiento del paciente y aportación de información | Prioridad 3 y 2 | Aportación de información y resolución de dudas sobre el tratamiento, prevención y reducción de reacciones adversas.Suministro de información escrita sobre el tratamiento.Uso de herramientas para la autogestión: lista de sitios web fiables y aplicaciones disponibles.Fomento de la cultura del cumplimiento terapéutico y la corresponsabilidad en los resultados del tratamiento.Adaptación a las necesidades del paciente.Fomento de un estilo de vida saludable |
| Prioridad 1 | Elaboración de material personalizado para cada paciente y/o cuidador (por ejemplo: hoja de medicación, diario o similar), en papel o formato electrónico.Formación y educación de los familiares y/o cuidadores para el correcto seguimiento del paciente.Fomento de la necesidad de comunicar al paciente cualquier proceso nuevo (nueva enfermedad, nueva medicación, problema social, etc.).Seguimiento del paciente entre visitas: telefarmacia (mensajes, llamadas telefónicas, etc.) | |
| Coordinación con el equipo sanitario | Prioridad 3 | Información sobre el número de teléfono y el horario de contacto con el farmacéutico.Unificación de criterios y mensajes entre los distintos profesionales sanitarios del equipo multidisciplinar (comunicación bidireccional).Coordinación pasiva con otros niveles asistenciales, preferiblemente a través de la HCE el centro.Desarrollo de programas dirigidos al cumplimiento de objetivos en la farmacoterapia |
| Prioridad 2 | Coordinación intrahospitalaria especializada (Psicooncología, Psiquiatría y/o Servicios Sociales).Prestación de Atención Farmacéutica presencial programada (coincidiendo con las visitas médicas) o mediante teleasistencia.Recomendación o información sobre el uso de SPD en coordinación con la farmacia comunitaria | |
| Prioridad 1 | Coordinación activa con los niveles asistenciales (oficina de Farmacia para SPD, centros sociosanitarios para verificación de planes farmacológicos).Elaboración de informes periódicos para el resto de los miembros del equipo multidisciplinar sobre casos de pacientes de nivel 1 prioritario (por teléfono, registro en la HCE o en sesiones multidisciplinares) y establecimiento de algoritmos de actuación.Proporcionar información al equipo multidisciplinar (canal de comunicación a determinar por cada centro) sobre los pacientes de nivel 1 de prioridad. Por ejemplo, llamada de atención en el sistema de información |
HCE: historial clínico electrónico; SPD: sistema personalizado de dosificación.
En la tabla 2 se resumen las recomendaciones de los expertos, y que constituyen el modelo de intervención en AF para pacientes con neoplasias malignas sólidas o hematológicas según los niveles de prioridad.
DiscusiónEn el contexto actual con el aumento del número y duración de los tratamientos oncológicos, así como la limitación de los recursos sanitarios, el ME para pacientes con cáncer desarrollado es, hasta donde sabemos, la primera herramienta diseñada para seleccionar a los pacientes en función del grado de AF necesaria. Los modelos actuales que definen el riesgo de los pacientes con cáncer se basan principalmente en la evaluación del riesgo de progresión de tipos específicos de cáncer o en la dificultad para realizar procesos diagnósticos a tiempo que no comprometan el pronóstico del paciente.
El éxito del tratamiento del cáncer depende de la participación activa de los pacientes en el tratamiento. Para ello, la atención multidisciplinar es el punto de partida y es necesario ofrecer una AF adaptada a las necesidades de cada paciente ya que la disponibilidad de los recursos es limitada.
Entre los factores que influyen en el cumplimiento terapéutico de los pacientes con cáncer cabe mencionar los factores demográficos, sociales, de salud y cognitivos, así como los factores clínicos relacionados con el uso de los servicios sanitarios13. Para desarrollar este modelo piloto de ME de riesgo y mantener la coherencia con los demás ME desarrollados por la SEFH11, tuvimos en cuenta la mayoría de esos factores a la hora de seleccionar a los pacientes que pueden beneficiarse de una AF más intensiva.
Nuestros resultados muestran que varias variables parecen contribuir al ME de riesgo, entre ellas el «embarazo», un «estilo de vida poco saludable», «factores relacionados con la relación paciente-profesional sanitario», el «deterioro cognitivo» y el «cumplimiento terapéutico». En nuestra opinión, estas variables son clave para la selección de pacientes especiales y con más necesidades, porque son importantes para alcanzar los objetivos terapéuticos. Es posible que el peso relativamente bajo en nuestro modelo sea consecuencia de la baja frecuencia de este tipo de pacientes. Así, se estima que aproximadamente uno de cada 1.000 embarazos se produce en pacientes con cáncer14. En el caso de que no pueda retrasarse el tratamiento oncológico en una paciente embarazada, deberá realizarse un seguimiento exhaustivo para responder y minimizar la toxicidad de la quimioterapia. Eso implicará seleccionar los fármacos más adecuados durante el embarazo e intentar reducir la exposición del feto porque los efectos secundarios de la quimioterapia pueden tener consecuencias de por vida15. En este escenario, el papel del farmacéutico oncológico es especialmente importante en el diseño del plan terapéutico de la paciente. Por eso, en nuestro modelo el embarazo eleva el riesgo de la paciente a prioridad 1, lo que indica su necesidad de una AF más completa.
En cuanto a las variables que presentan un peso relativamente bajo en nuestro modelo, exponemos a continuación las razones para mantenerlas en el mismo. «Estilo de vida poco saludable» se definió en función del consumo de drogas y/o alcohol; se trata de factores bien conocidos y asociados a la falta de cumplimiento terapéutico16, por lo que consideramos que no podían descartarse en nuestra herramienta. Las malas «relaciones paciente-profesional sanitario» se consideran uno de los principales determinantes de la falta de cumplimiento terapéutico17. Las intervenciones dirigidas a mejorar la comunicación paciente-profesional mejoran el cumplimiento terapéutico en la quimioterapia oral18. Algunos tratamientos contra el cáncer se asocian a un deterioro cognitivo19, que a su vez puede condicionar las actividades diarias, incluido el cumplimiento terapéutico y/o de las recomendaciones médicas. El uso del índice de Pfeiffer en las consultas de farmacia oncológica no es habitual, pero puede facilitar la detección precoz del deterioro cognitivo y ha sido recomendado por expertos para evaluar la función cognitiva en este entorno20. La falta de cumplimiento terapéutico está relacionada con la falta de respuesta, por ejemplo, en los pacientes con leucemia mieloide crónica21. Aunque hay datos ligeramente distintos según el diagnóstico, la evidencia sugiere que el cumplimiento terapéutico en las terapias antineoplásicas orales es un problema para una proporción importante de pacientes22 y los programas coordinados por farmacéuticos son capaces de mejorar la adherencia a la quimioterapia oral23. Por lo tanto, el seguimiento del cumplimiento terapéutico es imperativo en los pacientes que reciben fármacos antineoplásicos orales, aunque los resultados del seguimiento dependan en gran medida del método de evaluación24. En nuestra herramienta de estratificación, si existe «sospecha de no adherencia» el cumplimiento terapéutico se evalúa mediante 2 métodos: uno cuantitativo y otro cualitativo. Sin embargo, existe evidencia de que los profesionales sanitarios sobrestiman el cumplimiento terapéutico de los pacientes25; por lo tanto, será necesario minimizar el sesgo de interpretación en este elemento.
Las variables que más afectan al nivel de prioridad fueron la «pluripatología/comorbilidades», «variables analíticas y otros parámetros que repercuten en el ajuste de la dosis», «modificación de la pauta de medicación habitual», «fármacos de alto riesgo», «toxicidad asociada al tratamiento», «polifarmacia», «interacciones», «primer tratamiento o cambio de tratamiento», «tercera línea de tratamiento o posterior», «fármacos antineoplásicos con pauta discontinua», «dificultad para tragar» y «riesgo nutricional». Estos resultados no son sorprendentes, ya que la gran mayoría de ellos están directamente relacionados con la terapia antineoplásica y su complejidad, incluidos la duración y el grado de toxicidad. En cuanto a las comorbilidades, aproximadamente la mitad de los pacientes con cáncer las presentan, pudiendo afectar el desarrollo, el estadio en el momento del diagnóstico, el tratamiento y el desenlace clínico en los pacientes con cáncer, incluida la supervivencia26. Los ajustes de dosis están relacionados con la toxicidad del tratamiento antineoplásico y compromete la intensidad de la dosis, lo que se ha asociado a una menor supervivencia global27. Las interacciones farmacológicas suponen un riesgo para la seguridad del paciente y la eficacia clínica y, en última instancia, pueden afectar a la calidad de vida de los pacientes28. El papel del farmacéutico oncológico es esencial a la hora de detectar las interacciones con medicamentos o con productos de medicina complementaria. El panel de expertos consideró que un paciente que recibe más de 3 líneas de tratamiento para una enfermedad avanzada tiene más probabilidades de sentirse desmotivado y, por lo tanto, es más difícil mantener el cumplimiento terapéutico. El primer tratamiento oncológico también puede ser más complejo, ya que requiere una adaptación rápida al diagnóstico de cáncer y sus consecuencias. La disfagia está relacionada con diversas afecciones, el tipo de neoplasia, la cirugía, la quimioterapia y la radioterapia, así como con las terapias más recientes como los inhibidores del receptor del factor de crecimiento epidérmico. Reconocer las dificultades de deglución es importante para adaptar el tratamiento y recomendar ejercicios o tratamientos específicos para las complicaciones orales concomitantes. La dificultad para tragar tiene un impacto directo en la calidad de vida de los pacientes con cáncer29. La desnutrición es frecuente en estos pacientes y se debe tanto a la presencia del tumor como a los tratamientos médicos y quirúrgicos para tratar la neoplasia. Tiene un impacto negativo en la calidad de vida y en la toxicidad del tratamiento, y se ha estimado que hasta un 10-20% de los pacientes con cáncer mueren debido a la desnutrición y no a la neoplasia. Existen pruebas de que desde el momento del diagnóstico de cáncer, deben tenerse en cuenta las cuestiones nutricionales y se debe evaluar el riesgo nutricional del paciente, algo que recomiendan las directrices ESPEN30.
Los puntos fuertes de este proyecto incluyen el hecho de que el grupo de expertos está compuesto por farmacéuticos oncológicos, en su mayoría certificados por BCOP y con más de 5 años de experiencia en este campo. Además, todos son miembros activos de GEDEFO, trabajan en hospitales de distintos niveles y están ubicados en diferentes regiones de España. Este modelo piloto se ha desarrollado a partir de las opiniones de expertos para crear un marco que englobe todos los factores que influyen en las crecientes necesidades asistenciales de los pacientes con cáncer. Se han establecido puntos de corte para identificar a los pacientes que requieren mayor nivel de AF.
Sin embargo, el modelo requiere la validación en una población representativa. Ya se ha realizado un estudio con más de 800 pacientes procedentes de 14 centros hospitalarios y los resultados se publicarán por separado. El modelo define actuaciones de AF que están en consonancia con las establecidas en otros modelos de la SEFH, lo cual es un objetivo final; además, es crucial evaluar si la aplicación de estas actuaciones mejora el desenlace clínico en los pacientes con cáncer.
Contribución a la literatura científicaEste estudio representa la primera aproximación publicada para dimensionar un aspecto de la atención sanitaria a las necesidades del paciente oncológico.
Se trata de un modelo integral que, una vez validado en una población representativa, se incorporará a la cartera de servicios de farmacia oncológica hospitalaria, permitiendo adecuar las mejores prácticas de atención farmacéutica oncológica a las necesidades de los pacientes.
Responsabilidades éticasNuestro estudio observacional no intervencionista se realizó de acuerdo con la Declaración de Helsinki y fue aprobado por el Comité Ético del Hospital Universitari Arnau de Vilanova (Lleida, España) y por la Agencia Española del Medicamento como un estudio observacional, sin poscomercialización. Se obtuvo el consentimiento informado por escrito de todos los pacientes incluidos en el estudio piloto.
En el presente trabajo se han tenido en cuenta las instrucciones para la presentación de manuscritos y las responsabilidades éticas.
FinanciaciónLa Sociedad Española de Farmacia Hospitalaria ha financiado el desarrollo de MAPEX. Se ha contado con el apoyo de la consultora ASCENDO y Fernando Rico-Villademoros ha colaborado en la redacción del manuscrito.
AutoríaTodos los autores abajo firmantes cumplen los requisitos de autoría.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses relacionado directa o indirectamente con el contenido del manuscrito.
AgradecimientosLos autores agradecen a la SEFH, el esfuerzo del desarrollo e implementación del MAPEX. Agradecen a los coordinadores del MAPEX, su visión y trabajo. Especialmente a Ramón Morillo por su trabajo colaborativo y su inspiración. A Fernando Rico-Villademoros, su ayuda en la preparación de un borrador de este manuscrito. El soporte en el desarrollo de la Herramienta de Estratificación, a la consultora ASCENDO, especialmente a Dolores Mateos, Ana Martinho y Alicia Olivas.
A todos los hospitales donde se ha desarrollado esta investigación, especialmente a los investigadores colaboradores de cada hospital que han hecho posible este trabajo. Del Hospital Arnau de Vilanova, Lleida: Marta Gilabert Sotoca y Judith Rius Perera; del Hospital Clínico Universitario de Santiago de Compostela: Manuel Tourís Lores, Elena López Montero, Goretti Durán Piñeiro, Sara Blanco Dorado, Alicia Mosquera Torre, Bibiana Sánchez Iglesias, Eugenia Giugovaz y María Jesús Lamas Díaz; del Hospital Universitario Marqués de Valdecilla: María Ochogavía Sufrategui; del Hospital Clínico Universitario Virgen de la Arrixaca: Laura Menéndez Naranjo y Almudena Mancebo González; del Hospital Universitario Virgen de la Macarena: Úrsula Baños Roldán; del Hospital Corporació de Salut del Maresme i la Selva, Calella, Anna Estefanell Tejero, Dolores Ruíz Poza y Nuria Sabaté Frías; y del Hospital Universitario Puerta del Mar, Cádiz. España: María José Huertas Fernández.
Y los autores a agradecen a los pacientes y familiares que son atendidos cada día en las consultas de farmacia oncológica y oncohematológica, por su disposición y colaboración siempre con nuestros proyectos, especialmente a cada paciente incluido en este estudio.