dalbavancina está aprobada para infecciones bacterianas agudas de la piel y las partes blandas, pero su uso fuera de ficha técnica en infecciones crónicas complejas se ha extendido. Actualmente, no hay una pauta establecida para este tipo de infecciones; al ser necesarios tratamientos muy prolongados, una estrategia basada en el ajuste de dosis mediante monitorización terapéutica de fármacos puede optimizar su uso e individualizar la pauta. Esta revisión sistemática analiza la dosificación de dalbavancina en infecciones complejas y las estrategias basadas en la monitorización terapéutica de fármacos para optimizar el tratamiento.
Material y métodosse realizó una búsqueda en PubMed, Embase, Scopus y Cochrane Library (2014–2024) con las palabras clave: «dalbavancin», «pharmacokinetics», «pharmacodynamics» «therapeutic drug monitoring» y «TDM». Tres revisores independientes seleccionaron y evaluaron los estudios. Se incluyeron estudios clínicos relacionados con la farmacocinética de dalbavancina y el uso de monitorización terapéutica en infecciones complejas que requieren pautas prolongadas. Los datos se analizaron cualitativamente debido a la heterogeneidad entre estudios.
Resultadosse identificaron 241 artículos, de los cuales, tras eliminar duplicados y aplicar criterios de inclusión y exclusión, se incluyeron 10. Estos estudios presentaron heterogeneidad en el diseño (6 retrospectivos y 4 prospectivos) y el tamaño muestral, abarcando un total de 457 pacientes y 1.298 muestras. La mayoría se centraron en infecciones osteoarticulares, tratadas con dalbavancina en regímenes de 2 dosis iniciales de 1.500 mg separadas por una semana, con ajuste de dosis posteriores según la monitorización de los niveles plasmáticos. Los objetivos farmacocinéticos/farmacodinámicos más utilizados fueron una concentración mínima o valle por encima de 8 μg/ml y una relación entre área bajo la curva y concentración mínima inhibitoria superior a 111,1; observándose que las estrategias guiadas por monitorización farmacocinética optimizaron la dosificación y mantuvieron niveles plasmáticos adecuados. Se observó variabilidad interindividual significativa en las concentraciones plasmáticas, influenciada por factores como la función renal y la superficie corporal.
Discusiónel uso de la monitorización terapéutica de fármacos en la dosificación de dalbavancina optimiza el tratamiento de infecciones crónicas complejas, ajustando intervalos entre dosis y permitiendo mantener niveles terapéuticos adecuados durante largos periodos de tiempo, aunque se requiere validación y definición de objetivos farmacocinéticos/farmacodinámicos.
dalbavancin is approved for acute bacterial skin and soft tissue infections, but its off-label use in complex chronic infections has become increasingly common. Currently, no established dosing regimen exists for such infections. Given the need for prolonged treatments, a dose adjustment strategy based on therapeutic drug monitoring may optimize its use and allow for individualized regimens. This systematic review analyzes dalbavancin dosing in complex infections and TDM-based strategies to optimize treatment.
Materials and methodsA search was conducted in PubMed, Embase, Scopus, and the Cochrane Library (2014–2024) using the keywords: “dalbavancin”, “pharmacokinetics”, “pharmacodynamics”, “therapeutic drug monitoring”, and “TDM”. Three independent reviewers selected and evaluated the studies. Clinical studies related to the pharmacokinetics of dalbavancin and the use of TDM in complex infections requiring prolonged regimens were included. Due to heterogeneity among studies, a qualitative analysis of the data was performed.
ResultsA total of 241 articles were identified. After removing duplicates and applying inclusion and exclusion criteria, 10 studies were included. These studies exhibited heterogeneity in design (6 retrospective and 4 prospective) and sample size, encompassing 457 patients and 1.298 samples. Most studies focused on osteoarticular infections treated with dalbavancin using an initial two-dose regimen of 1,500 mg administered one week apart, followed by dose adjustments based on plasma level monitoring. The most commonly targeted pharmacokinetic/pharmacodynamic parameters were a trough concentration above 8 μg/ml and an area under the curve/minimum inhibitory concentration ratio greater than 111.1. Therapeutic Drug Monitoring-Guided strategies were found to optimize dosing and maintain adequate plasma levels. Significant interindividual variability in plasma concentrations was observed, influenced by factors such as renal function and body surface area.
DiscussionThe use of Therapeutic Drug Monitoring in dalbavancin dosing optimizes the treatment of complex chronic infections by adjusting dosing intervals and maintaining adequate therapeutic levels over extended periods. However, further validation and definition of specific pharmacokinetic/pharmacodynamic targets are needed.
Dalbavancina es un lipoglicopéptido parenteral de acción prolongada1, que ejerce su actividad antimicrobiana principalmente a través de la interacción con los residuos terminales D-alanil-D-alanina de los precursores del peptidoglicano2, lo que impide la actividad de las enzimas transpeptidasa y transglicosilasa3,4. Fue aprobada por la Food and Drug Administration (FDA) en 2014 y por la European Medicines Agency (EMA) en 2015 para infecciones de la piel y las partes blandas (ABSSSI)3,5.
Cada vez es más frecuente su uso fuera de ficha técnica en el tratamiento de infecciones crónicas complejas causadas por bacterias grampositivas, como infecciones osteoarticulares, periprotésicas y endocarditis5–7.
La dalbavancina presenta propiedades farmacocinéticas y farmacodinámicas (PK/PD) peculiares. Su larga vida media, permite la administración de una única dosis de 1.500 mg para el tratamiento de infecciones de la piel y las partes blandas, o bien un esquema de 1.000 mg seguido de 500 mg una semana después6–9. Esta semivida prolongada, que se ha visto que es de al menos 8,5 días9, se debe a su elevada unión a proteínas plasmáticas (principalmente albúmina), que alcanza el 93% en humanos8,9. Su volumen de distribución es superior a 10 litros8,9, con un aclaramiento de 0,0473 ml/min9. Se distribuye ampliamente en el líquido extracelular de los tejidos blandos8 y su eliminación es tanto renal (hasta un 45%) como extrarrenal8,9. No se recomienda ajuste de dosis en insuficiencia renal leve o moderada ni en insuficiencia hepática; sin embargo, en casos de insuficiencia renal grave, sí es necesaria una reducción de dosis8. Además, la dalbavancina no interfiere con la actividad de las enzimas del citocromo P45010–14. Todos estos factores contribuyen a su fácil manejo.
Dalbavancina es eficaz frente a bacterias grampositivas, incluyendo Staphylococcus aureus (S. aureus) resistente a meticilina (MRSA), S. aureus con sensibilidad intermedia a vancomicina, estafilococos coagulasa-negativos multirresistentes y enterococos resistentes a vancomicina con el fenotipo VanB11,15,16. Algunas infecciones complejas, como las infecciones óseas y articulares (BJI), infecciones asociadas a prótesis articulares (PJI) y endocarditis infecciosa (IE) están causadas por S. aureus y otras especies de estafilococos y estreptococos17,18. Estas infecciones son más difíciles de tratar debido a la formación de biopelículas y a que la penetración de los antibióticos en las estructuras óseas y articulares puede ser variable según el fármaco, siendo en algunos casos limitada, especialmente en el hueso y en presencia de biopelículas19. Esto hace necesarios tratamientos de larga duración y con fármacos con buena distribución tisular, como se ha demostrado para dalbavancina en estudios de distribución tisular20. Esto convierte a la dalbavancina en un antibiótico con gran potencial en estos casos. Sin embargo, estas indicaciones no se incluyen en la autorización de uso actual.
Debido a su actividad frente a cocos grampositivos, incluyendo MRSA, la larga vida media y el perfil de seguridad favorable, dalbavancina representa una alternativa potencial a la administración IV diaria de otros antibióticos, con el largo periodo de hospitalización que esto conlleva en pacientes con infecciones osteoarticulares, periprotésicas e infecciones de injertos vasculares11–13,15–19,21.
Cada vez hay más evidencia del uso prolongado de dalbavancina en infecciones crónicas complejas, con series de casos publicados que muestran resultados clínicos favorables13,18,20,22–26. Sin embargo, las estrategias de dosificación varían ampliamente de unos estudios a otros y no hay claras recomendaciones o guías publicadas sobre regímenes de dosificación extendidos. Esto ha hecho que, en muchos casos, la dosificación esté guiada por la monitorización terapéutica de fármacos (TDM).
Es por esta necesidad no cubierta que, en esta revisión sistemática, hacemos una búsqueda de los estudios existentes que han propuesto pautas de administración de dalbavancina en infecciones complejas, basándose en TDM, y así evidenciar regímenes potenciales para extender el tratamiento más allá del régimen aprobado de la dosificación en infecciones de la piel y las partes blandas3,4.
En un modelo de infección por S. aureus en ratones, se demostró que los valores del área bajo la curva concentración-tiempo a las 24 horas/concentración mínima inhibitoria (fAUC24h/CIM), necesarios para mantener una reducción en la carga bacteriana de S. aureus de 2 logaritmos (equivalente a una disminución de 100 veces en el número de bacterias, o al 99% del inóculo inicial) fueron de 111,1 ± 51,8127. Esto significa que, en los ratones infectados, el fármaco debía mantener una relación AUC24h/CIM mayor que 111,1 para lograr una reducción significativa en la cantidad de bacterias. Posteriormente, mediante simulaciones farmacocinéticas poblacionales, se calculó que un AUC24h/CMI mayor que 111,1 correspondía a un nivel valle de 8,04 mg/l para una CMI de 0,125 mg/l. Este valor se obtuvo a partir de los umbrales de fAUC24h calculados previamente para asegurar el objetivo PK/PD óptimo contra S. aureus, basados en los valores de CMI más comunes (0,0625 mg/l y 0,125 mg/l). Los umbrales de fAUC24h fueron de 6,94 y 13,89 mg·h/l, lo que, considerando la alta unión de dalbavancina a proteínas plasmáticas, se tradujo en AUC24h totales de 99,2 y 198,3 mg·h/l, respectivamente. Se validó que las concentraciones plasmáticas podían estimar de manera confiable los valores de AUC24h, permitiendo la determinación de umbrales valle de 4,02 mg/l y 8,04 mg/l para CIM de 0,0625 mg/l y 0,125 mg/l, respectivamente28.
Hasta el momento, no existen revisiones sistemáticas que analicen el régimen óptimo de administración de dalbavancina en infecciones crónicas complejas causadas por microorganismos grampositivos. Nuestro objetivo es revisar la literatura actual para describir los regímenes de administración más frecuentes de dalbavancina en este tipo de infecciones, evaluar si se cumplen los objetivos PK/PD descritos en la literatura al emplear estos regímenes, y explorar las estrategias basadas en TDM utilizadas para optimizar el tratamiento. Además, buscamos describir la variabilidad interindividual observada en los niveles plasmáticos y las características del paciente que podrían influir en ella.
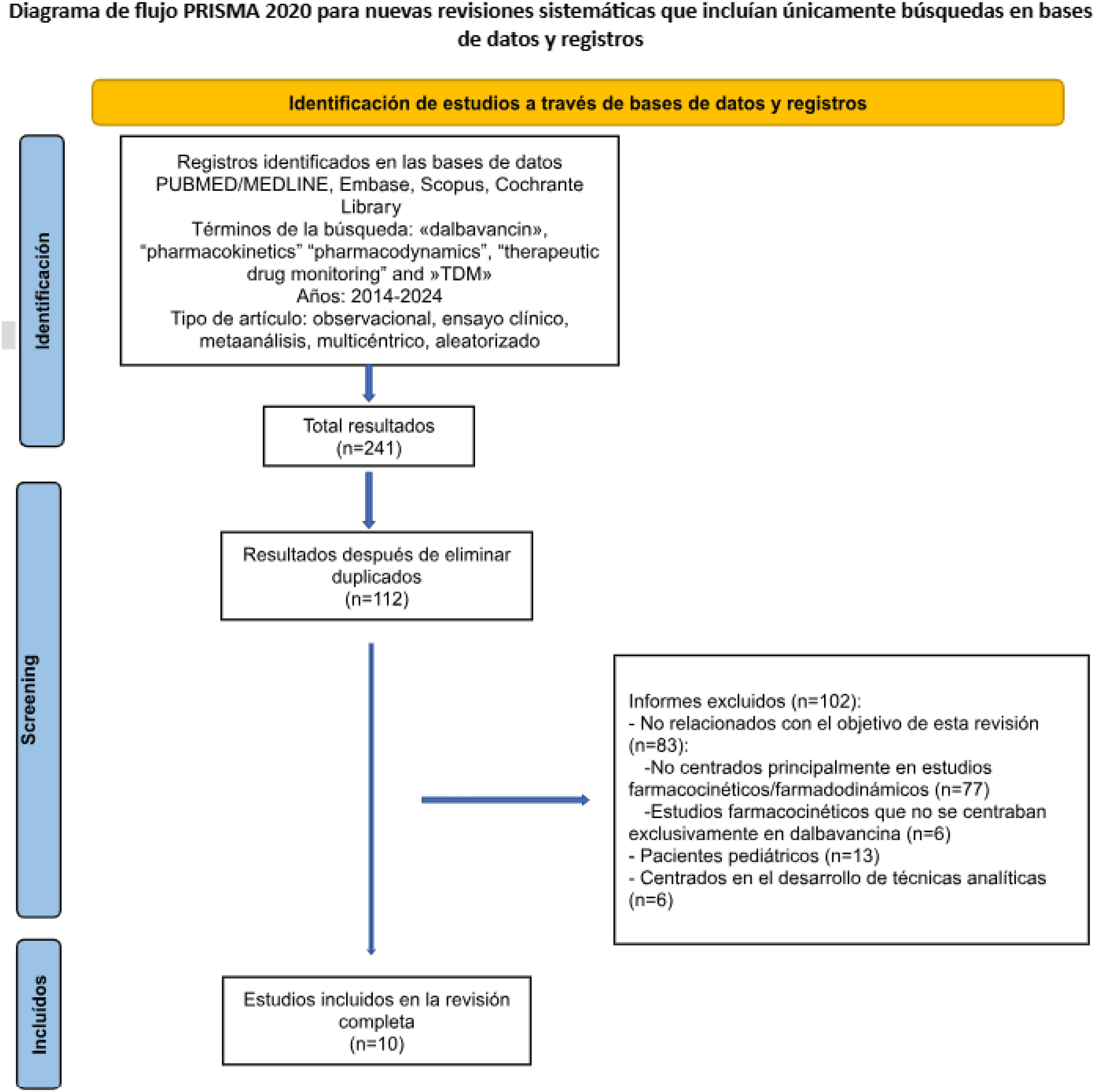
Material y métodosEl protocolo para esta revisión fue registrado en la base de datos PROSPERO (CRD42024622177)29. El estudio se llevó a cabo según la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)30 (fig. 1).
Estrategia de búsqueda y selección de artículosSe realizó una búsqueda sistemática en las bases de datos PubMed, Embase, Scopus y Cochrane Library de artículos publicados entre los años 2014 y 2024. La estrategia de búsqueda se diseñó usando las siguientes palabras clave: «dalbavancin», «pharmacokinetics», «pharmacodynamics» «therapeutic drug monitoring» y «TDM». Se utilizó la siguiente estrategia de búsqueda: ((dalbavancin) AND (pharmacokinetics OR pharmacodynamics)) AND (therapeutic drug monitoring OR TDM). Esta estrategia se aplicó en todos los campos, incluyendo título, resumen y texto completo. Se consideraron tanto artículos en inglés como en español. No se consideraron estudios realizados en animales.
Dos autores de la revisión (Laura Moñino-Dominguez y Alicia Aguado-Paredes) examinaron de manera independiente los títulos y resúmenes de las referencias identificadas utilizando Rayyan. El texto completo de los títulos y resúmenes relevantes fue entonces evaluado de manera independiente para identificar estudios que cumplieran con los criterios de inclusión. Las discrepancias se resolvieron mediante consenso y, en caso de no alcanzarlo, consultando a un autor adicional de la revisión (Jaime Cordero-Ramos).
Criterios de inclusiónSe seleccionaron ensayos clínicos aleatorizados, estudios prospectivos, estudios retrospectivos, series de casos o reportes de casos publicados en revistas médicas revisadas por pares, relacionados con la farmacocinética de dalbavancina y la aplicación del TDM en la personalización del tratamiento de infecciones complejas con pautas de tratamiento prolongadas (infecciones osteoarticulares, endocarditis infecciosa e infecciones protésicas, ya sean vasculares u ortopédicas).
Criterios de exclusiónExcluimos editoriales, comentarios, cartas al editor e informes de casos y series de casos con menos de 10 participantes.
También se excluyeron estudios sobre animales o centrados en datos de animales, así como estudios in vitro. Se excluyeron aquellos estudios cuyo objetivo principal no era el análisis farmacocinético de dalbavancina, así como los estudios farmacocinéticos que no se centraban exclusivamente en dalbavancina. Además, se excluyeron los estudios centrados en técnicas analíticas para la determinación de los niveles plasmáticos de dalbavancina, así como los artículos cuyo texto completo estaban publicados en idiomas distintos al inglés o al español.
La exclusión de series de casos con menos de 10 participantes se basó en la necesidad de incluir solo estudios con una muestra representativa que permita generar conclusiones más fiables y transferibles.
Extracción de datosDos revisores (Laura Moñino-Dominguez y Alicia Aguado-Paredes) extrajeron de manera independiente la información relevante de todos los estudios incluidos, utilizando un formulario de extracción de datos personalizado.
De igual forma, evaluaron de manera independiente el riesgo de sesgo. La escala de Newcastle–Ottawa (NOS) se aplicó para evaluar la calidad de los estudios observacionales. La escala varía de 0 a 9, con puntajes más altos indicando mayor calidad. Elegimos un punto de corte de mayor o igual que 6 para estudios de buena calidad. Cualquier desacuerdo se resolvió mediante discusión con un tercer autor de la revisión (Jaime Cordero-Ramos).
Se ha llevado a cabo un análisis cualitativo de los estudios incluidos. No se realizó un metaanálisis debido a la heterogeneidad significativa entre los estudios por la variabilidad en las poblaciones, las diferencias en las intervenciones y los desenlaces medidos.
Los datos relevantes de cada estudio fueron extraídos y sintetizados cualitativamente. Las características principales de los estudios y sus hallazgos fueron organizados y presentados en tablas y narrativas descriptivas para proporcionar una visión comprensiva de la evidencia disponible.
ResultadosLa búsqueda inicial arrojó un total de 241 artículos. Después de eliminar duplicados, quedaron 112 artículos únicos. Se revisaron los títulos y resúmenes de estos 112 artículos, de los cuales 102 fueron excluidos por no cumplir con los criterios de inclusión. De estos, 83 artículos fueron excluidos porque no estaban relacionados con el objetivo de esta revisión, debido a que su objetivo primario no era el análisis de la farmacocinética de dalbavancina (n = 77) o que analizaba la farmacocinética de dalbavancina, pero a la vez que la de otros fármacos (n = 6). Trece artículos fueron excluidos porque se llevaron a cabo en pacientes pediátricos y 6 porque estaban enfocados en el desarrollo de técnicas analíticas para la determinación en sangre de niveles de dalbavancina. Finalmente, se incluyeron 10 estudios en la revisión sistemática (fig. 1).
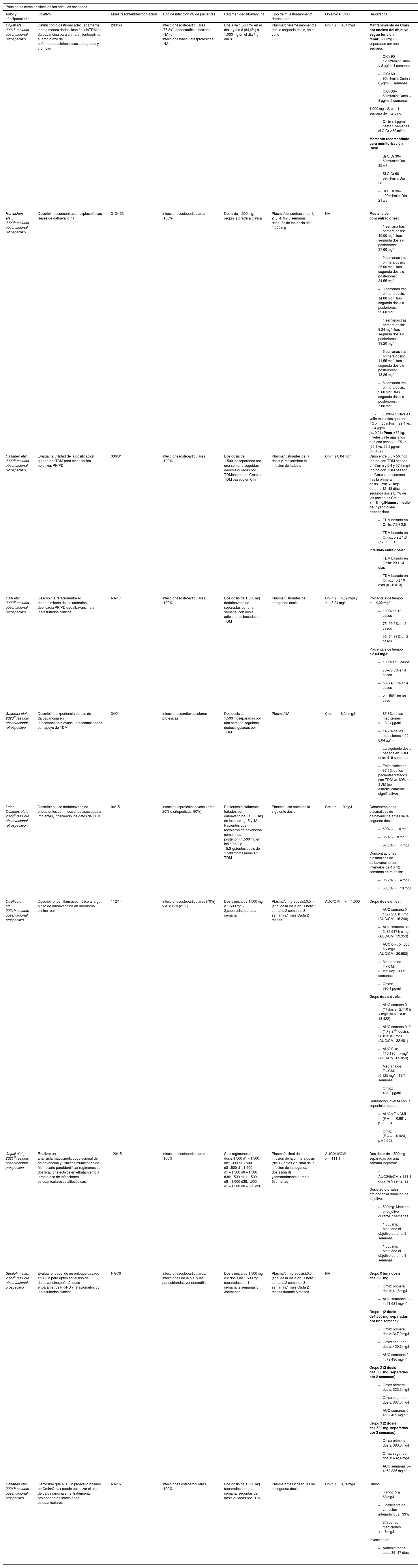
Se incluyeron estudios con variabilidad en el diseño y el tamaño de la muestra. Entre los estudios incluidos, 6 fueron estudios observacionales retrospectivos31–36 y 4 estudios observacionales prospectivos37–40 (tabla 1). Todos los estudios fueron de un solo centro, excepto uno, que se realizó en 236. Las características de los estudios revisados se encuentran resumidas en la tabla 1.
Principales características de los estudios revisados
| Principales características de los artículos revisados | |||||||
|---|---|---|---|---|---|---|---|
| Autor y año/tipoestudio | Objetivo | Muestrasobtenidas/población | Tipo de infección (% de pacientes) | Régimen dedalbavancina | Tipo de muestra/momento derecogida | Objetivo PK/PD | Resultados |
| Cojutti etal., 202131/estudio observacional retrospectivo | Definir cómo gestionar adecuadamente losregímenes dedosificación y laTDM de dalbavancina para un tratamientoóptimo a largo plazo de enfermedadesinfecciosas subagudas y crónicas | 289/69 | Infeccionesosteoarticulares (76,8%),endocarditisinfecciosa (NA) e infeccionesvascularesprotésicas (NA) | Dosis de 1.500 mg en el día 1 y día 8 (84,4%) o 1.000 mg en el día 1 y día 8 | Plasma/diferentesmomentos tras la segunda dosis, en el valle | Cmin ≥8,04 mg/l | Mantenimiento de Cmin por encima del objetivo según función renal1.500 mg × 2, separadas por una semana:
|
| Hervochon etal., 202332/estudio observacional retrospectivo | Describir lasconcentracionesplasmáticas reales de dalbavancina | 313/133 | Infeccionesosteoarticulares (100%) | Dosis de 1.500 mg, según la práctica clínica | Plasma/concentraciones 1, 2, 3, 4, 6 y 8 semanas después de las dosis de 1.500 mg | NA | Mediana de concentraciones:
|
| Cattaneo etal., 202333/estudio observacional retrospectivo | Evaluar la utilidad de la dosificación guiada por TDM para alcanzar los objetivos PK/PD | 336/81 | Infeccionesosteoarticulares (100%) | Dos dosis de 1.500 mgseparadas por una semana,seguidas dedosis guiadas por TDMbasado en Cmax o TDM basado en Cmin | Plasma/justoantes de la dosis y tras terminar la infusión de ladosis | Cmin ≥ 8,04 mg/l | Cmin entre 5,3 y 56 mg/l (grupo con TDM basado en Cmin) y 5,4 y 57,3 mg/l (grupo con TDM basado en Cmax) una semana tras la primera dosis.Cmin > 8 mg/l durante 42–48 días tras segunda dosis.8,7% de los pacientes Cmin <8 mg/lNúmero medio de inyecciones necesarias:
|
| Gatti etal., 202334/estudio observacional retrospectivo | Describir la relaciónentre el mantenimiento de los umbrales deeficacia PK/PD dedalbavancina y losresultados clínicos | NA/17 | Infeccionesosteoarticulares (100%) | Dos dosis de 1.500 mg dedalbavancina separadas por una semana, con dosis adicionales basadas en TDM | Plasma/justoantes de lasegunda dosis | Cmin ≥4,02 mg/l y ≥8,04 mg/l | Porcentaje de tiempo ≥4,02 mg/l:
|
| Gallerani etal., 202335/estudio observacional retrospectivo | Describir la experiencia de uso de dalbavancina en infeccionescardiovascularescomplicadas con apoyo de TDM | 34/21 | Infeccionescardiovasculares protésicas | Dos dosis de 1.500 mgseparadas por una semana,seguidas dedosis guiadas por TDM | Plasma/NA | Cmin ≥8,04 mg/l |
|
| Lafon-Desmurs etal., 202436/estudio observacional retrospectivo | Describir el uso dedalbavancina enpacientes coninfecciones asociadas a implantes, incluyendo los datos de TDM | 94/15 | Infeccionesprotésicas(vasculares, 20% u ortopédicas, 80%) | Pacientesinicialmente tratados con dalbavancina = 1.500 mg en los días 1, 15 y 42. Pacientes que recibieron dalbavancina como línea posterior = 1.500 mg en los días 1 y 15.Siguientes dosis de 1.500 mg basadas en TDM | Plasma/justo antes de la siguiente dosis | Cmin ≥10 mg/l | Concentraciones plasmáticas de dalbavancina antes de la segunda dosis:
|
| De Nicolo etal., 202137/estudio observacional prospectivo | Describir el perfilfarmacocinético a largo plazo de dalbavancina en unentorno clínico real | 112/14 | Infeccionesosteoarticulares (79%) y ABSSSI (21%) | Dosis única de 1.500 mg o 1.500 mg × 2,separadas por una semana | Plasma/0 h(predosis),0,5 h (final de la infusión),1 hora,1 semana,2 semanas,3 semanas,1 mes,Cada 2 meses | AUC/CMI>1.000 | Grupo dosis única:
|
| Cojutti etal., 202138/estudio observacional prospectivo | Realizar un análisisfarmacocinéticopoblacional de dalbavancina y utilizar simulaciones de Montecarlo paraidentificar regímenes de dosificaciónefectivos en eltratamiento a largo plazo de infecciones osteoarticularesestafilocócicas | 120/15 | Infeccionesosteoarticulares (100%) | Seis regímenes de dosis:1.500 d1 + 1.500 d8;1.000 d1 + 500 d81.500 d1; 1.500 d1 + 1.500 d8 + 1.500 d36;1.500 d1 + 1.500 d8 + 1.000 d36;1.500 d1 + 1.500 d8 + 500 d36 | Plasma/al final de la infusión de la primera dosis (día 1), antes y al final de la infusión de la segunda dosis (día 8) ysemanalmente durante 6semanas | AUC24h/CMI >111,1 | Dos dosis de 1.500 mg separadas por una semana lograron:
|
| Stroffolini etal., 202239/estudio observacional prospectivo | Evaluar el papel de un enfoque basado en TDM para optimizar el uso de dalbavancina,enfocándose enparámetros PK/PD y relacionarlos con losresultados clínicos | NA/76 | Infeccionesosteoarticulares, infecciones de la piel y las partesblandas yendocarditis | Dosis única de 1.500 mg o 2 dosis de 1.500 mg separadas por 1 semana, 2 semanas o 3semanas | Plasma/0 h (predosis),0,5 h (final de la infusión),1 hora,1 semana,2 semanas,3 semanas,1 mes,Cada 2 meses,durante 6 meses | NA | Grupo 0 (una dosis de1.500 mg):
|
| Cattaneo etal., 202440/estudio observacional prospectivo | Demostrar que el TDM proactivo basado en Cmin/Cmax puede optimizar el uso de dalbavancina en el tratamiento prolongado de infecciones osteoarticulares | NA/16 | Infecciones osteoarticulares (100%) | Dos dosis de 1.500 mg separadas por una semana, seguidas de dosis guiadas por TDM | Plasma/antes y después de la segunda dosis | Cmin ≥8,04 mg/l | Cmin:
|
ABSSSI: acute bacterial skin and skin structure infections; Cmin: concentración mínima o valle; Cmax: concentración máxima; d: día; FG: filtrado glomerular; NA: no especificado; PK/PD: farmacocinético-farmacodinámico; TDM: monitorización terapéutica de fármacos.
En total, los estudios incluidos abarcaron 1.298 muestras correspondientes a 457 pacientes. El número de muestras por estudio varió entre 34 y 336, mientras que el de pacientes osciló entre 14 y 133, aunque algunos trabajos no especificaron esta información.
Los estudios incluidos en la revisión abordaron diversas infecciones complejas, siendo las infecciones osteoarticulares (como osteomielitis, artritis séptica, infecciones protésicas y espondilodiscitis) las más frecuentes. Estas infecciones estuvieron presentes en 9 de los 10 estudios, representando el 100% del tipo de infección en 5 de ellos32–34,38,40, y un alto porcentaje en otros 3 estudios, con un 7937, 76,831 y 80%36 de casos. En un estudio adicional, el porcentaje de infecciones osteoarticulares no se especificó39.
Otros tipos de infecciones complejas incluyeron infecciones protésicas vasculares y endocarditis. Sin embargo, en estos estudios también se observó la presencia de pacientes con infecciones osteoarticulares, generalmente en un porcentaje mayor31,36,37,39.
El objetivo principal de los estudios incluidos en esta revisión sistemática fue evaluar la dosificación adecuada de dalbavancina en el tratamiento de infecciones complejas (especialmente osteoarticulares), describir las concentraciones plasmáticas reales del fármaco y determinar si estas superan los objetivos terapéuticos establecidos en la literatura. También se pretende valorar la utilidad del TDM para alcanzar los objetivos PK/PD y para optimizar los regímenes de dosificación, y comprender la variabilidad interindividual en las concentraciones plasmáticas de dalbavancina.
Dosis e intervalo de administraciónLa mayoría de los trabajos revisados utilizaron un régimen de 2 dosis de 1.500 mg administradas con una semana de diferencia31,33–35,37,40. En algunos casos, los pacientes recibieron dosis adicionales guiadas por TDM33–35,40.
Dos estudios ajustaron el régimen de dalbavancina en los pacientes con insuficiencia renal grave (filtrado glomerular [FG] menor que 30 ml/min): en uno de ellos se administraron 2 dosis de 1.000 mg, separadas por una semana31, y en el otro se empleó un esquema de 1.000 mg el día 1, seguido de dosis de 500 mg guiadas por TDM33.
En otro trabajo, se incluyeron 2 estrategias posológicas diferentes: el 40,5% de los pacientes recibió una dosis única de 1.500 mg, mientras que el 58,5% restante recibió 2 dosis de 1.500 mg separadas por una, 2 o 3 semanas, según criterio del investigador, aunque este no fue especificado39.
Un estudio eligió la pauta según el tratamiento antibiótico previo. Los pacientes que habían recibido previamente otro antibiótico fueron tratados con 1.500 mg los días 1 y 15, mientras que aquellos que comenzaron con dalbavancina recibieron las dosis los días 1, 15 y 42. Este último grupo representó el 93,3% de los pacientes36.
En otro trabajo, 35 de los 133 pacientes recibieron una dosis única, mientras que 98 recibieron múltiples administraciones, con una media de 14 días entre ellas. Aunque no se especificaron las dosis exactas, el análisis de concentraciones plasmáticas se centró en pacientes tratados con 2 dosis de 1.500 mg separadas por una semana32. Finalmente, un último estudio evaluó 6 regímenes de administración distintos de dalbavancina: 1.500 mg día 1 + 1.500 mg día 8; 1.000 mg día 1 + 500 mg día 8; 1.500 mg día 1; 1.500 mg día 1 + 1.500 mg día 8 + 1.500 mg día 36; 1.500 mg día 1 + 1.500 mg día 8 + 1.000 mg día 36; 1.500 mg día 1 + 1.500 mg día 8 + 500 mg día 3637.
Todos estos regímenes se resumen en la tabla 1.
Objetivos farmacocinéticos y farmacodinámicos y distribución global de las concentraciones de dalbavancinaEl objetivo PK/PD más utilizado fue la Cmin o valle31–36,40. La mayoría de los estudios establecieron como objetivo mantener la Cmin por encima de 8 μg/ml31,33–35,40, y otros definieron umbrales de 4 μg/ml34 o 10 μg/ml36. Dos estudios utilizaron como objetivo la relación AUC/CMI: en uno se buscaba una relación AUC24h/CMI mayor que 111,138 y en otro un AUC/CMI mayor que 1.00037.
En un estudio, a partir simulaciones de Montecarlo, se estimaron las concentraciones que se alcanzarían tras 2 dosis de 1.500 mg (o 1.000 mg en pacientes con FG menores que 30 ml/min) administradas con una semana de diferencia, en función del filtrado glomerular. Se consideró que este régimen mantenía la Cmin por encima de 8 μg/ml durante:
- •
4 semanas en pacientes con aclaramiento de creatinina (ClCr) de 90–120 ml/min.
- •
5 semanas en aquellos con 60–90 ml/min.
- •
6 semanas en pacientes con 30–60 ml/min.
En pacientes con ClCr menor que 30 ml/min, con dosis reducidas, la Cmin se mantuvo por encima de 8 μg/ml durante 5 semanas31.
Otro estudio que empleó como objetivo PK/PD la relación AUC24h/CMI mayor que 111,1 demostró que el régimen de 2 dosis de 1.500 mg (en día 1 y día 8) mantenía este objetivo durante un periodo de 5 semanas. Además, se estimó que, con dosis adicionales de refuerzo de 500 mg, 1.000 mg o 1.500 mg, administradas en el día 36 (semana 5), este periodo se prolonga a 7, 8 y 9 semanas, respectivamente. En este estudio, no se incluyeron pacientes con la función renal alterada38. Resultados similares se observaron en otro estudio, donde las Cmin se mantuvieron por encima de 8 μg/ml hasta 6 semanas después de la segunda dosis de 1.500 mg33.
En otro estudio se vio que una semana después de la primera dosis de 1.500 mg, el 69% de las Cmin medidas fueron superiores a 10 μg/ml, el 85% a 8 μg/ml, y el 97,9% a 4 μg/ml. Con dosis adicionales de 1.500 mg que se administraron en intervalos de 4–12 semanas basado en TDM, el 96,7% de las Cmin se mantuvieron por encima de 4 μg/ml y el 68,3% superaron 10 μg/ml36.
Otro estudio utilizó el AUC y la CMI para evaluar la diferencia en la exposición a dalbavancina entre pacientes tratados con una dosis única de 1.500 mg y aquellos tratados con 2 dosis de 1.500 mg separadas por una semana. En los resultados se mostró que el grupo de dosis doble presentó una mayor exposición acumulada (AUC 0-∞: 116.196 h·mg/l frente a 54.666 h·mg/l), mayor tiempo por encima de la CMI (13,7 semanas frente a 11,9 semanas) y una concentración máxima (Cmax, definida como la concentración más alta de fármaco en plasma tras la administración de una dosis) también superior (431,2 μg/ml frente a 390,1 μg/ml). Aunque ambos grupos superaron el punto de corte establecido de AUC/CMI mayor que 1.000, la exposición fue significativamente mayor con 2 dosis37.
De manera similar, otro estudio comparó la exposición entre pacientes que recibieron una dosis única frente a aquellos con dosis sucesivas, utilizando las concentraciones mínimas o valle. Los resultados, detallados en la tabla 1, mostraron que estas concentraciones eran más altas en los pacientes que recibieron dosis sucesivas, en comparación con aquellos tratados con una sola dosis, cuando se midieron tras el mismo intervalo de tiempo desde la última dosis en ambos grupos32.
Por último, un estudio evaluó la Cmax y encontró que los pacientes que recibieron 2 dosis de 1.500 mg separadas por una semana lograron una Cmax significativamente mayor (420,6 μg/ml, p = 0,05) y un área bajo la curva acumulada en las primeras 4 semanas (AUC 0–4w) también significativamente superior (79,486 mg·h/l, p < 0,001) en comparación con aquellos que recibieron las dosis separadas por 2 o 3 semanas. Además, se identificó una correlación significativa entre la Cmax tras la primera dosis y el AUC acumulado en las primeras 4 semanas (p = 0,018). Los pacientes con una Cmax menores que 313 μg/ml, tras la primera dosis presentaron un mayor riesgo de fallo terapéutico, con una sensibilidad del 100% y una especificidad del 78% (p = 0,035)39. Los valores de Cmax y AUC de los distintos grupos se detallan en la tabla 1.
Monitorización terapéutica de fármacos de dalbavancinaEl ajuste del régimen posológico de dalbavancina mediante TDM ha sido evaluado en 5 estudios32–36,40, en los que se optimizó la frecuencia de las dosis adicionales tras un esquema inicial de 2 dosis de 1.500 mg separadas por una semana.
En uno de ellos, basándose en un modelo farmacocinético poblacional, se sugirieron diferentes momentos para medir las concentraciones valle según el esquema de dosis y la función renal. En pacientes con ClCr de 30–59, 60–89 y 90–120 ml/min, se recomendó realizar el TDM en los días 35 ± 3; 28 ± 3 o 21 ± 3, respectivamente, tras la administración de las 2 primeras dosis31.
En un estudio, el TDM permitió administrar dosis adicionales de dalbavancina en intervalos de 4 a 9 semanas, ajustados según la función renal del paciente. El momento de la siguiente dosis se determinó utilizando el modelo de farmacocinética poblacional previamente mencionado31. Con esta estrategia, el 85,3% de las concentraciones plasmáticas superaron los 8 μg/ml, y el éxito clínico fue del 87,5% en pacientes con TDM, frente al 60% sin TDM, aunque sin diferencias estadísticamente significativas35.
Otro estudio evaluó los resultados a largo plazo de implantar el TDM en la práctica clínica habitual. Utilizando modelos logarítmicos, se estimó el momento óptimo de la siguiente dosis basándose en la Cmin y la Cmax. Se buscó mantener la Cmin por encima de 8 μg/ml, y el 82% de las mediciones alcanzaron este objetivo. Las dosis adicionales se administraron con un intervalo promedio de 39 a 47 días, dependiendo de los niveles plasmáticos40.
En un estudio se compararon 2 enfoques de TDM: uno basado en Cmin y otro en Cmax. No hubo diferencias estadísticamente significativas en las medias de Cmin entre ambos grupos (tabla 1). Menos del 10% de las Cmin estuvieron por debajo de 8 μg/ml y ninguna fue inferior a 4 μg/ml. En el enfoque basado en Cmax, se lograron intervalos más largos entre administraciones, con menos dosis necesarias, alcanzando diferencias estadísticamente significativas. El número medio de inyecciones necesarias fue de 5,2 ± 1,8 en el enfoque basado en Cmax, en comparación con 7,3 ± 2,6 en el enfoque basado en Cmin (p < 0,0001). El intervalo medio entre dosis fue de 40 ± 10 días con el enfoque basado en Cmax, frente a 29 ± 14 días con el enfoque basado en Cmin (p = 0,013)33.
Finalmente, otro estudio reportó que el TDM permitió extender los intervalos entre dosis hasta 4–12 semanas, con el 96,7% de las concentraciones por encima de 4 μg/ml y el 68,3% superando los 10 μg/ml. Sin embargo, no se especificó cómo se determinaba el momento de la siguiente dosis36.
Variabilidad interindividualSe observó una considerable variabilidad interindividual en las concentraciones valle. En un estudio, los valores oscilaron entre 5,3 y 56 mg/l (grupo TDM basado en Cmin) y entre 5,4 y 57,3 mg/l (grupo TDM basado en Cmax)33. En otro estudio, las concentraciones valle fluctuaron entre 5 y 68 μg/ml, con un coeficiente de variación del 33%40.
La insuficiencia renal fue un factor clave en la variabilidad de las concentraciones de dalbavancina. Las concentraciones fueron significativamente más altas en pacientes con FG menor que 60 ml/min en comparación con aquellos con FG mayor que 60 ml/min (29,4 μg/ml vs. 22,4 μg/m, p = 0,01)32. En otro estudio, se identificó el aclaramiento de creatinina como la única variable asociada con la eliminación de dalbavancina (p = 0,041), mostrando una relación inversa31. Además, los intervalos entre dosis, ajustados según TDM, variaron entre 4 y 9 semanas, dependiendo de la función renal35. El ajuste de dosis mediante simulaciones de Montecarlo permitió mantener concentraciones plasmáticas adecuadas en pacientes con insuficiencia renal31.
El peso corporal también mostró un impacto significativo en las concentraciones de dalbavancina. Los pacientes con un peso mayor que 75 kg presentaron concentraciones significativamente menores que aquellos con un peso menor que 75 kg (22,2 μg/ml vs. 25,9 μg/ml, p = 0,02)32.
Finalmente, la superficie corporal fue otro factor importante en la exposición al fármaco. En uno de los estudios, la superficie corporal mostró una relación inversa con el AUC total durante las 2 primeras semanas de tratamiento (AUC 0–2w: 58.012 h × mg/l, R = −0,881, p = 0,004), con el tiempo por encima de la CMI (T > MIC, R = −0,881, p = 0,004) y con la Cmax (R = −0,924, p = 0,002)37. Estos hallazgos se confirmaron en otro estudio que identificó una correlación inversa significativa entre la superficie corporal y el AUC en la primera semana (p = 0,006), el AUC en el primer mes (p = 0,004) y con la Cmax (p = 0,002), sugiriendo la necesidad de ajustar las dosis en pacientes con mayor superficie corporal para alcanzar niveles terapéuticos adecuados39.
DiscusiónLa presente revisión sistemática es el análisis más completo hasta la fecha sobre la monitorización de las concentraciones plasmáticas de dalbavancina en infecciones complejas, incluyendo 10 estudios observacionales que abarcaron 1.298 muestras de 457 pacientes. Los resultados destacan la utilidad de la monitorización terapéutica de fármacos para optimizar los regímenes de dosificación de dalbavancina y lograr los objetivos farmacocinéticos/farmacodinámicos, especialmente en escenarios con alta variabilidad interindividual en las concentraciones plasmáticas.
La mayoría de los estudios revisados emplearon un esquema de 2 dosis de 1.500 mg, separadas por una semana, un régimen basado en modelos farmacocinéticos poblacionales que garantiza concentraciones adecuadas durante 5 semanas38. Sin embargo, observamos una gran flexibilidad en la dosificación, con el uso de TDM para determinar el momento óptimo de administración de dosis adicionales33–36,40 y ajustes posológicos en pacientes con insuficiencia renal31,33.
Los objetivos PK/PD más comunes fueron mantener niveles valle por encima de 8 μg/ml31,33–35,40 o una relación AUC/CMI >111,1 basándose en los estudios de Lepak y Cojutti27,28. Aunque un estudio propuso un umbral más restrictivo de 10 μg/ml36, la falta de justificación plantea interrogantes sobre su relevancia clínica.
Si bien la mayoría de los estudios incluidos en esta revisión utilizaron Cmin o AUC/CMI como objetivos PK/PD, algunos evaluaron Cmax como parámetro de exposición, justificando su uso como alternativa para evaluar la farmacocinética de dalbavancina y predecir su comportamiento33,39. Se demostró que este parámetro está relacionado con la respuesta clínica temprana, ya que valores inferiores a 313 mg mg/l tras la primera dosis se correlacionaron con un mayor riesgo de fallo terapéutico39. Además, los pacientes que recibieron 2 dosis de 1.500 mg separadas por una semana lograron una Cmax significativamente mayor, lo que se tradujo en una mayor exposición acumulada (AUC 0–4 semanas)39. En otro estudio se utilizó Cmax como alternativa a Cmin para guiar el TDM y ajustar los intervalos entre dosis33. No obstante, AUC/CMI y Cmin siguen siendo los objetivos PK/PD mejor establecidos para evaluar la efectividad de dalbavancina a largo plazo.
Por otra parte, otro estudio estableció un umbral de AUC/CMI mayor que 1.00037, basado en un modelo farmacocinético de dalbavancina41. Este umbral se determinó a partir de simulaciones de Montecarlo y modelos PK/PD, y representa la exposición acumulada a dalbavancina a lo largo del tratamiento. Es complementario del umbral AUC24h/CMI mayor que 111,1, ya que mantener este valor en el tiempo permite alcanzar un AUC total/CMI mayor que 1.00041.
En la mayoría de los estudios revisados, se observó que la administración de 2 dosis de 1.500 mg separadas por una semana era un esquema adecuado para alcanzar los objetivos PK/PD31,33–35,40.
Cinco estudios aplicaron TDM para ajustar el régimen posológico de dalbavancina tras las primeras dosis33–36,40, empleando estrategias como simulaciones de Montecarlo o ajustes basados en niveles valle o Cmax. Estas estrategias permitieron mantener niveles terapéuticos durante periodos prolongados y reducir la frecuencia de administración de dalbavancina, especialmente en aquellos pacientes con alteraciones renales33,38,40. Incluso se demostró como administrar dosis adicionales en determinados momentos extenderían el periodo en el que los niveles valle se encuentran por encima del objetivo terapéutico. Esto sugiere que el uso de TDM permite prolongar el intervalo entre dosis sin comprometer los resultados clínicos. Estos resultados son importantes, ya que los regímenes estándar aprobados para infecciones de piel y partes blandas mantienen niveles plasmáticos adecuados durante aproximadamente 3 semanas, lo que suele ser suficiente para estas infecciones, pero no para infecciones complejas o crónicas.
Aunque no se encontraron diferencias estadísticamente significativas en términos de éxito clínico entre pacientes con y sin TDM35, esto puede deberse al tamaño muestral reducido de ese estudio y se necesitarían más investigaciones en torno a este descubrimiento.
Otro hallazgo clave de los estudios incluidos en esta revisión fue la variabilidad interindividual en las concentraciones plasmáticas de dalbavancina, influida por factores como la función renal, el peso y la superficie corporal31,32,37,39. Pacientes con FG menor que 60 ml/min alcanzaron concentraciones significativamente más altas, mientras que aquellos con peso mayor que 75 kg o mayor superficie corporal (sin haberse identificado un umbral específico para este parámetro) mostraron una menor exposición al fármaco. Esto refuerza la importancia de ajustar la dosis de forma personalizada en pacientes con variaciones extremas en la función renal o el peso corporal.
ConclusionesCon base en la evidencia disponible, recomendamos realizar la monitorización terapéutica de dalbavancina entre las 3–5 semanas tras la administración de la pauta inicial, según la función renal, para evaluar la necesidad de redosificación.
En pacientes con FG mayor o igual que 60 ml/min, las concentraciones valle suelen mantenerse por encima de 8 μg/ml durante 4-5 semanas tras la administración de 2 dosis de 1.500 mg separadas por una semana. Si no se dispone de TDM y se requiere prolongar el tratamiento, se podría administrar una dosis adicional de 500, 1.000 o 1.500 mg en la semana 5, lo que permitiría extender la exposición por 1, 2 o 3 semanas adicionales, respectivamente, según la duración prevista del tratamiento.
Cuando se dispone de TDM, el manejo puede ajustarse a los niveles plasmáticos:
- •
Niveles adecuados (mayor que 8 μg/ml): Mantener seguimiento clínico y considerar repetir TDM en 2 semanas si se requiere prolongar el tratamiento.
- •
Niveles 6–8 μg/ml: repetir TDM en una semana. Si los niveles descienden o hay signos de fallo terapéutico, considerar una dosis de 500 mg. Repetir TDM en 2 semanas.
- •
Niveles 4–6 μg/ml: administrar 1.000 mg y repetir TDM en 2 semanas.
- •
Niveles menores que 4 μg/ml: administrar 1.500 mg y repetir TDM en 2 semanas.
En pacientes con ClCr menor que 60 ml/min, no se ha estudiado el efecto de dosis adicionales, por lo que no recomendamos su administración empírica. La redosificación debe basarse exclusivamente en TDM si se detectan niveles infraterapéuticos, por lo que podría realizarse monitorización a las 5–6 semanas. Si se confirma un descenso significativo en las concentraciones y se considera necesaria una dosis adicional, una dosis de 500 mg con reevaluación mediante TDM a las 2 semanas podría ser la opción más prudente.
En pacientes con insuficiencia renal grave (ClCr menor que 30 ml/min), la administración de 2 dosis de 1.000 mg en los días 1 y 8 puede ser una estrategia adecuada.
Estas recomendaciones se basan en la mejor evidencia disponible hasta la fecha, pero deben ser interpretadas con precaución y adaptadas a la situación clínica individual de cada paciente. La decisión final sobre la redosificación debe considerar la evolución clínica y, siempre que sea posible, apoyarse en el TDM.
Es fundamental realizar estudios con un mayor tamaño muestral y diseños aleatorizados para validar estas observaciones y desarrollar recomendaciones de dosificación en infecciones complejas por microorganismos grampositivos tratados con dalbavancina. Además, sería conveniente unificar los objetivos PK/PD y evaluar el impacto del TDM en parámetros clínicos más amplios, como la resolución de infecciones.
En resumen, esta revisión destaca que un enfoque basado en TDM no solo asegura una exposición adecuada al fármaco, sino que también permite personalizar la dosificación según las características del paciente. Aunque los resultados son prometedores, se requiere evidencia adicional de ensayos clínicos para consolidar estas estrategias como estándar en la práctica clínica.
LimitacionesEntre las limitaciones de esta revisión se incluyen:
- •
Diseño de los estudios: todos los estudios incluidos son observacionales, lo que introduce sesgos potenciales y limita la posibilidad de establecer relaciones causales.
- •
Tamaño muestral reducido: varios estudios presentan tamaños de muestra pequeños, dificultando la generalización de los resultados.
- •
Heterogeneidad en métodos y objetivos: la falta de consenso sobre los puntos de corte PK/PD complica la comparación de resultados.
- •
Ámbito monocéntrico: la mayoría de los estudios se realizaron en un solo centro, limitando la aplicabilidad de los hallazgos a diferentes entornos clínicos.
Esta revisión proporciona una visión exhaustiva y actualizada de los estudios publicados sobre la monitorización terapéutica de dalbavancina desde 2021 hasta la fecha, destacando su relevancia y novedad en el contexto clínico del tratamiento de infecciones que requieren un manejo prolongado con este antibiótico.
A pesar de las limitaciones inherentes a los estudios observacionales, este trabajo representa un avance significativo en la comprensión de la farmacocinética de la dalbavancina y su aplicación en infecciones complejas.
Asimismo, esta revisión identifica áreas emergentes de investigación que podrían abordar las brechas existentes en la literatura actual. Aunque el tamaño muestral de los estudios incluidos es limitado, este aspecto se ha compensado mediante un análisis detallado y un enfoque en patrones consistentes dentro de las muestras analizadas.
FinanciaciónLos autores declaran que no han recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración de contribución de autoría CRediTLaura Moñino-Dominguez: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. Alicia Aguado-Paredes: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Methodology, Investigation, Data curation, Conceptualization. Jaime Cordero-Ramos: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Project administration, Methodology, Investigation, Data curation, Conceptualization.