La necrosis esofágica aguda (NEA) es una afección poco frecuente, con una prevalencia reportada entre el 0,01 y el 0,28% en series endoscópicas. Se caracteriza por necrosis de la mucosa esofágica de predominio distal con extensión variable a nivel proximal y terminación abrupta en la unión gastroesofágica. La NEA se ha relacionado con casos de diabetes mellitus, insuficiencia renal, malnutrición, cirrosis hepática, neoplasias, infecciones, vómitos y algunos fármacos. El mecanismo patogénico no es bien conocido y parece multifactorial; algunas teorías sugieren un componente de hipoperfusión sistémica o una obstrucción del vaciamiento gástrico con acumulación de abundante cantidad de líquido en el estómago y reflujo gastroesofágico, donde el ácido gástrico causa daño y necrosis. La tasa de mortalidad oscila entre el 13 y el 35%1.
Se expone el caso de una paciente con diagnóstico de cáncer de pulmón no microcítico (CPNM) metastásico con mutaciones activadoras del receptor del factor de crecimiento epidérmico (EGFR), quien, tras 7 meses de tratamiento con osimertinib, desarrolló una NEA.
Osimertinib es un inhibidor de la tirosin-cinasa (ITK) de EGFR utilizado en este contexto terapéutico. En cuanto a su perfil de toxicidad gastrointestinal, se ha reportado diarrea en el 41% de los pacientes, estomatitis en el 18%, náuseas en el 10%, anorexia en el 9% (grado 3 en hasta el 1%) y vómitos en el 6%2.
Descripción del casoUna mujer de 68 años, con peso de 55 kg, nunca fue fumadora, con hipertensión arterial en tratamiento con bisoprolol 10 mg al día y colecistectomía como antecedentes médicos relevantes. Se diagnostica de CPNM tipo adenocarcinoma con células en anillo de sello, estadio IV por metástasis óseas, pulmonares y hepáticas, con presencia de mutación L858R en el exón 21 de EGFR y PD-L1 con positividad débil (1–49%). Dado el perfil mutacional, se inicia tratamiento con dacomitinib, un ITK-EGFR, a dosis reducidas de 30 mg una vez al día. Esta decisión se toma considerando el riesgo de efectos adversos en pacientes mayores de 65 años, ya que en este grupo se ha observado una mayor incidencia de toxicidades de grado 3–4. Además, se tuvo en cuenta el estado funcional de la paciente, clasificado como nivel 2 en la escala ECOG (Eastern Cooperative Oncology Group). En el día +42 del inicio del tratamiento, precisa nuevamente reducción de dosis a 15 mg una vez al día por toxicidad cutánea y gastrointestinal grado 2. A pesar de ello, se alcanza respuesta parcial de la enfermedad según los criterios RECIST. Tras más de 2 años de tratamiento, la paciente desarrolla progresivamente pérdida de agudeza visual que precisa valoración por oftalmología, sin mejoría tras varios tratamientos. Tras descartarse otras causas, se decide retirar dacomitinib y, en ese momento, se inicia tratamiento con osimertinib 80 mg una vez al día, con excelente tolerancia inicial, manteniendo respuesta parcial según RECIST.
Tras 7 meses de tratamiento con osimertinib, la paciente acude a urgencias por náuseas y vómitos grado 3, junto con intolerancia oral y pérdida de 5 kilogramos de peso en 3 semanas (tabla 1), y se le pauta tratamiento sintomático con metoclopramida 10 mg cada 8 horas, dexametasona 4 mg una vez al día, ondansetron 4 mg cada 8 horas y omeprazol 20 mg al día. Tras 5 días vuelve a acudir a urgencias por la persistencia de náuseas y vómitos grado 3, y ante la sospecha de toxicidad digestiva relacionada con osimertinib, se suspende. Se mantiene el tratamiento sintomático pautado en la primera visita a urgencias. A pesar de ello, la sintomatología persiste, por lo que, una semana después de la interrupción del fármaco, se decide el ingreso hospitalario para tratamiento y estudio.
Evolución antropométrica y analítica de la paciente desde el inicio de osimertinib
| Inicioosimertinib | + 90 días | + 180 días | + 210 díasprimera visita a urgencias | + 215 días segunda visita a urgencias y suspensión de osimertinib | +217 díasIngresohospitalario | +222Ingesohospitalario | |
|---|---|---|---|---|---|---|---|
| Peso (kg) | 55 | 56 | 55 | 50 | 50 | 50 | 50 |
| Glucosa (mg/dl) | 100 | 94 | 96 | 76 | 84 | 51 | |
| Creatinina(mg/dl) | 0,63 | 0,59 | 0,68 | 1,21 | 0,48 | 0,7 | 1,93 |
| FG (ml/min/1,73m2) | 91 | 93 | 88 | 45 | 99 | 87 | 26 |
| Bilirrubina (mg/dl) | 0,58 | 0,64 | 1,5 | 1,35 | 1,47 | 2,02 | |
| LDH (U/l) | 169 | 287 | 408 | 363 | |||
| AST (U/l) | 24 | 20 | 26 | ||||
| ALT (U/l) | 21 | 11 | 13 | 14 | 27 | 28 | 16 |
| Proteínas totales (g/dl) | 6,5 | 6,6 | 6,6 | 6,2 | 4 | ||
| Hemoglobina (g/dl) | 13,8 | 13,7 | 12,4 | 11,8 | 9,7 | 14,1 | 8,7 |
| Leucocitos (x10^3/μl) | 8,73 | 7,49 | 5,47 | 13,98 | 5,07 | 14,12 | 2,66 |
| Neutrófilos(x10^3/μl) | 6,08 | 4,93 | 3,46 | 12,40 | 3,62 | 12,19 | 2,39 |
| Plaquetas(x10^3/μl) | 286 | 163 | 167 | 183 | 137 | 200 | 49 |
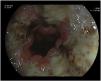
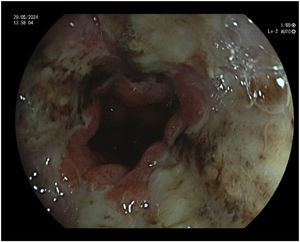
Durante el ingreso se pauta como tratamiento de soporte pantoprazol 40 mg una vez al día, metoclopramida 10 mg cada 8 horas, ondansetrón 4 mg cada 8 horas, dexametasona 4 mg una vez al día y sueroterapia. Se realiza analítica, tomografía axial computarizada (TAC) craneal, que descarta enfermedad metastásica cerebral, y TAC de tórax, abdomen y pelvis que descartan progresión tumoral. Se realiza también una esofagogastroduodenoscopia que muestra una mucosa esofágica cubierta por fibrina, con áreas necróticas (fig. 1), especialmente en esófago distal, y necrosis en bulbo duodenal, todo ello compatible con NEA. Se valora por el servicio de digestivo, concluyéndose que no existen opciones terapéuticas endoscópicas ni quirúrgicas, considerándose únicamente candidata a tratamiento de soporte.
A las 24 horas del diagnóstico de la NEA, la paciente desarrolla una posible sepsis de origen digestivo en relación con la misma. Finalmente, ante el deterioro clínico y la situación de gravedad se decide tratamiento conservador, priorizando medidas de bienestar y limitación del esfuerzo terapéutico.
Se notifica la sospecha de reacción adversa al Sistema Español de Farmacovigilancia.
DiscusiónDebido a su mecanismo de acción, osimertinib interfiere en la proliferación y diferenciación de los queratinocitos en la mucosa oral, lo que explica que la estomatitis sea un efecto adverso frecuente asociado a este fármaco3. Este efecto sobre el epitelio escamoso plantea la posibilidad de que dicho mecanismo fisiopatológico pudiera estar implicado en el desarrollo de la NEA.
En CPNM, hasta un 2% de los pacientes tratados con crizotinib (utilizado en CPNM con reordenamiento del gen linfoma anaplásico de cinasa), pueden desarrollar esofagitis y úlceras esofágicas4. Inoue et al. describieron en 2017 el caso de un paciente con CPNM tratado con afatinib, un ITK-EGFR, que desarrolló una esofagitis severa. Según los autores, esta complicación se debió probablemente al aumento de las concentraciones de afatinib en plasma tras un periodo de baja ingesta, ya que su absorción depende de la presencia de alimentos5.
En otras neoplasias también se han descrito toxicidades gastrointestinales similares asociadas a diversos ITK. Kanagalingam et al. reportaron en 2021 el caso de un paciente que desarrolló esofagitis disecante superficial, asociado a lenvatinib6. En el caso de sunitinib, la esofagitis también se ha descrito como un efecto adverso frecuente, que ha desencadenado acontecimientos mortales7. Mohammad et al. reportaron en 2017 el caso de un paciente con leucemia mieloide crónica en tratamiento con bosutinib, que desarrolló NEA complicada8. La NEA es una entidad rara, de etiología desconocida y patogenia multifactorial.
Es complejo determinar la causa de la NEA en esta paciente. Según el algoritmo de Naranjo, se clasifica como una reacción adversa posible para osimertinib9. Los vómitos y la pérdida de peso comenzaron 7 meses después del inicio de osimertinib. La paciente no recibió ningún otro fármaco que pudiera justificar dicha sintomatología. Los adenocarcinomas con células en anillo de sello, presentados como tumores primarios en el pulmón, son poco frecuentes y tienen un comportamiento altamente agresivo, lo que podría haber contribuido al desarrollo de la NEA10. Puede plantearse la hipótesis de que la NEA se produjera como resultado de una combinación de hipoperfusión sistémica y la exposición de la mucosa esofágica al ácido gástrico, favorecida por los vómitos asociados a la toxicidad gastrointestinal del medicamento, el proceso neoplásico o el estado de malnutrición que presentaba la paciente.
Responsabilidades éticasLos autores has seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
FinanciaciónLas autoras declaran que no han recibido financiación alguna para la realización de este trabajo.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.
Declaración de contribución de autoría de CRediTAlicia Aguado-Paredes: Writing – review & editing, Writing – original draft, Visualization, Validation, Methodology, Formal analysis, Conceptualization. Laura Moñino-Dominguez: Writing – review & editing, Writing – original draft, Validation, Methodology, Conceptualization. Maria del Carmen Damas-Fuentes: Writing – review & editing, Writing – original draft, Validation, Supervision, Methodology, Conceptualization.