el 11 de marzo de 2020, la Organización Mundial de la Salud declaró la COVID-19 como pandemia. Durante las primeras etapas se utilizaron tratamientos sin evidencia científica, como la hidroxicloroquina y, más adelante, el remdesivir. En paralelo, en España, se realizaban ensayos clínicos para evaluar nuevas terapias con mayor rigor científico. Este artículo analiza el perfil de los estudios, la tasa de publicación y la finalización de estos durante la pandemia por COVID-19 en España.
Métodosse realizó un estudio metaepidemiológico, analítico y retrospectivo sobre las características, la tasa de publicación de resultados y la tasa de finalización de los ensayos clínicos con medicamentos relacionados con SARS-CoV-2, autorizados en España, entre marzo de 2020 y agosto de 2021, enfocados en el tratamiento y la profilaxis de la enfermedad. Se revisaron 179 ensayos clínicos utilizando el Registro Español de Estudios Clínicos, ClinicalTrials.gov, PubMed, Embase y TESEO. Se realizó el análisis estadístico con SPSS v.26.
Resultadosel 67,0% de los ensayos fueron nacionales y el 71,0% multicéntricos, destacando los promotores no comerciales (64,8%) y los estudios en fases II (44,7%) y III (48,0%). La mayoría empleó un diseño comparativo (93,9%), enfocado preferentemente en el tratamiento (91,1%) frente a la profilaxis de la enfermedad por SARS-CoV-2, con predominio del reposicionamiento terapéutico (72,1%). Particularmente, los estudios iniciados durante la primera ola de la pandemia (marzo-junio de 2020) fueron, en su mayoría, no internacionales, no comerciales, sin comparación con placebo y destinados al reposicionamiento de medicamentos. Un 21,2% de los ensayos clínicos cerró de forma prematura, principalmente por problemas de reclutamiento, de interrupción involuntaria o de falta de eficacia esperada. Hasta la fecha del final del estudio, el 41,1% de los ensayos disponía de informe final y el 31,3% publicó sus resultados, la mayoría de ellos (71,9%) en revistas del primer cuartil. Se hallaron asociaciones estadísticamente significativas entre la publicación de resultados y variables como el carácter multicéntrico, el no haber cerrado prematuramente, el contar con informe final y ensayos fase III.
El hecho de que un gran número de los ensayos clínicos no llegara a publicarse (68,7%) supone una pérdida de oportunidad en términos de conocimiento.
Conclusiónse concluye la necesidad de mejorar la transparencia, registrar todos los resultados —incluidos los negativos— y revisar aspectos clave del diseño y financiación, como recomendaciones para futuras investigaciones, incluso en situaciones de urgencia sanitaria.
On 11 March 2020, World Health Organisation declared COVID-19 a pandemic. During the early stages, treatments lacking scientific evidence, such as hydroxychloroquine and later remdesivir, were used; meanwhile, clinical trials were being conducted in Spain to evaluate new therapies with greater scientific rigor. This article analyses the study profile, publication rate and completion of studies during the COVID-19 pandemic in Spain.
MethodsMeta-epidemiological, analytical, and retrospective study analyzed the characteristics and rate of completion of clinical trials with SARS-CoV-2-related drugs authorized in Spain between March 2020 and March 2021, focusing on treatment and prophylaxis. 179 clinical trials were reviewed using sources such as Registro Español de Estudios Clínicos, ClinicalTrials.gov, PubMed, Embase and TESEO. Statistical analysis was performed with SPSS v.26.
Results67.0% of the trials were national and 71.0% multicentre, with non-commercial sponsors (64.8%) and phase II (44.7%) and phase III (48.0%) studies being the most common. The majority employed a comparative design (93.9%), preferentially focused on treatment (91.1%) versus prophylaxis of SARS-CoV-2 disease, with a predominance of therapeutic repositioning (72.1%). Notably, studies initiated during the first wave of the pandemic (March–June 2020) were mostly non-international, non-commercial, non-placebo-controlled and aimed at drug repositioning. Some 21.2% of the clinical trials closed prematurely, mainly due to recruitment problems, Involuntary discontinuation or Failure to achieve expected efficacy. By the end of the study, 41.1% of the clinical trials had a final report and 31.3% published their results, most of them (71.9%) in first quartile journals. Statistically significant associations were found between the publication of results and variables such as multicentre, not having closed prematurely, having a final report, and phase III trials.
The fact that a large number of clinical trials were not published (68.7%) represents a missed opportunity in terms of knowledge.
ConclusionWe conclude that there is a need to improve transparency, record all results– including negative ones– and review key aspects of design and funding, as recommendations for future research, including in health emergencies.
El 11 de marzo de 2020 la Organización Mundial de la Salud (OMS) declaró la enfermedad producida por el coronavirus SARS-CoV-2 como pandemia, ya que está «profundamente preocupada por los alarmantes niveles de propagación de la enfermedad y por su gravedad, y por los niveles también alarmantes de inacción»1. Este mismo organismo ya había alertado sobre la enfermedad en un informe sobre la misión conjunta OMS-China publicado en febrero de 20202, en el que proporcionaba una serie de recomendaciones para la prevención, detección y aislamiento de los casos, así como sobre la vigilancia de la evolución de la enfermedad y actividades en materia de prevención de la salud entre la población y la cobertura informativa en los medios de comunicación. En este mismo informe solo se hace referencia a medidas de soporte no farmacológicas, excepto en las recomendaciones realizadas a China en la que se aconseja «establecer un programa de investigación centralizado para acelerar los proyectos más prometedores de rápida implementación, incluyendo diagnósticos y ensayos serológicos, pruebas de posibles antivirales y vacunas candidatas, así como la participación de China en ensayos clínicos seleccionados en varios países».
Antes de declararse oficialmente la pandemia eran muy pocos los estudios publicados sobre el uso de terapia farmacológica en la infección por coronavirus3. En ese momento, se iniciaron ensayos clínicos (EECC) en China con el objetivo de probar diferentes antivíricos y otros medicamentos, pero sin alcanzar una gran evidencia científica sobre la eficacia de ninguno de ellos.
En el momento en que aparecen los primeros casos de infección por SARS-CoV-2 en España, el abordaje terapéutico de estos pacientes por los profesionales sanitarios se caracterizó por un patrón de incertidumbre, enfocado únicamente a la clínica. En España, al igual que en otros países europeos (Francia, Italia, etc.), se administraron medicamentos en indicaciones fuera de ficha técnica, como la hidroxicloroquina, lopinavir/ritonavir, azitromicina y, más adelante, remdesivir, siguiendo recomendaciones de la comunidad científica y de las autoridades sanitarias, sin tener datos firmes de su eficacia. Estos fármacos, utilizados en la práctica clínica habitual para el tratamiento de diversas enfermedades, poseen un perfil de seguridad conocido, tanto sus reacciones adversas como sus potenciales interacciones farmacológicas, algunas de ellas graves, teniendo en cuenta que muchos de los pacientes tratados eran ancianos o tenían enfermedades previas4–6. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) hizo un gran esfuerzo para que en los hospitales españoles se dispusiera de dichos fármacos siguiendo estas recomendaciones, puesto que ya se estaban utilizando en el tratamiento de los pacientes afectados.
La mejor forma de generar evidencia científica de calidad es la realización de EECC controlados. Los resultados obtenidos en las investigaciones científicas permiten determinar sobre la mejor estrategia terapéutica. La manera de difundir esta información es a través de los registros nacionales (p. ej. España, con el Registro Español de Ensayos Clínicos) y la publicación de los resultados, que el Real Decreto (RD) 1090/2015 establece como obligatoria7. Es por ello que las autoridades sanitarias de todos los países, y especialmente España y Reino Unido, instaron a poner en marcha EECC, inicialmente con medicamentos que ya se estaban empleando de forma empírica. Destaca la iniciativa de la OMS, el ensayo Solidarity8, o del National Health Service en Reino Unido, con el patrocinio del ensayo Recovery9, cuyos resultados fueron publicados rápidamente. Además, se desarrollaron nuevos proyectos de investigación con otras moléculas en desarrollo, que de manera precoz, instaban a incluir al mayor número posible de pacientes. El principal objetivo fue proporcionar nuevas oportunidades terapéuticas a los pacientes y obtener datos sobre la eficacia y seguridad de los fármacos que avalen que su balance beneficio-riesgo es favorable.
En España, aproximadamente un 17% de las investigaciones con medicamentos son de carácter no comercial o académico10. Sin embargo, durante la pandemia COVID-19 hubo un número muy importante de EECC independientes o de promotor no comercial, patrocinados por grupos colaborativos, sociedades científicas, fundaciones de hospitales o investigadores independientes. Se realizó un gran esfuerzo por parte de todos los agentes implicados en la evaluación, la autorización, la puesta en marcha y el desarrollo de los EECC, destacando el llevado a cabo por los investigadores independientes. Este esfuerzo no solo fue organizativo, incluyendo la evaluación y la aprobación rápida de los protocolos presentados y el inicio apresurado en los hospitales (donde las unidades de EECC tuvieron un papel decisivo, adaptando rápidamente sus procedimientos normalizados de trabajo y su participación en la distribución de recursos), sino también económico, destinando un importante desembolso de dinero público11,12.
La Organización para la Cooperación y Desarrollo Económico (OCDE), al igual que las principales entidades farmacéuticas, sitúa a España como uno de los países que más EECC acerca del SARS-CoV-2 ha llevado a cabo en el momento álgido de la pandemia12. Una vez transcurrido un tiempo, es necesario plantear algunas cuestiones como: cuántos de estos ensayos han finalizado; cuántos estudios han publicado resultados, a pesar de ser negativos; cuáles fueron los problemas que surgieron durante su realización y, en resumen, si ha valido la pena el esfuerzo hecho en la puesta en marcha. En este contexto, se plantean los siguientes objetivos: analizar el perfil de los EECC con medicamentos para la infección por SARS-CoV-2 realizados en España durante la pandemia, así como describir la tasa de publicación y finalización de los mismos.
Material y métodosSe realizó un estudio metaepidemiológico, analítico y retrospectivo, sobre las características, grado de finalización y publicación de los EECC con medicamentos destinados a la profilaxis y tratamiento de la infección por SARS-CoV-2, aprobados en España entre marzo de 2020 y agosto de 2021.
Criterios de elegibilidadCriterios de inclusiónSe incluyeron todos los EECC con medicamentos autorizados en España entre marzo de 2020 y agosto de 2021 (18 meses) por la AEMPS, y registrados en el Registro Español de Estudios Clínicos (REEC), destinados a la profilaxis y tratamiento de la infección por SARS-CoV-2 y sus síntomas. Como estrategia de calidad, solo se incluyeron aquellas investigaciones que fueron publicadas en revistas indexadas.
Criterios de exclusiónQuedaron descartados los EECC con vacunas dirigidos a la prevención de la infección y los EECC fase I en población pediátrica. Además, se excluyeron los artículos de opinión científica, cartas al director y publicaciones en congresos.
Fuentes de informaciónSe realizó una revisión por pares entre noviembre de 2024 y marzo de 2025 a partir de las principales fuentes de información sobre ensayos clínicos: REEC, el registro estadounidense de EECC (clinicaltrials.gov) y el correspondiente en Europa (clinicaltrialsregister.eu); las bases de datos seleccionadas fueron PubMed y Embase; y se revisó el registro de datos sobe Tesis Doctorales TESEO para asegurar una búsqueda completa. Se descartaron otras bases de datos debido a la duplicidad de sus resultados. Todos los datos del estudio se registraron a través de la plataforma REDCap®, que se ajusta a los requisitos establecidos en la legislación en cuanto a integridad, exactitud, fiabilidad y consistencia.
Estrategia de búsquedaPara la selección de los EECC encontrados en los registros de investigación se utilizaron los criterios de elegibilidad previamente definidos. Se realizó una estrategia de búsqueda combinando los términos MeSH y DeCS, y se utilizaron los operadores booleanos «Y» y «O», y para cada base de datos se utilizó el filtro «revisiones» como se describe en la tabla 1.
Estrategias de búsqueda en las bases de datos seleccionadas
| Base de datos | Estrategia de búsqueda (Noviembre de 2024) |
|---|---|
| PubMed | [(“Clinicaltrial”[MeSH]) OR (research)) AND ((((((((((((“COVID-19” OR (“2019 novel coronavirus disease”)) OR (“COVID19”)) OR (“COVID-19 pandemic”)) OR (“SARS-CoV-2 infection”)) OR (“COVID-19 virus disease”)) OR (“2019 novel coronavirus infection”)]AND (“spain”) |
| Embase | ‘covid-19’/exp. OR ‘sars-related coronavirus’/exp., ‘therapy’/exp. AND ‘therapy’/exp. AND ‘clinical trial’/exp. OR ‘randomizedcontrolled trial’/exp. AND ‘spain’/exp |
La extracción de datos fue realizada por pares, de forma independiente, utilizando un formulario estandarizado que recoge la siguiente información: código del estudio, EudraCT, National Clinical Trial (NCT) number, cobertura geográfica, promotor, tipo de diseño, tipo de control, tratamiento experimental, cierre prematuro y su motivo del cierre, objetivo del estudio, comunicación de resultados, tiempos de inicio del ensayo, reclutamiento y cierre, porcentaje y lugar de publicación de resultados.
Categorización de las intervenciones en los ensayos clínicosReposicionamiento terapéutico: ensayos que evaluaron medicamentos con autorización de comercialización vigente en España por parte de la AEMPS para el tratamiento de otras patologías distintas a la COVID-19.
Nueva molécula: ensayos que investigaron medicamentos sin autorización de comercialización previa de la AEMPS para ninguna indicación
Terapia celular: ensayos cuya intervención consistía en la administración de células preparadas mediante manipulación previa, con fines terapéuticos.
EstadísticaEl análisis estadístico se realizó mediante el software SPSS v.26. El nivel de significación estadística utilizado fue del 5% (p < 0,05). Las características de los EECC se presentaron mediante estadísticas descriptivas. Las variables categóricas se describieron por la frecuencia absoluta y relativa. En ambos casos, se especificó el número de observaciones y los datos faltantes.
Las comparaciones de las características de los EECC que han publicado los resultados versus los que no han publicado se realizaron mediante un análisis bivariante. Se utilizó el estadístico ji-cuadrada de Pearson.
ResultadosDurante el periodo de estudio se aprobaron 191 EECC con medicamentos, 12 de ellos fueron excluidos debido a que se encontraban en fase I dirigidos a población pediátrica y 10 EECC correspondían a vacunas como opción terapéutica. El objetivo principal de la mayoría de los 179 EECC fue el reposicionamiento terapéutico (72,1%). Además, 45 investigaciones (25,1%) con medicamentos nuevos no aprobados previamente por la AEMPS para ninguna enfermedad y un único ensayo clínico presentó objetivo mixto, definido como la combinación de un reposicionamiento de fármacos junto con nuevas moléculas (ensayo Solidarity8). Únicamente, 6 estudios (2,8%) fueron realizados con medicamentos clasificados como terapia celular.
De los 179 EECC, 67,2% fueron estudios nacionales y 71,0% multicéntricos, con predominancia de promotores no comerciales (64,8%), mayoritariamente de fase III (48,1%) y fase II (44,7%) (tabla 1). En cuanto a la metodología, destaca el diseño comparativo empleado en el 93,9% de los estudios. La mayoría de los ensayos estaban dirigidos al tratamiento (91,1%) y un 10,6% a la profilaxis de la enfermedad. El 21,2% de los ensayos se cerraron prematuramente, siendo los principales motivos problemas de reclutamiento (36,6%), retirada del consentimiento (26,8%) y falta de eficacia (21,9%). Hasta la fecha de corte, en noviembre 2024, el 41,1% había emitido un informe final y el 31,3% publicó resultados en revistas científicas (71,9% en el primer cuartil).
Se encontró una relación estadísticamente significativa entre disponer del informe final y variables como: estudio internacional (54,7% vs. 45,3%; p < 0,001), carácter multicéntrico (84,0% vs. 16,0%; p = 0,002), el promotor comercial (64,2% vs. 35,8%; p < 0,001), el tratamiento comparado con placebo (54,7% vs. 45,3%; p = 0,001), ensayo con el objetivo de reposicionar un fármaco existente (57,3% vs. 42,7%; p < 0,001) y no haber sufrido un cierre prematuro (69,3% vs. 30,7%; p = 0,009).
De los 179 ensayos clínicos, únicamente 49 fueron publicados en revistas indexadas. Se halló relación entre la publicación y las variables orientadas al diseño metodológico del estudio: multicéntrico (85,7% vs. 14,3%; p = 0,004), fase III (58,9% vs. 41,1%; p = 0,049) y nacional (53,6% vs. 46,4%; p = 0,01), aunque hubo más EECC internacionales entre los publicados en el primer cuartil (58,5% vs. 41,5%; p = 0,002).
Por otro lado, las variables orientadas a los resultados destacan la disponibilidad de un informe final sobre el propio estudio (64,3% vs. 35,7%; p < 0,001) y no presentan un cierre de forma prematura (89,3% vs. 10,7%; p = 0,02).
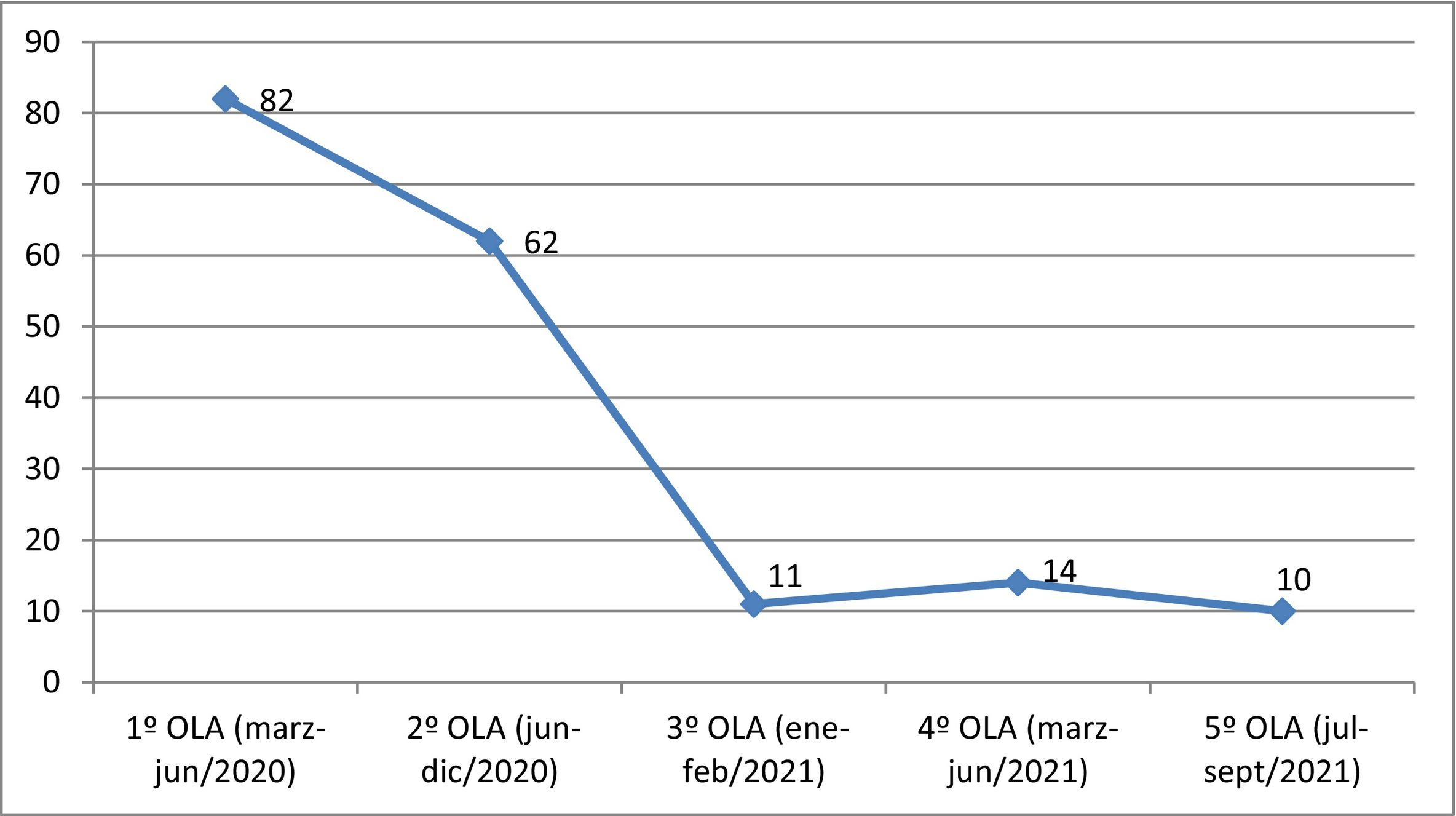
En concreto, las características principales de los estudios (N = 82) que iniciaron específicamente durante la primera ola de COVID (marzo-junio de 2020) fueron las siguientes: estudios no internacionales (82,9% vs. 17,1%; p < 0,001), promotores no comerciales (80,5% vs. 19,5%; p < 0,001), no comparativos con placebo (73,2% vs. 26,8%; p < 0,001) y con el objetivo de reposicionar fármacos (84,1% vs. 15,9%; p = 0,001).
Con respecto a las características de los estudios con aprobación durante la segunda ola (N = 62) fueron: estudios no internacionales (61,3% vs. 38,7%; p < 0,001), con promotor comercial (90,3% vs 9,7%; p < 0,001), comparativos con placebo (66,1% vs. 33,9% p = 0,04) y con el objetivo de reposicionar fármacos (70,9% vs. 29,1%; p = 0,001). Mientras que los aprobados durante la tercera, cuarta y quinta ola (N = 35) fueron: estudios internacionales (61,5% vs. 38,5%; p < 0,001), promotores comerciales (68,8% vs. 31,2%), comparativos con placebo (78,8% vs. 21,2%; p < 0,001) y con el objetivo de evaluar nuevas moléculas (59,4% vs. 40,6%; p = 0,003) (fig. 1; tabla 2).
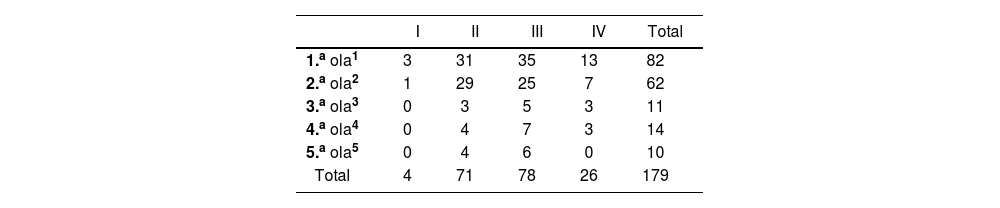
Distribución de ensayos clínicos en función de la fase y tiempo de inicio
| I | II | III | IV | Total | |
|---|---|---|---|---|---|
| 1.a ola1 | 3 | 31 | 35 | 13 | 82 |
| 2.a ola2 | 1 | 29 | 25 | 7 | 62 |
| 3.a ola3 | 0 | 3 | 5 | 3 | 11 |
| 4.a ola4 | 0 | 4 | 7 | 3 | 14 |
| 5.a ola5 | 0 | 4 | 6 | 0 | 10 |
| Total | 4 | 71 | 78 | 26 | 179 |
1:Marzo-junio de 2020; 2:junio-diciembre de 2020; 3: enero-febrero de 2021; 4: marzo-junio de 2021; 5: julio-septiembre de 2021.
La necesidad de obtener tratamientos efectivos y seguros contra la COVID-19 generó la puesta en marcha masiva de EECC. Según datos recientes, a nivel global fueron registrados en Clinicaltrials.gov más de 2.700 EECC relacionados con el SARS-CoV-213. En España se llegaron a registrar 191 estudios en el REEC. Estas cifras confirman el esfuerzo realizado por la comunidad científico-sanitaria en la búsqueda de conocimiento en este campo.
Diversas revisiones publicadas revelan importantes retos en términos de calidad, impacto, diseño y publicación en los EECC14. Por un lado, señalan que gran número de EECC presentaron importantes limitaciones metodológicas claves para maximizar su valor científico; entre ellas destacan la ausencia de un diseño consistente, los tamaños muestrales insuficientes, la ausencia de un grupo control, la ausencia de cegamiento de pacientes y médicos, y el diseño no aleatorizado15. Por otra parte, la falta de coordinación entre diferentes entidades es considerada un factor determinante en la realización de estudios16. La falta de calidad es más marcada durante la primera ola de la pandemia, momento que coincide con la necesidad de un mayor conocimiento y demanda sanitaria16,17.
En una revisión de Dal-Ré y Mahillo-Fernández18 que incluía 159 EECC no patrocinados por la industria farmacéutica, llevados a cabo en diferentes países europeos occidentales durante un año (mayo de 2020-mayo de 2021), un 44% de ellos mostraba algún criterio de baja calidad metodológica. Por este motivo, los resultados obtenidos en estos ensayos dificultaron su reproducibilidad y obtención de datos concluyentes. Un ejemplo fue el ensayo clínico que evaluaba la efectividad de hidroxicloroquina en combinación con macrólidos, con ausencia de resultados estadísticos rigurosos19. Este tipo de publicaciones favorecieron la situación de confusión producida inicialmente con respecto a los tratamientos, que finalmente obligaron a numerosas revistas científicas a retractarse a causa de una débil solidez metodológica y dudosa claridad ética20.
Además de las deficiencias metodológicas mencionadas, en nuestro estudio se ha detectado que gran número de EECC registrados en España (68,7%) no llegaron a publicar los resultados en una revista científica. Esta cifra concuerda con los resultados obtenidos en otras revisiones, como Fincham et al. (2024), donde la tasa de no publicación fue del 70,1%21. Cabe destacar que el hecho de no compartir los resultados de un ensayo clínico públicamente puede considerarse un perjuicio para los profesionales sanitarios, las autoridades regulatorias y los pacientes. El sesgo de publicación, ya sea positivo o negativo, no favorece la generación de evidencia.
Con respecto a las características metodológicas de los EECC realizados en España, se puede observar similitud frente a la investigación a nivel global. En cuanto al diseño, la mayoría de los estudios realizados durante este periodo adoptaron un planteamiento controlado y aleatorizado para garantizar la validez interna de los resultados. Un ejemplo de este diseño fue realizado en el ensayo Solidarity8, realizado por la OMS.
En cuanto a la rama control del tratamiento, los resultados obtenidos en el presente estudio sitúan como principal comparador el placebo en el 40,8% de las investigaciones, resultado superior al descrito en la revisión por Silva et al. (2023)22, con 29,1%.
Las principales barreras encontradas en el desarrollo de los EECC fueron la dificultad en el reclutamiento, la falta de eficacia y la financiación, de forma similar a las descritas por Cook et al.23 en su estudio canadiense. Además de los aspectos mencionados, es necesario considerar el impacto de la publicación de los EECC realizados. El 31,3% de los estudios analizados publicaron sus resultados en una revista científica, frente al resultado descrito por Showell et al.24, que recogen un 53%. Este porcentaje contrasta con la obligación legal de publicar los resultados de los ensayos clínicos, tanto positivos como negativos, tal como recoge la legislación vigente25.
Por otra parte, el 89,2% de las investigaciones publicadas fueron en revistas del primer cuartil de indexación, cifra muy similar al 80% descrito en el Informe anual de investigación contra el cáncer26. Esta situación plantea problemas éticos sobre la transparencia de datos, ya que muchos estudios quedaron como repositorio preprint o inacabados27. A su vez, estas investigaciones presentan el potencial de influir sobre la toma de decisiones políticas sanitarias. Un ejemplo de ello fue la prescripción de dexametasona para la reducción de mortalidad por infección respiratoria de SARS-CoV-2 en el estudio Recovery28. Esta falta de publicación de los datos obtenidos en estudios científicos puede generar una gran desconfianza.
Diversos autores y autoridades sanitarias han señalado la importancia de la calidad de la evidencia generada por estos ensayos. London y Kimmelman29 proponen 5 condiciones que debe cumplir la investigación clínica en contexto de urgencia sanitaria para que genere conocimiento y sea de relevancia social. En marzo de 2020, la Agencia Europea de Medicamentos (EMA) y la Food and Drug Administration (FDA) publicaron unas guías como herramientas de ayuda en investigación clínica durante la pandemia, con el propósito de registrar las posibles desviaciones de los protocolos y proporcionar recomendaciones para proteger la seguridad de los pacientes, manteniendo la integridad de los EECC30,31. Por su parte, la AEMPS publicó unas recomendaciones basadas en las establecidas por la EMA y adaptadas a la legislación de nuestro país32.
Durante la realización del presente estudio surgieron una serie de limitaciones. En primer lugar, el tiempo considerado para la revisión de las publicaciones fue limitado, hecho justificado por la naturaleza aguda de la infección por COVID-19 y la diferencia del margen de tiempo entre la selección de estudios (agosto de 2021) y el inicio de la búsqueda (noviembre de 2024).
Otra limitación relevante fue la escasez de información detallada sobre la finalización anticipada de algunos ensayos clínicos. Algunos estudios fueron suspendidos, cancelados o finalizaron de forma prematura, sin justificar explicaciones claras. En estas situaciones, se completó la información a través de las propias publicaciones científicas o fuentes secundarias como el REEC descrito por la AEMPS. Esta falta de transparencia limitó la posibilidad de una adecuada interpretación de las razones detrás de estas decisiones, así como su posible impacto.
ConclusiónDurante el periodo de pandemia por COVID-19, España desarrolló un moderado aumento en el número de ensayos clínicos con medicamentos, justificado por la urgencia global por identificar alternativas eficaces. En la primera ola, la mayoría de los estudios se centraron en el reposicionamiento de fármacos, con predominio de investigaciones multicéntricas, nacionales y de promotores no comerciales. A medida que avanzó la pandemia, se observó un predominio de investigaciones más complejas, con carácter internacional, promotores comerciales y diseños orientados a nuevas terapias.
Los hallazgos sugieren que existe un gran número de estudios clínicos que no llegaron a publicarse en una revista científica. Esto se traduce en una ineficacia en la investigación, de forma que no aporta valor científico ni contribuye a generar conocimiento, lo que es especialmente crítico en momentos con tanta incertidumbre. Para minimizar esta pérdida de oportunidad, es necesario mejorar la transparencia, actualizando los registros científicos y cumpliendo la obligación de hacer públicos los resultados obtenidos. Finalmente, es necesario que se revisen los factores limitantes que pueden contribuir en el estado de las publicaciones para que puedan minimizarse, previamente al proceso de diseño, financiación y evaluación científica. Esta medida puede emplearse tanto en situaciones como la pandemia por SARS-CoV-2 como en la investigación clínica habitual.
Responsabilidades éticasLos autores declaran que este trabajo es original y no ha sido publicado previamente ni está bajo consideración en otra revista y que todos los autores han contribuido significativamente y aprueban la versión final del manuscrito. Se han seguido las normas éticas aplicables en investigación. No han utilizado ni publicado datos identificativos de pacientes.
FinanciaciónLos autores declaran que no se recibió ningún tipo de financiación.
Contribución de los autoresCristina González-Pérez: análisis formal, escritura, revisión y edición del artículo; Eduardo Tejedor-Tejada: análisis formal, curación de datos, escritura articulo original; María del Puy Goyache Goñi: metodología, análisis formal, curación de datos; María Serrano-Alonso: escritura, revisión y edición del artículo, supervisión y María Pilar Suñé-Martín: metodología, análisis formal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración de contribución de autoría CRediTEduardo Tejedor-Tejada: Writing – review & editing, Writing – original draft, Validation, Supervision, Project administration, Methodology, Formal analysis, Data curation. Cristina González-Pérez: Writing – review & editing, Writing – original draft, Validation, Formal analysis, Data curation. María del Puy Goyache Goñi: Writing – review & editing, Writing – original draft, Validation, Supervision, Methodology, Investigation, Formal analysis, Data curation. María Pilar Suñé-Martín: Writing – review & editing, Writing – original draft, Validation, Methodology, Investigation, Data curation, Conceptualization. María Serrano-Alonso: Writing – review & editing, Writing – original draft, Supervision, Methodology, Investigation, Data curation, Conceptualization. Rafael Sánchez-del Hoyo: Validation, Supervision, Methodology, Formal analysis.