evaluar el perfil de seguridad de nirmatrelvir-ritonavir (NMV-r) en la práctica clínica real y analizar la relevancia clínica de las interacciones farmacológicas en el desarrollo de eventos adversos.
Material y métodosestudio observacional, retrospectivo en el que se evaluaron los datos de seguridad de pacientes tratados con NMV-r entre abril y julio de 2022. Se recopilaron datos demográficos y analíticos antes de comenzar el tratamiento. La duración del seguimiento fue de 28 días y se evaluó el número reacciones adversas reportadas, así como si fueron manejadas de forma ambulatoria o precisaron de asistencia sanitaria especializada y la presencia de deterioro de la función renal y hepática. Se revisó el tratamiento concomitante, identificando interacciones farmacológicas teóricas (IFT) cuya gravedad fue definida mediante la clasificación Lexi-interact.
Resultadosel estudio incluyó 146 pacientes, 82 (56,16 %) eran mujeres, cuya mediana de edad fue de 65 años (22-95). El número de IFT detectadas y mantenidas durante el tratamiento con NMV-r fue de 164, siendo el porcentaje de pacientes con al menos una interacción de 62,33%. La mediana de IFT por paciente fue de uno (0-5). En 18 pacientes (11,84%) se reportó al menos un evento adverso (EA). Once EA se relacionaron potencialmente con alguna IFT, 7 pacientes requirieron contacto con asistencia hospitalaria para el manejo del EA, 8 pacientes presentaron deterioro de la función renal y 2 de la función hepática a los 28 días. Los principales grupos de fármacos implicados en la aparición de algún EA fueron los anticoagulantes orales, así como los calcio-antagonistas.
Conclusionesnuestros resultados muestran un elevado número de IFT detectadas entre NMV-r y otros fármacos, aunque la frecuencia de EA asociados fue baja. Este estudio proporciona un mayor conocimiento de los fármacos implicados en dichas interacciones y su potencial relación con la aparición de EA.
The aim of the study was to evaluate the safety profile of nirmatrelvir-ritonavir (NMV-r) in real clinical practice and to analyze the clinical relevance of drug-drug interactions in the development of adverse events.
MethodsObservational, retrospective study in which safety data of patients treated with NMV-r between April and July 2022 in an outpatient setting were evaluated. The duration of follow-up was 28 days and the number of adverse reactions reported, as well as whether they were managed on an outpatient basis or required health care, and the presence of renal and hepatic function impairment were assessed. Concomitant treatment was reviewed, identifying theoretical drug-drug interactions (TDDIs) whose severity was defined using the Lexi-interact classification.
ResultsThe study included 146 patients, 82 (56,16%) were women, whose median age was 65 years (22-95). The number of TDDIs detected and maintained during treatment with NMV-r was 164, with the percentage of patients with at least one interaction being 62,33%. The median number of TDDIs per patient was 1 (0-5). At least 1 adverse event (AE) was reported in 18 patients (11,84%). Eleven AEs were potentially related to any TDDI. Seven patients required contact with hospital assistance for AE management. Eight patients had impaired renal function and 2 had impaired liver function at 28 days. The main groups of drugs implicated in the occurrence of an AE were oral anticoagulants and calcium antagonists.
ConclusionsOur results show a high number of TDDIs detected were detected between NMV-r and other drugs. This study provides greater knowledge of the drugs involved in such interactions and their potential relationship with the occurrence of adverse events.
Nirmatrelvir/ritonavir (NMV-r) es un antivírico autorizado por la EMA e indicado en adultos que no requieren aporte de oxígeno suplementario y que tienen riesgo elevado de progresión a formas graves de la enfermedad por coronavirus 2019 (COVID-19), enfermedad infecciosa que ha causado más de 6 millones de muertes en todo el mundo1. Su eficacia está demostrada con base en los resultados del ensayo clínico EPIC-HR, un estudio fase 2/3 controlado con placebo, en el que el tratamiento con NMV-r muestra una reducción relativa del 89% del riesgo de hospitalización o muerte por cualquier causa en los 28 días siguientes al inicio del tratamiento2. EPIC-HR notifica numéricamente más sospechas de eventos adversos (EA) relacionados con NMV-r que con placebo. Actualmente NMV-r es el tratamiento de elección en pacientes inmunodeprimidos o que tienen un alto riesgo de desarrollar formas graves de esta enfermedad, empleado a dosis estándar de 300 mg de nirmatrelvir con 100 mg de ritonavir cada 12 horas durante 5 días. El efecto de nirmatrelvir se atribuye al bloqueo de la proteasa seudo 3C de SARS-CoV-2 y es metabolizado en humanos por vía enzimática del citocromo P450 (CYP3A4)3. Ritonavir es un conocido y potente inhibidor de esta enzima, por lo que se utiliza en el tratamiento de la infección por VIH como potenciador de los inhibidores de proteasa y es bien conocido por su capacidad de generar interacción, potencialmente grave, con muchos otros fármacos4. De hecho, se estima que aproximadamente un 30% de la población general estaría expuesta a potenciales interacciones con este fármaco, lo que incrementa a más de un 60% en los mayores de 60 años5. Existen diversos algoritmos para el manejo de las interacciones farmacológicas en los pacientes en tratamiento con NMV-r6,7; sin embargo, pese al conocimiento teórico de la interacción, actualmente se dispone de escasos estudios que analicen su relevancia clínica en la práctica habitual. Además, la reciente aplicabilidad de ritonavir en la infección por SARS-CoV-2 supone la posibilidad de prescripción del fármaco por médicos no familiarizados con el manejo de este fármaco, lo cual conlleva la posible aparición de un EA por interacciones farmacológicas inadvertidas en el momento de pautar el tratamiento. El objetivo de este trabajo es evaluar el perfil de seguridad de NMV-r en vida real, recogiendo las interacciones teóricas detectadas, los EA observados y analizar la relevancia clínica de las interacciones farmacológicas en el desarrollo de EA.
MétodosEstudio observacional, retrospectivo, en el cual se evaluaron datos de seguridad en una cohorte de 146 pacientes tratados consecutivamente con NMV-r entre el periodo de abril y julio de 2022. El tratamiento con NMV-r se realizó a dosis de 300 mg de nirmatrelvir y 100 mg de ritonavir cada 12 horas durante 5 días, salvo en los pacientes que requirieron ajuste de dosis por alteración de la función renal, que recibieron 150 mg de nirmatrelvir y 100 mg de ritonavir con la misma posología. El ámbito del estudio fue ambulatorio en los pacientes pertenecientes a un hospital de clase 5 según la clasificación clúster8, con 1.300 camas y una población asignada como hospital de referencia de 450.000 personas. Se recogieron datos demográficos (edad y sexo), así como analíticos (filtración glomerular estimada y transaminasas) antes de empezar con el tratamiento, nivel de priorización según los criterios publicados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y el protocolo del hospital: pacientes sin requerimiento de oxígeno, dentro de los primeros 5 días de síntomas, inmunodeprimidos o con riesgo de desarrollar formas graves de COVID-19. La duración de seguimiento fue de 28 días, evaluándose el número de reacciones adversas reportadas, el requerimiento de asistencia sanitaria (tanto en ámbito de atención primaria como especializada) y la función renal y hepática. Las reacciones adversas fueron clasificadas según los criterios de terminología común de reacciones adversas del National Cancer Institute, (versión 5.0). Se revisó el tratamiento farmacológico concomitante de todos los pacientes incluidos en el estudio. Las interacciones teóricas atribuidas a fármacos que no fueron interrumpidos se cuantificaron y clasificaron según el código ATC de la organización mundial de la salud (OMS) y son el objeto de estudio de este trabajo. La gravedad de cada interacción fue evaluada según la clasificación Lexi-interact, una base de datos de Lexicomp, de acceso libre y ámbito internacional que refleja tanto el nivel de urgencia como la naturaleza de las acciones necesarias a tomar ante una interacción9. En el proceso de validación farmacéutica se recomendó interrumpir el tratamiento en aquellos fármacos donde la interacción teórica era de alta significación clínica (D/X Lexi-Interact) y el balance beneficio/riesgo pudiera ser desfavorable. Los datos del estudio se recogieron del programa de prescripción e historia clínica del centro. Para el análisis estadístico se realizó un análisis descriptivo. Se utilizó la frecuencia absoluta y relativa para describir las variables cualitativas y mediana y el rango intercuartílico para las cuantitativas. El estudio fue aprobado por el Comité Ético de Investigación con Medicamentos del hospital (referencia 23/150) que eliminó la necesidad de consentimiento informado por escrito y permitió el uso de información previamente recopilada y anonimizada. Los resultados se informaron de acuerdo con las pautas STROBE (Strengthening the Reporting of Observational Studies in Epidemiology).
ResultadosDe los 146 pacientes incluidos en el estudio, 82 (56,1%) eran mujeres, cuya mediana de edad fue de 65 años (22-95). Veintisiete pacientes (18,69%) requirieron ajuste de dosis previo al inicio de tratamiento por función renal comprendida entre 30 y 60 ml/min. En estos pacientes la dosis fue de 150 mg de nirmatrelvir y 100 mg de ritonavir cada 12 horas durante 5 días; 106 (72,60%) pacientes cumplieron indicación por estar dentro del grupo uno de pacientes con condiciones de alto riesgo priorizadas en adultos de la AEMPS10, que corresponde a pacientes inmunodeprimidos independientemente del estado de vacunación. Treinta pacientes (20,54%) pertenecían al grupo 4 de pacientes mayores a 80 años con al menos un factor de riesgo de progresión a formas graves. Un paciente (0,68%) no estaba vacunado. El número de interacciones teóricas detectadas y mantenidas durante el tratamiento con NMV-r fue de 164, siendo el porcentaje de pacientes con al menos una interacción de 62,33%. La mediana de interacciones por paciente fue de uno (0-5). Entre las interacciones teóricas que no llevaron a la retirada de fármacos, 140 (85,37%) fueron de clase C (monitorizar terapia), 18 (10,98%) de clase D (considerar modificar terapia) y 6 (3,66%) de clase X (contraindicado); en este último caso las asociaciones se mantuvieron tras la evaluación conjunta entre el médico y el farmacéutico, por considerarse que el tratamiento concomitante mostraba un balance beneficio-riesgo favorable. En la tabla 1 se describen los EA detectados, relacionados o no a interacciones y si se requirió contacto con asistencia sanitaria o no, así como el número de pacientes que presentaron deterioro de la función renal y/o hepática. La tabla 2 desglosa los grupos farmacoterapéuticos que produjeron potencialmente algún EA, de qué EA se trató y qué fármaco estuvo implicado.
Resumen global de los eventos adversos
| Variable | n = 146 (%) |
|---|---|
| Pacientes con eventos adversos a 28 días | 18 (11,84) |
| Eventos adversos relacionados potencialmente con interacciones | 11 (61,1) |
| Pacientes con manejo ambulatorio de eventos adversos | 11 (7,53) |
| Pacientes que requirieron contacto con asistencia sanitaria (atención primaria u hospitalaria) | 7 (4,60) |
| Pacientes con deterioro de la función renal a los 28 días | 8 (7,02) |
| Pacientes con deterioro de la función hepática a los 28 días | 2 (1,75) |
| Pacientes con interrupción de nirmatrelvir-ritonavir por eventos adversos | 2 (1,37) |
Descripción de las reacciones adversas reportadas según grupo terapéutico implicado en la interacción teórica
| Grupos terapéuticos implicados en los EA a los 28 días: | No. de EA | EA reportado (n) | Fármaco implicado en la aparición del EA |
|---|---|---|---|
| B01A (anticoagulantes orales) | 4 | Disminución del INR (3) | Acenocumarol |
| Anemización (1) | Edoxabán | ||
| C08C (antagonistas del calcio) | 3 | Hipotensión (2) | Amlodipino |
| Edema periférico (1) | Amlodipino | ||
| A10B (antidiabéticos orales) | 2 | Diarrea (2) | Metformina |
| N02B (analgésicos y antipiréticos) | 2 | Diarrea (2) | Metamizol |
| C10A (inhibidores de HMGCoA reductasa) | 1 | Pérdida de consciencia (1) | Rosuvastatina |
| G04C (fármacos usados en HBP) | 1 | Fallo renal agudo (1) | Tamsulosina |
| H02A (glucocorticoides uso sistémico) | 1 | Trastornos neuromusculares (1) | Dexametasona |
| H03A (hormonas tiroideas) | 1 | Alteración del perfil tiroideo (1) | Levotiroxina |
| L01X (quimioterapia antineoplásica) | 1 | Hipocalcemia (1) | Bortezomib |
| N02A (opioides) | 1 | Diarrea (1) | Morfina |
| A11C (vitamina D y derivados) | 1 | Disgeusia (1) | Colecalciferol |
EA: Evento adverso; INR: International Normalized Ratio.
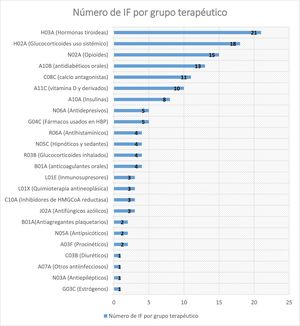
De los 146 pacientes, 76 (52,05%) no presentaron ningún EA pese a que mantuvieron algún fármaco que interaccionaba potencialmente con NMV-r. El número de interacciones farmacológicas (IF) detectadas que no produjeron EA en nuestros pacientes se describen en la figura 1.
Se detectaron 3 EA de grado 3 o 4. La interacción entre NMV-r y tamsulosina en un paciente produjo fallo renal agudo que requirió el ingreso hospitalario. En el segundo caso, un paciente tratado con amlodipino desarrolló hipotensión, manejada en el ámbito de atención primaria. En el tercer caso, un paciente tratado con bortezomib desarrolló hipocalcemia grado 3 que requirió visita a urgencias y tratamiento con gluconato cálcico intravenoso.
DiscusiónComparado con el ensayo pivotal, en nuestra cohorte de pacientes hemos apreciado una menor incidencia de cualquier EA (12,33% vs. 22,6%), y de una menor gravedad (1,3% de EA se categorizaron como grado 3 o 4 vs. 4,1%)2. Es posible que pueda atribuirse a la falta de seguimiento proactivo por medio de la realización de encuestas a los pacientes, en contraste con las condiciones de seguimiento del ensayo clínico. Las principales diferencias entre nuestros pacientes y los del estudio de Hammond et al. fueron que la mediana de edad de nuestros pacientes era superior (65 vs. 44 años) y la mayor cobertura vacunal en nuestra cohorte (99% vs. 0%), no teniendo correlación con las variables analizadas en nuestro estudio.
En una revisión reciente llevada a cabo por Marzolini et al. se resume la probabilidad de tener IF teóricas clínicamente relevantes en función de los fármacos implicados11. Los resultados de nuestro estudio concuerdan con lo expuesto en esta revisión, ya que analiza el bajo potencial de IF clínicamente significativa entre grupos como antidiabéticos orales y glucocorticoides. En nuestra cohorte, ambos grupos terapéuticos se situaron como los de mayor frecuencia de interacciones potenciales sin producir daño. Por otra parte, la revisión establece el potencial de IF relevante entre NMV-r y antihipertensivos como los antagonistas del calcio, cuyo AUC puede verse incrementado hasta 2 veces y en nuestra población se produjo un EA en un 21% de los pacientes tratados con antagonistas del calcio, 11 no se asociaron a ningún EA.
Otro grupo de fármacos que se trata en dicha revisión es el de los anticoagulantes orales y antiagregantes plaquetarios, que fueron objeto de la IF clínicamente relevante mayoritaria en nuestro estudio. En concreto en 3 de 4 pacientes tratados conjuntamente con NMV-r y acenocumarol se produjo una disminución en el INR, requiriendo ajuste ambulatorio de la dosis del antivitamina K. Esto concuerda con estudios, como el realizado por Muse et al.12, en el que se midió el INR en 29 pacientes tratados con NMV-r y warfarina. La mediana del INR antes de la administración de NMV-r fue de 2,4 (1,1 - 3,7), pero disminuyó a 1,95 (1,5 - 2,3) tras el inicio de NMV-r y aproximadamente la mitad de los pacientes experimentaron valores de INR subterapéuticos (objetivo INR 2-3).
Dado el elevado porcentaje de pacientes en los que se detectaron interacciones farmacológicas, podemos concluir que el tratamiento con NMV-r conlleva un manejo exhaustivo de la farmacoterapia de los pacientes, habitualmente mayores y polimedicados. Dicho manejo suele conllevar reducciones de dosis, discontinuaciones de algunos fármacos o incremento en la monitorización de eventos adversos. En la población estudiada muchos fármacos fueron discontinuados, recomendándose la reintroducción de los mismos tras 3 días de haber terminado el tratamiento con NMV-r.
En nuestro estudio, el elevado número de IF detectadas no se correspondió con la baja incidencia de EA relacionadas con dichas IF. Además de no poder descartar que la causa sea por falta de seguimiento proactivo, esto puede ser debido principalmente a la baja dosis usada de ritonavir (100 mg) comparado con su uso en el tratamiento del VIH (200-400 mg al día) y con la corta duración de la pauta de tratamiento, de 5 días frente a los tratamientos crónicos en VIH. Se ha observado que el efecto de inhibición de CYP3A4 por parte de ritonavir es máximo a las 48 horas13, mientras que los efectos de inducción enzimática de CYP2C9 o CYP2C19 se dan con mayor intensidad a los 5 o 7 días de tratamiento, pudiendo tener menor relevancia clínica las IF que se desarrollen por medio de la inducción.
Una de las principales limitaciones de nuestro estudio es su carácter retrospectivo. Por otra parte, hubo EA que se produjeron en los pacientes con interacciones farmacológicas teóricas que podrían no tener relación exclusiva con dicha interacción, ya que forman parte del perfil de seguridad intrínseco de dichos medicamentos, como son la diarrea en los pacientes con metformina y o la disgeusia en el paciente con colecalciferol. Para la clasificación de las interacciones según la gravedad se utiliza una única base de datos, con intención de mantener un criterio homogéneo. La principal fortaleza del estudio es que proporciona un mayor conocimiento de los fármacos implicados, así como de la naturaleza de las interacciones y sus potenciales efectos, lo cual puede permitir diseñar estrategias dirigidas a la detección precoz de grupos de pacientes con medicación de mayor riesgo y a mejorar los resultados en salud, apoyando las decisiones clínicas con experiencia en la vida real.
ConclusionesNuestros resultados muestran un elevado número de interacciones farmacológicas teóricas detectadas entre NMV-r y otros fármacos, aunque la frecuencia de EA asociados es baja. Este estudio proporciona un mayor conocimiento de los fármacos implicados en dichas interacciones y su potencial relación con la aparición de EA. El farmacéutico hospitalario podría ser una figura clave en el manejo farmacoterapéutico de los pacientes tratados con NMV-r, así como en la prevención de EA, aunque se necesitarían futuros estudios para valorar el efecto de la revisión de interacciones por el farmacéutico en los resultados de salud.
La urgencia sanitaria que ha supuesto la COVID-19 ha obligado a una rápida generación de evidencia científica, por lo que en el momento actual es necesaria la publicación de estudios que amplíen nuestros conocimientos en el manejo farmacológico de esta enfermedad, papel en el que los servicios de farmacia hospitalaria son un elemento clave14,15.
Aportación a la literatura científicaEl presente estudio aporta experiencia de uso de nirmatrelvir-ritonavir en vida real. Este medicamento cubre una necesidad médica en los pacientes con alto riesgo de desarrollo de infección grave por SARS-CoV-2, por lo que ha recibido autorización condicional por parte de la EMA; sin embargo, el manejo de las interacciones farmacológicas y su papel en el desarrollo de eventos adversos aún no están claros. La evidencia de eventos adversos reportados, sumado al análisis de las interacciones farmacológicas teóricas detectadas hace que este artículo pueda ser de utilidad para ayudar a optimizar el uso de medicamentos y guiar la toma de decisiones clínicas el tratamiento de pacientes con COVID-19.
Declaración de autoríaÁlvaro González Gómez y Jose Manuel Caro-Teller han colaborado con la concepción de la idea original, Diseño del trabajo, recogida, análisis e interpretación de los datos, escritura, revisión crítica y aprobación de los datos.
Iván González Barrios ha colaborado con el diseño del trabajo, recogida y análisis de los datos, escritura y revisión crítica del artículo.
Almudena Castro Frontiñán ha colaborado en Interpretación de los datos, escritura y revisión del manuscrito.
Pedro Pablo Rodríguez Quesada ha colaborado en la revisión del manuscrito.
José Miguel Ferrari-Piquero ha contribuido al análisis e interpretación de los datos y la escritura y revisión crítica del artículo.
Todos los autores han aprobado la versión final del artículo.
FinanciaciónSin financiación.
Conflicto de interesesSin conflicto de intereses.
Responsabilidad y cesión de derechosTodos los autores aceptamos la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (disponible en http://www.icmje.org/).
Los autores cedemos, en el supuesto de publicación, de forma exclusiva los derechos de reproducción, distribución, traducción y comunicación pública (por cualquier medio o soporte sonoro, audiovisual o electrónico) de nuestro trabajo a Farmacia Hospitalaria y por extensión a la SEFH.
Responsabilidades éticasEl estudio fue aprobado por el Comité Ético de Investigación con Medicamentos del hospital (ref. 23/150) que eliminó la necesidad de consentimiento informado por escrito y permitió el uso de información previamente recopilada y anonimizada.