Analizar la relación entre las dosis administradas de gemcitabina-carboplatino (GEM-CARBO) y la incidencia y grado de toxicidad, hematológica y renal, y la adherencia al tratamiento en pacientes con cáncer de pulmón no microcítico.
MétodosEstudio retrospectivo de 37 meses de duración. El conjunto mínimo de datos para realizar el seguimiento de los pacientes se obtuvo con ayuda del programa informático Farmis-Oncofarm® y de las historias clínicas y farmacoterapéuticas.
La toxicidad hematológica se evaluó de acuerdo con la Common Toxicity Criteria 3.0. La toxicidad renal se valoró a partir de los datos de concentración sérica de creatinina y el aclaramiento de creatinina.
ResultadosSe han incluido en el estudio 31 pacientes a los que se les administraron un total de 122 ciclos. La incidencia de anemia y neutropenia grado III fue de un 34,0 y un 30,8%, respectivamente, de trombocitopenia de grado III del 3,8% y de grado IV del 7,7%. No se ha identificado ningún caso de toxicidad renal. El 65,0% de los pacientes recibieron más del 85,0% de la dosis de carboplatino teórica planeada y el 58,0% de los pacientes recibieron más del 85,0% de la dosis de gemcitabina teórica planeada. Se retrasó la administración en el 18,0% de los ciclos prescritos.
ConclusionesLa indicación y prescripción del esquema GEM-CARBO se ha ajustado con unas evidencias científicas sólidas, pero su toxicidad hematológica ha limitado su uso y ha dificultado la administración de la intensidad de dosis prevista comprometiendo la efectividad del tratamiento.
To analyse the relationship between doses of gemcitabine-carboplatin (GEM-CARBO) administered and incidence and level of haematological and renal toxicity, and the adherence to the treatment in patients with non-small cell lung cancer.
MethodsRetrospective study which lasted for 37 months. We were able to obtain the minimum set of data needed to carry out the follow-up with the help of Farmis-Oncofarm® software and the medical and pharmacotherapeutic records.
The haematological toxicity was assessed in accordance with the Common Toxicity Criteria 3.0. Renal toxicity was evaluated using serum creatinine levels and creatinine clearance.
ResultsThirty-one patients were included in the study who were administered a total of 122 cycles. There was a 34.0% and 30.8% incidence of anaemia and grade 3 neutropaenia, respectively. There was also a 3.8% and 7.7% incidence of grade 3 and grade 4 thrombocytopaenia, respectively. No cases of renal toxicity were found. 65.0% of patients received more than 85.0% of the planned theoretical dosage of carboplatin and 58% of patients received more than 85.0% of the planned theoretical dosage of gemcitabine. Administration was delayed in 18.0% of the cycles prescribed.
ConclusionsThe indication and prescription of the GEM-CARBO regimen was adjusted in accordance with solid scientific evidence, but its haematological toxicity limited its use and made it difficult to maintain the dose intensity foreseen in the study. This compromised the effectiveness of the treatment.
El cáncer de pulmón es el más frecuente del mundo, se estima que su incidencia global se incrementa un 0,5% anualmente y se establece como la principal causa de muerte relacionada con cáncer tanto en hombres como en mujeres, razón hombre:mujer de 11:11,2.
Entre el 75-80% de los casos diagnosticados de cáncer de pulmón pertenecen al tipo histológico no microcítico (CPNM) y en el momento del diagnóstico más de la mitad de los pacientes presentan enfermedad metastásica no operable o en estadio IV3. La mediana de la supervivencia de estos pacientes si no reciben tratamiento antineoplásico varía entre 4 y 5 meses4,5.
La cirugía es la mejor opción curativa cuando la enfermedad se diagnostica en un estadio precoz (I-II) y en algunos casos seleccionados de enfermedad localmente avanzada (estadio IIIa)6. En el momento del diagnóstico más del 40% de los pacientes no son candidatos a cirugía bien porque presentan metástasis a distancia o porque la enfermedad está avanzada (estadio IIIb-IV). En estos últimos la opción terapéutica es la quimioterapia antineoplásica que ha mostrado ser superior a los mejores cuidados de soporte7. La disponibilidad de un número elevado de esquemas oncológicos y la variabilidad y complejidad en su utilización exigen la participación de un equipo interdisciplinario como garantía de una mejora de la calidad de la terapia que recibe el paciente1,8.
Los dobletes constituidos por las sales de platino, cisplatino o carboplatino (CARBO), en combinación con gemcitabina (GEM), paclitaxel, vinorelbina, docetaxel o pemetrexed, constituyen los esquemas farmacoterapéuticos más utilizados en el CPNM avanzado, siendo la combinación con cisplatino la primera línea de tratamiento6–10. Estos dobletes han sido comparados entre sí y los resultados obtenidos indican que su eficacia es equivalente pero ocasionan diferente perfil de toxicidad6–15. Del análisis de los estudios se desprende que las combinaciones con CARBO son menos tóxicas y tienen un grado de aceptación mayor por parte de los pacientes que las combinaciones con cisplatino16.
Los estudios realizados en pacientes con CPNM avanzado o metastásico tratados con el doblete quimioterápico de GEM-CARBO demuestran una eficacia medida como respuesta global, supervivencia, tiempo medio de progresión y supervivencia a un año similar cuando se mantiene la periodicidad entre ciclos (21 días) y se administran las dosis plenas de CARBO (área bajo la curva concentración plasmática-tiempo [AUC] objetivo de 5mg/ml/min) y GEM (días 1 y 8 del ciclo a la dosis de 1.200mg/m2). Sin embargo, el perfil y el grado de toxicidad hematológica derivado varía según la fuente bibliográfica consultada, así, la incidencia de anemia de grados III y IV varía entre el 2,1 y el 18%, la de neutropenia de grados III y IV entre el 2,6 y el 34% y la de trombocitopenia de grados III y IV entre el 13,8 y el 32,6%13–15.
El objetivo de este estudio es analizar la relación entre las dosis de GEM-CARBO administradas y la incidencia y grado de toxicidad hematológica y renal derivados del tratamiento en pacientes con CPNM avanzado (IIIb-IV), y la adherencia al mismo.
MétodosEstudio retrospectivo realizado en el Hospital Universitario Dr. Peset de Valencia con los pacientes diagnosticados de CPNM avanzado que durante el período comprendido entre enero de 2006 y enero de 2009 (37 meses) iniciaron tratamiento con el esquema GEM-CARBO. Este esquema constituye en el Hospital Universitario Dr. Peset de Valencia la primera línea de tratamiento para los pacientes diagnosticados de CPNM de edad avanzada, con intolerancia confirmada a cisplatino y/o pacientes con insuficiencia renal16–19.
El esquema GEM-CARBO está formado por GEM 1250mg/m2, administrado en perfusión intravenosa durante 30min los días 1 y 8 del ciclo, y CARBO dosificado para alcanzar un AUC objetivo de 5mg/ml/min, administrado en perfusión continua de 60min el día 1 del ciclo. A los pacientes mayores de 65 años con un bajo estadio funcional según protocolo en el marco de un estudio asistencial igual o mayor que 2 (Escala Eastern Cooperative Oncology Group [ECOG])20 se les dosificó para obtener un AUC objetivo de 4mg/ml/min para disminuir la probabilidad de aparición de morbilidad asociada a carboplatino19,21,22.
La selección de dosis de CARBO se realizó con la fórmula de Calvert23: D=AUCobjetivo x (TFG+25), en la que la ecuación de Cockroft-Gault (CG)24 se utiliza como estándar de práctica en el cálculo de la tasa de filtración glomerular (TFG).
El máximo número de ciclos predefinidos para este esquema, con una periodicidad interciclo predefinida de 21 días, es de 4 si se estabiliza la enfermedad, o de 6 ciclos en caso de respuesta al tratamiento6,9,19. En aquellos pacientes con progresión de la enfermedad durante el tratamiento o elevada toxicidad se suspendió el tratamiento con este esquema.
La toxicidad hematológica se manejó con retrasos en la periodicidad de la quimioterapia para recuperación hematológica, individualización posológica y profilaxis secundaria con eritropoyetina y factores estimuladores de colonias (CSF)13–19,22.
Los datos necesarios para el seguimiento clínico y farmacoterapéutico de los pacientes se obtuvieron del programa informático Farmis-Oncofarm®, y de las historias clínicas y farmacoterapéuticas.
Se registraron las variables antropométricas, edad, peso y talla, y estadio funcional.
Se calcularon de forma individualizada las dosis de antineoplásicos teóricas (Dt) para el primer ciclo del esquema GEM-CARBO con el fin de evaluar la variabilidad con la dosis prescrita (Dp), aceptándose diferencias de dosis (DD) de ± 10% para el CARBO debido a la utilización de varias fórmulas para su cálculo y a la aproximación realizada de FGR en ClCr, y de ± 5% para la GEM16,25–27. La DD se calculó utilizando la expresión siguiente: DD=[(Dp-Dt)/Dt] x 100.
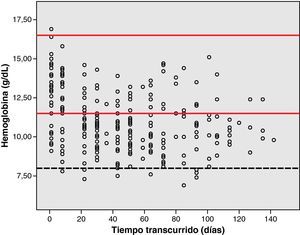
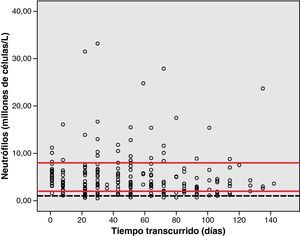
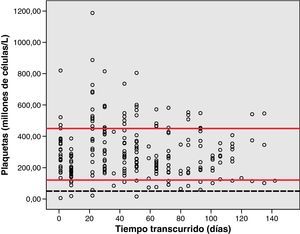
La toxicidad hematológica se evaluó de acuerdo con la Common Toxicity Criteria (CTC) 3.0 a partir de los registros realizados durante el tratamiento de la hemoglobina (Hb), recuento absoluto de neutrófilos (RAN) y el recuento de plaquetas (Pt). El ámbito de normalidad definido en este hospital para la Hb está comprendido entre 11,5 y 16,5g/dl, para el RAN entre 2 y 8 x 109 cél./l y para las Pt valores comprendidos entre 120 y 450 x109 cél./l.
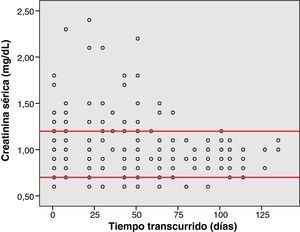
La toxicidad renal se valoró a partir de los datos de concentración sérica de creatinina (Cr) y el aclaramiento de creatinina (ClCr) calculado de acuerdo con la fórmula de CG. Un incremento de la Cr basal en 0,5mg/dl o superior se valoró como toxicidad renal positiva.
La toxicidad inherente al esquema farmacoterapéutico GEM-CARBO se determinó mediante la evaluación de la toxicidad hematológica y renal, tras la administración del primer ciclo, en aquellos pacientes a los que se les administraron las dosis de antineoplásicos acordes al estándar predefinido del esquema y no recibieron factores eritropoyéticos ni CSF como tratamiento de soporte.
La evaluación de la adherencia al tratamiento se ha realizado a partir de los parámetros descritos en los 4 puntos siguientes25–27:
- 1.
Número de pacientes que recibieron la totalidad de ciclos del esquema.
- 2.
Intensidad de dosis; porcentaje de dosis administrada en los pacientes de un antineoplásico en un plazo de tiempo determinado (hasta progresión y/o ciclos predefinidos según respuesta), respecto a la dosis total teórica26.
- 3.
Número de pacientes cuya intensidad de dosis es mayor al 85%, ya que dosis inferiores comprometen la eficacia del tratamiento. El límite del 85% se establece en los ensayos clínicos para analizar la adherencia o cumplimiento adecuado25–27.
- 4.
Retrasos en la periodicidad interciclos mayores a ± 3 días. El equipo asistencial estableció que diferencias de 3 días por encima o por debajo de la fecha prevista no alteran el cumplimiento en la periodicidad del esquema.
De los 31 pacientes incluidos en el estudio, 30 eran varones y el 55% de la población (17/31) de edad superior a 65 años, 5/31 presentaban bajo estado funcional (escala ECOG igual o superior a 2). Recibieron un total de 122 ciclos (122 días 1 y 115 días 8).
En la tabla 1 se muestran las medidas de tendencia central y de dispersión de las variables antropométricas, bioquímicas y posológicas, medidas en el ciclo 1 del tratamiento.
Variables antropométricas, bioquímicas y posológicas en el ciclo 1
| Variables | Media (IC 95%) |
| Edad (años) | 66,5 (60,2-72,8) |
| Peso (kg) | 72,8 (68,6-77,0) |
| Talla (cm) | 166,8 (164,5-169,1) |
| Cr (mg/dl) | 1,1 (1,0-1,2) |
| ClCr (ml/min) | 71,4 (61,7-81,1) |
| Dosis carboplatino prescrita (mg) | 468,6 (419,9-517,3) |
| Dosis carboplatino teórica (mg) | 477,8 (422,3-533,3) |
| DD de carboplatino en ciclo 1 (%) | -0,85 (-3,69-1,99) |
| Dosis gemcitabina prescrita (mg) | 2.220 (2.088,5-2.351,5) |
| Dosis gemcitabina teórica (mg) | 2.262,5 (2.191,5-2.333,5) |
| DD de gemcitabina en el ciclo 1 (%) | -2,16 (-6,78-2,46) |
DD: diferencia de dosis; IC 95%: intervalo de confianza al 95%.
Al inicio del tratamiento con el esquema GEM-CARBO todos los pacientes presentaron valores de Hb, Pt y RAN en el ámbito de normalidad. El 19% de la población (6/31) había recibido un tratamiento previo con otro esquema mielosupresor y recibía tratamiento con eritropoyetina y CSF como profilaxis secundaria de anemia y neutropenia a la quimioterapia al inicio del tratamiento con el esquema GEM-CARBO.
La individualización de la dosis de CARBO se realizó para obtener un AUC objetivo de 5mg/ml/min en un 84% de la población (26/31 pacientes). En el 16% restante (5/31) se seleccionó un AUC objetivo de 4mg/ml/min. Para estos 5 pacientes la dosis mediana de CARBO prescrita en el ciclo 1 fue de 380mg y la mediana teórica calculada de 372mg.
En el primer ciclo de tratamiento, para un 97% de los pacientes (30/31), la variación entre la dosis de GEM prescrita y la teórica calculada fue menor a un ± 5%. El paciente que no cumple esta condición es porque presentaba un estadio funcional bajo y tras la administración del ciclo 1 día 1 del esquema GEM-CARBO se definió para éste un plan farmacoterapéutico excluyendo la administración de GEM el día 8 de cada ciclo.
Cinco pacientes fallecieron antes de recibir el segundo ciclo del esquema, por lo que se excluyeron para el posterior análisis de toxicidad y adherencia, quedando una muestra de 26 pacientes para estos estudios.
Análisis de toxicidadLa figura 1 muestra el gráfico de dispersión de las determinaciones de Hb de los pacientes, desde que iniciaron la quimioterapia con el esquema GEM-CARBO (día 1) hasta el día que finalizaron. Las figuras 2, 3 y 4 reproducen los gráficos de dispersión de las determinaciones de RAN, Pt y de las determinaciones de Cr, respectivamente.
La incidencia de toxicidad hematológica grados III y IV del esquema GEM-CARBO en los pacientes incluidos en el estudio fue del 53,8% (14/26) pacientes. La tabla 2 muestra los distintos episodios de toxicidad hematológica registrados en la población estudiada por ciclo.
Incidencia de toxicidad hematológica de grados III y IV por ciclo ocasionada por el tratamiento con el esquema GEM-CARBO en la población en estudio
| Toxicidad hematológica | Ciclo 1 (n=26) | Ciclo 2 (n=26) | Ciclo 3 (n=25) | Ciclo 4 (n=20) | Ciclo 5 (n=12) | Ciclo 6 (n=8) | Total (%) |
| Anemia | |||||||
| Grado III | 1 | 2 | 1 | 1 | 4 | - | 9 (34,6) |
| Grado IV | - | - | - | - | - | - | - |
| Neutropenia | |||||||
| Grado III | - | 3 | 2 | 2 | 1 | - | 8 (30,8) |
| Grado IV | - | - | - | - | - | - | - |
| Trombocitopenia | |||||||
| Grado III | - | 1 | - | - | - | - | 1 (3,8) |
| Grado IV | 1 | - | 1 | - | - | - | 2 (7,7) |
Al inicio del segundo ciclo de tratamiento se evaluaron las variables hematológicas únicamente en aquellos pacientes que recibieron en el primer ciclo del esquema una dosis de CARBO que no se diferenciaba más de un ± 10% de la dosis teórica calculada y además no habían iniciado tratamiento con eritropoyetina ni CSF. Esta situación la presentaron 19 pacientes y ha permitido evaluar la incidencia de toxicidad hematológica tras la administración del primer ciclo del estándar del esquema GEM-CARBO en pacientes con CPNM en estadio avanzado. En esta situación se ha identificado neutropenia de grado III en un paciente (5,3%) y trombocitopenia de grado IV en otro (5,3%).
Un paciente (1/26, 4% de la población) presentó un aumento de Cr superior a 0,5mg/dl entre 2 ciclos sucesivos. No obstante, este aumento no tuvo significación clínica ya que al tratarse de un paciente con insuficiencia renal crónica, el ClCr y la dosis de CARBO no se modificaron significativamente.
Evaluación de adherenciaEn el primer ciclo de tratamiento, la DD de CARBO prescrita y la teórica calculada en el 90% de los pacientes (28/31) fue menor a ± 10%. En 2 pacientes (7%) la dosis de CARBO administrada fue inferior a la dosis teórica calculada en un 17 y un 28%, respectivamente. Esta decisión se adoptó como medida preventiva, ya que los pacientes en el tratamiento previo con otros esquemas farmacoterapéuticos mielosupresores habían desarrollado toxicidad hematológica18,19,22. Un paciente (3%) recibió sobredosificación de un 15% respecto a la dosis teórica calculada ya que en el momento de la prescripción se utilizó un valor de Cr no actualizado.
El número de pacientes que recibió el máximo de ciclos indicados del esquema GEM-CARBO fue de 16/26 (61,5%). Ocho de 26 pacientes recibieron un máximo de 4 ciclos por estabilización de su enfermedad, y 8 de 26 pacientes, 6 ciclos por respuesta de su enfermedad al tratamiento. La mediana de ciclos administrados fue de 4 (rango intercuartílico 3,0-5,5).
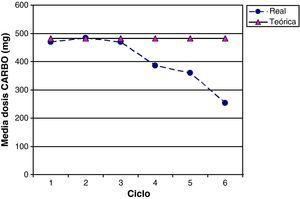
La intensidad de dosis de CARBO para los 26 pacientes del estudio fue del 82,8% (IC 95% 74,3-91,3), 17/26 pacientes (65,0%) recibieron más del 85% de la dosis de CARBO teórica planeada. En la figura 5 se comparan las dosis medias de CARBO reales prescritas frente a las teóricas calculadas en cada uno de los ciclos del esquema GEM-CARBO, observándose una diferencia significativa a partir del cuarto ciclo; momento en el que se inicia una reducción de las dosis, individualizándolas según toxicidad hematológica ya que previamente esta toxicidad se había manejado con retrasos en la periodicidad interciclos.
Se retrasó la administración de los fármacos en su primer día de ciclo en 16 de los 91 potenciales ciclos del esquema prescritos (18,0%) y 13 de éstos se produjeron antes del ciclo 4 de tratamiento.
Se modificó la dosis de CARBO respecto de la prescrita en el primer ciclo debido a toxicidad hematológica en 10/91 ciclos prescritos (11,0%). La dosis reducida en todos los casos se calculó un AUC objetivo de 4mg/ml/min.
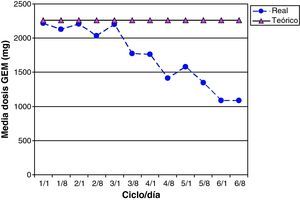
La intensidad de dosis de GEM fue del 78,0% (IC 95% 67,1-88,9), 15 de 26 pacientes (58,0%) recibieron más del 85% de la dosis de GEM teórica acumulada. En la figura 6 se comparan las dosis medias de GEM reales prescritas frente a las teóricas calculadas por ciclo. Las reducciones de dosis de GEM son más abundantes a partir del ciclo 4 de tratamiento coincidiendo con las reducciones de dosis de CARBO. Se modificó la dosis de GEM debido a toxicidad hematológica, obviando la administración del día 8 del ciclo correspondiente, en 19 de 213 posibles (9,0%).
En 3 de 26 pacientes (11%), que recibieron desde el ciclo 1 una dosis de CARBO calculada para alcanzar un AUC objetivo de 4mg/ml/min por tratarse de pacientes con una edad superior a 65 años y estadio funcional bajo, no se registró toxicidad hematológica grados III y IV y se les administró el número máximo de ciclos predefinidos del esquema sin sufrir éste ningún retraso en la periodicidad ni modificaciones en las dosis de ambos fármacos.
DiscusiónEl predominio de varones incluidos en el estudio está en concordancia con la mayor incidencia de CPNM descrita en este sexo2.
La prescripción de los antineoplásicos que componen el estándar del esquema GEM-CARBO en el ciclo 1 se ha ajustado a las características descritas en la bibliografía6,7,17,18. Se ha determinado que la probabilidad de producir toxicidad hematológica en los pacientes sin tratamiento mielosupresor previo y sin tratamiento con eritropoyetina y CSF tras la administración completa del primer ciclo es baja pero de elevada gravedad, siendo la neutropenia de grado III y la trombocitopenia de grado IV las de más pronta aparición. En la población estudiada la incidencia de toxicidad hematológica de grados III y IV ha aumentado a medida que han aumentado las dosis de antineoplásicos acumuladas en los pacientes, destacando la aparición de anemia y neutropenia de grado III en un 34,0 y un 30,8% de los pacientes, respectivamente, frente al 18,0% de anemia y el 34,0% de neutropenia, grados III y IV descritos en la bibliografía13–15, y una incidencia inferior pero más grave de trombocitopenia grado III del 3,8% y de grado IV del 7,7%, frente a la incidencia del 32,6% de trombocitopenia de grados III y IV de algunos estudios consultados13–15.
En la práctica asistencial la toxicidad hematológica se ha manejado de acuerdo con las recomendaciones descritas13–19,22: administración de eritropoyetina y factores estimuladores de colonias, transfusiones de sangre y plaquetas, retrasos en la periodicidad interciclos para favorecer la recuperación hematológica del paciente y reducciones de dosis de los antineoplásicos. Con todo, el cumplimiento del plan terapéutico ha sido pobre, el estándar del esquema GEM-CARBO no ha sido bien tolerado por los pacientes debido principalmente a la toxicidad hematológica desarrollada. Estos resultados contrastan con la buena tolerabilidad de ambos antineoplásicos descrita en los estudios consultados desarrollados en fase II y en fase III del esquema GEM-CARBO; estas diferencias podrían explicarse por la menor edad y comorbilidades de la población incluida en los ensayos clínicos12–14. En este estudio poco más de la mitad de los pacientes (61,5%) recibieron la totalidad de los ciclos del esquema previstos al inicio del tratamiento y la media de la intensidad de dosis de los antineoplásicos en los pacientes fue para ambos inferiores al 85%, siendo éste el valor límite de dosis que seleccionan los ensayos clínicos para considerar una adherencia o cumplimiento adecuada, ya que dosis acumuladas inferiores al 85% de las teóricas comprometen la eficacia del tratamiento25–27.
No se ha identificado ningún caso significativo de toxicidad renal. Por esta razón se justifica la elección del esquema evaluado para pacientes con CPNM e insuficiencia renal asociada en los que la utilización de cisplatino podría producir toxicidad renal y agravar su morbilidad.
La mayor seguridad en la administración de CARBO para un AUC objetivo de 4 concuerda con los diferentes estudios realizados con la combinación GEM-CARBO en los que este último se dosificó para un AUC objetivo de 4mg/ml/min en los que se identificó una importante reducción de toxicidad hematológica de grados III y IV21. En los pacientes incluidos en este estudio dosificados para un AUC objetivo de 4 no se identificó toxicidad hematológica grado III-IV, tampoco fue necesario retrasar la administración de ninguno de sus ciclos y los pacientes completaron la totalidad de los ciclos programados de acuerdo con la respuesta clínica individual al tratamiento quimioterápico recibido. Así mismo, los pacientes a los que inicialmente se les dosificó el CARBO para un AUC objetivo de 5mg/ml/min y posteriormente requirieron reducciones de dosis debido a la aparición de toxicidad hematológica, estas reducciones se ajustaron a una individualización de CARBO para un AUC objetivo de 4mg/ml/min.
En conclusión, la indicación y prescripción del esquema GEM-CARBO se ha ajustado con unas evidencias científicas sólidas16–19,21, pero su perfil de seguridad, debido principalmente a la aparición de toxicidad hematológica de grados III y IV, ha limitado su uso y ha dificultado la administración de la intensidad de dosis prevista comprometiendo la efectividad del tratamiento. Se hace necesario pues el estudio dosis-respuesta del esquema GEM-CARBO modificando el estándar de prescripción del CARBO para un AUC objetivo de 4mg/ml/min en pacientes con CPNM avanzado, ya que por presentar un perfil de toxicidad hematológica menor la adherencia al tratamiento es mayor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.