Conocer el perfil de uso de nutrición parenteral, enteral y nutrición mixta en un hospital de agudos y otro de crónicos.
DiseñoEstudio observacional retrospectivo, no aleatorizado.
ÁmbitoÁrea Sanitaria Sevilla Sur: Hospital de Agudos (H1) y Hospital de Crónicos (H2) de 447 y 84 camas respectivamente.
Se analizan todos los episodios de nutriciones artificiales administradas en un periodo de 6 meses. Criterios de exclusión: edad < 18 años, suplementos orales o nutrición periférica.
ResultadosSe empleó nutrición artificial en 568 episodios; 406 de nutrición enteral, 162 de nutrición parenteral, un 4,95; 3,54 y 1,41% respectivamente del total de ingresos.
La nutrición enteral fue más frecuente en el hospital H2 (n=219, 15,5/100 hospitalizaciones) y la nutrición parenteral fue más usada en H1 (n=155, 6,96/100 hospitalizaciones), siendo el servicio mayoritario UCI; 43,8%.
Se recurrió al soporte nutricional mixto en 68 pacientes (0,59% del total de ingresos), siendo mayoritario su uso en Cirugía n=32 (p < 0,001). La fórmula dieta enteral más utilizada fue la especial para diabetes; H1 41,2%, H2 46,6%. La mortalidad en pacientes con nutrición enteral fue H1 37%, H2 63%, que se asoció con la edad (OR=1,025; IC 95%: 1,006-1,046; p<0,05), el género masculino (OR=1,612; IC 95%: 1,023-2,540; p<0,05) y estancia en UCI (OR=49,379; IC 95%: 11,971-203,675; p<0,01).
ConclusionesLa nutrición enteral fue empleada de forma mayoritaria tanto en el hospital de agudos como en el de crónicos. La nutrición parenteral y el soporte nutricional mixto se usaron casi exclusivamente en el hospital de agudos.
To evaluate the use of parenteral, enteral, and mixed nutrition in one acute and one chronic hospital.
DesignRetrospective, non-randomised, observational study.
Study sitesSouth Seville Health Area: Acute Hospital (H1) and Chronic Hospital (H2) with 447 and 84 beds, respectively.
We analysed all episodes of artificial nutrition administered in a 6-month period. Exclusion criteria included: age <18 years, oral supplements, and peripheral nutrition.
ResultsArtificial nutrition was used in a total of 568 episodes: 406 were enteral nutrition, 162 were parenteral nutrition, constituting 4.95%, 3.54% and 1,41% of all hospitalisations, respectively. Enteral nutrition was more common at H2 hospital (n=219, 15.5/100 hospitalisations) and parenteral nutrition was more commonly used at H1 (n=155, 6.96/100 hospitalisations), with the ICU providing the majority of treatments (43.8%).
Mixed nutritional support was used in 68 patients (0.59% of all cases), and was most commonly used in the surgery department (n=32, P<.001). The most commonly used enteral formula was the special diabetes diet; 41.2% at H1 and 46.6% at H2. Patient mortality with enteral nutrition was 37% at H1, 63% at H2, and was correlated with age (OR=1.025, 95% CI: 1.006-1.046, P<.05), male sex (OR=1.612, 95% CI: 1.023-2.540, P<.05), and time in ICU (OR=49.379, 95% CI: 11.971-203.675, P<.01).
ConclusionsEnteral nutrition was more frequently used in both the acute and chronic hospitals. Parenteral nutrition and mixed nutritional support were used almost exclusively at the acute hospital.
La desnutrición es un problema que afecta a los pacientes hospitalizados con una amplia variabilidad en su prevalencia en relación con las características del hospital, el tipo de población a la que atiende, el tipo de enfermedad así como la atención que se presta al estado nutricional del paciente en la historia clínica1.
En las diferentes etapas de evolución clínica de pacientes agudos es frecuente la utilización simultánea de nutrición parenteral y enteral. La aplicación combinada de ambos no tiene un consenso en cuanto a su denominación, así podemos encontrarnos con los siguientes términos: nutrición enteral y parenteral mixta o soporte nutricional mixto2, pero también se le conoce como nutrición parenteral complementaria3,4, nutrición mixta4, nutrición enteral y parenteral combinada5,6 o soporte combinado7. La nutrición mixta puede asociarse a un mejor grado de cumplimiento de los objetivos de soporte nutricional cuando existen limitaciones para alcanzar el aporte prefijado por una u otra vía de nutrición artificial por problemas de intolerancia digestiva o metabólica2–4,6,8, sin embargo, son escasos los datos en la literatura médica acerca de su uso hospitalario.
Los criterios de aplicación de la nutrición artificial están definidos por las guías de práctica clínica, pero el diferente perfil de enfermedades atendidas en hospitales de distinto tamaño puede condicionar diferentes perfiles en nutrición parenteral y enteral. La mayoría de datos de uso de nutrición artificial de la literatura especializada proceden de servicios quirúrgicos, por lo que en hospitales de crónicos o paliativos, las diferentes enfermedades o tipo de pacientes podrían sugerir una menor frecuencia de aplicación de estas técnicas de nutrición artificial.
Un mejor conocimiento de los criterios de utilización de ambos tipos de nutrición artificial en el ámbito hospitalario puede ayudar a conocer el grado de seguimiento de las recomendaciones, así como su grado de implementación, como modo de mejora continua en la práctica clínica.
El objetivo del estudio es describir las diferencias en el uso de la nutrición parenteral, enteral y soporte nutricional mixto en un hospital de agudos y de crónicos.
MétodosÁmbitoHospital Universitario Nuestra Señora de Valme (Sevilla) de 447 camas; hospital general de especialidades y Hospital El Tomillar (Sevilla), de 84 camas, hospital de crónicos. Ingresos durante el período de estudio: 10.080 en el Hospital de Valme (H1; hospital de agudos) y 1.393 en el Hospital El Tomillar (H2; hospital de crónicos).
DiseñoEstudio observacional retrospectivo, no aleatorizado.
Fuente de informaciónPrograma de prescripción electrónica (aplicación Dominion versión 2.4), registro electrónico de historias clínicas, servicio de documentación clínica del área hospitalaria y base de datos de preparación de mezclas intravenosas del servicio de farmacia.
Criterios de inclusiónTodos los pacientes hospitalizados durante el período de 6 meses comprendido entre el 1 de agosto de 2009 y el 31 de enero de 2010, con nutrición parenteral o nutrición enteral completa por sonda, ostomía o vía oral.
Criterios de exclusiónPacientes edad < 18 años, neonatos y pacientes a los que se les prescriben suplementos nutricionales orales o nutrición parenteral periférica.
Variables- –
Dependientes: muerte.
- –
Independientes: sexo, edad, tipo de nutrición artificial, tipo de dieta fórmula, modificaciones en nutrición parenteral total, duración de la nutrición artificial, vía de administración, hospital y unidad clínica; agrupando como unidades médicas (U Med) a los servicios de medicina interna, infecciosos, neumología, digestivo y hematología para facilitar el análisis estadístico. El hospital H2 está constituido exclusivamente por la unidad de crónicos y paliativos (UCP).
Con el objeto de identificar el conjunto de factores pronósticos de fallecimiento tanto en nutrición parenteral como enteral, se realizaron modelos multivariantes de regresión logística binaria y se calculó el tamaño muestral necesario con la regla de Freeman. El resultado fue de 90 pacientes por muerte en el caso de nutrición parenteral y 140 en el caso de nutrición enteral. En total se consideraron necesarias muestras de 180 y 280 pacientes, respectivamente.
Análisis estadísticoLas variables cuantitativas se resumieron con medias y desviaciones estándar, o bien con medianas y percentiles P25 y P75 en caso de distribuciones asimétricas, y las variables cualitativas con frecuencias y porcentajes.
Se compararon las variables numéricas entre 2 grupos aplicándose la prueba t de Student para muestras independientes o la prueba U de Mann-Whitney en caso de no normalidad así como, en caso de significación, se calcularon intervalos de confianza al 95% (Hodges-Lehman) para la diferencia entre las medianas. Para analizar las relaciones entre variables cualitativas se aplicó la prueba ji al cuadrado o bien los métodos no asintóticos de la prueba de Montecarlo y la prueba exacta.
Por último, y con el objetivo de encontrar factores pronósticos del fallecimiento, se realizó un modelo de regresión logística binaria tras un análisis univariante previo, el cual identificó el conjunto de variables relacionadas con el mismo al 5%. Posteriormente, aquellas variables con significación < 15% fueron introducidas en el modelo multivariante para la selección final. Para el conjunto final de variables independientes en el modelo, el procedimiento calculó la odds ratio y sus respectivos intervalos de confianza al 95%. Este análisis se realizó para cada tipo de nutrición en estudio.
El análisis de los datos se realizó con el paquete estadístico SPSS 18.0 para Windows.
ResultadosDurante este periodo de estudio se registraron 11.473 ingresos en el área; siendo 10.080 hospitalizaciones en H1 y 1393 en H2.
Se indicó nutrición artificial (NA) en 568 episodios (4,95%); 162 de nutrición parenteral y 406 nutrición enteral, que suponen un 1,41 y 3,54% respectivamente del total de ingresos. Solamente 68 (12% de pacientes con nutrición artificial y un 0,59% del total de ingresos hospitalarios) empleó soporte nutricional mixto.
Al comparar la frecuencia de uso de la nutrición parenteral total (NPT) y la nutrición enteral (NE) en el área hospitalaria, se observó que la NPT era más frecuente en el hospital de agudos (95,7%; n=155) mientras que es en el hospital de crónicos donde se registra un mayor uso de NE (53,9%; n=219).
La prueba de Mann-Whitney empleada para comparar la diferencia de medianas de edades entre los 2 hospitales, mostró que existen 13 años de diferencia (−13, IC 95%: −11; −15; p<0,01), siendo los pacientes ingresados en el hospital de crónicos los de mayor edad.
Las diferencias de uso de los distintos tipos de nutrición artificial entre hospitales se describen en la tabla 1. Igualmente se indican los motivos de prescripción de los diferentes tipos de nutriciones en los diferentes hospitales en las tablas 2.1 y 2.2. El motivo mayoritario de prescripción de NE fue la disfagia neurológica, con un 38 y un 91% en el hospital de agudos y de crónicos respectivamente. En el caso de la NPT, el motivo más frecuente de prescripción fue la cirugía oncológica, con un 44% de las prescripciones en el hospital de agudos y un 57% de las mismas en el hospital de crónicos.
Tipo de soporte nutricional y duración del mismo en el hospital de agudos y en el de crónicos
| Hospital de Agudos | |||
| x¯±SD | Mediana (P25; P75) | Rango (mínimo-máximo) | |
| Edad (años)a | 66,3±13,4 | 67 (60; 77) | 22-92 |
| Duración NPTa (días) | 12,9±9,4 | 11 (6; 18) | 1-48 |
| Duración NEa (días) | 14,6±19,9 | 10 (4; 19) | 1-225 |
| % (n/N) | |
| Hombres | 60,6 (94/155) |
| NPT | 95,7 (155/162) |
| NE | 6,1 (187/406) |
| Nutrición Mixta | 10,7 (61/568) |
| Hospital de Crónicos | |||
| x¯±SD | Mediana (P25; P75) | Rango (mínimo-máximo) | |
| Edad (años)a | 79,6±11,0 | 83 (77; 87) | 35-96 |
| Duración NPTa (días) | 10±9,4 | 6 (5; 14) | 4-30 |
| Duración NEa (días) | 12,95±12,1 | 10 (5; 17) | 1-85 |
| % (n/N) | |
| Mujeres | 71,4 (5/7) |
| NPT | 4,3 (7/162) |
| NE | 53,9 (219/406) |
| Nutrición Mixta | 1,2 (7/568) |
Indicaciones de prescripción de NPT por patologías en el hospital de agudos y de crónicos
| Hospital de Agudos N=155 | |||
| Indicación general | Indicación por patologías | n | % (n/N) |
| Cirugía oncológica | Neoplasia maligna colon, recto | 34 | 44% (69/155) |
| Neoplasia maligna páncreas | 12 | ||
| Neoplasia maligna estómago | 11 | ||
| Neoplasia maligna esófago, ovario, mediastino, vejiga, riñón, vesícula biliar | 12 | ||
| Cirugía digestiva no oncológica | Coledocolitiasis, divertículo intestino delgado, enteritis regional, colitis | 21 | 43% (66/155) |
| Pancreatitis aguda, crónica | 19 | ||
| Apendicitis aguda, envenenamiento accidental por alcali caústico, úlcera duodeno con obstrucción, íleo paralítico, fístula intestino excepto recto y ano | 13 | ||
| Hernia inguinal unilateral, bilateral, perforación intestino | 10 | ||
| Embolia arterial, resección intestino delgado parcial o total | 3 | ||
| Enfermedades digestivas | Úlcera estómago con hemorragia, cirrosis hepática alcohólica y no alcohólica, diarrea, absceso intestino | 14 | 9% (14/155) |
| Otros | Septicemia, mucositis por terapia antineoplásica | 6 | 4% (6/155) |
| Hospital de Crónicos N=7 | |||
| Indicación general | Indicación por patologías | n | % (n/ N) |
| Cirugía oncológica | Neoplasia maligna estómago, esófago, lengua, orofaringe | 4 | 57% (4/7) |
| Cirugía digestiva no oncológica | Divertículo intestino delgado, gastroparesia | 2 | 29% (2/7) |
| Otros | Otros | 1 | 14% (1/7) |
Indicaciones de prescripción de NE por patologías en el hospital de agudos y de crónicos
| Hospital de Agudos N=187 | |||
| Indicación general | Indicación por patologías | n | % (n/N) |
| Disfagia neurológica | Enfermedad cerebrovascular, hemorragia subaracnoidea | 28 | 38% (72/187) |
| Encefalopatia, tumor maligno orofaringe, cerebro, traumatismo craneo, cara y cuello | 13 | ||
| Demencia senil, enfermedad de Alzheimer | 11 | ||
| Esclerosis lateral amiotrófica, enfermedad de Parkinson | 10 | ||
| Encefalopatía metabólica | 9 | ||
| Disfagia mecánica | Complicaciones respiratorias, neumonía asociada a respirador | 29 | 18% (33/187) |
| Estenosis esófago, acalasia y broncoespasmo | 4 | ||
| Cirugía digestiva no oncológica | Pancreatitis aguda, colecistitis, coledocolitiasis | 18 | 17% (31/187) |
| Enteritis regional, colitis ulcerosa, fístula, resección intestino delgado parcial o total, hernia inguinal, divertículo intestino delgado, enteritis tóxicas | 13 | ||
| Enfermedades digestivas | Encefalopatía hepática, cirrosis hepática alcohólica | 8 | 8,5% (16/187) |
| Absceso intestino, úlcera intestino, úlcera estómago con hemorragia | 8 | ||
| Cirugía oncológica | Neoplasia maligna colon, estómago, páncreas, orofaringe, otras neoplasias malignas | 34 | 18% (34/187) |
| Intolerancia al alimento | Diarrea | 1 | 0,5% (1/187) |
| Hospital de crónicos N=219 | |||
| Indicación general | Indicación por patologías | n | % (n/N) |
| Disfagia neurológica | Demencia senil, enfermedad de Alzheimer | 100 | 91% (200/219) |
| Enfermedad cerebrovascular, hemorragia subaracnoidea | 72 | ||
| Encefalopatia, tumor maligno cerebro, hidrocefalia | 14 | ||
| Encefalopatía metabólica | 9 | ||
| enfermedad de Parkinson | 5 | ||
| Disfagia mecánica | Neoplasia maligna cerebro, mama, pulmón, otras neoplasias malignas | 7 | 5% (10/219) |
| Complicaciones respiratorias, neumonía asociada a respirador | 3 | ||
| Enfermedades digestivas | Úlcera estómago con hemorragia | 1 | 0,5% (1/219) |
| Cirugía oncológica | Neoplasia maligna colon, estómago, vejiga | 6 | 2,5% (6/219) |
| Intolerancia al alimento | Gastritis | 2 | 1% (2/219) |
El mayor porcentaje de prescripción de nutrición parenteral se registró en H1 (95,7%), contribuyendo fundamentalmente las unidades de cuidados intensivos (UCI) y cirugía con unos porcentajes de uso de 43,8 y 43,2% respectivamente. En el hospital de crónicos supuso tan solo un 4,3% del total del área.
La diferencia de duración de la NPT entre hospitales no fue valorable debido al reducido tamaño muestral en H2 (n=7).
La mayoría de las fórmulas de NPT dispensadas presentaban una composición predefinida conteniendo aminoácidos, lípidos, glucosa y electrolitos (cloruro cálcico, glicerofosfato sódico, sulfato de magnesio, cloruro potásico, acetato sódico, sulfato de cinc). A todas ellas se les añaden vitaminas y oligoelementos en su preparación para proporcionar de este modo una nutrición parenteral completa. Las vitaminas hidrosolubles adicionadas son: vitamina B1, B2, B6, C, nicotinamida, pantoténico, ácido fólico, biotina y cianocobalamina. Las vitaminas liposolubles adicionadas son: vitamina A, D2, E y K1. Los oligoelementos adicionados incluyen Cr, Cu, Fe, Mn, I, Mo, Se y Zn (tabla 3.1). El tipo de nutrición más prescrita (81,5%) fue la fórmula de bajo estrés; con un contenido de nitrógeno entre 9-12g y con un contenido calórico de entre 1.520-1.600kcal.
Características de las fórmulas de nutrición parenteral total dispensadas en el hospital de agudos y de crónicosa
| Contenido en nitrógeno (g) | 9,1 | 12 | 13 | 16 | Otras |
| Volumen | 2.500 | 1.477 | 2.105 | 2.000 | Composición individualizada |
| Kcal totales | 1.520 | 1.600 | 1.575 | 2.200 | |
| Kcal no proteicas/g N2 | 144 | 108 | 96.15 | 108 | |
| Glucosa (g) | 200 | 187 | 200 | 250 | |
| Lípidos (g) | 50 | 56 | 50 | 75 | |
| Tipo de lípidos | |||||
| Tipo de aceite | SojaOliva | SojaCocoOlivaPescado | Soja | SojaCocoOlivaPescado | Tipo de aceite |
| Relación ω6/ω3 | 9 | 2,5 | 7 | 2,5 | |
| Hospital de agudos N(%) | 125 (80,6%) | 25 (16,1%) | 5 (3,2%) | ||
| Hospital de crónicos N(%) | 7 (100%) | 0 (0%) | 0 (0%) | ||
| Total de nutriciones | 132 (81,5%) | 25 (15,4%) | 5 (3,1%) | ||
Al ser la gran mayoría de las nutriciones comerciales, las modificaciones llevadas a cabo en las mismas fueron prácticamente nulas. La mayoría de modificaciones se realizaron en las nutriciones de composición individualizada; que no se adaptaron a la composición de las comerciales preparadas en bolsas tricamerales. Las modificaciones realizadas en la bolsa de nutrición parenteral (n=40) afectaron al 24,7% del total de NPT (tabla 3.2). Destaca la adición de insulina (n=28), siendo menos frecuentes las modificaciones de electrolitos, glutamina o adición de medicamentos. No se realizaron modificaciones en el volumen de las nutriciones así como tampoco en el contenido de calcio o fósforo o tipo de lípidos adicionados.
Modificaciones de las nutriciones parenterales totales
| Modificaciones de la nutrición parenteral total | n (%)a |
| Adición de Insulina | 28 (17,3) |
| Adición de Glutamina | 7 (58,3) |
| Sin potasio | 2 (16,7) |
| Sin sodio | 1 (8,3) |
| Sin lípidos | 1 (8,3) |
| Adición de medicamentos (omeprazol) | 1 (8,3) |
| TOTAL DE MODIFICACIONES | 40 (24,7%) |
Se observan 41/162 pacientes (25%) con una duración de nutrición parenteral inferior o igual a 5 días.
Características de la nutrición enteralFue el tipo de nutrición artificial más usada en ambos hospitales, 54,7% en H1 (187/342 tratamientos totales de nutrición artificial en H1) y 96,9% en H2 (219/226 total de tratamientos de nutrición artificial en H2). La diferencia fue mayor cuando se consideró la NE respecto al porcentaje de hospitalizaciones: 1,86% en H1 vs 15,7% en H2. No se observaron diferencias significativas en cuanto a la duración de NE en los diferentes hospitales; mediana de duración de NE = 10 días; p>0,05.
Cuando se consideran conjuntamente ambos hospitales, el servicio de crónicos y paliativos correspondiente al hospital de crónicos H2 fue el que más la empleó; 219 tratamientos (53,9%), seguido con una considerable diferencia de las unidades médicas del hospital de agudos con un 15% (n=61) y cirugía con un 10,6% (n=43). El resto de servicios fueron: UCI (6,9%), UCP (5,7%), Neurología (5,7%), Otorrinolaringología (1,0%) y Psiquiatría (1,2%).
La vía preferente de administración de nutrición enteral fue la sonda nasogástrica (91,9%) (tabla 4).
El tipo de dieta fórmula de nutrición enteral más usada en ambos hospitales fue la especial de tipo diabético con un 41,2% (n=77) y un 46,6% (n=102) del total de tratamientos con nutrición enteral en el hospital de agudos y crónicos respectivamente.
Los tipos de dieta fórmula enteral que ocasionaron diferencias entre ambos hospitales fueron: la dieta fórmula especial para hepatopatía, hipoosmolar, completa oligomérica normoproteica, completa polimérica normoproteica normocalórica sin fibra, completa polimérica hiperproteica hipercalórica y completa polimérica hiperproteica normocalórica (p<0,0005) (tabla 5).
Consumo de fórmula enteral en el hospital de agudos y de crónicos. Relación entre el tipo de dieta fórmula y hospital (p<0,0005)
| Dieta fórmula enteral | % (n/N) | Hospital de agudos | Hospital de crónicos |
| Especial diabética (normoproteica o hiperproteica) | 44,1 (179/406) | 41,2 | 46,6 |
| Completa polimérica normoproteica normocalórica sin fibra | 20,7 (84/406) | 10,2 | 29,7 |
| Completa polimérica normoproteica con fibra | 11,1 (45/406) | 10,2 | 11,9 |
| Completa polimérica hiperproteica normocalórica | 9,9 (40/406) | 18,2 | 2,7 |
| Otrasa | 8,9 (36/406) | 12,3 | 5,9 |
| Completa polimérica hiperproteica hipercalórica | 5,4 (22/406) | 8,0 | 3,2 |
El soporte nutricional mixto es la utilización simultánea de nutrición parenteral y enteral. Este tipo de soporte nutricional se empleó en un 12% de los pacientes del área, siendo los motivos más frecuentes la cirugía digestiva y la cirugía oncológica, con un 28% (19/68) y un 34% (23/68) respectivamente.
En el hospital de agudos hubo 61 episodios con soporte nutricional mixto (17,8% del total de NA de H1, 10,7% respecto al total de NA del área hospitalaria), mientras que en el hospital de crónicos solo se combinaron los 2 tipos de nutrición artificial en 7 episodios (3,1% del total de NA de H2, 1,2% respecto del total de NA del área hospitalaria) (tabla 1).
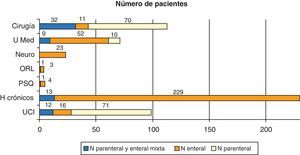
En cuanto a la relación entre el uso del soporte nutricional mixto y los diferentes servicios, la prueba de ji al cuadrado mostró significación estadística (p<0,01) en cirugía, UCI, neurología y UCP. Cirugía y UCI son los servicios que más emplean este tipo de combinación, mientras que UCP y neurología prescriben preferentemente nutrición enteral (fig. 1).
Características de dispensación de nutrición artificial en el hospital de agudos y de crónicos.
Hospital de agudos: se incluyen los siguientes servicios: Cirugía, U Med: Unidades Médicas (Medicina Interna, Infecciosos, Neumología, Digestivo y Hematología); Neuro: Neurología, ORL: Otorrinolaringología; PSQ: Psiquiatría y UCI: Unidad de Cuidados Intensivos. Hospital de crónicos (H crónicos) formado por la unidad de cuidados crónicos y paliativos.
La mortalidad intrahospitalaria durante el período de estudio fue de 574; lo que supone un 5% del total de pacientes ingresados en dicho período (11.473), siendo la mortalidad de 2,4% (239/10.080) en el hospital de agudos y de 24,0% (335/1393) en el hospital de crónicos.
En cuanto a la mortalidad en pacientes con nutrición artificial, el porcentaje de fallecimientos fue de 19,1% (31/162) en pacientes que recibieron NPT y de 36,0% (146/406) en pacientes que recibieron NE.
Al analizar por separados el hospital H1 y H2 se observó que la mortalidad asociada a episodios de NE fue superior en H2 (H1: 37 vs H2: 63%; p<0,05).
En cuanto a la mortalidad asociada a NPT fue de 87,1% en H1 y 12,9% en H2.
Aunque la diferencia sea de casi un 80% a favor de H1, los resultados no se pueden considerar significativos debidos al reducido tamaño muestral.
No hubo relación entre el uso de soporte nutricional mixto y la mortalidad; siendo la prueba de ji al cuadrado no significativa.
Análisis multivariante realizado entre el tipo de nutrición artificial y la evolución a fallecimientoCuando se analizan de forma independiente cada una de las variables con respecto al fallecimiento en pacientes con nutrición parenteral, solo se observa relación con respecto a la unidad de prescripción; UCI representa un 59% de fallecimientos (p<0,05). El resto de las variables no resultaron significativas; edad, duración de la NPT, el sexo, el tipo de nutrición parenteral empleada, ni el tipo de hospital.
Al realizar el análisis multivariante se vio que la mortalidad por nutrición parenteral se veía afectada por la edad, el tipo de nutrición y el servicio donde se utiliza.
Así, se observa que la edad supone OR=1,045 (IC 95%: 1,013-1,079); p<0,01, el tipo de nutrición especial frente a la de menor estrés supone un OR = 11,097 (IC 95%: 1.376-89.524); p<0,05 y el servicio de UCI supone respecto a cirugía un riesgo de OR=3,85 (IC 95%: 1,547-9,582); p<0,01. La UCP supone un OR=8,605 (IC 95%: 1,926-38,455); p<0,01.
Cuando se analizan diferentes variables en relación a la posibilidad de asociarse con fallecimiento en pacientes con NE se observa que la edad; RR: −2 (IC 95%: −5,0), p<0,05, el tipo de hospital; RR=1,784 (IC 95%: 1,178, 2,70), y la unidad clínica; p<0,01 pueden influenciar. No resultaron significativas las variables: días de NE, el sexo, el tipo de NE, el empleo de nutrición mixta ni el tipo de vía de administración.
Al realizar el correspondiente modelo para el análisis multivariante se deduce que las variables que afectan a la evolución a fallecimiento en pacientes con NE son: la edad (OR=1,025; IC 95% 1,006, 1,046; p<0,05), el sexo masculino (OR=1,612; IC 95%: 1,023-2,540; p<0,05) y los servicios de UCI (OR=49,379; IC 95%: 11,971-203,675; p<0,01), UCP (OR=6,193; IC 95%: 2,098-18,278; p<0,01) y neurología (OR=5,338; IC 95%: 1,398-20,384; p<0,05). Ello supone que el riesgo de mortalidad en pacientes con NE se ve influido por la mayor edad (78; P25=69,75, P75=84), el sexo masculino y el ingreso en UCI.
Se ha de tener en cuenta que en algunas variables se obtuvieron IC 95% muy amplios lo que nos indica que se requeriría un mayor tamaño muestral para confirmar nuestros resultados.
DiscusiónNuestros resultados indican que la nutrición enteral es la forma preferente de soporte nutricional tanto en un hospital de agudos como de crónicos, siendo la disfagia neurológica el motivo mayoritario de prescripción. En el hospital de crónicos la nutrición enteral se utiliza ampliamente, en relación al número de ingresos, pero se asocia a una elevada mortalidad probablemente por la edad avanzada y la comorbilidad de los pacientes. La nutrición parenteral y el soporte nutricional mixto se usan casi exclusivamente en el hospital de agudos, pero con menor frecuencia que la nutrición enteral.
En nuestro estudio el porcentaje de pacientes que reciben nutrición artificial en relación con los ingresos de ese período de tiempo es tan solo de un 4,95%, lo que puede reflejar un bajo grado de detección de pacientes desnutridos, aunque hemos de considerar que no se han tenido en cuenta a los pacientes que han recibido suplementos orales así como a los que recibieron nutrición parenteral periférica, lo cual podría haber modificado nuestros resultados.
En un hospital de agudos de mayor número de camas (Vall d‘Hebron, Barcelona), la prevalencia de prescripción de nutrición parenteral respecto a los ingresos era del 2% siendo la mayoría de los pacientes procedentes de los servicios de UCI o cirugía9.
En un hospital universitario con pacientes quirúrgicos, la mediana de duración nutrición parenteral fue de 11 días10, similar a lo observado en nuestros datos. Otro estudio realizado en un hospital de Vigo en pacientes quirúrgicos, se observó que la duración media de la NPT pasó de 16 días en 2002 a 12 días en 2003. La mediana de edad de indicación de nutrición parenteral total fue de 67 años, siendo un porcentaje mayor de varones los que requirieron este tipo de nutrición11.
Nuestros datos por tanto son concordantes con otros hospitales de agudos en cuanto a frecuencia de utilización de NPT (1,41%), uso mayoritario en cirugía y UCI y duración.
Sin embargo, se ha visto en un 25% su empleo durante menos de 5 días, inferior a lo recomendado en guías de práctica clínica. Probablemente esta duración inferior a 5 días se deba a complicaciones con la nutrición parenteral o incluso a fallecimiento; aspectos que no se han podido confirmar.
El hecho de no tener que adicionar nutrientes o electrolitos a la nutrición permite el uso de nutriciones comerciales estandarizadas y con ello se facilita y reduce la carga de trabajo en el servicio de farmacia.
En nuestra área hospitalaria la adición de insulina en las bolsas de nutrición parenteral fue de solo un 17,3%. La existencia de protocolos alternativos para el control de glucemia con análogos de insulina de vida media larga, de reciente introducción, justifica esta baja utilización de la adición de insulina en la bolsa de NPT, que contrasta con el amplio empleo de fórmulas enterales especiales para diabetes.La hiperglucemia en pacientes con nutrición parenteral suele ser frecuente debido a la resistencia a la insulina, exceso de aporte de hidratos de carbono, resultando beneficioso el uso de insulina12–14. En un estudio realizado en Reino Unido se observó que la administración conjunta de nutrición enteral y parenteral inducía la producción de incretinas y con ello un mejor control de las glucemias y menor resistencia a la insulina en comparación a la administración de nutrición parenteral total aislada15.
En el hospital de crónicos de nuestro estudio el uso de NPT resultó ser muy reducido, no posibilitando establecer comparaciones con el hospital de agudos. Esto contrasta con el elevado empleo de NE probablemente por la menor complejidad en el manejo de los pacientes de esta técnica así como por resultar menos invasiva, teniendo en cuenta que suele tratarse de pacientes con enfermedades que requieren tratamiento paliativo. La NE es considerada como más ventajosa que la NPT por ser segura, mantener la función gastrointestinal, presentar menos complicaciones infecciosas y menor coste recomendándose como nutrición artificial preferente5,6,16.
Los datos de nuestro estudio son concordantes con estas consideraciones pues la NE se utilizó 2,5 veces más que la NPT, siendo preferente en ambos hospitales.
El soporte nutricional mixto no recibe un nombre único en la literatura médica, ni existe un término MeSH específico por lo que se ve dificultada la búsqueda bibliográfica. Hay estudios referentes a su uso en pacientes quirúrgicos, traumatizados, críticos y no quirúrgicos5,6 aunque resulta mayoritaria su utilización en unidades como UCI o cirugía. Sin embargo, no está descrita en la literatura especializada su frecuencia de uso en el ámbito hospitalario en general. Tanto en hospitales de crónicos como de agudos. En nuestro estudio hemos confirmado el uso frecuente del soporte nutricional mixto en UCI y cirugía. En otros servicios no queda claro el uso mayoritario de esta combinación.
La nutrición enteral y parenteral mixta es aún poco utilizada según nuestros datos a pesar de ofrecer un mejor soporte nutricional desde el punto de vista teórico.
Aún no queda claro cuándo iniciar la combinación de NE y NPT; si es mejor iniciarla simultáneamente o solo tras unos días (3-10 días) de aporte con NE hipocalórica7,16–19. La combinación de la nutrición parenteral con 10-30ml/h de nutrición enteral parece favorecer la integridad intestinal12. El metaanálisis de Dhaliwal indica que dicha combinación no mejora el pronóstico de los pacientes; estancia hospitalaria o días de ventilación mecánica pero sí supone un aumento del coste7. Por otro lado, el estudio de Bauer et al.20 solo indica mejoría en indicadores nutricionales pero Martin et al. indican que el empleo de soporte nutricional mixto no solo reduce la mortalidad, sino también la estancia hospitalaria, aunque ésta se redujo con un mínimo beneficio21. En un estudio prospectivo realizado en 160 pacientes con cáncer avanzado se observó que la combinación de nutrición parenteral y enteral resultaba en una menor pérdida de peso y mayor calidad de vida que si se administraba solamente nutrición enteral22.
Son necesarios estudios controlados sobre el uso de nutrición parenteral complementaria por vía periférica en caso de imposibilidad de la vía central para aclarar el posible beneficio de la nutrición parenteral y enteral mixta2,8,12.
Hemos observado en el hospital de crónicos de nuestra área hospitalaria una mayor proporción de pacientes con nutrición artificial, pudiendo ser la mayor edad y la comorbilidad lo que lo justifique, puesto que en el desarrollo de la desnutrición, la edad constituye un factor de riesgo según el estudio de Pérez et al. En nuestro estudio la edad de los pacientes es mayor en el hospital de crónicos. En el hospital de agudos son los servicios médicos, con edad media mayor, los que tienen mayor uso de nutrición enteral. Ambos datos indican una mayor frecuencia de aplicación de nutrición artificial en relación directa con la edad avanzada de los pacientes.
La mortalidad de los pacientes con NPT y NE en nuestra área es elevada. En UCI alcanza el 59% de los pacientes con NPT. Sin embargo, en el hospital de crónicos la mortalidad afecta a prácticamente uno de cada 2 pacientes que reciben cualquiera de los tipos de nutrición. Según nuestros resultados la mortalidad por NE se relaciona con la edad, el sexo masculino y la unidad clínica en la que ingresa el paciente, siendo mayor en UCI.
Independientemente de la aplicación de soporte nutricional artificial, la mortalidad global en el hospital de crónicos es de un 24,0%. La elevada mortalidad de los pacientes con NE en este hospital es concordante con la avanzada edad, prevalencia de demencia avanzada, comorbilidad y discapacidad, siendo muchos de ellos portadores de NE en el domicilio.
En cuanto a la tipología de formula enteral, destaca la amplia utilización de la fórmula especial para diabetes, con un 44% del total de NE, y muy superior al porcentaje de pacientes diabéticos hospitalizados; 13,8% según el estudio de Olveira de 1999 realizado en Andalucía23. Probablemente la hiperglucemia de estrés justifique esta mayor utilización de fórmula enteral especial.
La implementación en los diferentes servicios del hospital de algoritmos de soporte nutricional podría resultar de interés. Estos algoritmos se basan en el uso de NE como soporte principal y si no resulta suficiente para alcanzar los requerimientos necesarios, entonces se añade NPT5,21. Se consigue que el inicio del soporte nutricional sea rápido y con ello un descenso de la morbimortalidad de los pacientes asociada a la desnutrición. Sería interesante valorar la posibilidad de introducción simultánea de NE en los pacientes hospitalizados que lleven varios días de nutrición parenteral, siendo la nutrición mixta una herramienta útil para un mejor cumplimiento de los aportes nutricionales. El farmacéutico podría intervenir mediante la revisión, junto con el médico prescriptor, de los diferentes tipos de soporte nutricional, valorando tanto la adecuación como la duración de los mismos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores queríamos agradecer el haber contado con la ayuda y colaboración del personal de Sistemas de Información y de la Unidad de Gestión Clínica de Farmacia del Área Hospitalaria de Valme.