El Plasma Rico en Plaquetas (PRP) es un plasma autólogo con una cifra de plaquetas superior a la del plasma basal, por haber sido sometido a algún proceso de extracción y concentración. El empleo del PRP como osteoinductor es conflictivo dado que, no existen estudios clínicos rigurosos que permita extraer conclusiones firmes respecto a su utilidad.
ObjetivoProporcionar información sobre las técnicas de obtención del PRP, las consideraciones legales sobre su obtención y empleo, el mecanismo de acción molecular, así como la evidencia disponible sobre su seguridad y tolerancia.
ResultadoEl PRP se obtiene de forma manual, mediante “técnica abierta”, o mediante kits desechables con “técnica cerrada”, siendo estos últimos productos sanitarios clasificados como IIa. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) considera el PRP como medicamento, estableciendo unos requisitos mínimos para garantizar su seguridad, trazabilidad, farmacovigiliancia e información. El PRP, por su elevado contenido en factores de crecimiento, reúne cualidades para ser un potente papel osteoinductor, capaz de acelerar la consolidación de fracturas o de osteointegrar rápida y eficientemente distintos tipos de implantes óseos. La tolerancia a la infiltración es generalmente buena, aunque hay que tener en cuenta su elevado potencial angiogénico.
ConclusionesEl PRP, dadas las características de producción y aplicación, es considerado por la AEMPS como un medicamento de dispensación bajo prescripción médica restringida, por lo que los servicios de farmacia hospitalaria deberían, cuando menos, supervisar su gestión y manipulación.
Platelet-Rich Plasma (PRP) is autologous plasma with higher concentration of platelet than basal level, because of an extracting and concentration process. PRP therapeutical use, as osteinductor role, is a controversial issue, due to there are no clinical studies with rigorous design and no firm conclusions can be drawn regarding its uses. Propose: To provide information about methods to obtain PRP, legal considerations about its extraction and use, molecular mechanism of action, as well as available evidence about security and tolerance.
ResultsPRP can be obtained by manual procedures (opened technique) or disposable kits (closed technique), the latter being medical devices classified as type IIa. AEMPS considers PRP as a drug, establishing some minimum requirements to guarantee safety, traceability, pharmacovigilance and information. PRP provides ideal qualities to play a powerful osteoinductor role to speed up fracture healing or to produce an efficiently and quickly osseointegration of different bone implants, due to the high growth factors content. Infiltration tolerance is generally good, however, it has to be taken into account its great angiogenical potential.
ConclusionsIn view of its production and application characteristics, PRP is considered as a drug on restricted medical prescription by the AEMPS, so pharmacy department must, at least, supervise its management and handling.
El plasma rico en plaquetas (PRP) se podría definir como volumen de plasma autólogo que contiene una concentración de plaquetas superior al nivel basal (150.000-350.000/μL), es decir, corresponde a una fracción del plasma centrifugado con concentraciones de plaquetas hasta 5 veces superiores a las normales1.
En los últimos años, esta herramienta terapéutica, ha surgido con fuerza debido a la notoriedad de su empleo en deportistas de élite2, por su capacidad de incrementar la regeneración ósea al ser utilizado junto con injertos de hueso autólogo. Existen en España algunos grupos de profesionales con amplia experiencia sobre el tema3,4. El PRP aparentemente, se trata de una opción de bajo coste e inocuidad, fácil manejo y con utilidad en procesos patológicos esquivos a los tratamientos convencionales. Sus indicaciones están en continua expansión, aplicándose a múltiples dolencias, entre ellas, a la osteoartritis de rodilla5.
Sin embargo, siendo un medicamento de uso humano, no cabe considerarlo como un medicamento de producción industrial. Tampoco cabe considerarlo como un medicamento de terapia avanzada de acuerdo con la definición dada por el Reglamento (CE) n° 1394/2007 del Parlamento Europeo y del Consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada6,7.
Un reciente brote de hepatitis B asociado al uso de PRP, y su consideración como medicamento6, nos indica que es necesario aplicar la Guía de Buenas Prácticas de Preparación a estos productos, y que el farmacéutico de hospital no puede permanecer al margen de la gestión y manipulación de los derivados del PRP 8.
Mecanismo de acciónEl PRP debe su interés terapéutico al papel instrumental decisivo de las plaquetas en el proceso de curación y reparación de una herida tisular. Se distinguen 3 fases: inflamación, proliferación y remodelado, en las que intervienen todos los Factores de Crecimiento (FC) contenidos en el PRP. Las plaquetas juegan un papel importante al funcionar como vehículo portador de FC y de otras proteínas contenidas en sus gránulos alfa. Estas sustancias, serán concentradas y depositadas en el lugar de la herida, exponiendo y orientando un concentrado fisiológico de proteínas que va a intervenir acelerando y favoreciendo el proceso de reparación y regeneración9.
El PRP desempeña un potente papel osteoinductor2, capaz de acelerar la consolidación de fracturas o de osteointegrar rápida y eficientemente distintos tipos de implantes óseos. Cabe señalar que el PRP tiene cabida en otros campos: cirugía dental10 y maxilofacial, ortopedia, otorrinolaringología, cirugía plastia, neurocirugía y periodoncia. Sin embargo, este artículo se centrará únicamente en su capacidad osteoinductora.
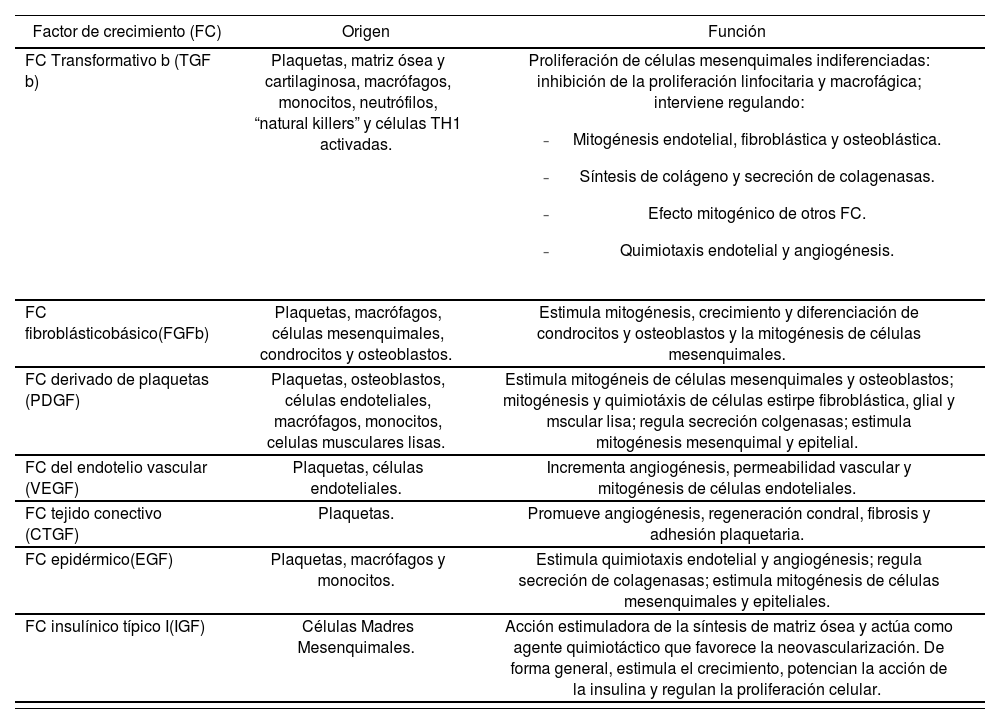
Los FC contenidos en el plasma rico en plaquetas se relacionan en la tabla 1. Entre otras encontramos las siguientes proteínas:
- –
TGF-ß: FC transformativo beta.
- –
FGF-b: FC fibroblástico básico.
- –
PDGF: FC derivado de las plaquetas.
- –
VEGF: FC del endotelio vascular.
- –
CTGF: FC tejido conectivo.
- –
EGF: FC epidérmico.
- –
IGF-I: factores de crecimiento insulínico tipo I.
Factores de crecimiento contenidos en el plasma rico en plaquetas
| Factor de crecimiento (FC) | Origen | Función |
|---|---|---|
| FC Transformativo b (TGF b) | Plaquetas, matriz ósea y cartilaginosa, macrófagos, monocitos, neutrófilos, “natural killers” y células TH1 activadas. | Proliferación de células mesenquimales indiferenciadas: inhibición de la proliferación linfocitaria y macrofágica; interviene regulando:
|
| FC fibroblásticobásico(FGFb) | Plaquetas, macrófagos, células mesenquimales, condrocitos y osteoblastos. | Estimula mitogénesis, crecimiento y diferenciación de condrocitos y osteoblastos y la mitogénesis de células mesenquimales. |
| FC derivado de plaquetas (PDGF) | Plaquetas, osteoblastos, células endoteliales, macrófagos, monocitos, celulas musculares lisas. | Estimula mitogéneis de células mesenquimales y osteoblastos; mitogénesis y quimiotáxis de células estirpe fibroblástica, glial y mscular lisa; regula secreción colgenasas; estimula mitogénesis mesenquimal y epitelial. |
| FC del endotelio vascular (VEGF) | Plaquetas, células endoteliales. | Incrementa angiogénesis, permeabilidad vascular y mitogénesis de células endoteliales. |
| FC tejido conectivo (CTGF) | Plaquetas. | Promueve angiogénesis, regeneración condral, fibrosis y adhesión plaquetaria. |
| FC epidérmico(EGF) | Plaquetas, macrófagos y monocitos. | Estimula quimiotaxis endotelial y angiogénesis; regula secreción de colagenasas; estimula mitogénesis de células mesenquimales y epiteliales. |
| FC insulínico típico I(IGF) | Células Madres Mesenquimales. | Acción estimuladora de la síntesis de matriz ósea y actúa como agente quimiotáctico que favorece la neovascularización. De forma general, estimula el crecimiento, potencian la acción de la insulina y regulan la proliferación celular. |
De este modo se utilizan las plaquetas como fuente exógena de FC que actúan estimulando la actividad de las células óseas y células epiteliales.
Técnica de obtenciónEl PRP se puede obtener mediante kits desechables con “técnica cerrada” o de forma manual mediante “técnica abierta”.
Dependiendo del sistema empleado, las concentraciones de plaquetas, leucocitos, eritrocitos y FC pueden variar. Al utilizar los distintos métodos se obtienen diferentes fracciones, entre las que se encuentran:
- –
Preparado Rico en Factores de Crecimiento (PRGF),
- –
Plasma Rico en Plaquetas y Factores de Crecimiento (PRPGF),
- –
Plasma Rico en Plaquetas (PRP),
- –
Plasma Pobre en Plaquetas (PPP),
- –
Plasma Rico en Plaquetas y Rico en Leucocitos (LRPRP),
- –
Plasma Rico en Plaquetas y Pobre en Leucocitos (LPPRP).
En el caso de la obtención por “técnica cerrada”, el método empleado deberá seguir las instrucciones descritas en cada sistema comercial. Citar como ejemplos los sistemas de Extracción de Plaquetas GPS III®, de BIOMET®, y de BTI®. Básicamente y aunque con pequeñas variaciones, los pasos serían los siguientes: extraer la sangre del paciente y disponerla en tubos aditivados y aptos para introducir en una centrifugadora concreta; la sangre debe centrifugarse inmediatamente tras la extracción y sin haber sido refrigerada; equilibrar la centrífuga y hacer girar la sangre estableciendo los parámetros (velocidad y tiempo) según lo propuesto por el fabricante; extraer las fracciones adecuadas según lo indicado y, por último, extracción de PRP siguiendo las normas del proveedor (resuspender las plaquetas y extraer PRP con la jeringa adecuada). Toda la manipulación de los dispositivos hay que realizarla asépticamente, siguiendo los protocolos de operación aséptica de cada centro de trabajo, para minimizar las posibilidades de contaminar las fracciones de plasma obtenidas. Es necesaria la utilidad de una cabina de flujo laminar adecuada en los procesos de fraccionamiento y activación, que disminuye el riesgo de contaminación microbiológica. Con respecto a los residuos, éstos deben desecharse siguiendo las directivas generales sobre higiene y la normativa legal que regula la eliminación apropiada de material infeccioso. La información se recopiló mediante consulta a las fichas técnicas de los productos comentados.
A continuación se describe la técnica abierta de obtención que, a partir de menores volúmenes de sangre y un equipamiento sencillo, permite obtener una mayor concentración de FC9.
Con una pipeta de 500 microlitros se aspira la fracción 1 y se traslada a un tubo estéril, previamente etiquetado, donde se reunirá todo el PRGF, repitiéndose el proceso con todos los tubos procedentes de la centrifugación. Con la misma pipeta (diferente punta estéril), se aspira la fracción 2 de todos los tubos y al igual que con la fracción 1, se lleva a otro tubo estéril etiquetado, que contendrá entonces, un plasma con una concentración de plaquetas similar a la de la sangre periférica (PGF).
Para la fracción 3 se realiza un pipeteado más cuidadoso, con una pipeta de 100 microlitros, para evitar las eventuales turbulencias que se puedan producir, y de este modo no aspirar los hematíes ni la serie blanca. Se repite este proceso 5 veces, colectándose lo obtenido en un tercer tubo estéril y etiquetado, el cual contendrá el PRGF. El volumen de plasma que se obtiene tras la centrifugación varía ligeramente de un individuo a otro, obteniéndose volúmenes diferentes de cada fracción. Por lo tanto, se debe contar siempre desde la serie blanca hacia arriba, y de obtenerse más plasma, éste será PPGF, cuyo volumen puede variar entre 1 y 2 ml. Así, si tenemos 4,5 ml de sangre, 1 ml de PRGF, 1 ml de PGF y el resto PPGF.
Todo el proceso se realiza con técnica estéril, aséptica, ya que el PRP se introduce en el organismo humano. Dada la falta de estudios bien diseñados sobre la estabilidad de los distintos componentes del PRP se considera que entre la extracción de la sangre y la administración del PRP (ya preparado) no pasen más de 45 minutos9,11.
Cuando el PRP se destina a tratar lesiones de partes blandas, no se considera necesaria la activación previa, debido a que esta se produce in situ al contacto con el colágeno tendinoso o con el propio coágulo de la rotura fibrilar. Cuando el PRP se utiliza para facilitar osteointegración de implantes o cuando se usa para el tratamiento de la osteoartritis12 de rodilla suele preferirse cierta activación (con trombina o cloruro cálcico) que, además, le confiere una consistencia gelatinosa que facilita su uso quirúrgico.
La sangre se recepciona en tubos estériles con citrato sódico al 3,8% como anticoagulante. Se centrifuga a 3.200 revoluciones por minuto (rpm) durante 15 min. El resultado son aproximadamente 2-3 ml de plasma enriquecido en plaquetas con concentraciones variables. Dicho plasma se centrifuga de nuevo durante 8 minutos a 1.800 rpm, a temperatura ambiente. Posteriormente, las fracciones obtenidas del plasma se separan mediante pipeteado muy meticuloso para no crear turbulencias.
Se comienza a pipetear desde arriba, pero la fracción más importante es la última:
- –
Fracción 1 –PPGF–: Los primeros 500 microlitros (0,5 ml.) es un plasma pobre en plaquetas y, por lo tanto, pobre en factores de crecimiento.
- –
Fracción 2 –PGF–: Los siguientes 500 microlitros corresponderán a un plasma con un número de plaquetas similar al que tiene la sangre periférica.
- –
Fracción 3 -PRGF-: La fracción de plasma más rico en plaquetas y factores de crecimiento son los 500 microlitros que se encuentran encima de la serie blanca.
Las fracciones con mayor contenido de plaquetas son las que se encuentran inmediatamente por encima de la serie blanca9 (0,1 mL. por encima de los hematíes). Esta fracción contiene un plasma hasta 5 veces más concentrado en plaquetas que la sangre periférica1. La siguiente fracción contiene un plasma 4 veces más concentrado.
Evidencia de seguridadLa tolerancia a la infiltración es en general muy buena. Es razonable pensar que la naturaleza autóloga y, por tanto, “propia”, del PRP facilite su tolerancia terapéutica, pero tolerancia no es sinónimo de inocuidad.
El VEGF, el factor de crecimiento fibroblástico básico, el factor de crecimiento hepatocitario (HGF) y el factor de crecimiento insulínico son factores de especial relevancia en el crecimiento de ciertos tumores debido a su elevado potencial angiogénico.
Estas propiedades de los FC, proclives a la generación y perpetuación de tumores, solo han sido descritas en animales de experimentación, sin evidencias, hasta el momento, que relacionen el uso de PRP en humanos con algún tipo de transformación carcinomatosa2.
Consideraciones legalesSiguiendo la normativa, que a continuación se especifica, podemos considerar el PRP11,13 como un medicamento de uso humano. La definición dada por el Reglamento (CE) n° 1394/2007 del Parlamento Europeo y del Consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada5, lo excluye tanto de ser medicamento de producción industrial como de ser medicamento de terapia avanzada.
Por otro lado, según RD-LEY 9/201414 quedan excluidos la sangre, los componentes y los derivados sanguíneos tal y como se definen en el Real Decreto 1088/2005, de 16 de septiembre15.
El principio básico que guía la autorización de cualquier medicamento es cumplir con las garantías de calidad, seguridad y eficacia11. Por tanto, para el PRP y cualquier otro medicamento autólogo será necesario establecer normas especificas que, garantizando una relación beneficio/riesgo positiva, estén sin embargo, ajustadas a las características del producto.
Por su consideración de hemoderivado se regula por los siguientes documentos:
- –
En el Real Decreto (RD) 1088/200515, de 16 de septiembre, se establecen los requisitos técnicos y condiciones mínimas de la hemodonación y de los centros y servicios de transfusión. El Anexo V de este RD ha sido modificado en la Orden SPI/2101/2011, de 22 de julio6,16.
- –
En la Orden SCO/322/200717, de 9 de febrero, se establecen los requisitos de trazabilidad y de notificación de reacciones y efectos adversos graves de la sangre y de los componentes sanguíneos, incorporada al ordenamiento jurídico interno la Directiva 2005/61/CE de la Comisión, de 30 de septiembre de 2005.
Quedarán excluidas de la utilización de estos procedimientos las personas pertenecientes al grupo que se describe en el Anexo II, punto C, del RD 1088/200515, donde constan los criterios de exclusión permanente y temporal.
Supone exclusión permanente para la donación autóloga antecedentes de: hepatitis B, excepto las personas que resulten negativas al antígeno de superficie de la hepatitis B (AgHBs), cuya inmunidad haya sido demostrada; marcadores positivos para el VHC; marcadores positivos para VIH- I/II y marcadores positivos para HTLV I/II. Como exclusión temporal es una contraindicación presentar infección bacteriana activa.
En cada donación deberán realizarse las pruebas analíticas que se indican en el Anexo III del RD 1088/200515, como requisitos de verificación para las donaciones de sangre total y componentes sanguíneos. Estas pruebas analíticas no deberán seguir de modo obligado las normas de correcta fabricación de medicamentos, siendo suficientes las normas habituales de los laboratorios de hematología y/o análisis clínicos.
Los criterios de interpretación de las pruebas de detección de agentes infecciosos en las donaciones tendrán en cuenta lo contemplado en el Anexo IV del antes mencionado RD 1088/200515.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) considera, por lo tanto, que el PRP es un medicamento de uso humano que se puede utilizar al amparo del artículo 5 de la Directiva 2001/83/CE, de 6 de noviembre, y las disposiciones legales que transponen dicha Directiva en nuestro país13.
Por ello, dadas las características de producción y aplicación del PRP, cabe considerarlo como medicamento de dispensación bajo prescripción médica restringida, de utilización reservada a determinados medios especializados que en todo caso, deberán contar con la autorización de las autoridades competentes en materia de inspección16.
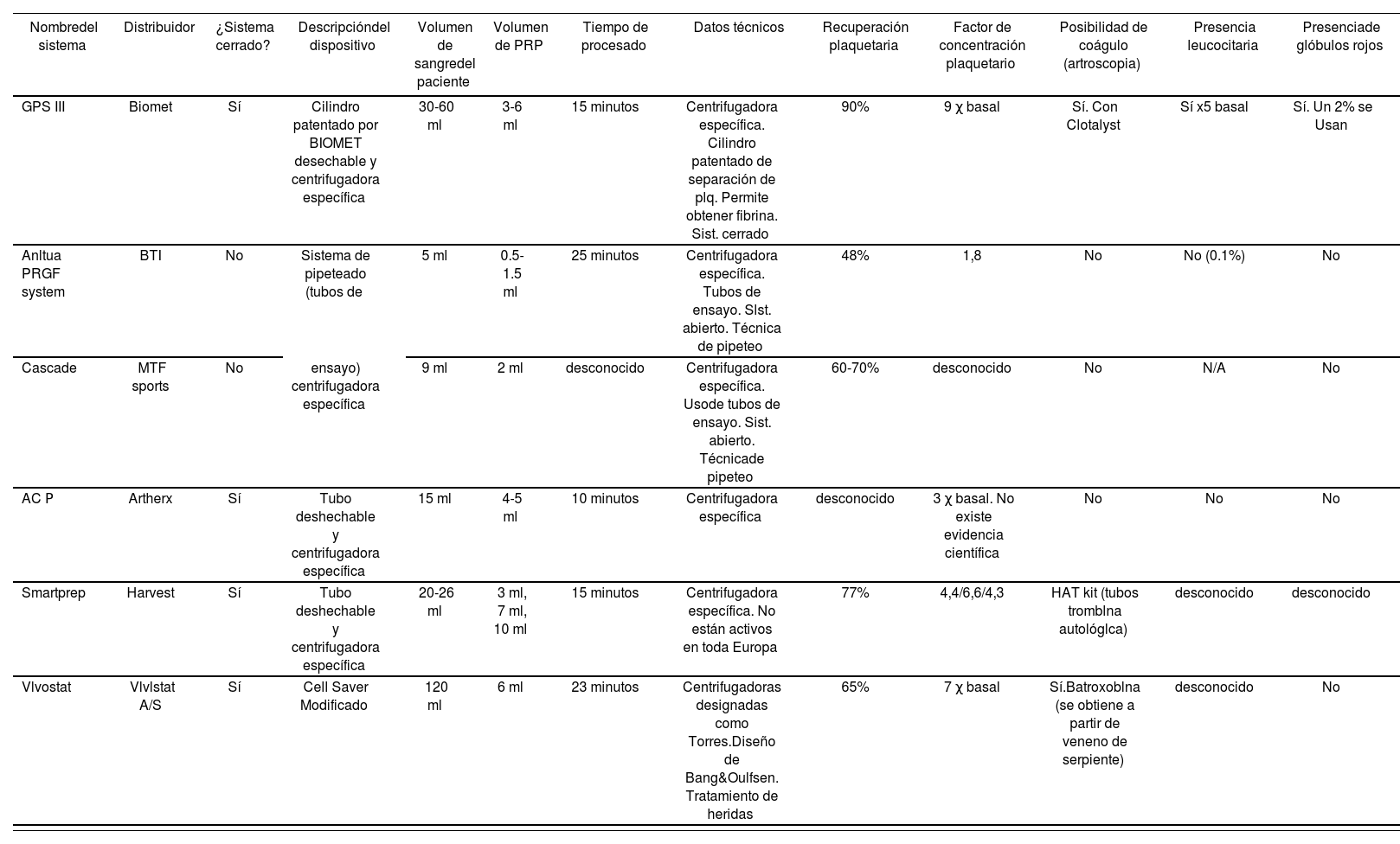
Del mismo modo, los kits desechables cerrados empleados para su obtención, siguiendo el RD 1591/200918 y la directriz comunitaria19 se tratan de producto sanitario (PS). Tal y como se ha expuesto anteriormente, el PRP se puede obtener de forma manual mediante “técnica abierta” o mediante kits desechables con “técnica cerrada”, siendo estos últimos clasificados como PS IIa. No obstante, no existe una lista exhaustiva de proveedores de kits cerrados de extracción de PRP, ya que las empresas que comercializan estos PS clase IIa, hasta la entrada en vigor del Real Decreto 1591/2009 no estaban obligadas a realizar la comunicación de puesta en el mercado a la AEMPS. Un ejemplo de algunos de estos kits, se detalla en la tabla 2. La información se recopiló mediante consulta a las fichas técnicas de los productos y, en caso de ausencia de datos se ha contactado con los laboratorios fabricantes, vía teléfono o correo electrónico.
Características de las casas comerciales de PRP
| Nombredel sistema | Distribuidor | ¿Sistema cerrado? | Descripcióndel dispositivo | Volumen de sangredel paciente | Volumen de PRP | Tiempo de procesado | Datos técnicos | Recuperación plaquetaria | Factor de concentración plaquetario | Posibilidad de coágulo (artroscopia) | Presencia leucocitaria | Presenciade glóbulos rojos |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GPS III | Biomet | Sí | Cilindro patentado por BIOMET desechable y centrifugadora específica | 30-60 ml | 3-6 ml | 15 minutos | Centrifugadora específica. Cilindro patentado de separación de plq. Permite obtener fibrina. Sist. cerrado | 90% | 9 χ basal | Sí. Con Clotalyst | Sí x5 basal | Sí. Un 2% se Usan |
| Anltua PRGF system | BTI | No | Sistema de pipeteado (tubos de | 5 ml | 0.5-1.5 ml | 25 minutos | Centrifugadora específica. Tubos de ensayo. Slst. abierto. Técnica de pipeteo | 48% | 1,8 | No | No (0.1%) | No |
| Cascade | MTF sports | No | ensayo) centrifugadora específica | 9 ml | 2 ml | desconocido | Centrifugadora específica. Usode tubos de ensayo. Sist. abierto. Técnicade pipeteo | 60-70% | desconocido | No | N/A | No |
| AC Ρ | Artherx | Sí | Tubo deshechable y centrifugadora específica | 15 ml | 4-5 ml | 10 minutos | Centrifugadora específica | desconocido | 3 χ basal. No existe evidencia científica | No | No | No |
| Smartprep | Harvest | Sí | Tubo deshechable y centrifugadora específica | 20-26 ml | 3 ml, 7 ml, 10 ml | 15 minutos | Centrifugadora específica. No están activos en toda Europa | 77% | 4,4/6,6/4,3 | HAT kit (tubos tromblna autológlca) | desconocido | desconocido |
| Vlvostat | Vlvlstat A/S | Sí | Cell Saver Modificado | 120 ml | 6 ml | 23 minutos | Centrifugadoras designadas como Torres.Diseño de Bang&Oulfsen. Tratamiento de heridas | 65% | 7 χ basal | Sí.Batroxoblna (se obtiene a partir de veneno de serpiente) | desconocido | No |
La AEMPS ha establecido qué requisitos mínimos ha de cumplir el PRP como medicamento de uso humano13,15:
Garantías de calidad: El facultativo prescriptor será el responsable de garantizar su cumplimiento (aunque el procesado y la obtención sean realizados por un tercero).
Garantías de trazabilidad: El facultativo prescriptor deberá adoptar las medidas precisas de control, vigilancia y trazabilidad que impidan la transmisión de enfermedades infecciosas. Será necesario cumplir todos los preceptos legales descritos. Se deberán realizar las pruebas analíticas que se incluyen en el RD 1088/200515.
Garantías de farmacovigilancia: Los profesionales sanitarios tienen el deber de comunicar las sospechas de reacciones adversas de las que tengan conocimiento y que pudieran haber sido causadas por medicamentos y/o por PS. Para ello se seguirán los cauces habituales6,16,20. Dada la consideración de medicamento que tiene el PRP y de PS el kit para obtención mediante técnica cerrada.
Garantías de Información: El facultativo prescriptor garantizará que el paciente que se va a someter a un tratamiento con PRP reciba la información mínima adecuada.
ConclusionesLos avances médicos comienzan su implantación, con frecuencia, antes de que exista una legislación que los contemple, y que proporcione a pacientes y profesionales un marco jurídico que garantice un uso seguro y racional de los mismos. Del mismo modo muchos de estos avances son utilizados fuera de los rígidos cauces de las diversas comisiones clínicas implicadas en el uso racional de los medicamentos, al considerarse no como medicamentos sino como PS, o como técnicas diversas de tratamiento.
El PRP ha ido introduciéndose en terapéutica con una enorme variabilidad en las técnicas de obtención y en las pautas utilizadas. Por tanto, no es de sorprender que el nivel de evidencia científica que lo acompaña sea bajo, lo que no ha de impedir que sea utilizado en pacientes y situaciones bien seleccionados.
Su consideración como medicamento, y los recientes casos de acontecimientos adversos relacionados con el PRP, hace necesaria la implicación de los servicios de farmacia en la gestión de los mismos y, llegado el caso, en su manipulación y acondicionamiento.