Sr. Director:
La enfermedad de Crohn (EC) se caracteriza por una inflamación transmural crónica, que afecta al tracto digestivo, principalmente íleon, colon y región perianal. La distribución intestinal característica es asimétrica, segmentaria y con tendencia a la recidiva y recurrencia incluso después de la resección intestinal. Generalmente se manifiesta en pacientes con edades inferiores a los 30 años, con clínica de dolor abdominal, fiebre y diarrea que a menudo se complica con el desarrollo de fístulas u obstrucciones intestinales1.
El diagnóstico se realiza tras valorar los datos clínicos, radiológicos, endoscópicos e histológicos, éstos últimos obtenidos de las biopsias y/o del examen de la muestra quirúrgica.
Para medir la actividad inflamatoria se utilizan diversos índices de actividad, entre los que destaca el CDAI2 (Crohn Disease Activity Index), que incluye ocho variables independientes, siete variables clínicas y un parámetro analítico.
Los fármacos de primera elección en el tratamiento de los brotes leves son mesalazina y sulfasalazina. También se emplean antibióticos, como metronidazol o ciprofloxacino, en el tratamiento de la enfermedad perianal. Los corticoides se prescriben en brotes moderados y graves, mientras que los inmunosupresores se utilizan en pacientes corticodependientes y en la enfermedad fistulizante, evitando el tratamiento continuado con corticoides en más de un 50% de los pacientes. Cuando los inmunosupresores no consiguen un buen control de la enfermedad o en pacientes refractarios al tratamiento, se utilizan anticuerpos monoclonales inhibidores del factor de necrosis tumoral alfa (TNFa), como infliximab y adalimumab.
Describimos el caso de una paciente con EC tratada con certolizumab pegol (CDP870), anticuerpo monoclonal en fase III de investigación clínica con especificidad frente al TNFa, ensayado en artritis reumatoide, psoriasis, enfermedad inflamatoria intestinal y asma grave.
Descripción del casoMujer de 32 años, diagnosticada de EC ileocecal en octubre de 2002 con antecedentes de tabaquismo. En enero de 2003 y por mala evolución de la enfermedad, se inició tratamiento con azatioprina a dosis de 150 mg al día. El tratamiento resultó ineficaz y en junio de 2003 presentó una fístula rectovaginal que obligó a realizar desbridamiento quirúrgico y tratamiento con antibióticos.
Dos meses más tarde presentó un brote grave y se decidió tratar con ciclosporina endovenosa 3 mg/kg que se interrumpió por recidiva clínica grave. Se reinició el tratamiento inicial con azatioprina. A finales de año presentó una segunda recidiva que obligó a añadir corticoides v.o. y, dada la mala evolución de la enfermedad, en enero de 2004 se inició tratamiento con infliximab 5 mg/kg. En junio de 2004 se suspendió el tratamiento debido a una hepatitis colestásica atribuida al infliximab. Sin embargo, entre el mes de julio de 2004 y julio de 2005 la EC se mantuvo inactiva en tratamiento con azatioprina.
En julio de 2005, volvió a presentar un nuevo brote grave por lo que se retiró el tratamiento con azatioprina y se inició metotrexato intramuscular 25 mg/semana. Tras administrar diez dosis no se obtuvo respuesta terapéutica; por este motivo, en diciembre, se solicitó autorización para realizar tratamiento compasivo con adalimumab (dosis de inducción de 160 mg, posteriormente 80 mg y finalmente 40 mg/semana) sin presentar una buena respuesta tras tres meses de tratamiento.
En marzo de 2006 presentó otro brote grave, por lo que ingresó en el hospital siendo tratada con ciclosporina endovenosa y posteriormente oral en combinación con corticoides en pauta descendiente. A pesar del tratamiento, en agosto de 2006, la paciente acudió al servicio de urgencias con clínica de 7-8 días de evolución caracterizada por proctalgia intensa y síndrome febril. Durante la exploración se observó un absceso en la fosa isquiorrectal que requirió desbridamiento quirúrgico y tratamiento antibiótico.
Tras no responder al tratamiento compasivo con micofenolato de mofetilo (500 mg cada 12 h) y pauta descendiente de corticoides, se solicitó un tratamiento compasivo con certolizumab con la indicación de EC corticodependiente extensa de difícil control y multirrefractaria. La dosis propuesta fue de 400 mg administrados en inyección subcutánea la semana 0, 2, 4 y posteriormente una vez al mes.
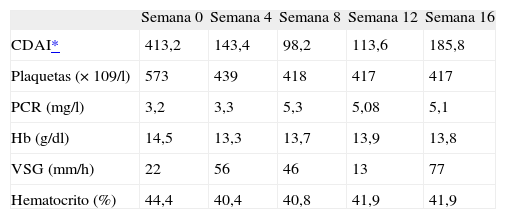
Inicialmente se observó buena respuesta al certolizumab pasando de quince a cuatro deposiciones/día de adecuada consistencia, disminución del dolor abdominal y mejoría del estado general. Se observó disminución de los parámetros inflamatorios tabilizándose los valores de fibrinógeno, velocidad de sedimentación globular (VSG) y proteína C reactiva. En función de los valores del CDAI la enfermedad se consideró inactiva (tabla 1).
Valores hematológicos y del CDAI
| Semana 0 | Semana 4 | Semana 8 | Semana 12 | Semana 16 | |
| CDAI* | 413,2 | 143,4 | 98,2 | 113,6 | 185,8 |
| Plaquetas (× 109/l) | 573 | 439 | 418 | 417 | 417 |
| PCR (mg/l) | 3,2 | 3,3 | 5,3 | 5,08 | 5,1 |
| Hb (g/dl) | 14,5 | 13,3 | 13,7 | 13,9 | 13,8 |
| VSG (mm/h) | 22 | 56 | 46 | 13 | 77 |
| Hematocrito (%) | 44,4 | 40,4 | 40,8 | 41,9 | 41,9 |
CDAI: Crohn Disease Activity Index; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
En la semana 15 la paciente presentó empeoramiento clínico con aumento del número de deposiciones/día y dolor abdominal leve. La analítica de control detectó un aumento de la VSG, del fibrinógeno y de la proteína C reactiva. Se realizó una colonoscopia que mostró úlceras exudativas profundas.
Con la sospecha de pérdida de eficacia se decidió aumentar la frecuencia de administración del anticuerpo, pasando a dosis de 400 mg cada 15 días.
Una vez administrada la quinta dosis de mantenimiento se confirmó la disminución de la respuesta terapéutica, y tras considerar fracaso terapéutico, se decidió suspender el tratamiento con certolizumab.
En resumen, la paciente fue refractaria a todos los tratamientos administrados (antiinflamatorios, inmunosupresores y anticuerpos monoclonales), presentó una corticodependencia importante y, en consecuencia, tras agotar las opciones farmacológicas disponibles, se realizó una ileostomía de descarga con el objetivo de mejorar el estado inmunológico y nutricional.
DiscusiónConseguir y mantener la remisión de la enfermedad es el objetivo principal del tratamiento de la EC. La heterogeneidad clínica de la enfermedad requiere un enfoque terapéutico individualizado dependiendo de la localización de las lesiones, la actividad inflamatoria y del patrón clínico evolutivo.
El mejor conocimiento de la etiopatogenia de la enfermedad ha permitido el desarrollo de nuevos fármacos biotecnológicos, como las moléculas anti-TNF3.
El certolizumab pegol (CDP870)4 es un anticuerpo monoclonal pegilado que bloquea el TNFa. Ensayos clínicos en fase II5 sugieren dosis de 400 mg de certolizumab para inducir respuesta terapéutica y remisión clínica, especialmente en pacientes con niveles elevados de proteína C.
Los datos más recientemente publicados son los estudios en tercera fase de investigación clínica PRECISE 1 y 2. PRECISE 16 concluye que la terapia con certolizumab en pacientes con EC moderada-severa obtiene mejores tasas de respuesta en comparación con placebo, aunque no se observan diferencias significativas en las tasas de remisión.
En PRECISE 27 un 47,9% de los pacientes con certolizumab tuvieron remisión clínica a la semana 26 vs el 28,6% con placebo (p < 0,001).
La evolución del tratamiento en nuestra paciente sugiere una pérdida de respuesta tras mejoría inicial que coincide con los resultados obtenidos por Schreiber et al5 en su ensayo clínico aleatorizado y comparado con placebo.
Hasta la fecha sólo se ha publicado un caso clínico de EC fistulizante tratada con certolizumab8, obteniendo respuesta terapéutica a los seis meses de tratamiento. En nuestro caso los resultados no fueron tan satisfactorios.