Sr. Director:
La ficha técnica (FT) de un medicamento constituye el documento oficial donde se describen, entre otros aspectos, las indicaciones y condiciones de uso de los mismos. Aprobada y revisada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y/o la Agencia Europea de Medicamentos (EMEA), la información que contiene debe ser congruente con los resultados de los estudios farmacológicos, clínicos y galénicos presentados en los documentos de registro y con los conocimientos científicos actuales de que se disponga1.
La información contenida en la FT esta regulada por el Real Decreto (RD) 1345/20072, convirtiéndose, a partir de la creación de la EMEA en 1995, en un documento estándar común dentro de todos los países de la UE. Dicho documento, “A guideline on summary of product characteristics”3, consta de 10 epígrafes entre los cuales se halla uno dedicado a posología y forma de administración, donde la dosis para cada vía de administración, para cada indicación y para cada grupo de edad o poblaciones especiales debe venir claramente definida1.
Por otro lado, cuando un medicamento es empleado en indicaciones y/o condiciones de uso diferentes a las autorizadas, como es el caso de su posología, entre otros, la literatura médica anglosajona, y por extensión la nuestra, se refiere a ello como uso “off-label” (OL)4. Dicha utilización, está regulada por el RD 1015/2009, según el cual ésta tendrá carácter excepcional, respetando las restricciones ligadas a la prescripción y/o dispensación del medicamento y el protocolo terapéutico asistencial del centro sanitario5.
La existencia de discrepancias y/o no concordancias entre la información posológica contenida en la FT de la AEMPS/EMEA frente a la contenida en la FT de la Food and Drug Administration (FDA)/otra agencia de medicamentos no europea6, así como la ausencia, en muchos casos, de recomendaciones para su individualización, ha condicionado, aumentándolo, el uso de posologías OL para un gran número de medicamentos y/o circunstancias, tal y como se describe, a continuación, en esta “Carta al Director”.
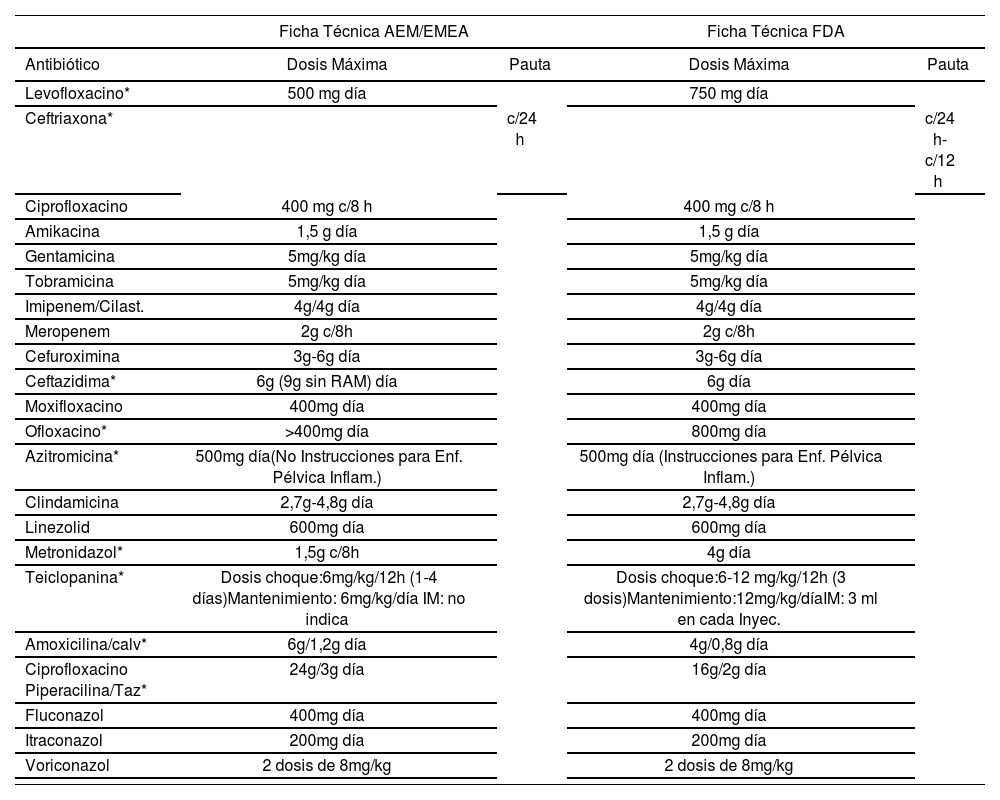
Utilizando datos propios, obtenidos, tal y como hemos indicado anteriormente, al comparar la información contenida en la FT aprobada por la AEMPS/EMEA con la contenida en la FT, para el mismo medicamento, aprobada por la FDA, de 22 de los antibióticos más utilizados en la unidad de Medicina Interna de nuestro hospital, como ejemplo de grupo de fármacos muy sensibles a la individualización del régimen posológico, se encontraron discrepancias en aproximadamente el 36% de las FT de los antibióticos estudiados: 27% referentes a dosis máxima, 4.5% a pauta posológica y otro 4.5% referente a otras especificaciones posológicas (Tabla 1). En este mismo sentido, y a título de ejemplo, Conroy et al., en un par de artículos publicados en 1999 y 2000, respectivamente, hallaron cifras de utilización OL de medicamentos del 7%-54%, en función del ámbito hospitalario contemplado7,8.
Información posológica contenida en la Ficha Técnica según AEMPS/EMEA ó FDA
| Ficha Técnica AEM/EMEA | Ficha Técnica FDA | |||
|---|---|---|---|---|
| Antibiótico | Dosis Máxima | Pauta | Dosis Máxima | Pauta |
| Levofloxacino* | 500 mg día | 750 mg día | ||
| Ceftriaxona* | c/24 h | c/24 h-c/12 h | ||
| Ciprofloxacino | 400 mg c/8 h | 400 mg c/8 h | ||
| Amikacina | 1,5 g día | 1,5 g día | ||
| Gentamicina | 5mg/kg día | 5mg/kg día | ||
| Tobramicina | 5mg/kg día | 5mg/kg día | ||
| Imipenem/Cilast. | 4g/4g día | 4g/4g día | ||
| Meropenem | 2g c/8h | 2g c/8h | ||
| Cefuroximina | 3g-6g día | 3g-6g día | ||
| Ceftazidima* | 6g (9g sin RAM) día | 6g día | ||
| Moxifloxacino | 400mg día | 400mg día | ||
| Ofloxacino* | >400mg día | 800mg día | ||
| Azitromicina* | 500mg día(No Instrucciones para Enf. Pélvica Inflam.) | 500mg día (Instrucciones para Enf. Pélvica Inflam.) | ||
| Clindamicina | 2,7g-4,8g día | 2,7g-4,8g día | ||
| Linezolid | 600mg día | 600mg día | ||
| Metronidazol* | 1,5g c/8h | 4g día | ||
| Teiclopanina* | Dosis choque:6mg/kg/12h (1-4 días)Mantenimiento: 6mg/kg/día IM: no indica | Dosis choque:6-12 mg/kg/12h (3 dosis)Mantenimiento:12mg/kg/díaIM: 3 ml en cada Inyec. | ||
| Amoxicilina/calv* | 6g/1,2g día | 4g/0,8g día | ||
| Ciprofloxacino Piperacilina/Taz* | 24g/3g día | 16g/2g día | ||
| Fluconazol | 400mg día | 400mg día | ||
| Itraconazol | 200mg día | 200mg día | ||
| Voriconazol | 2 dosis de 8mg/kg | 2 dosis de 8mg/kg | ||
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; EMA: Agencia Europea de Medicamentos; FDA: Food and Drug Administration
Por lo tanto, debido al mencionado y extenso uso de posologías OL, y al objeto de obtener el mayor balance beneficio-riesgo para el paciente, el menor coste-eficacia posible, así como garantizar el cumplimiento de la legislación sanitaria correspondiente, se puede concluir la necesidad de desarrollar e incluir, tanto a nivel hospitalario como ambulatorio, estos regímenes posológicos OL, relativos a antibióticos y al resto de fármacos pertenecientes a los distintos grupos terapéuticos, dentro de los correspondientes protocolos terapéuticos, de obligado cumplimiento por parte de los médicos prescriptores, tal y como se describe en el RD-1015/2009.