La enfermedad de Crohn (EC) es un proceso crónico e incurable. La incidencia de nuevos casos de EC varía mucho entre áreas. En España, datos publicados recientemente en 2014 sitúan la incidencia en 8,9 casos por 100.000 habitantes y año. La prevalencia en España se estima alrededor de 137.17/100.000 habitantes (IC 95% 114-160)2.
El objetivo del tratamiento consiste en conseguir y mantener la remisión completa de la enfermedad y en evitar y tratar las complicaciones. La heterogeneidad clínica de la EC va a requerir un tratamiento individualizado que depende de múltiples factores entre los que destacan la localización, la gravedad, el patrón evolutivo, la respuesta previa al tratamiento y la presencia de complicaciones.
Por lo general, las personas con EC tienen exacerbaciones agudas intercaladas con períodos de remisión o enfermedad menos activa. El tratamiento se dirige en gran medida a aliviar los síntomas en lugar de curar. El tratamiento activo de la enfermedad aguda (inducción de la remisión) debe distinguirse de la prevención de la recaída (mantenimiento de la remisión)3.
Como primera línea de tratamiento están los glucocorticoides. En personas que no puedan tolerar o estén contraindicados los glucocorticoides se puede considerar budesonida por vía oral. Otra alternativa a los corticoides, son los aminosalicilatos: el ácido aminosalicilíco o mesalazina (5-ASA). En caso de exacerbaciones graves de la enfermedad, no será posible llevar a cabo el tratamiento con budesonida o 5-ASA.
Se debe añadir al tratamiento azatioprina (AZA) o 6-mercaptopurina (6-MP) si hay 2 o más exacerbaciones en el periodo de un año o si no ha habido suficiente respuesta a los glucocorticoides. Si no se toleran AZA o 6-MP, o si hay deficiencia de tiopurina metiltransferasa (TPMT), se puede combinar el tratamiento con glucocorticoides y metotrexato (MTX).
En el caso de no responder a la terapia convencional o que ésta esté contraindicada, para exacerbaciones graves de la enfermedad, se recomienda la terapia biológica: los fármacos anti factor de necrosis tumoral (TNF-α). Estos fármacos presentan dos características importantes: rapidez de acción en la inducción de la remisión clínica, y eficacia en el mantenimiento de la remisión inducida por el propio fármaco. Existen dos anti-TNF aprobados en España para la EC: infliximab (IFX) y adalimumab (ADA).
Lo más recomendable actualmente sería emplear un tratamiento convencional, secuencial con plazos de tiempo bien prefijados en función del curso evolutivo de la enfermedad para introducir el tratamiento inmunomodulador-biológico sin demora, lo que ha sido denominado como estrategia «step-up acelerada»4,5.
Un meta análisis elaborado por Peyrin-Biroulet et al6, indica que IFX, ADA y certolizumab son fármacos eficaces para inducir la remisión. Certolizumab sólo está autorizado en Suiza para EC, pero no en el resto de Europa. Dicho fármaco, junto con el natalizumab están aprobados por la FDA para la inducción de la remisión de EC.7,8
No existen ensayos comparativos “head to head” entre los dos biológicos disponibles en nuestro país (IFX y ADA) que puedan orientar la elección5.
Si se pierde la eficacia del anti-TNF al cabo de un año, se podrá acortar el intervalo de administración o aumentar la dosis. Si aún así no aumenta la efectividad, se puede continuar el tratamiento con un segundo anti-TNF4,5,9,10.
En este contexto aparece vedolizumab (VDZ Entyvio®, Lab Takeda Pharma) aprobado por la Agencia Europea de Medicamentos (EMA)11 y la Agencia Española de Medicamentos y Productos Sanitarios (AEMyPS)12 para el tratamiento de la colitis ulcerosa y la enfermedad de Crohn activa, de moderada a grave, en pacientes adultos que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta o sean intolerantes al tratamiento convencional o con un antagonista del factor de necrosis tumoral alfa TNFα).
Se trata de un anticuerpo monoclonal humanizado que se une específicamente a la integrina a407, que se expresa mayoritariamente en linfocitos T colaboradores que migran al intestino. La pauta posológica recomendada es de 300 mg administrados mediante perfusión intravenosa en las semanas 0, 2 y 6 y cada 8 semanas a partir de entonces.
EficaciaSe han llevado a cabo 2 Ensayos clínicos (EECC) con VDZ en EC: GEMINI II13 que compara VDZ con placebo, para el tratamiento de la EC de moderada a graveyGEMINI III14 que compara VDZ frente a placebo para el tratamiento de la EC después de haber fallado al tratamiento previo con anti-TNF.
El GEMINI II es un ensayo fase III, multicéntrico, doble ciego, internacional, aleatorizado, controlado con placebo de grupos paralelos que incluyó 1.115 pacientes entre las dos cohortes. Consta de 2 fases: una fase de inducción y una de mantenimiento. En este ensayo aproximadamente la mitad de los pacientes habían fallado a anti-TNF previamente. El objetivo de este estudio fue determinar el efecto de VDZ en pacientes que habían fallado a 1 o mas terapia convencionales previas para EC incluyendo inmunomoduladores (6-MP, AZA o MTX) y a anti-TNF alfa. Para asegurarse que la eficacia de VDZ se evaluara en pacientes naive a anti-TNF no se permitió reclutar mas del 50% de pacientes respecto a la población total incluida con fallo previo a anti-TNF.
En la fase de inducción (cohorte 1) los pacientes fueron randomizados en un ratio 3:2 para recibir bien VDZ a dosis de 300 mg IV o placebo a las semanas 0 y 2 y fueron seguidos hasta la semana 6, tiempo en el cual se midió el estado de la enfermedad.
Para la fase de mantenimiento tenemos la cohorte de la fase de inducción en tratamiento con VDZ y una cohorte 2 que recibieron VDZ de manera abierta durante también 2 semanas. Los pacientes de ambas cohortes que obtuvieron respuesta a la semana 6 (disminución de CDAI > 70 puntos) fueron randomizados en un ratio 1:1:1 para continuar el ciego y recibir o bien VDZ c/ 8 semanas, VDZ c/ 4 semanas o placebo durante 52 semanas. El resto de pacientes que no alcanzaron respuesta en la semana 6 fueron asignados a recibir VDZ c/4 semanas, pero no fueron randomizados. Las dos variables principales de eficacia en la fase de inducción fueron: Remisión clínica (puntuación CDAI ≤ 150 puntos y respuesta clínica mejorada (reducción > 100 puntos en la escala CDAI-100 con respecto al nivel basal) a la semana 6.
El CDAI (Crohn’s Disease Activity Index) es el patrón de oro para cuantificar la actividad clínica utilizado en los ensayos clínicos. Desde el punto de vista clínico, se clasifica brote leve (CDAI de 150 a 220), brote moderado (CDAI de 220 a 450) y brote grave (CDAI > 450).
El GEMINI III es un ensayo fase III, multicéntrico, doble ciego, internacional y controlado con placebo que incluyó 416 pacientes. Tenía como objetivo primario determinar el efecto de VDZ como terapia de inducción de la remisión clínica en la semana 6 en pacientes con fallo a anti-TNF previos (75% de los pacientes incluidos en el ensayo). El grupo activo recibió una dosis de VDZ de 300 mg en la semana 0, 2 y 6. El grupo control recibió placebo en esas mismas semanas. Los objetivos secundarios del ensayo fueron determinar el efecto de VDZ en respuesta clínica mejorada a la semana 6 y remisión clínica semana 10 en la población con fallo a anti-TNF y remisión clínica semana 6 y 10 de la población global.
Respecto a los resultados obtenidos en los ensayos: GEMINI II y III se observan en la Tabla 1 y 2 respectivamente.
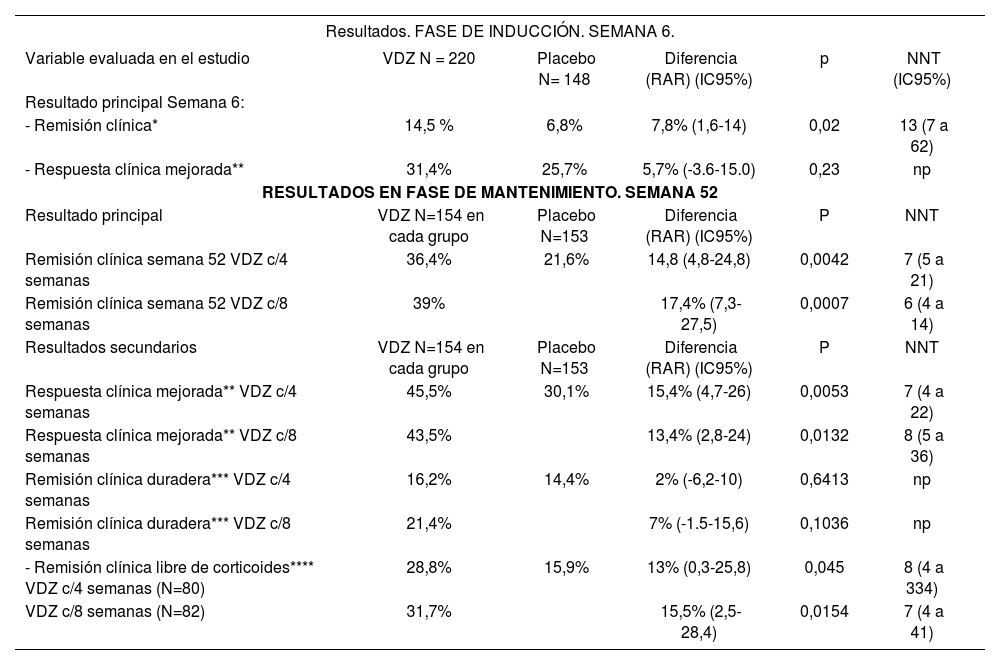
Resultados del ensayo GEMINI II
| Resultados. FASE DE INDUCCIÓN. SEMANA 6. | |||||
|---|---|---|---|---|---|
| Variable evaluada en el estudio | VDZ N = 220 | Placebo N= 148 | Diferencia (RAR) (IC95%) | p | NNT (IC95%) |
| Resultado principal Semana 6: | |||||
| - Remisión clínica* | 14,5 % | 6,8% | 7,8% (1,6-14) | 0,02 | 13 (7 a 62) |
| - Respuesta clínica mejorada** | 31,4% | 25,7% | 5,7% (-3.6-15.0) | 0,23 | np |
| RESULTADOS EN FASE DE MANTENIMIENTO. SEMANA 52 | |||||
| Resultado principal | VDZ N=154 en cada grupo | Placebo N=153 | Diferencia (RAR) (IC95%) | P | NNT |
| Remisión clínica semana 52 VDZ c/4 semanas | 36,4% | 21,6% | 14,8 (4,8-24,8) | 0,0042 | 7 (5 a 21) |
| Remisión clínica semana 52 VDZ c/8 semanas | 39% | 17,4% (7,3-27,5) | 0,0007 | 6 (4 a 14) | |
| Resultados secundarios | VDZ N=154 en cada grupo | Placebo N=153 | Diferencia (RAR) (IC95%) | P | NNT |
| Respuesta clínica mejorada** VDZ c/4 semanas | 45,5% | 30,1% | 15,4% (4,7-26) | 0,0053 | 7 (4 a 22) |
| Respuesta clínica mejorada** VDZ c/8 semanas | 43,5% | 13,4% (2,8-24) | 0,0132 | 8 (5 a 36) | |
| Remisión clínica duradera*** VDZ c/4 semanas | 16,2% | 14,4% | 2% (-6,2-10) | 0,6413 | np |
| Remisión clínica duradera*** VDZ c/8 semanas | 21,4% | 7% (-1.5-15,6) | 0,1036 | np | |
| - Remisión clínica libre de corticoides**** VDZ c/4 semanas (N=80) | 28,8% | 15,9% | 13% (0,3-25,8) | 0,045 | 8 (4 a 334) |
| VDZ c/8 semanas (N=82) | 31,7% | 15,5% (2,5-28,4) | 0,0154 | 7 (4 a 41) | |
VDZ: Vedolizumab; RAR=Reducción absoluta de riesgo; NNT= Numero necesario de pacientes a tratar para obtener una unidad adicional de eficacia.
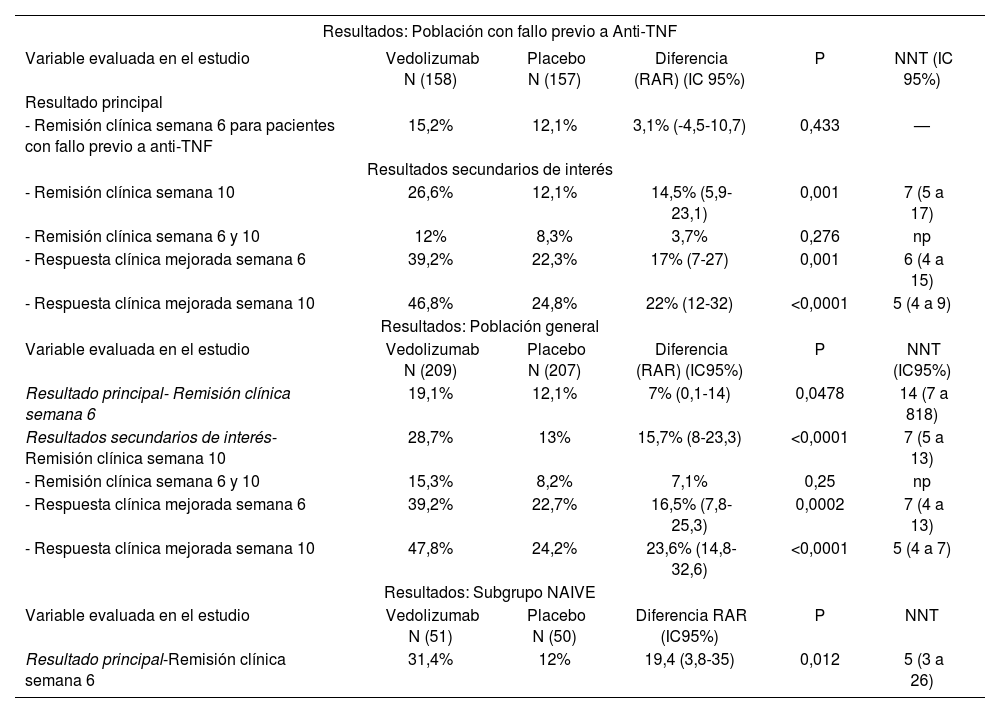
Resultados del ensayo GEMINI III
| Resultados: Población con fallo previo a Anti-TNF | |||||
|---|---|---|---|---|---|
| Variable evaluada en el estudio | Vedolizumab N (158) | Placebo N (157) | Diferencia (RAR) (IC 95%) | P | NNT (IC 95%) |
| Resultado principal | |||||
| - Remisión clínica semana 6 para pacientes con fallo previo a anti-TNF | 15,2% | 12,1% | 3,1% (-4,5-10,7) | 0,433 | — |
| Resultados secundarios de interés | |||||
| - Remisión clínica semana 10 | 26,6% | 12,1% | 14,5% (5,9-23,1) | 0,001 | 7 (5 a 17) |
| - Remisión clínica semana 6 y 10 | 12% | 8,3% | 3,7% | 0,276 | np |
| - Respuesta clínica mejorada semana 6 | 39,2% | 22,3% | 17% (7-27) | 0,001 | 6 (4 a 15) |
| - Respuesta clínica mejorada semana 10 | 46,8% | 24,8% | 22% (12-32) | <0,0001 | 5 (4 a 9) |
| Resultados: Población general | |||||
| Variable evaluada en el estudio | Vedolizumab N (209) | Placebo N (207) | Diferencia (RAR) (IC95%) | P | NNT (IC95%) |
| Resultado principal- Remisión clínica semana 6 | 19,1% | 12,1% | 7% (0,1-14) | 0,0478 | 14 (7 a 818) |
| Resultados secundarios de interés- Remisión clínica semana 10 | 28,7% | 13% | 15,7% (8-23,3) | <0,0001 | 7 (5 a 13) |
| - Remisión clínica semana 6 y 10 | 15,3% | 8,2% | 7,1% | 0,25 | np |
| - Respuesta clínica mejorada semana 6 | 39,2% | 22,7% | 16,5% (7,8-25,3) | 0,0002 | 7 (4 a 13) |
| - Respuesta clínica mejorada semana 10 | 47,8% | 24,2% | 23,6% (14,8-32,6) | <0,0001 | 5 (4 a 7) |
| Resultados: Subgrupo NAIVE | |||||
| Variable evaluada en el estudio | Vedolizumab N (51) | Placebo N (50) | Diferencia RAR (IC95%) | P | NNT |
| Resultado principal-Remisión clínica semana 6 | 31,4% | 12% | 19,4 (3,8-35) | 0,012 | 5 (3 a 26) |
En los estudios realizados hasta la comercialización, los efectos adversos más frecuentes son nasofaringitis, dolor de cabeza, artralgia, dolor abdominal e infecciones, y los más graves fueron anemia, exacerbación de la enfermedad, abscesos anales y abdominales, infecciones graves y distintas neoplasias.
En GEMINI II, una paciente desarrolló cáncer de mama en la fase de inducción, mientras que en la fase de mantenimiento, hubo un caso de tumor carcinoide en el apéndice, otro de carcinoma de piel de células escamosas, y un caso de carcinoma de piel de células basales.
En GEMINI III, durante el ensayo, un paciente desarrolló síntomas neurológicos y aunque se descartó una leucoencefalopatía multifocal progresiva (LMP), fue retirado del estudio por presentar un ependimoma, que fue la única neoplasia desarrollada durante el estudio.
Con VDZ no ha habido notificación de tuberculosis extrapulmonares o sistémicas.
No se dispone de datos para establecer la seguridad en niños de 0 a 17 años. Además, no se han realizado estudios de interacciones. Se recomienda que se siga estudiando la seguridad a largo plazo.
Área económicaDebido a que el precio del VDZ aun no está fijado en España, el análisis económico se ha realizado con el precio de facturación tomado de la aplicación de medicamentos en situaciones especiales15.
Con estas salvedades, y de acuerdo al análisis coste-incremental, VDZ resulta la alternativa más costosa comparado con los anti-TNF: ADA e IFX.
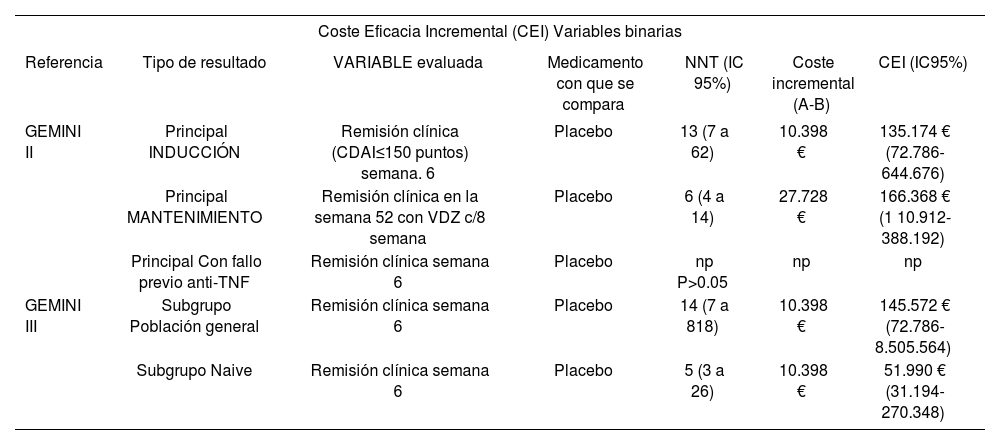
Según los datos del estudio GEMINI II y el coste incremental del tratamiento respecto a placebo (sin considerar los costes de Hospital de Día), por cada paciente adicional que alcance remisión clínica en semana 6 el coste adicional estimado es de 135.174 €. Del mismo estudio por cada paciente adicional que se mantenga en remisión clínica en semana 52 el coste adicional estimado es de 166.368 €.
Según los datos del estudio GEMINI III y el coste incremental del tratamiento respecto a placebo (sin considerar los costes de Hospital de Día), por cada paciente adicional del subgrupo “población global” (que incluía tanto pacientes sin tratamiento previo como pacientes pretratados tras fallo previo a anti-TNF) que alcancen remisión clínica en semana 6 el coste adicional estimado es de 145.572€. Del mismo estudio, por cada paciente del subgrupo “pacientes sin tratamiento previo” que alcance remisión clínica en semana 6 el coste adicional estimado es de 51.990€ (Tabla 3).
Coste eficacia incremental
| Coste Eficacia Incremental (CEI) Variables binarias | ||||||
|---|---|---|---|---|---|---|
| Referencia | Tipo de resultado | VARIABLE evaluada | Medicamento con que se compara | NNT (IC 95%) | Coste incremental (A-B) | CEI (IC95%) |
| GEMINI II | Principal INDUCCIÓN | Remisión clínica (CDAI≤150 puntos) semana. 6 | Placebo | 13 (7 a 62) | 10.398 € | 135.174 € (72.786-644.676) |
| Principal MANTENIMIENTO | Remisión clínica en la semana 52 con VDZ c/8 semana | Placebo | 6 (4 a 14) | 27.728 € | 166.368 € (1 10.912-388.192) | |
| Principal Con fallo previo anti-TNF | Remisión clínica semana 6 | Placebo | np P>0.05 | np | np | |
| GEMINI III | Subgrupo Población general | Remisión clínica semana 6 | Placebo | 14 (7 a 818) | 10.398 € | 145.572 € (72.786-8.505.564) |
| Subgrupo Naive | Remisión clínica semana 6 | Placebo | 5 (3 a 26) | 10.398 € | 51.990 € (31.194-270.348) | |
Se presenta el resultado de CEI base según el NNT y del coste incremental o diferencial respecto a placebo (que es con lo que se compara en GEMINI II y III) y sin tener en cuenta los costes de hospital de día. CEI: coste eficacia incremental.
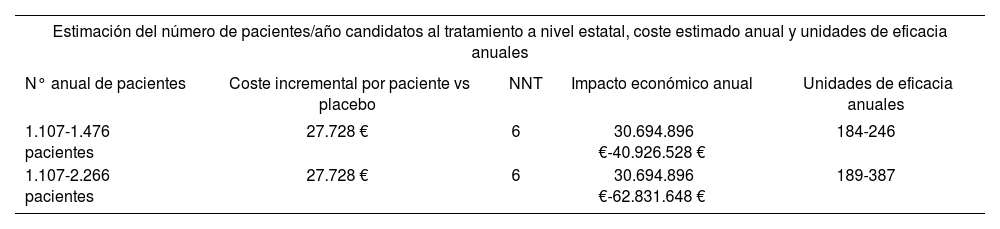
Respecto al impacto económico a nivel estatal, si consideramos a VDZ en segunda línea el impacto tras fracaso a un anti-TNF según los porcentajes de fracaso obtenidos de GEMINI II y III, el impacto sería de 30.694.896 €/ año-40.926.528 €/año para tratar 1.107-1.476 pacientes en el territorio nacional.
En tercera línea, el impacto económico tras fracaso a 2 anti-TNF, donde actualmente no tendríamos ninguna otra opción terapéutica, sería de 30.694.896 €/año62.831.648 €/año para tratar 1.107-2.266 pacientes en el territorio nacional (Tabla 4).
Estimación económica considerando a VDZ en 2a línea y 3a línea de tratamiento tras anti-TNF
| Estimación del número de pacientes/año candidatos al tratamiento a nivel estatal, coste estimado anual y unidades de eficacia anuales | ||||
|---|---|---|---|---|
| N° anual de pacientes | Coste incremental por paciente vs placebo | NNT | Impacto económico anual | Unidades de eficacia anuales |
| 1.107-1.476 pacientes | 27.728 € | 6 | 30.694.896 €-40.926.528 € | 184-246 |
| 1.107-2.266 pacientes | 27.728 € | 6 | 30.694.896 €-62.831.648 € | 189-387 |
El comparador empleado en ambos ensayos clínicos fue placebo. VDZ en ambos ensayos muestra superioridad frente a placebo. Sin embargo, en la actualidad existen dos fármacos anti-TNF aprobados en España y que se emplean en la práctica habitual para el tratamiento de la EC de moderada a grave tras fracaso a terapia convencional: IFX y ADA. Estos fármacos han demostrado ser efectivos para la EC, alcanzando los pacientes una rápida remisión. Sin embargo, ambos, dejan de ser igual de efectivos a lo largo del tiempo, y es necesario para controlar los brotes de la enfermedad, cambiar la pauta o el tipo de anti-TNF.
Tanto en GEMINI II como en GEMINI III, había pacientes que habían fracasado previamente a fármacos anti-TNF, 50% aproximadamente en GEMINI II y 75% aproximadamente en GEMINI III. Sin embargo llama la atención los diferentes porcentajes de fracaso a 1 ó 2 anti-TNF de ambos ensayos clínicos. La población con fallo a un anti-TNF fue del 21% y 22%-28% (GEMINI II y III respectivamente) y con fallo a dos anti-TNF fue de 21% y 39-43% (GEMINI II y III respectivamente)
En GEMINI II se observa que VDZ es eficaz en la inducción de la remisión clínica definida como CDAI≤ 150 puntos en la semana 6, pero no en la respuesta clínica mejorada (CDAI-100) en semana 6.
De aquellos pacientes que efectivamente obtuvieron respuesta en la semana 6 con VDZ las tasas de respuesta en cuanto a remisión clínica y remisión clínica en pacientes libres de corticoides son mejores en los pacientes que reciben VDZ c/8 semanas, mientras que en respuesta clínica mejorada los resultados son mejores en pacientes que reciben VDZ cada menos tiempo (c/4 semanas).
Respecto a los resultados de análisis exploratorios con corticoides en fase de inducción, observamos que tanto la remisión clínica como la respuesta clínica mejorada son mejores en aquellos pacientes que permanecieron en tratamiento combinado con corticoide que con VDZ solo hasta la semana 6.
En GEMINI III, no se alcanzó significación estadística en la variable principal, remisión clínica a la semana 6 en los pacientes con fallo previo a anti-TNF, sin embargo, sí se observaron diferencias estadísticamente significativas en esta misma variable en la población global a favor de VDZ.
La respuesta clínica mejorada en la semana 6 en pacientes con fallo previo a anti-TNF y en población global fue estadísticamente significativa en los pacientes tratados con VDZ y aumentó con el tiempo. Se deduce de estos resultados que el tiempo para lograr la remisión con VDZ pueda ser de 10 semanas, particularmente en pacientes con fallo previo a anti-TNF. En la población con fallo previo a anti-TNF, el % de pacientes en remisión clínica pasa de 15,2% (semana 6) a 26,6% (semana 10) en solo 4 semanas, mientras permanece constante en la rama de placebo (12,1%).
Esto último se observa también al analizar los resultados de remisión clínica a la semana 10. No hay apenas diferencias en las RAR entre la población con fallo previo a anti-TNF y la población global (14,5% vs. 15,7%) respectivamente. Este resultado podría sugerir la necesidad de una dosis de tratamiento adicional (es decir, semanas 0, 2 y 6) y un tiempo más largo (10 semanas) de seguimiento para observar un beneficio clínicamente relevante.
La remisión clínica en las semanas 6 y 10 no se alcanzó ni en la sub-población con fallo previo a anti-TNF ni tampoco en la población global, pero se obtuvieron mejores resultados en la población global en esta variable.
En el subgrupo de población sin tratamiento previo la remisión clínica en semana 6 fue de 31,4% vs 12% (VDZ vs placebo).
Respecto al uso concomitante de corticoides en el ensayo GEMINI III se observan mejores resultados con el uso de corticoides, al igual que en GEMINI II.
Las diferencias observadas en las tasas de remisión clínica a la semana 6 entre ambos estudios GEMINI II y III podrían ser debidas a las distintas poblaciones de partida como son la proporción de pacientes con exposición previa anti-TNF (1, 2 ó 3), en el GEMINI II (47,6%) y en GEMINI III (75,7%). Los valores de corte de CDAI de ambos ensayos, en GEMINI II (450) vs GEMINI III (400) así como la variación aleatoria entre el subgrupo de pacientes sin tratamiento previo que podría haber influido en las diferencias observadas en las tasas de remisión clínica a la semana 6 entre los pacientes no tratados con anti-TNF de ambos ensayos.
En conclusión los efectos de VDZ en inducción son modestos en general observando los resultados de ambos ensayos, mientras que los efectos en mantenimiento en GEMINI III no se pueden valorar debido a la corta duración del ensayo. En cambio, en GEMINI II, si se observan efectos en mantenimiento a la semana 52. En este ensayo entre los pacientes que responden en la fase de inducción, la remisión clínica ocurre en el 39%y el 36,4% de los que continúan con VDZ c/8 y c/4 semanas respectivamente vs 21,6% de los pacientes que están con placebo. Los efectos fueron similares entre remisión clínica a la semana 52, y la remisión clínica de los pacientes libres de corticoides.
Conclusión-Posicionamiento terapéutico y condiciones de uso.A la vista de los resultados de eficacia y seguridad, el posicionamiento propuesto es de considerarlo Categoría D-1. Se incluye en la Guía Farmacoterapéutica con recomendaciones específicas: Como una alternativa eficaz, en segunda o tercera línea de tratamiento de la enfermedad de Crohn de moderada a grave.