linezolid es una oxazolidina frecuentemente implicada en el desarrollo de toxicidad hematológica, siendo el aclaramiento renal el mecanismo mayoritario en su eliminación. Se evaluó la influencia de la hiperfiltración glomerular en la toxicidad hematológica inducida por linezolid en pacientes con aclaramiento incrementado frente a pacientes con función renal normal.
Material y métodosse diseñó un estudio observacional y retrospectivo en pacientes hospitalizados, tratados al menos 5 días con linezolid entre 2014 y 2019. Se compararon pacientes con aclaramiento de creatinina incrementado (≥130 mL/min) y normal (60–90 mL/min). Se definió la toxicidad hematológica como el descenso en plaquetas y hemoglobina del 25% y en neutrófilos del 50% frente a los valores basales. Se clasificó el grado de toxicidad según Common Terminology Criteria for Adverse Events v5 y se comparó la incidencia entre ambos grupos mediante Chi-cuadrado y Fisher. Así mismo, se calculó el porcentaje de disminución de los 3 parámetros y su asociación mediante el test de Mann–Whitney y se registraron las interrupciones y transfusiones asociadas.
Resultadosse evaluaron 30 pacientes hiperfiltradores y 38 normofiltradores. El 16,66% de hiperfiltradores presentó toxicidad hematológica frente al 44,74% (p = 0,014). La trombocitopenia fue del 13,33 vs. 36,84% (p = 0,051), la anemia del 3,3 vs. 10,52% (p = 0,374) y la neutropenia del 10 vs. 23,68% (p = 0,204). La mediana del porcentaje de descenso plaquetario en hiperfiltradores frente a normofiltradores fue del −10,36 (−193,33–62,03) vs. 2,68 (−163,16–82,71) (p = 0,333), de hemoglobina 2,50 (−12,12–25,93) vs. 9,09 (−17,72–30,63) (p = 0,047) y de neutrófilos 9,14 (−73,91–76,47) vs. 27,33 (−86,66–90,90) (p = 0,093). El 10,5% con filtrado normal presentó toxicidad grado 3 o superior, el 2,6% interrumpió el tratamiento y el 5,2% requirieron transfusiones. Ningún paciente hiperfiltrador presentó toxicidad clínicamente significativa ni interrupciones/transfusiones asociadas a ella.
Conclusiónnuestro estudio sugiere una menor incidencia y relevancia clínica de toxicidad hematológica en pacientes con aclaramiento incrementado. La trombocitopenia es la condición más frecuente en ambos. Esto probablemente esté relacionado con la menor exposición al fármaco condicionada por la mayor eliminación plasmática y presumiblemente menor efectividad antimicrobiana. Los resultados corroboran el potencial beneficio de la monitorización farmacocinética en poblaciones de riesgo.
Linezolid is an oxazolidin commonly related to the development of hematological toxicity, being renal clearance the major factor involved in the drug clearance. The aim of this study is to evaluate the influence of increased filtration rates in the incidence of linezolid-induced hematological toxicity by comparing augmented renal clearance (ARC) patients versus normal renal function patients.
Material and methodsA retrospective, observational study was conducted on hospitalized patients treated with linezolid for 5 days or more during 2014–2019 period. Patients with a filtration rate of ≥130 mL/min versus reference patients (60–90 mL/min) were compared. Hematological toxicity was defined as a decrease of 25% in platelets, of 25% in hemoglobin and/or 50% in neutrophils from baseline. Toxicity relevance was classified according to Common Terminology Criteria for Adverse Events v5. Incidence of hematological toxicity between groups was studied by chi-square and Fisher test. Furthermore, percentaje disminution of all three parameters was calculated and compared by Mann–Whitney test and treatment interruption and tranfusion requirements were registered.
Results30 ARC patients and 38 reference patients were included. Hematological toxicity was observed in 16.66% of ARC patients vs 44.74% of reference patients (p = 0.014); thrombocytopenia in 13.33% vs 36.84% (p = 0.051), anemia in 3.3% vs 10.52% (p = 0.374) and neutropenia in 10% vs 23.68% (p = 0.204). Median percentaje of platelets decrease in ARC patients was −10.36 (−193.33–62.03) vs 2.68 (−163.16–82.71) in reference patients (p = 0.333), while hemoglobin decrease was 2.50 (−12.12–25.93) vs 9.09 (−17.72–30.63) (p = 0.047) and neutrophils decrease was 9.14 (−73.91–76.47) vs 27.33 (−86.66–90.90) (p = 0.093). 10.5% of normal renal function patients reported at least one adverse event grade 3 or superior while 2.6% of them interrupted treatment and 5.2% had tranfusion requirements. No major events or interruptions were reported in ARC patients.
ConclusionOur findings suggest a lower incidence and clinical relevance of hematological toxicity in augmented renal clearance patients. Thrombocytopenia was the major event in both populations. This might be related to a lower exposure to the drug due to the higher clearance and likely lower therapeutic efficiency. These results suggest a potential benefit of therapeutic drug monitoring on high risk patients.
Linezolid es un antimicrobiano perteneciente al grupo de las oxazolidinas1 con actividad frente a un amplio espectro de bacterias grampositivas2. Es actualmente empleado en el ámbito hospitalario como tratamiento empírico de elección en infección de piel y partes blandas3 y en neumonía nosocomial y asociada a ventilación mecánica4, por su buena cobertura de microorganismos multiresistentes, a destacar Staphylococcus aureus meticilin-resistente y Enterococcus faecium resistente a vancomicina, patógenos frecuentemente implicados en infecciones nosocomiales4.
En relación con su perfil de seguridad, cabe destacar la toxicidad hematológica como efecto adverso más frecuente2, siendo la trombocitopenia la reacción más descrita en la literatura con una prevalencia comprendida entre el 15 y el 50%5.
Aproximadamente de 30 a 40% de linezolid se elimina inalterado en orina, por lo que la función renal supone un factor considerable de la variabilidad interpaciente en relación con el aclaramiento del fármaco pese a que la dosificación está estandarizada. La bibliografía actual relaciona la disminución de la función renal (<60 mL/min/1,73m26) con una mayor incidencia de toxicidad principalmente hematológica7, como consecuencia de una mayor exposición.
Por su parte, la hiperfiltración glomerular es un fenómeno que se caracteriza por un incremento del aclaramiento de creatinina (ACr) en pacientes con factores de riesgo8. Esta situación se ha descrito tradicionalmente en pacientes críticos y se define comúnmente como un incremento del aclaramiento de creatinina superior a 130 mL /min/1,73m28, pudiendo conllevar una eliminación más rápida de los fármacos y por tanto, una menor exposición9. Además, se ha descrito que ciertas situaciones fisiológicas (sexo masculino, edad) o patológicas (trauma, cirugía, malignidad hematológica…) pueden predisponer a ella8. El objetivo del presente estudio es evaluar si esta condición clínica se asocia a una menor incidencia de toxicidad hematológica inducida por linezolid, así como cuantificar los descensos de los 3 parámetros hematológicos (plaquetas, hemoglobina y neutrófilos) e identificar otras causas potencialmente asociadas a ella.
Material y métodosSe diseñó un estudio observacional, retrospectivo y unicéntrico en el que se incluyeron pacientes mayores de 18 años, ingresados en plantas de hospitalización convencional e inicio de tratamiento con linezolid, y con seguimiento hasta su finalización tanto a nivel hospitalario como ambulatorio.
Se incluyeron en el estudio 2 tipos de pacientes en base a su tasa de filtración glomerular (FG) calculada por la fórmula de Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI)8, según las determinaciones analíticas realizadas durante el ingreso: hiperfiltradores (HF), con FG > 130 mL/min/1,73 m2 (120mL/min en mujeres10) y normofiltradores (NF) con FG comprendidas entre 60 y 90 mL/min/1,73m211. Además, se estudiaron exclusivamente terapias con duración de 5 días o superior en aquellos pacientes con analítica de control registrada tanto al inicio como al finalizar linezolid, permitiéndose una diferencia de ±2 días en ambas analíticas.
Los pacientes con FG inferior a 60 mL/min/1,73 m2, sin determinaciones analíticas, ingresados en unidad de Medicina Intensiva o con hemoglobina y plaquetas basales inferiores a 10 mg/dl y 100 × 103/mm3, respectivamente, fueron excluidos.
Como variables demográficas se recogieron sexo, edad, peso, talla, superficie corporal e índice de masa corporal (IMC). Para determinar la función renal, se recogieron los valores de FG, creatinina y urea. En relación con la infección, se recogió la localización de la misma y los valores de proteína C reactiva, ferritina y procalcitonina. En cuanto a variables farmacológicas se recogieron la posología, duración, vía de administración e interrupciones en el mismo ocasionadas por la toxicidad.
Con el fin de identificar potenciales etiologías desencadenantes de toxicidad hematológica5 en la población se registraron: enfermedades crónicas, tratamiento inmunosupresor concomitante, quimioterapia (QT) en los últimos 6 meses y número de fármacos con potencial inducción de toxicidad plaquetaria12–14.
Se registraron los valores hematológicos (plaquetas, hemoglobina y neutrófilos) tanto al inicio como al final del tratamiento con linezolid y se calculó el porcentaje de descenso, considerándose «toxicidad hematológica» el descenso de al menos uno de los 3 parámetros respecto al valor basal: 25% de las plaquetas (PQ), 25% de la hemoglobina (HB) y 50% de los neutrófilos (NT)5. El grado de toxicidad se caracterizó según la versión 5.0 de la Common Terminology Criteria for Adverse Events (CT-CAE)15. Así mismo, se registró la necesidad de transfusiones asociadas a ella.
Se empleó el programa de prescripción electrónica y un cuaderno de recogida de datos pseudoanonimizado. Se calculó mediante el software estadístico Minitab® versión 21.1.0. Se incluyó la mediana como medida de tendencia central en las variables cuantitativas y las frecuencias absolutas y relativas para las variables cualitativas. Se estudió su ajuste a la distribución normal, a partir del test de Kolmogorov–Smirnov. El estudio de asociación de las variables cuantitativas se realizó mediante t-Student y el de las cualitativas, mediante Chi-cuadrado y Fisher, para muestras pequeñas. Se calculó el porcentaje de disminución de los 3 parámetros hematológicos (plaquetas, hemoglobina y neutrófilos) y se estudió su asociación mediante Mann–Whitney. Así mismo, se estudió la correlación entre este porcentaje de disminución y el valor de FG y duración de antibioterapia, mediante regresión de Spearman. Por último, se analizó la posible asociación de otros factores desencadentes de toxicidad hematológica descritos en literatura con el fin de determinar otra etiología además de la función renal. En todos los análisis se consideró un nivel de significación de p < 0,05.
El presente estudio ha sido autorizado por el Comité Ético de Investigación Clínica del hospital.
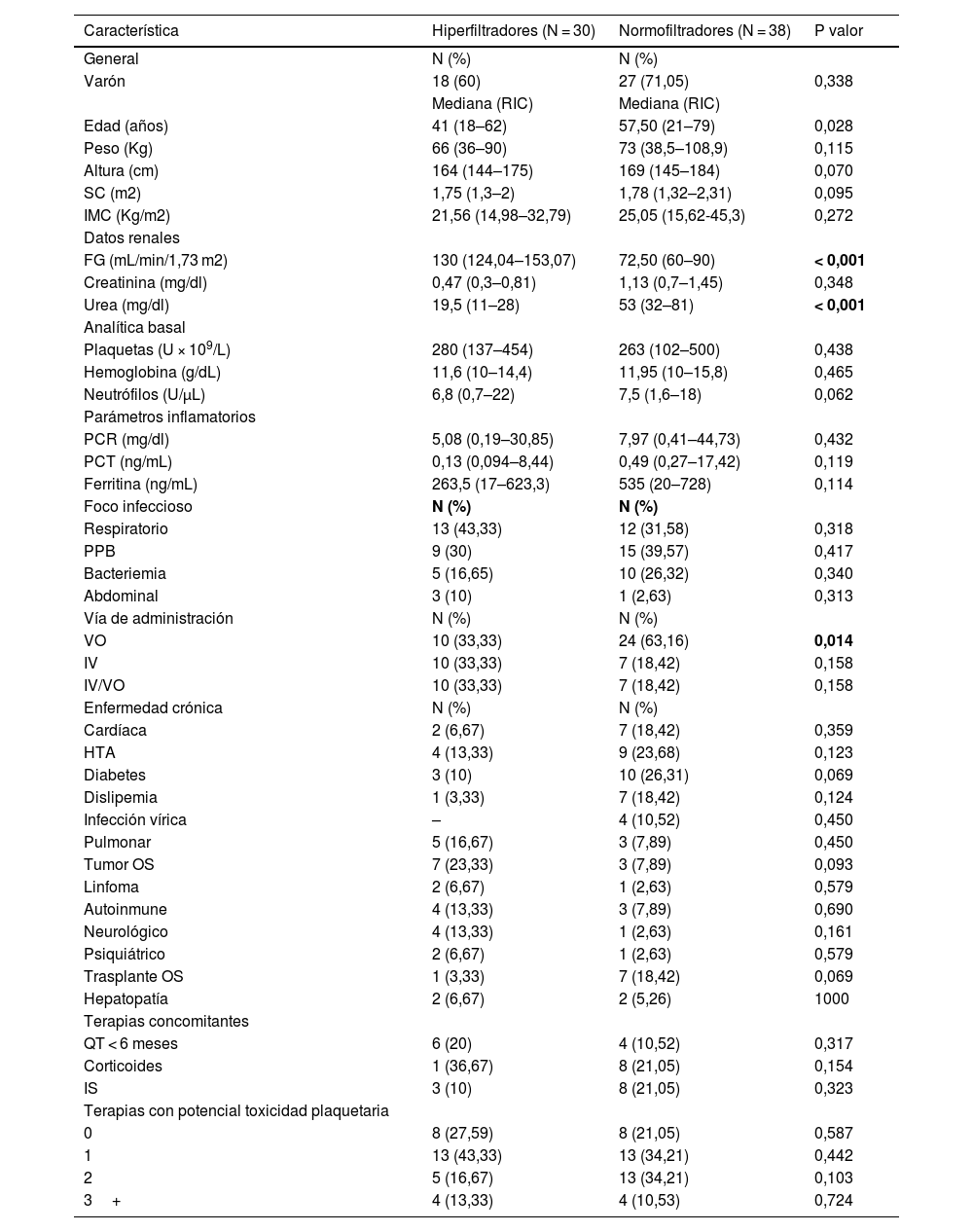
ResultadosSe incluyó un total de 68 pacientes (30 hiperfiltradores y 38 normofiltradores) tratados en el período comprendido entre enero 2014 y diciembre 2019. La mediana de duración del tratamiento con linezolid fue de 8 (5–28) días en los pacientes HF y de 8 (5–25) días en aquellos NF. En la tabla se reflejan los parámetros analíticos basales, el foco infeccioso y vía de administración de linezolid de todos los pacientes (ver tabla 1) Todos recibieron linezolid 600 mg cada 12 horas.
Características de la población de estudio y terapias recibidas previa o concomitantemente potencialmente implicadas en el desarrollo de toxicidad hematológicaa, b and c
| Característica | Hiperfiltradores (N = 30) | Normofiltradores (N = 38) | P valor |
|---|---|---|---|
| General | N (%) | N (%) | |
| Varón | 18 (60) | 27 (71,05) | 0,338 |
| Mediana (RIC) | Mediana (RIC) | ||
| Edad (años) | 41 (18–62) | 57,50 (21–79) | 0,028 |
| Peso (Kg) | 66 (36–90) | 73 (38,5–108,9) | 0,115 |
| Altura (cm) | 164 (144–175) | 169 (145–184) | 0,070 |
| SC (m2) | 1,75 (1,3–2) | 1,78 (1,32–2,31) | 0,095 |
| IMC (Kg/m2) | 21,56 (14,98–32,79) | 25,05 (15,62-45,3) | 0,272 |
| Datos renales | |||
| FG (mL/min/1,73 m2) | 130 (124,04–153,07) | 72,50 (60–90) | < 0,001 |
| Creatinina (mg/dl) | 0,47 (0,3–0,81) | 1,13 (0,7–1,45) | 0,348 |
| Urea (mg/dl) | 19,5 (11–28) | 53 (32–81) | < 0,001 |
| Analítica basal | |||
| Plaquetas (U × 109/L) | 280 (137–454) | 263 (102–500) | 0,438 |
| Hemoglobina (g/dL) | 11,6 (10–14,4) | 11,95 (10–15,8) | 0,465 |
| Neutrófilos (U/μL) | 6,8 (0,7–22) | 7,5 (1,6–18) | 0,062 |
| Parámetros inflamatorios | |||
| PCR (mg/dl) | 5,08 (0,19–30,85) | 7,97 (0,41–44,73) | 0,432 |
| PCT (ng/mL) | 0,13 (0,094–8,44) | 0,49 (0,27–17,42) | 0,119 |
| Ferritina (ng/mL) | 263,5 (17–623,3) | 535 (20–728) | 0,114 |
| Foco infeccioso | N (%) | N (%) | |
| Respiratorio | 13 (43,33) | 12 (31,58) | 0,318 |
| PPB | 9 (30) | 15 (39,57) | 0,417 |
| Bacteriemia | 5 (16,65) | 10 (26,32) | 0,340 |
| Abdominal | 3 (10) | 1 (2,63) | 0,313 |
| Vía de administración | N (%) | N (%) | |
| VO | 10 (33,33) | 24 (63,16) | 0,014 |
| IV | 10 (33,33) | 7 (18,42) | 0,158 |
| IV/VO | 10 (33,33) | 7 (18,42) | 0,158 |
| Enfermedad crónica | N (%) | N (%) | |
| Cardíaca | 2 (6,67) | 7 (18,42) | 0,359 |
| HTA | 4 (13,33) | 9 (23,68) | 0,123 |
| Diabetes | 3 (10) | 10 (26,31) | 0,069 |
| Dislipemia | 1 (3,33) | 7 (18,42) | 0,124 |
| Infección vírica | – | 4 (10,52) | 0,450 |
| Pulmonar | 5 (16,67) | 3 (7,89) | 0,450 |
| Tumor OS | 7 (23,33) | 3 (7,89) | 0,093 |
| Linfoma | 2 (6,67) | 1 (2,63) | 0,579 |
| Autoinmune | 4 (13,33) | 3 (7,89) | 0,690 |
| Neurológico | 4 (13,33) | 1 (2,63) | 0,161 |
| Psiquiátrico | 2 (6,67) | 1 (2,63) | 0,579 |
| Trasplante OS | 1 (3,33) | 7 (18,42) | 0,069 |
| Hepatopatía | 2 (6,67) | 2 (5,26) | 1000 |
| Terapias concomitantes | |||
| QT < 6 meses | 6 (20) | 4 (10,52) | 0,317 |
| Corticoides | 1 (36,67) | 8 (21,05) | 0,154 |
| IS | 3 (10) | 8 (21,05) | 0,323 |
| Terapias con potencial toxicidad plaquetaria | |||
| 0 | 8 (27,59) | 8 (21,05) | 0,587 |
| 1 | 13 (43,33) | 13 (34,21) | 0,442 |
| 2 | 5 (16,67) | 13 (34,21) | 0,103 |
| 3+ | 4 (13,33) | 4 (10,53) | 0,724 |
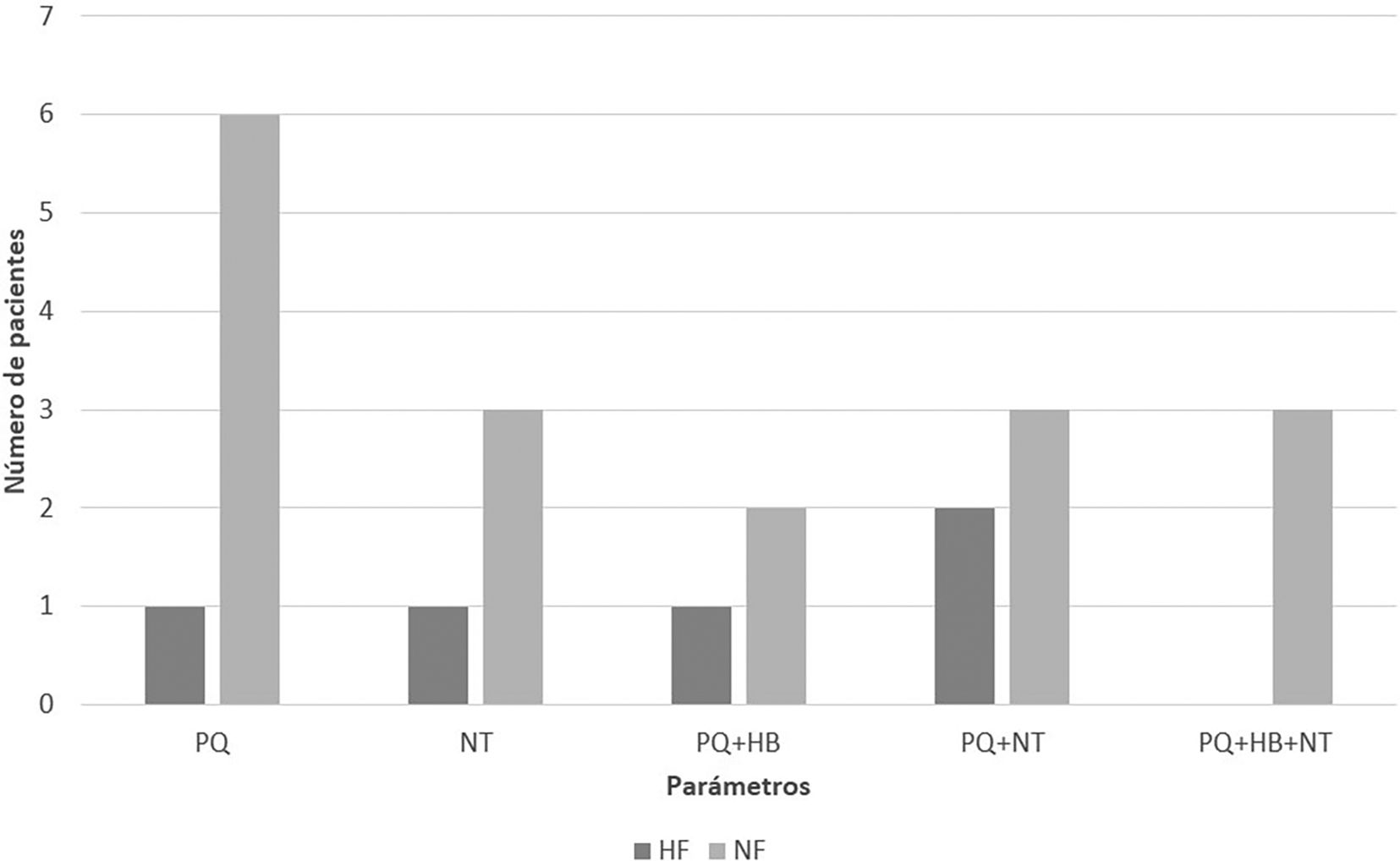
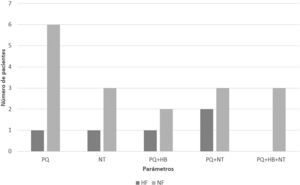
El 16,66% de HF presentó toxicidad hematológica frente al 44,74% de NF (p = 0,014). La toxicidad plaquetaria fue del 13,33 vs. 36,84% (p = 0,051). El 3,3% de HF presentó anemia vs. 10,52% de NF (p = 0,374). Por su parte, la incidencia de neutropenia fue del 10% frente al 23,68% (p = 0,204). En la gráfica se refleja la distribución según el tipo de toxicidad experimentada por cada paciente (ver figura 1).
En relación con el grado de toxicidad en HF, ningún paciente experimentó toxicidad grado 3 o superior frente al 10,5% de pacientes NF. En cuanto a la gravedad de la misma en este último grupo, un paciente presentó anemia grado 3, 2 pacientes neutropenia grado 3 y un paciente neutropenia grado 4. En relación con la repercusión clínica en este último grupo, un paciente interrumpió tratamiento con linezolid y 2 pacientes requirieron transfusiones como consecuencia de la toxicidad. No se notificaron en la historia clínica otros eventos adversos clínicamente relevantes característicos de linezolid16 en ninguno de los 68 pacientes estudiados.
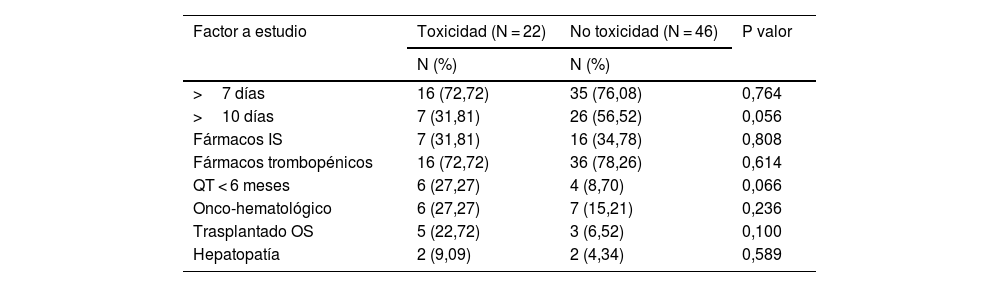
En la tabla 1 se especifican las enfermedades crónicas de toda la población, así como terapias previas (QT) y fármacos concomitantes con potencial actividad inductora de toxicidad hematológica según literatura. En la tabla 2 se estudia la asociación de los factores que presumiblemente predisponen a toxicidad hematológica17 con la incidencia de toxicidad.
Estudio de asociación de los pacientes con factores predisponentes a toxicidad que experimentan toxicidad hematológica frente a los que no la tuvierona, b
| Factor a estudio | Toxicidad (N = 22) | No toxicidad (N = 46) | P valor |
|---|---|---|---|
| N (%) | N (%) | ||
| >7 días | 16 (72,72) | 35 (76,08) | 0,764 |
| >10 días | 7 (31,81) | 26 (56,52) | 0,056 |
| Fármacos IS | 7 (31,81) | 16 (34,78) | 0,808 |
| Fármacos trombopénicos | 16 (72,72) | 36 (78,26) | 0,614 |
| QT < 6 meses | 6 (27,27) | 4 (8,70) | 0,066 |
| Onco-hematológico | 6 (27,27) | 7 (15,21) | 0,236 |
| Trasplantado OS | 5 (22,72) | 3 (6,52) | 0,100 |
| Hepatopatía | 2 (9,09) | 2 (4,34) | 0,589 |
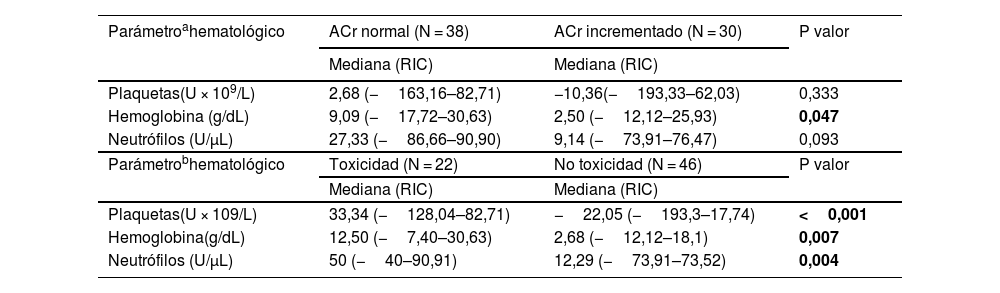
En la tabla 3 se comparan las medianas de los porcentajes de descenso al inicio y final del tratamiento de los 3 parámetros evaluados (PQ, HB y NT) según 2 situaciones clínicas: en la primera según la función renal (HF vs. NF) mientras que en la segunda se comparan las 2 poblaciones de pacientes que experimentaron toxicidad en al menos uno de los 3 parámetros frente a los que no padecieron en ninguno, independientemente de su ACr.
Porcentaje de descenso al finalizar tratamiento con linezolid respecto de los valores al inicio de los 3 parámetros hematológicas estudiados (plaquetas, hemoglobina, neutrófilos)a, b, c
| Parámetroahematológico | ACr normal (N = 38) | ACr incrementado (N = 30) | P valor |
|---|---|---|---|
| Mediana (RIC) | Mediana (RIC) | ||
| Plaquetas(U × 109/L) | 2,68 (−163,16–82,71) | −10,36(−193,33–62,03) | 0,333 |
| Hemoglobina (g/dL) | 9,09 (−17,72–30,63) | 2,50 (−12,12–25,93) | 0,047 |
| Neutrófilos (U/μL) | 27,33 (−86,66–90,90) | 9,14 (−73,91–76,47) | 0,093 |
| Parámetrobhematológico | Toxicidad (N = 22) | No toxicidad (N = 46) | P valor |
| Mediana (RIC) | Mediana (RIC) | ||
| Plaquetas(U × 109/L) | 33,34 (−128,04–82,71) | −22,05 (−193,3–17,74) | <0,001 |
| Hemoglobina(g/dL) | 12,50 (−7,40–30,63) | 2,68 (−12,12–18,1) | 0,007 |
| Neutrófilos (U/μL) | 50 (−40–90,91) | 12,29 (−73,91–73,52) | 0,004 |
Finalmente, el estudio de correlación entre el FG y el porcentaje de descenso de los parámetros hematológicos según el coeficiente de correlación de Spearman realizado en los 68 pacientes fue: PQ (R =−0,087 p = 0,493), HB (R = −0,286 p = 0,03), NT (R = −0,087 p = 0,514). Por su parte, se estudió la correlación con la duración total del tratamiento de toda la población obteniéndose lo siguiente: PQ (R = −0,046 p = 0,714), HB (R = 0,069 p = 0,606), NT (R = 0,136 p = 0,221).
DiscusiónLa literatura describe la etiología exacta de la hiperfiltración como desconocida y la correlaciona frecuentemente con el paciente crítico10. Sime et al. la relacionaron por otro lado con el empleo de medicamentos vasoactivos y fluidoterapia18. Así mismo, Balk postuló la teoría del síndrome de respuesta inflamatoria sistémica (SIRS), en el que los pacientes con una situación clínica proinflamatoria tal como neoplasia, sepsis, trauma y cirugía mayor reciente, entre otras, con potencial liberación de citoquinas, presentan disminución de la resistencia vascular e incremento del gasto cardíaco19, siendo ambos factores implicados en el incremento de filtrado glomerular8. Bilbao-Meseguer et al. señalaron el sexo masculino y la edad como factores predisponentes10, con medianas de edad en torno a 40 años en los pacientes descritos en los estudios frente a edades superiores a 50 años en poblaciones con ACr inferior, característica apreciable en nuestra población10 (tabla 1). Los pacientes ingresados en Medicina Intensiva fueron así mismo excluidos de nuestro estudio por su elevada complejidad y politerapia habitual con lo que se estudiaron exclusivamente pacientes en plantas de hospitalización.
En relación con la toxicidad hematológica inducida por linezolid en población general, González del Castillo et al. asocian una mayor incidencia de trombocitopenia con una duración prolongada de tratamiento, hepatopatías, fallo renal, cáncer, bajo IMC y recuento basal plaquetario bajo5. Hanai et al. identificaron así mismo 3 factores de riesgo en la incidencia de trombocitopenia: ACr, hemodiálisis y duración de tratamiento; y uno en la incidencia de anemia: duración17. De los factores mencionados, en nuestro estudio se excluyó tanto a pacientes con ACr disminuido como con trombocitopenia <100 × 103/mm3 al inicio. No se halló significación estadística para ninguno de los factores implicados comúnmente descritos en la literatura5, ni en terapias concomitantes potencialmente desencadenantes de toxicidad (fármacos con potencial trombopénico12–14, IS, QT) al comparar la incidencia de toxicidad en toda la población (tabla 2), lo que probablemente esté relacionado con el relativamente pequeño tamaño de muestra de nuestro estudio.
Por otro lado, la correlación de los porcentajes de descenso con el aclaramiento y duración de la antibioterapia calculada mediante Spearman, no nos permite establecer una relación lineal concluyente para ninguna de las comparaciones. Únicamente se obtuvo significación entre el descenso de HB y el ACr, con relación negativa, lo que podría demostrar que a medida que se incrementa el ACr, el descenso de HB como consecuencia del tratamiento con linezolid será menor. Sin embargo, esta asociación parece considerablemente baja en nuestra población.
No se ha localizado en literatura ningún estudio de seguridad realizado exclusivamente en poblaciones de pacientes sin deterioro renal, por lo que no se dispone de referencias a la hora de estimar la prevalencia esperada. En nuestra población únicamente la incidencia de toxicidad hematológica global resultó significativa, mientras que la toxicidad individualmente en el resto de parámetros (PQ, HB, NT) no lo fue. Pese a esto, en la figura 1 se aprecia que la serie plaquetaria es la más afectada en ACr normal. Es más, la incidencia de toxicidad plaquetaria obtenida en este subgrupo concuerda con aquella descrita en otros estudios de toxicidad realizados en población general20, mientras que la observada en nuestra población de HF es considerablemente inferior, situación igualmente observada en el descenso de la hemoglobina. Por ello, la ausencia de significación de nuestro estudio al evaluar PQ, HB y NT individualmente, probablemente guarde relación con el pequeño tamaño de muestra por la baja prevalencia de ACr incrementado en pacientes hospitalizados y los restrictivos criterios de inclusión de nuestro estudio.
La evidencia poscomercialización de linezolid ha descrito una elevada prevalencia de trombocitopenia en los primeros días de terapia frente a la tardía aparición de anemia21, hasta 10–14 días posteriores al inicio, por la lenta instauración de mielosupresión en la mayoría de pacientes6, no recomendándose regímenes superiores a 14 días de tratamiento6. Dicha situación clínica se manifiesta en la figura 1, ya que ningún paciente del estudio experimenta anemia aisladamente. Debido a esto, Crass et al. proponen una reducción de dosis estandarizada y monitorización farmacocinética en pacientes con ACr disminuido y duración prevista de antibioterapia superior a 14 días6.
En nuestro estudio el grado de toxicidad presenta mayor relevancia clínica en pacientes NF (anemia y neutropenia) al igual que sus implicaciones: la interrupción y necesidad de trasfusiones, situaciones no presentes en HF. Por su parte, la tabla 3 muestra los porcentajes de descenso en ambas poblaciones, con diferencias únicamente significativas en el descenso de HB. Destacar que en los 3 parámetros los descensos son aparentemente menores en HF. En la segunda comparativa, independientemente de la función renal, se manifiesta un porcentaje de descenso significativo (tabla 3) en los 3 parámetros, al comparar pacientes con afectación de al menos uno (PQ, HB, NT), frente a los que no experimentan ninguno, lo que podría explicarse por el efecto mielosupresivo generalizado de linezolid6.
Una limitación en este tipo de estudio supone la técnica preferente para determinar el FG. Actualmente los niveles de inulina se consideran el gold standard8, sin embargo, esto supone un elevado coste-beneficio7. El aclaramiento de creatinina podría obtenerse mediante su medición en orina de 24h22, técnica no realizada de forma rutinaria en la mayoría de los pacientes de nuestro centro frente a la determinación de los niveles sericos de creatinina (CKD-EPI, MDRD-4), cuyas fórmulas tienden a infraestimar el aclaramiento en pacientes hiperfiltradores10, por lo que cabría suponer un FG superior al descrito en nuestra población (tabla 1).
La bibliografía localizada en ACr incrementado hace referencia principalmente al estudio farmacocinético en pacientes críticos con linezolid en términos de efectividad; Barrasa et al. demostraron la influencia del ACr aumentado en los niveles subterapéuticos de linezolid, no observándose esto en pacientes con ACr normal o inferior9. Wang et al. confirmaron que la dosificación estándar (1200 mg/día) fue insuficiente en parte de su población estudiada23. La menor exposición al fármaco descrita en estos pacientes explicaría la menor incidencia y relevancia de toxicidad hematológica observada en nuestra población. Luque et al. desarrollaron por su parte un algoritmo farmacocinético de dosificación con el fin de garantizar la seguridad y efectividad24.
Actualmente se emplea la dosificación estándar de linezolid (600 mg/12 h) tanto oral como intravenosa independientemente del FG y de la variabilidad interindividual6, por lo que, probablemente los pacientes se beneficiarían de una adecuación posológica individualizada en base a su situación clínica, además de la monitorización de las concentraciones plasmáticas de linezolid en poblaciones de riesgo.
Nuestro estudio sugiere, por tanto, una posible relación en la menor incidencia de toxicidad hematológica en pacientes con ACr incrementado frente a pacientes con ACr normal. Además de esta menor prevalencia, la relevancia clínica y repercusiones derivadas de esta toxicidad también parece ser inferior. La menor incidencia de toxicidad inducida por linezolid en pacientes con ACr incrementado podría estar relacionada con la menor exposición al fármaco de estos pacientes, condicionada por la elevada tasa de eliminación renal. Debido a esta posibilidad, sería recomendable estudiar paralelamente la eficacia antimicrobiana del linezolid en esta población.
La obtención de niveles plasmáticos subterapéuticos, tal como se describe en la literatura, podría derivar en una terapia inadecuada con el consiguiente riesgo de fracaso terapéutico. Por todo ello, consideramos que la individualización posológica y la monitorización farmacocinética se posicionan como medidas probablemente beneficiosas en pacientes con ACr incrementado.
Responsabilidades éticasEl presente estudio se encuentra autorizado por el Comité de Ética de la Investigación con medicamentos (CEIm).
Todos los autores aceptamos la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (disponible en http://www.icmje.org/).
Los autores cedemos, en el supuesto de publicación, de forma exclusiva los derechos de reproducción, distribución, traducción y comunicación pública (por cualquier medio o soporte sonoro, audiovisual o electrónico) de nuestro trabajo a Farmacia Hospitalaria y por extensión a la SEFH. Para ello se firmará una carta de cesión de derechos en el momento del envío del trabajo a través del sistema online de gestión de manuscritos.
FinanciaciónNada que declarar.
Conflicto de interesesSin conflicto de interés.
Presentación en CongresosEuropean Association of Hospital Pharmacist (EAHP), Viena, Marzo 2022.
Aportación a la literatura científicaLos resultados de nuestro estudio completan, en términos de seguridad clínica, la evidencia de las limitadas publicaciones en pacientes hiperfiltradores que asocian esta situación clínica a una menor exposición a linezolid, dada la obtención de niveles plasmáticos infraterapéuticos en las determinaciones analíticas. Se ha descrito así mismo en ellos una respuesta antimicrobiana inferior asociada. El presente estudio sugiere además una menor incidencia y relevancia de toxicidad hematológica en la práctica clínica habitual, realizando la primera comparación descrita en literatura con una población de referencia sin alteración renal.