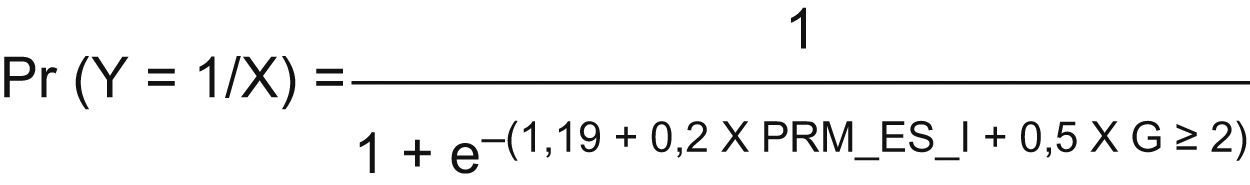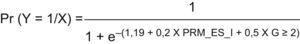Identificar y cuantificar la influencia de diferentes variables en la implantación de medidas de optimización farmacoterapéutica en pacientes ingresados.
MétodoEstudio descriptivo, transversal. Período: 2000–2007. Ámbito: hospital general universitario público (25.000 pacientes ingresados/año).
El Programa de Mejora de la Calidad de la Farmacoterapia y la Seguridad del Paciente implantado da cobertura al 30% de los pacientes. A partir de los registros del aplicativo Atefarm® Farmis, se analizaron las recomendaciones farmacoterapéuticas (RF) realizadas por los farmacéuticos al médico. Las variables seleccionadas fueron las siguientes: riesgo del medicamento (problema relacionado con el medicamento [PRM]) (0, bajo; 1, alto), categoría del PRM, (0, indicación; 1, efectividad; 2, seguridad), gravedad potencial (escala 1–5), impacto de la RF (0, efectividad; 1, seguridad; 2, eficiencia) e implantación de la RF (sí/no).
Se calculó la frecuencia (%) y el intervalo de confianza del 95% (IC95%) de las variables categóricas y se realizó un análisis de regresión logística multivariante para identificar el grado de influencia de las variables en la implantación de las RF.
ResultadosSe identificaron 7.920 PRM en 4.680 pacientes. En el 85% (6.762) de los PRM se realizó una RF, que se implantó en el 83% (IC95%: 74,2–89,8). La gravedad potencial del PRM superior o igual a 2 (OR: 1,57; IC95%: 1,27–1,94) y la categoría del PRM de efectividad y seguridad (OR: 1,19; IC95%: 1,02–1,39) se manifestaron como determinantes de la implantación de la RF en el paciente.
ConclusionesLa probabilidad de implantación de RF en el paciente está relacionada con la gravedad potencial y la categoría del PRM identificado. Así, las recomendaciones orientadas a mejorar la efectividad de la farmacoterapia o la seguridad del paciente, y con consecuencias clínicas potenciales presentan mayor éxito en su aplicación al paciente.
To identify and quantify the influence of different variables on the implementation of pharmacotherapy optimisation measures in hospitalised patients.
MethodDescriptive transversal study. Period: 2000–2007. Environment: public university general hospital (25,000 patients admitted/year).
The Programme implemented to improve pharmacotherapy quality and patient safety covers 30% of all patients. Using records from the Atefarm® Farmis application, we analysed pharmacotherapy recommendations (PRs) made by pharmacists to doctors. The selected variables were the following: Risk of the medication for ADE (1-high, 0-low), ADE category, (0-indication, 1-effectiveness, 2-safety), potential severity (scale of 1 to 5), impact of the PR (0-effectiveness, 1-safety, 2-efficiency) and implementation of the PR (yes/no).
We calculated the frequency (%) and 95% CI for the categorical variables and performed a multivariate logistical regression analysis to identify the variables’ degree of influence on implementing the PRs.
ResultsWe identified 7920 ADEs in 4680 patients. A PR was issued in 85% of the cases (6762), and it was implemented in 83% (95% CI 74.2–89.8). Potential severity of the ADE ≥2 (OR 1.57; 95% CI 1.27–1.94), and ADE category for effectiveness and safety (OR 1.19; 95% CI 1.02–1.39) were shown to be determining factors for implementing the PR for the patient.
ConclusionsThe probability that a PR will be implemented for a patient is related to the potential severity and the category of the identified ADE. Therefore, recommendations intended to improve effectiveness of pharmacotherapy or patient safety, and those with potential clinical consequences have a greater chance of being applied to a patient.
La asistencia al paciente es un proceso complejo e interdisciplinario orientado a resolver sus problemas de salud y mejorar su calidad de vida. Sin embargo, este proceso no está exento de riesgos, como se ha puesto de manifiesto en diversos estudios realizados en diferentes entornos asistenciales, que cuantifican la incidencia y las consecuencias de los acontecimientos adversos relacionados con la asistencia sanitaria1–3. La mayor parte de estos acontecimientos adversos están relacionados con la medicación, y con frecuencia interfieren en la consecución de resultados óptimos de la atención sanitaria al paciente, con importantes consecuencias clínicas, sociales y económicas.
Por estos motivos, la implantación de programas de mejora de la calidad de la farmacoterapia y seguridad de los pacientes (PCFySP) se ha propuesto como objetivo común de diferentes instituciones y sociedades científicas y profesionales4–6 con el fin de conseguir que los farmacéuticos continúen avanzando en su contribución al uso más adecuado y seguro de los medicamentos. Así, la Sociedad Española de Farmacia Hospitalaria establece entre sus objetivos para el año 2020: «incrementar la participación del farmacéutico en la optimización de la farmacoterapia individualizada». Este objetivo representa la participación del farmacéutico como miembro del equipo asistencial interdisciplinario, con el fin de identificar, prevenir y resolver problemas relacionados con los medicamentos (PRM), que representan oportunidades de mejora de la farmacoterapia, e implantar medidas de optimización farmacoterapéutica en los pacientes7,8.
El valor añadido que el farmacéutico aporta al proceso de utilización de medicamentos se ha evidenciado en términos de reducción significativa de las complicaciones clínicas derivadas de los PRM, la estancia hospitalaria y el coste de los tratamientos, de acuerdo con diferentes estudios publicados9–11 tanto en el ámbito nacional como en el internacional. La aceptación de las recomendaciones farmacoterapéuticas (RF) realizadas por los farmacéuticos, por parte del resto de profesionales implicados en el cuidado del paciente, presenta una amplia variabilidad situada entre un 60–95%12–14 y representa, en muchas ocasiones, el paso limitante para la implantación de medidas de optimización farmacoterapéutica en el paciente.
Algunos estudios sugieren que diferentes variables relacionadas con el PRM identificado, la RF propuesta, el servicio clínico o los profesionales implicados15–17 pueden determinar la aceptación de las recomendaciones de optimización farmacoterapéutica y su implantación en el paciente; en este sentido, el estudio de dichas variables puede contribuir a conseguir una mayor eficiencia de las actuaciones farmacéuticas de mejora de la farmacoterapia.
En este contexto, se plantea el presente estudio con el objetivo de identificar y cuantificar la influencia de diferentes variables, relacionadas con el PRM identificado y la RF realizada, en la implantación de medidas de optimización farmacoterapéutica en los pacientes ingresados.
MétodosTipo de estudio. Estudio observacional, descriptivo y transversal realizado durante un período de ocho años, comprendido entre 2000–2007.
Pacientes y ámbito. La población de estudio está compuesta por todos los pacientes ingresados en un hospital general, universitario y público con 25.000 pacientes ingresados/año, en los que se han identificado PRM, a partir de la revisión de la historia clínica o durante el pase de visita, o bien a través de la monitorización farmacoterapéutica realizada desde el Sistema Integral de Dispensación Individualizada de Medicamentos del Servicio de Farmacia.
El PCFySP implantado en el hospital desde el año 2000 y que da cobertura aproximadamente al 30% de los pacientes ingresados se basa en la metodología Iaser©18 en la que se diferencian las siguientes fases: identificación de pacientes con oportunidades de mejora de la farmacoterapia, actuación farmacéutica, seguimiento farmacoterapéutico, evaluación de resultados individuales en el paciente, análisis y difusión de resultados poblacionales. Tras la identificación de un paciente con PRM se concreta un plan de actuación farmacéutica que implica realizar una RF, si procede, al resto del equipo interdisciplinario, con la finalidad de implantar una medida de optimización farmacoterapéutica en el paciente. La recomendación se realizó en las primeras 24h tras la identificación del PRM, de forma verbal, mediante comunicación directa o telefónica con el profesional médico implicado en el cuidado del paciente, o de forma escrita a través de su registro en la historia clínica. Se estableció un margen de 48h para valorar la aceptación y posterior aplicación en el paciente de la RF realizada. Todas las actuaciones farmacéuticas se documentaron en una hoja individualizada de monitorización farmacoterapéutica y posteriormente en el aplicativo informático Atefarm® Farmis (IMF, 2008).
Las variables analizadas se clasificaron en dos categorías, según estuvieran relacionadas con la tipificación del PRM identificado o con la RF realizada, como se describe en la tabla 1.
Variables analizadas
| Categoría | Variable/descripción |
| PRM | Riesgo del medicamento implicado: alto o bajo |
| Categoría del PRM: indicación, efectividad, seguridad o adherencia | |
| Gravedad potencial del PRM: escala de 1–5 | |
| Recomendación farmacoterapéutica | Impacto: efectividad, seguridad o eficiencia |
| Implantación (sí/no) |
PRM: problema relacionado con medicamentos.
La clasificación de los medicamentos implicados en el PRM en riesgo alto o bajo se realizó sobre la base de los criterios del Institute for Safe Medication Practices19 y el Ministerio de Sanidad y Consumo20,21, considerando también de riesgo alto los medicamentos que requieren individualización posológica por monitorización farmacocinética en el hospital (vancomicina, aminoglucósidos).
La categoría del PRM se ha clasificado en 4 tipos y la gravedad potencial en una escala de 1–5, de menor a mayores consecuencias clínicas en el paciente, de acuerdo con la metodología aprobada en el hospital18,22,23 (tabla 2).
Escala de gravedad potencial de los problemas relacionados con los medicamentos y ejemplos de recomendaciones farmacoterapéuticas realizadas
| Grado | Descripción |
| 1 | PRM/EM que no provocaría daño o que provocaría daño reversible (sin cambio en signos vitales) que requeriría aumento de monitorización |
| Ejemplos: cambio de levofloxacino de 500mg/24h IV a levofloxacino de 500mg/24h vía oral sin retirada de acceso IV; cambio de linezolid de 600mg/12h IV a vancomicina de 1g/12h IV en paciente con infección por Staphilococcus aureus meticilin resistente sensible a ambos | |
| PRM/EM que provocaría daño reversible (sin cambio en signos vitales) que requeriría modificación del tratamiento | |
| 2 | Ejemplos: cambio de imipenem de 1g/8h a imipenem de 500mg/6h ajustado a función renal del paciente; cambio de gentamicina de 240mg/24h IV a vancomicina de 180mg/24h IV ajustado a función renal del paciente |
| PRM/EM que provocaría daño reversible que requeriría tratamiento adicional, ingreso hospitalario o aumento de la estancia | |
| 3 | Ejemplos: cambio de ceftriaxona de 1g/12h IV a levofloxacino de 500mg/24h IV en paciente con alergia documentada a betalactámicos, cambio de vancomicina de 1g/12h IV a vancomicina de 1g/24h IV ajustado a función renal del paciente. |
| PRM/EM que provocaría daño irreversible o discapacitante | |
| 4 | Ejemplos: cambio de morfina de 300mg en perfusión IV de 24h por morfina de 30mg en perfusión IV de 24h por error de prescripción, cambio de tacrólimo de 3mg/12h IV a tacrólimo de 1,5mg en perfusión IV de 24h |
| PRM/EM que provocaría la muerte del paciente | |
| 5 | No se ha producido ningún caso |
IV: intravenosa; PRM: problema relacionado con medicamentos.
Análisis estadístico. Se realizó un análisis descriptivo de las variables incluidas en el estudio, las variables categóricas se han representado como frecuencias relativas expresadas en porcentajes y las variables cuantitativas mediante los índices respectivos en función de la simetría de su distribución: media y desviación estándar (distribución simétrica) y mediana y distancia intercuartil (distribución asimétrica).
Para identificar las variables que influyen en la implantación de recomendaciones de optimización farmacoterapéutica se realizó un análisis de regresión logística multivariante, definiendo como variable respuesta la implantación de la RF. Las variables explicativas o dependientes fueron las siguientes: medicamento (alto o bajo riesgo), categoría de PRM, gravedad potencial del PRM, impacto de la RF. Las variables explicativas con tres o más categorías se recodificaron en dos para simplificar el análisis: categoría del PRM (0, indicación; 1, efectividad o seguridad), gravedad potencial del PRM (0, gravedad=1; 1, gravedad ≥2,) e impacto de la RF (0, eficiencia; 1, efectividad o seguridad).
Para el desarrollo del modelo de regresión logística24 se realizó un cribado de las variables explicativas, a partir del análisis de regresiones univariantes, para seleccionar los potenciales factores pronóstico que se iban a incluir en el modelo multivariante (valores de p inferiores a 0,25). Con las variables resultantes se exploraron los diferentes modelos multivariantes con los métodos de inclusión y exclusión secuencial, fijando los valores p de significación para la inclusión y exclusión de variables en 0,05 y 0,10, respectivamente. En segundo lugar, se introdujeron los términos de interacción para comprobar si mejoraban los índices de ajuste (cambios significativos del logaritmo de la verosimilitud). El análisis estadístico se realizó en el programa SPSS versión 12 (SPSS Inc., Chicago, IL).
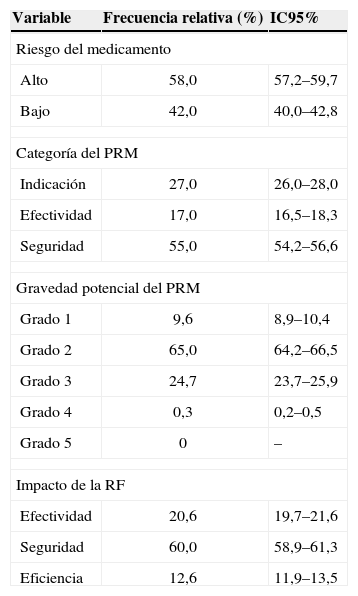
ResultadosEl PCFySP ha dado cobertura de seguimiento farmacoterapéutico a un total de 55.123 pacientes en el período analizado (2000–2007) y se incluyeron en el estudio 4.680 pacientes en los que se identificaron 7.920 PRM; en el 85% (6.762) se realizó una RF que se implantó en el paciente en el 83,0% de los casos (intervalo de confianza del 95% [IC95%]: 74,2–89,8). En la tabla 3 se presentan la frecuencia relativa para las variables categóricas predictoras evaluadas junto con su IC95%.
Características descriptivas de las variables categóricas
| Variable | Frecuencia relativa (%) | IC95% |
| Riesgo del medicamento | ||
| Alto | 58,0 | 57,2–59,7 |
| Bajo | 42,0 | 40,0–42,8 |
| Categoría del PRM | ||
| Indicación | 27,0 | 26,0–28,0 |
| Efectividad | 17,0 | 16,5–18,3 |
| Seguridad | 55,0 | 54,2–56,6 |
| Gravedad potencial del PRM | ||
| Grado 1 | 9,6 | 8,9–10,4 |
| Grado 2 | 65,0 | 64,2–66,5 |
| Grado 3 | 24,7 | 23,7–25,9 |
| Grado 4 | 0,3 | 0,2–0,5 |
| Grado 5 | 0 | – |
| Impacto de la RF | ||
| Efectividad | 20,6 | 19,7–21,6 |
| Seguridad | 60,0 | 58,9–61,3 |
| Eficiencia | 12,6 | 11,9–13,5 |
IC95%: intervalo de confianza del 95%; PRM: problema relacionado con la medicación; RF: recomendación farmacéutica.
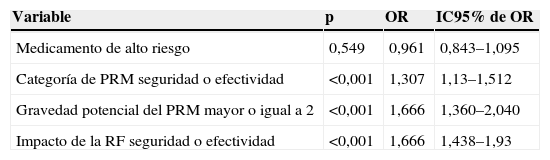
En la tabla 4 se presentan los resultados de las regresiones univariantes. De acuerdo con los resultados de este análisis, se seleccionaron las variables categoría de PRM efectividad/seguridad respecto a indicación, gravedad potencial del PRM mayor o igual a 2 respecto a gravedad potencial 1 e impacto de la RF en seguridad y eficacia respecto a eficiencia, para la construcción del modelo predictivo, por presentar una p<0,25 y un signo correcto en el coeficiente.
Resultados del análisis univariante
| Variable | p | OR | IC95% de OR |
| Medicamento de alto riesgo | 0,549 | 0,961 | 0,843–1,095 |
| Categoría de PRM seguridad o efectividad | <0,001 | 1,307 | 1,13–1,512 |
| Gravedad potencial del PRM mayor o igual a 2 | <0,001 | 1,666 | 1,360–2,040 |
| Impacto de la RF seguridad o efectividad | <0,001 | 1,666 | 1,438–1,93 |
IC95%: intervalo de confianza del 95%; OR: odds ratio; PRM: problema relacionado con la medicación; RF: recomendación farmacoterapéutica.
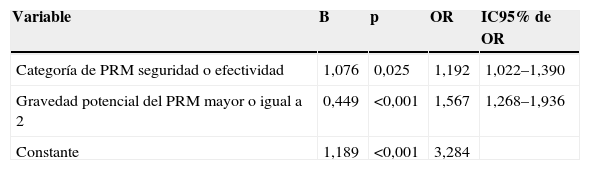
En la tabla 5 se presentan los resultados del modelo de regresión logística definitivo. El modelo predictivo de regresión logística multivariante incluyó las variables categoría de PRM seguridad o efectividad y gravedad potencial mayor o igual a 2.
Modelo de regresión logística definitivo
| Variable | B | p | OR | IC95% de OR |
| Categoría de PRM seguridad o efectividad | 1,076 | 0,025 | 1,192 | 1,022–1,390 |
| Gravedad potencial del PRM mayor o igual a 2 | 0,449 | <0,001 | 1,567 | 1,268–1,936 |
| Constante | 1,189 | <0,001 | 3,284 |
IC95%: intervalo de confianza del 95%; OR: odds ratio; PRM: problema relacionado con la medicación.
La ecuación predictiva (fig. 1) del modelo seleccionado se representa mediante el modelo de regresión logística y proporciona la probabilidad de implantación de una recomendación de optimización farmacoterapéutica en el paciente en función de las variables explicativas: categoría de PRM de seguridad o efectividad y gravedad potencial del PRM mayor o igual a 2.
Tras la aplicación del modelo de regresión se obtuvo que la probabilidad de implantación de medidas de optimización farmacoterapéutica en PRM de seguridad o efectividad fue de 0,59 cuando el PRM presentó una gravedad potencial igual o superior a 2, y de 0,31 si la gravedad fue inferior a 2. En los PRM de indicación, la probabilidad de implantación de medidas de optimización farmacoterapéutica fue inferior: 0,49 en PRM de gravedad igual o superior a 2 y 0,17 si la gravedad fue menor a 2.
DiscusiónEl objetivo final de los PCFySP es la optimización de la farmacoterapia para incrementar la probabilidad de obtener resultados óptimos y reducir la probabilidad de riesgos para el paciente. Con este fin, se diseña un plan de actuación farmacoterapéutica sobre la base de las necesidades del paciente y las oportunidades de mejora de la farmacoterapia identificadas. La implantación de estas medidas supone un proceso complejo y multifactorial que depende, en primer lugar, de la aceptación de la RF por parte del equipo clínico.
En el presente estudio se analizaron un total de 6.762 RF realizadas en pacientes ingresados en un hospital general, con un nivel de implantación de las medidas de optimización farmacoterapéutica propuestas no inferior al 85% de las realizadas. Este resultado es similar al obtenido por Kloper et al25 en un metaanálisis sobre 23 estudios realizados en diferentes entornos asistenciales, y cuyos porcentajes de aceptación varían entre 58,1–97,5%. Otros estudios, como el realizado por De Name et al12, que evalúan las recomendaciones de optimización de la farmacoterapia en pacientes diabéticos ambulatorios, o el realizado por Arroyo et al26 en pacientes oncológicos y críticos obtienen porcentajes de aceptación del 61,4 y el 94%, respectivamente. La amplia variabilidad encontrada sugiere la necesidad de identificar cuáles son los factores con mayor influencia en el grado de aceptación de las recomendaciones en el entorno asistencial propio, con el fin de priorizar aquellas medidas de optimización farmacoterapéuticas que el equipo de salud considera de mayor relevancia para los resultados en el paciente.
Tras realizar el análisis univariante, se observó que las variables categoría del PRM seguridad o efectividad, gravedad potencial del PRM mayor o igual a 2 e impacto de la RF seguridad o efectividad presentaron una relación estadísticamente significativa con la implantación de la RF. Sin embargo, el análisis multivariante finalmente seleccionó las variables categoría y gravedad del PRM como las variables predictoras con mayor influencia sobre la implantación de medidas de optimización farmacoterapéutica en el paciente, lo que pone de manifiesto que estas dos características del PRM deben ser las variables prioritarias al realizar el plan de actuación farmacéutica.
En el modelo de predicción final obtenido en nuestro estudio se observó que las RF relacionadas con PRM de gravedad potencial mayor o igual a 2 tenían el doble de probabilidad de ser aceptadas que las relacionadas con gravedad 1, siendo esta relación estadísticamente significativa. La relación entre la aceptación de la RF y la gravedad del PRM ha sido ampliamente estudiada16,26; no obstante, la diversidad en el tipo de estudios realizados limita la comparación entre ellos. En un estudio realizado por Barber et al15 se concluye que la aceptación depende de la gravedad, pero determinan la gravedad del PRM de forma indirecta, al relacionarla con el servicio clínico al que está adscrito el paciente. Así, obtienen que las actuaciones realizadas en la unidad de cuidados intensivos tienen una mayor aceptación que las realizadas en otras unidades. En nuestro estudio, con un análisis individual de la gravedad potencial del PRM basado en características del medicamento implicado y la situación clínica del paciente (tabla 3) se demostró que esta variable es la que mayor influencia parece tener en la toma de decisiones farmacoterapéuticas, al diferenciar entre los PRM sin consecuencias clínicas relevantes (gravedad 1) y los PRM con consecuencias clínicas potencialmente relevantes para el paciente (gravedad 2 o superior).
La categoría del PRM está estrechamente relacionada con la implantación de la RF en nuestro modelo; así, la probabilidad de que se implante en el paciente una RF relacionada con la seguridad o efectividad de los medicamentos es un 20% superior a la probabilidad de implantación de las recomendaciones relacionadas con la indicación (tabla 5). De forma similar, Bedouch et al27 obtienen que las recomendaciones de individualización posológica relacionadas igualmente con la seguridad y efectividad de los tratamientos presentan una probabilidad de aceptación 3,86 veces (IC95%: 1,63–8,86) superior. Esto sugiere que las recomendaciones relacionadas con la indicación se consideran posiblemente menos relevantes desde el punto de vista clínico y con una orientación mayoritaria a la reducción de costes de la farmacoterapia. En este sentido, la integración del farmacéutico en el equipo clínico con el fin de participar en la toma de decisiones farmacoterapéuticas desde el inicio del plan terapéutico y potenciar la educación al profesional podría contribuir al uso de los medicamentos más adecuado, sobre la base de criterios de seguridad, eficacia y coste, como ha puesto de manifiesto una reciente revisión sistemática publicada por Ostini et al28.
Por otra parte, otras variables estudiadas que no han demostrado relación con la implantación de la RF han sido el tipo de medicamento implicado y el impacto de la actuación. En nuestro estudio, el 58% de los PRM se relacionó con medicamentos de «alto riesgo» pero no se observó una relación estadísticamente significativa con la implantación de la RF (p=0,549). Sin embargo, sí se obtuvo esta relación con la gravedad del PRM, que considera el riesgo del medicamento en el contexto de la situación clínica del paciente. El impacto de la actuación generalmente está relacionado con la categoría del PRM; en nuestro estudio, la mayoría de las actuaciones farmacéuticas se relacionaron con la seguridad (60%), en segundo lugar con la efectividad (20,6%) y, por último, con la eficiencia (12,3%), distribución similar a la obtenida en otros estudios26,29,30. Tras agrupar el impacto de la RF en seguridad-efectividad respecto a eficiencia se observó una relación estadísticamente significativa con la implantación de la recomendación; no obstante, no se incluyó en el modelo definitivo, posiblemente por la fuerte relación con la variable categoría del PRM.
La cuantificación de todos los factores relacionados con la implantación de las recomendaciones de optimización farmacoterapéutica es compleja y, en ocasiones, difícil de medir. Una de las limitaciones del estudio es que no se han considerado otros factores estudiados en la bibliografía, tales como el profesional implicado o la forma/vía de comunicación utilizada. En general, algunos autores observan una mayor aceptación en las recomendaciones realizadas de forma verbal respecto a la escrita17,27; en nuestro entorno, la forma mayoritaria de comunicación con el profesional es verbal, de modo que no es posible estudiar su relación con la implantación de la recomendación en el paciente. Por otra parte, otros estudios observan diferencias en función del profesional implicado (estudiantes-residentes-facultativo especialista, por ejemplo)16,25, aspecto que pone de manifiesto la posible influencia de las habilidades de comunicación y experiencia profesional del farmacéutico para participar en la toma de decisiones farmacoterapéuticas de forma efectiva. En nuestro estudio, este factor no ha podido ser estudiado, ya que solo realizan RF los farmacéuticos especialistas y residentes, y estos siempre supervisados por los especialistas, de manera que podría producirse un sesgo en la interpretación de potenciales diferencias.
Finalmente, el modelo de predicción obtenido concluye que la implantación de la recomendación de optimización farmacoterapéutica está relacionada significativamente con la categoría y, sobre todo, con la gravedad de la oportunidad de mejora en la farmacoterapia identificada en el paciente. Así, cuando el PRM identificado puede afectar a la efectividad del tratamiento o la seguridad del paciente, la probabilidad de aceptación se incrementa en un 20% (IC95%: 0–40%), y cuando la gravedad del PRM es mayor o igual a 2, es decir, con riesgo de consecuencias clínicas relevantes para el paciente, la probabilidad de aceptación se incrementa en un 50% (IC95%: 30–100%). Este hecho pone de manifiesto la necesidad de priorizar la realización de RF sobre oportunidades de mejora en la farmacoterapia con gravedad mayor o igual a 2 y basadas en efectividad y seguridad, con la finalidad de reducir la variabilidad en la aceptación y garantizar la implantación de medidas de optimización farmacoterapéutica relevantes en los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Resultados preliminares presentados en formato póster en el 53.o Congreso de la Sociedad Española de Farmacia Hospitalaria, celebrado en Valencia del 21–24 de octubre de 2008.