Laindividualización posológica de los fármacosde estrecho índice terapéutico, como la ciclosporinaA (CsA), exige caracterizar el perfil farmacocinético delpaciente en base a sus concentraciones en fluidosbiológicos. La determinación de las concentracionesdel fármaco en cualquier matriz biológica llevaimplícito un error analítico; éste puedeocasionar una estimación sesgada de los parámetrosfarmacocinéticos del paciente y, en consecuencia, elestablecimiento de pautas posológicas que no garanticen laefectividad y la seguridad del tratamientofarmacoterapéutico. En efecto, los errores analíticosde las técnicas empleadas en la monitorización de lasconcentraciones del fármaco podrán ocasionarmodificaciones de la posología con resultados más omenos importantes sobre el paciente (1); su importanciaclínica depende de factores como el ámbitoterapéutico del fármaco, su concentración enestado estacionario y la sensibilidad del paciente al mismo. Eneste escenario es obvio que cuando la concentración real delfármaco se encuentra próxima a cualquiera de loslímites de su ámbito terapéutico, lamodificación en la dosis causada por un resultadoanalítico impreciso podrá ocasionar problemas deineficacia terapéutica y la toxicidad yatrogénica deltratamiento (2).
En suma,garantizar la fiabilidad de la información de lasconcentraciones de los fármacos determinadas en ellaboratorio de farmacocinética clínica es un aspectoestructural de la filosofía y práctica que soporta lamonitorización de fármacos, ya que condiciona lacalidad de los resultados clínicos en los pacientes. Portanto, las unidades de farmacocinética clínicacumplen su cometido final cuando se asegura la fiabilidad y lacalidad de la información farmacoterapéutica aportadaa la atención del paciente (3).
La CsA es unfármaco inmunosupresor que se administra en pacientes condiversos trasplantes con el objetivo de prevenir el rechazo delinjerto. La alta variabilidad, tanto a nivel interindividual comointraindividual, encontrada en los procesos cinéticos ydinámicos, así como el estrecho ámbitoterapéutico asociado a este fármaco, particularmenteevidente en las primeras semanas postrasplante, justifica laincorporación de la determinación de CsA en sangretotal como un proceso más de la monitorización en elpaciente trasplantado (4, 5). Así se ha demostrado lautilidad de la individualización posológica alprevenir el rechazo del órgano trasplantado, minimizar latoxicidad inherente al fármaco y/o evaluar laetiología de la disfunción del trasplante. A su vezesta práctica permite asegurar el cumplimiento del pacientey controlar diversos factores que alteran el perfil cinéticodel fármaco como pueden ser las interaccionesfarmacológicas (6, 7).
El objetivo delpresente trabajo es analizar la calidad de la determinaciónde CsA en sangre total mediante inmunofluorescencia polarizadaindirecta (ensayo monoclonal) con la finalidad de validar lainformación obtenida en la monitorización de estefármaco.
MÉTODO
Elanálisis de la calidad de la determinación de CsA ensangre total, mediante la técnica de inmunofluorescenciapolarizada indirecta (Abbott, TDx), se ha realizado mediante lavaloración de la precisión y la exactitud en ladeterminación de concentraciones conocidas de CsA(controles). La optimización de la calidad de ladeterminación de CsA se ha realizado mediante elestablecimiento y la validación de los límites dealerta y de invalidación asociados a los controles de formaindividual (precisión) y poblacional (exactitud). Elestablecimiento de estos límites se ha realizado mediante ladeterminación replicada de tres controles deconcentración: 150 ng/ml (control bajo), 400 ng/ml (controlmedio) y 800 ng/ml (control alto) intercalados entre las muestrasde los pacientes y procesados en días distintos comprendidosentre noviembre de 1996 y hasta mayo de 1997 (grupo A). Losresultados obtenidos durante este período de tiempo sevalidaron con los controles determinados en la misma unidad defarmacocinética clínica durante el período detiempo comprendido entre junio de 1997 y julio de 1999 (grupo B).Finalmente, los datos obtenidos entre noviembre de 1996 y julio de1999 se utilizaron para la caracterización del modelo deerror de la técnica analítica empleada.
Técnica analítica
Ladeterminación de la concentración sanguínea deCsA se ha realizado en el sistema automatizado TDx (Abbott, EstadosUnidos) mediante una metodología de inmunoensayocompetitivo. Esta técnica se fundamenta en la competenciaexistente entre el antígeno marcado con fluoresceína(fármaco trazador) y el antígeno del paciente(fármaco a determinar) para ocupar los sitios deunión de las moléculas del anticuerpo (reactivo).Cuando se produce el enlace entre las moléculas larelación antígeno del paciente/trazador determina lacantidad de complejo anticuerpo-trazador formado, responsableúltimo de la polarización resultante. A medida que lamuestra del paciente contenga mayor cantidad de antígeno(fármaco), éste desplazará al trazador de suunión con el anticuerpo y se obtendrá una menorconcentración del complejo anticuerpo trazador, queocasionará una menor polarización. Por el contrario,cuando existe una baja concentración del antígeno enla muestra la concentración del complejo anticuerpo-trazadorserá mayor y su polarización será máselevada. Los valores de polarización obtenidos setransforman en concentraciones de CsA mediante la curva decalibración propia de la técnica analítica. Deesta forma es posible obtener con relativa sencillez y rapidezconcentraciones sanguíneas de CsA comprendidas entre 25 y1.500 ng/ml. En este caso se han utilizado los controlesdispensados por Abbott durante el período de tiempocomprendido entre noviembre de 1996 y julio de 1999.
Exactitud yprecisión
La exactitud dela técnica analítica viene determinada por laconcordancia del valor de la determinación analíticacon el valor verdadero del control y se ha cuantificado mediante lamedia del error fraccional (ecuación 1). La precisiónde la técnica analítica es el grado dedispersión existente entre una serie de observacionesrepetidas y se ha cuantificado como la desviaciónestándar del error fraccional medio (ecuación 2)(8):
dondeyj es el valor observado de ladeterminación analítica y f(*)j es el valor verdadero delcontrol.
En ambos gruposde datos se valoró la normalidad de la distribuciónde probabilidad del error fraccional mediante la prueba deKolmogorov-Smirnov. Asimismo, la comparación de la media delerror fraccional entre los dos grupos (exactitud) se realizómediante una prueba «t» de Student, y la homogeneidadde varianzas del error fraccional (precisión) serealizó mediante la prueba de Levene. Se asumió laexistencia de diferencias estadísticamente significativascuando el valor de p era inferior a 0,05.
Elanálisis de la exactitud y la precisión permiteobtener el error analítico máximo asociado a cadaconcentración de referencia. El error analíticomáximo (EAM) se calculó mediante la ecuación3:
EAM = Exactitud+ 2 · Precisión [ecuación 3]
donde laexactitud y la precisión se expresan en porcentaje. Esteparámetro permitirá comparar la exactitud y laprecisión de esta técnica analítica enrelación con el error máximo tolerable en lamonitorización de CsA.
Lavaloración de la exactitud y precisión realizada dela forma descrita no permite evaluar el estado de la técnicaanalítica a partir de la determinación de unúnico control. En este sentido resulta de gran utilidaddesarrollar procedimientos que permitan conocer el estado de latécnica analítica a tiempo real. Entre estosprocedimientos se encuentra el establecimiento de loslímites de exactitud y precisión.
Límites de precisión
Loslímites de alerta utilizados en la determinación deCsA están definidos por el intervalo central de valores quecontienen el 95% de los resultados de cada control. Del mismo modose definen los límites de invalidación como elintervalo central de valores que comprende el 99% de los resultadosobtenidos. Con los valores analíticos correspondientes algrupo A se han determinado los límites de alerta einvalidación para cada control mediante laconstrucción de los gráficos de control deLevy-Jennings. En estos gráficos se representa en el eje deabscisas el orden cronológico de las determinacionesrealizadas y en ordenadas el valor observado. El gráficoresultante informa sobre la variabilidad de los resultadosobtenidos.
Lavalidación de los límites de precisiónestablecidos se ha realizado con los resultados analíticosobtenidos de los controles del grupo B. Para ello se ha comparadoel porcentaje de valores fuera de los límites de alerta einvalidación estimados en los grupos A y B mediante laprueba estadística de Chi cuadrado. Se asumió laexistencia de diferencias estadísticamente significativascuando el valor de p era inferior a 0,05.
Límites de exactitud
Loslímites de alerta e invalidación utilizados en ladeterminación de CsA están definidos por el intervalocentral de valores, donde se sitúan el 95 y 99%,respectivamente, de las medias observadas en muestras detamaño 30. Los límites de estos intervalos,también denominados intervalos de tolerancia, se hancalculado en el grupo A a partir de la media y la desviaciónestándar poblacional. La evolución temporal de lamedia móvil anterior de periodicidad 30 informa sobre latendencia de los resultados obtenidos.
Lavalidación de los límites de exactitud establecidosse ha realizado con los resultados analíticos obtenidos delos controles del grupo B. Para ello se ha comparado el porcentajede días fuera de los límites de exactitud en losgrupos A y B, mediante la prueba estadística de Chicuadrado. Se asumió la existencia de diferenciasestadísticamente significativas cuando el valor de p erainferior a 0,05.
Modelo devarianza del método analítico
El modelo devarianza de la técnica analítica es unafunción explícita que relaciona el valor de unadeterminada concentración del fármaco(concentración de referencia) y la variabilidad delmétodo analítico asociada a esa concentración.En este caso se han seleccionado como concentraciones de referencialos controles utilizados en la monitorización de lasconcentraciones de CsA. Así, las medidas repetidas de estoscontroles permiten caracterizar su valor medio y su variabilidad,cuantificada mediante la desviaciónestándar.
Posteriormente,la relación existente entre las concentracionesplasmáticas y sus respectivas desviaciones estándarse ha estudiado mediante distintos modelos de varianza. Así,las desviaciones estándar correspondientes a cadaconcentración de referencia se ajustaron a unaecuación polinómica de tercer orden. Este modelo secomparó con la serie de modelos restringidos establecidos,de modo secuencial, mediante la supresión de alguno oalgunos de los términos del polinomio de tercer grado. Enlos modelos desarrollados se ha incluido el términoindependiente para estimar el límite decuantificación de la técnica analítica. Laestimación de los parámetros del modelo serealizó por regresión lineal por mínimoscuadrados ordinarios. La selección del modelo de varianzaque caracteriza la variabilidad de la técnicaanalítica de CsA se realizó en base a los resultadosdel ajuste de los modelos, en términos de suma de cuadradosde los residuales (SS), coeficiente de determinaciónajustado (r2 adj) ycriterio de información de Akaike (AIC).
RESULTADOS
Durante elperíodo de estudio se han procesado medianteinmunofluorescencia polarizada indirecta un total de 505 datosexperimentales correspondientes a los controles analíticosbajo, medio y alto disponibles para la determinación de CsA.De ellos, los primeros 252 valores se han asignado al grupo A y los253 restantes al grupo B. La media y la desviaciónestándar correspondiente a cada control analítico enambos grupos de estudio se muestra en la tabla 1.
| Tabla 1. Concentracionesexperimentales y desviación estándar de lasconcentraciones de referencia de CsA | ||||||
| Concentraciónreferencia (ng/ml) | Grupo A | Grupo B | ||||
| N | Media | DE | N | Media | DE | |
| 150 | 86 | 153,67 | 14,17 | 83 | 149,44 | 14,62 |
| 400 | 83 | 398,86 | 37,45 | 78 | 397,48 | 31,32 |
| 800 | 83 | 791,54 | 57,94 | 92 | 793,44 | 56,07 |
Exactitud yprecisión de la técnicaanalítica
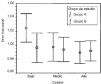
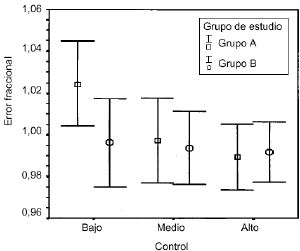
Los resultadosdel análisis de la exactitud y precisión mediante elerror fraccional se muestra en la tabla2. La prueba de Kolmogorov-Smirnov no detectódiferencias estadísticamente significativas respecto de ladistribución normal en ninguna de las concentraciones dereferencia estudiadas. En ninguno de los casos se apreciandiferencias estadísticamente significativas, aunque losvalores de la concentración de referencia de 150 ng/ml en elgrupo B tienden a ser menores que en el grupo A. Estos mismosresultados, expresados en forma gráfica, se muestran en lafigura 1, donde se aprecia que elintervalo de confianza del 95% del error fraccional incluye elvalor unitario, y, por tanto, en ningún caso existe un sesgosistemático, salvo en el grupo A cuando laconcentración de referencia es de 150 ng/ml. La homogeneidadde varianzas entre ambos grupos se comprobó mediante laprueba de Levene. Estos resultados indican que la exactitud y laprecisión entre ambos grupos no difiere de formasignificativa, aunque en el grupo A la concentración dereferencia de 150 ng/ml presenta una tendencia sistemática aser sobrevalorada. De hecho estas concentraciones de referenciason, en promedio, un 2,4% más elevadas que su valorreal.
| Tabla 2. Error fraccionalmedio y desviación estándar de las determinaciones delos controles analíticos de CsA | |||||||
| Concentraciónreferencia (ng/ml) | Grupo A | Grupo B | p* | ||||
| N | Media | DE | N | Media | DE | ||
| 150 | 86 | 1,024 | 0,094 | 83 | 0,996 | 0,097 | 0,058 |
| 400 | 83 | 0,997 | 0,094 | 78 | 0,994 | 0,078 | 0,801 |
| 800 | 83 | 0,989 | 0,072 | 92 | 0,992 | 0,070 | 0,826 |
*Prueba «t» de Student Fisher. | |||||||
Figura 1.--Media e intervalo de confianza del 95% de larelación entre los valores observados y la concentración dereferencia.
Por otra parte,el error analítico máximo en el grupo A para lasconcentraciones de referencia de 150, 400 y 800 ng/ml es del 21,2,19,1 y 15,5%, respectivamente. En el grupo B los valores obtenidosson 19,8, 16,2 y 14,8 para las concentraciones de referencia de150, 400 y 800 ng/ml, respectivamente.
Límites de precisión
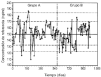
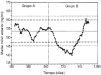
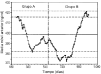
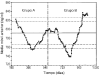
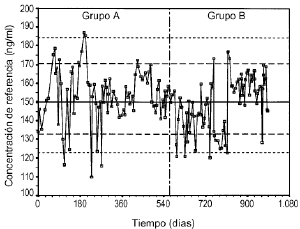
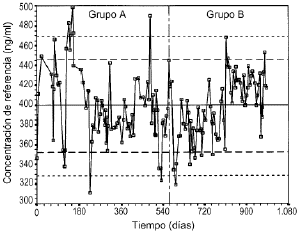
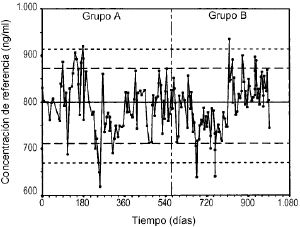
Losgráficos de control de Levy-Jennings que representan loslímites de alerta e invalidación para el controlanalítico bajo, medio y alto se representan en las figuras 2, 3 y 4, respectivamente. En estosgráficos se aprecia que para los tres controles los valoresobservados en las determinaciones analíticas se distribuyende forma aleatoria alrededor del valor de referencia y en sumayoría se encuentran dentro de los límites deinvalidación establecidos tanto para los valores observadosen el grupo A como en el grupo B. El porcentaje de valores fuera delos límites de alerta e invalidación en los grupos Ay B, así como la significación estadísticaresultante de su comparación, se muestra en la tabla 3. En todos los casos las diferencias entrelos grupos A y B no son estadísticamente significativas,excepto en el control medio, donde el porcentaje de determinacionesdentro de los límites de invalidación es mayor parael grupo B.
Figura 2.--Gráfico de control de Levy-Jenningspara la concentración de referencia de 150 ng/ml.
Figura 3.--Gráfico de control de Levy-Jenningspara la concentración de referencia de 400 ng/ml.
Figura 4.--Gráfico de control de Levy-Jenningspara la concentración de referencia de 800 ng/ml.
| Tabla 3. Límites dealerta e invalidación para valorarla precisión de latécnica analítica de CsA en funciónde laconcentración de referencia y porcentajede controles dentro deestos límites en el grupo A y B | ||||||
| Límites | Control | Inferior | Superior | % grupo A | % grupo B | p* |
| Alerta | Bajo | 132,7 | 170,5 | 84 | 78 | 0,369 |
| Medio | 352,0 | 445,7 | 82 | 87 | 0,356 | |
| Alto | 719,3 | 872,8 | 87 | 88 | 0,796 | |
| Invalidación | Bajo | 123,0 | 184,3 | 94 | 95 | 0,773 |
| Medio | 328,6 | 469,1 | 92 | 99 | 0,027 | |
| Alto | 669,6 | 913,4 | 96 | 97 | 0,898 | |
*Prueba de x2. | ||||||
Límites de exactitud
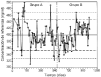
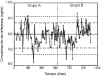
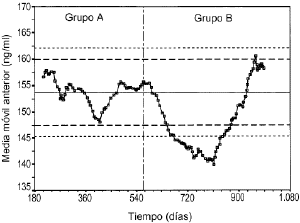
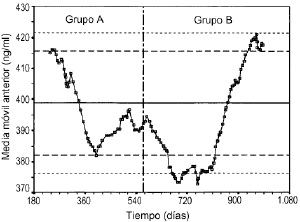
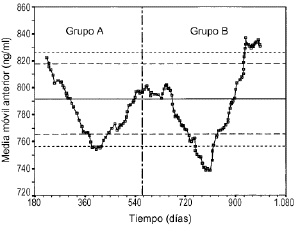
Laevolución temporal de la media móvil anterior deperiodicidad 30 y los límites de alerta einvalidación de cada control se muestran en las figuras 5, 6 y 7. En todos ellos se aprecia unamayor tendencia a distanciarse del valor de referencia einfravalorar el valor de las concentraciones de referencia en lasdeterminaciones realizadas en el grupo B. En todas lasconcentraciones de referencia, entre los días 600 y 800, seobserva una tendencia sistemática a obtener resultados pordebajo del límite inferior de invalidación. Por otrolado, también se observan resultados por encima de loslímites superiores de alerta e invalidación a partirdel día 900 del estudio. El porcentaje de valores fuera delos límites de alerta e invalidación en los grupos Ay B, así como la significación estadísticaresultante de su comparación, se muestra en la tabla 4. En el grupo B para cualquierconcentración de referencia el porcentaje de determinacionesdentro de los límites de alerta e invalidación essignificativamente inferior al obtenido en el grupo A.
Figura 5.--Media móvil anterior (periodicidad 30)para la concentración de referencia de 150 ng/ml.
Figura 6.--Media móvil anterior (periodicidad 30)para la concentración de referencia de 400 ng/ml.
Figura 7.--Media móvil anterior (periodicidad 30)para la concentración de referencia de 800 ng/ml.
| Tabla 4. Límites dealerta e invalidaciónde la exactitud de latécnica analítica de CsA en funciónde laconcentración de referencia y porcentajede controles dentro deestos límites en el grupo A y B | ||||||
| Límites | Control | Inferior | Superior | % grupo A | % grupo B | p* |
| Alerta | Bajo | 147,4 | 159,9 | 100 | 50,6 | < 0,001 |
| Medio | 382,1 | 415,7 | 96,3 | 43,6 | < 0,001 | |
| Alto | 765,6 | 817,5 | 77,8 | 53,8 | 0,003 | |
| Invalidación | Bajo | 145,3 | 162,1 | 100 | 61,4 | < 0,001 |
| Medio | 376,3 | 421,5 | 100 | 85,9 | 0,004 | |
| Alto | 756,6 | 826,5 | 88,9 | 65,9 | 0,001 | |
*Prueba de x2. | ||||||
Modelo deerror de la técnica analítica
Los modelos deerror utilizados para caracterizar la desviaciónestándar asociada a cada concentración de referencia,así como los criterios para la selección del modeloóptimo, criterio de información de Akaike (AIC), sumade cuadrados de los residuales (SS) y coeficiente dedeterminación ajustado (r2 adj) semuestran en la tabla 5.Según estos criterios, el modelo que mejor describe ladesviación estándar asociada a cadaconcentración es el modelo aditivo proporcional (modelo IIde la tabla 5), puesto que presenta el menor AIC y el mayorr2ajustado. De esta forma el modelo de error para ladeterminación de CsA mediante inmunofluorescencia polarizadaindirecta en nuestra unidad de farmacocinéticaclínica queda definido mediante la ecuación4:
| Tabla 5. Coeficiente dedeterminación ajustado (r2adj), criterio deinformación de Akaike (AIC) y sumade cuadrados delos residuales (SS) en funciónde modelos deerror | ||||
| Modelo deerror | r2adj | AIC | SS | |
| I. Constante | s =P1 | 0 | 30,633 | 1.284,813 |
| II. Aditivoproporcional | s =P1 + P2 · Cp | 0,969 | 9,173 | 26,801 |
| III.Aditivo-cuadrático | s =P1 + P2 · Cp2 | 0,901 | 21,765 | 84,876 |
| IV. Polinómico desegundo orden | s= P1 +P2 · Cp + P3 · Cp2 | 0,943 | 18,749 | 24,222 |
s = 9,724 + 0,05918 · Cp[ecuación 4]
Es decir, paravalores de concentraciones sanguíneas de CsA superiores a 30ng/ml el error de la técnica analítica es inferior al6%.
DISCUSION
Garantizar lacalidad de las determinaciones realizadas en el laboratorio defarmacocinética clínica y establecer y validarprocedimientos de alarma que permitan identificar situaciones dondela exactitud y precisión de la técnicaanalítica están comprometidas son consideradasfunciones básicas de los laboratorios de estas unidadesasistenciales. Por este motivo conocer la exactitud y laprecisión con la cual se establecen las concentraciones decada fármaco en cada laboratorio es obligado. En nuestrocaso (tablas 1 y 2) la exactitud y precisión de lainmunofluorescencia polarizada indirecta en la determinaciónde CsA presenta una tendencia sistemática a sobrevalorar enun 2,4% las concentraciones de referencia de 150 ng/ml. Este sesgocarece de importancia clínica por cuanto que es inferior ala variabilidad analítica establecida mediante el modelo deerror de esta técnica analítica (5,9%) para ladeterminación de CsA.
Por otra parte,los resultados del error analítico máximo deben serinterpretados en función del error máximo tolerablepara la determinación de CsA mediante esta técnicaanalítica. Cuando el análisis replicado de unamuestra define una distribución de frecuencia gaussiana paralos resultados obtenidos, cualquier concentraciónsanguínea correspondiente a la mitad del ámbitoterapéutico será considerada dentro de esteámbito, con una probabilidad menor al 5%, si sudesviación estándar es inferior a la cuarta parte delámbito terapéutico. Esta desviaciónestándar constituye el error analítico máximotolerable. Es decir, si se considera el ámbitoterapéutico de CsA entre 150 y 350 ng/ml, el errormáximo tolerable para su determinación medianteinmunofluorescencia polarizada es de 50 ng/ml, o el 20% si senormaliza respecto a la concentración sanguínea amitad del ámbito terapéutico. Cuando los erroresmáximos tolerables son inferiores al 25%, la técnicaanalítica presenta una exactitud y precisiónadecuadas siempre que los errores analíticos máximosde cada concentración de referencia sean iguales oinferiores al error analítico máximo tolerable comosucede en nuestro caso.
Elanálisis de los límites de precisión evidenciauna similitud entre los límites de invalidaciónobtenidos en nuestro laboratorio y los recomendados por ellaboratorio fabricante. Así, los límites para laconcentración de referencia de 150 ng/ml se sitúanentre 120 y 180 ng/ml, los límites para laconcentración de referencia de 400 ng/ml son 340 y 460ng/ml, y los límites para la concentra-ción dereferencia de 800 ng/ml se sitúan entre 680 y 920 ng/ml. Sinembargo, es de gran utilidad práctica disponer delímites de alerta, con el fin de determinar con mayorsensibilidad la presencia de valores de concentraciones dereferencia sesgados. No obstante, al ser el intervalo de alertamás estrecho que el intervalo de invalidación y, conel fin de evitar la presencia de falsos positivos, se considera quedos determinaciones consecutivas fuera de los límites dealerta tiene el mismo valor que una determinación fuera delos límites de invalidación.
Elestablecimiento de estrategias que permitan valorar de formacontinuada el estado de la técnica analíticagarantiza la calidad de la información obtenida a partir delas concentraciones sanguíneas. En este sentido, lautilización de la media móvil es útil paraevidenciar tendencias sistemáticas en ladeterminación de los fármacos. De hecho, en lasfiguras 5, 6 y 7 se aprecia cómo se podría haberanticipado el sesgo ocasionado en la determinación de CsA sise hubiese realizado de forma continuada el análisis de los30 valores anteriores. Es más, esta prácticadebería ser incluida en los procedimientos normalizados detrabajo de los laboratorios de farmacocinéticaclínica y, en la medida que fuese posible, deberíaser informatizada con el fin de ayudar a la toma de decisiones. Deesta forma es posible la validación continua de latécnica analítica utilizada para garantizar laóptima interpretación de las concentracionessanguíneas de CsA.
Finalmente, laimportancia de la determinación del modelo de error de latécnica analítica se deriva de su importancia en laestimación bayesiana de los parámetrosfarmacocinéticos de CsA. En efecto, la aplicación dela técnica bayesiana, con garantía de éxito,requiere estimados exactos y precisos de los parámetrosfarmacocinéticos poblacionales y de su variabilidad (9). Unacorrecta selección de un modelo poblacional, cuyosparámetros van a ser utilizados como informaciónprevia para la dosificación de los pacientes, exige conocerel índice de credibilidad o contenido veraz de lainformación que proporciona un determinado valor deconcentración plasmática en el paciente (10).Así, uno de los sumatorios de la función objetivobayesiana a minimizar se refiere a las concentraciones defármaco en sangre del paciente, que se ponderan mediante lavarianza de dichas concentraciones (variabilidad residual). Lavariabilidad residual se debe a la presencia de errores aleatorios,no controlables y no explicables por diferencias interindividuales.Entre las potenciales fuentes de error que afectan a lavariabilidad residual se puede citar la técnicaanalítica, la preparación y toma de la muestra, losprocesos de preparación y administración delfármaco, el modelo farmacocinético utilizado y lavariabilidad intraindividual. En general, la variabilidad residualse cuantifica mediante la varianza residual (*2)(3).En algunas ocasiones la variabilidadocasionada por la técnica analítica es ladeterminante principal de la variabilidad residual. En este caso lavarianza de la técnica analítica es una buenaestimación de la varianza residual y, por tanto, es laponderación más adecuada para la correctautilización de los algoritmos bayesianos. Para poderponderar cada valor de concentración en sangre de acuerdocon la varianza de la técnica analítica es necesarioobtener el modelo de varianza de la técnicaanalítica. Este modelo es una funciónexplícita que relaciona la variabilidad de la técnicaanalítica (expresada como desviaciónestándar, *t) y el valor de laconcentración plasmática.
Enopinión de los autores, los procedimientos descritos paraoptimizar la monitorización de las concentracionessanguíneas de CsA deben realizarse en cada laboratorio defarmacocinética clínica con el fin de adecuar losprocesos de trabajo al entorno en el cual sedesarrollan.