Estimar el coste incremental por año de vida ganado (AVG) de la utilización de aflibercept en combinación con FOLFIRI como tratamiento de 2a línea en pacientes con cáncer colorrectal metastásico (CCRm) previamente tratados con oxaliplatino.
Material y métodosBasándose en los resultados del ensayo clínico VELOUR, se utilizó un modelo de Markov con 3 estados de salud (enfermedad estable, progresión y muerte) y ciclos de 2 semanas. La transición al estado de salud «progresión» implicaba interrumpir el tratamiento en 2a línea y administrar una 3a línea de tratamiento. La estimación de costes incluyó costes del manejo de la enfermedad (farmacológicos, acontecimientos adversos, administración, etc.). Costes y resultados en salud fueron descontados al 3% anualmente. Para probar la robustez del modelo se realizaron análisis de sensibilidad determinístico y probabilístico.
ResultadosLa administración de aflibercept + FOLFIRI como 2a línea de quimioterapia aporta 1,78 AVG (21 meses de vida ganados). Con FOLFIRI se consiguen 1,43 AVG (17 meses). El coste del manejo clínico de aflibercept + FOLFIRI supone una inversión adicional de 13.564 € frente a FOLFIRI a lo largo de toda la vida del paciente, siendo el coste total de 38.346 € para aflibercept + FOLFIRI y 24.782 € para FOLFIRI. Se obtiene un RCEI (ratio coste efectividad incremental) de 38.931 €/AVG con aflibercept + FOLFIRI frente a FOLFIRI.
ConclusiónAflibercept en combinación con FOLFIRI incrementa la supervivencia global frente a FOLFIRI, lo que supone una estrategia efectiva en el tratamiento de pacientes con CCRm. La relación coste-efectividad incremental de aflibercept en combinación con FOLFIRI supone una estrategia eficiente, coste-efectiva, para el Sistema Nacional de Salud.
To estimate the incremental cost per life-year gained (LYG) of aflibercept in combination with FOLFIRI as second-line treatment in metastatic colorectal cancer (mCRC) patients previously treated with oxaliplatin.
MethodsBased on clinical trial VELOUR results, a three-state Markov model (stable disease, progression and death) with 2-week cycle duration was designed. Transition to health state «progression» implied the interruption of second-line treatment and administration of a third-line treatment (post-second line chemotherapy). Cost estimation included disease management cost (pharmaceutical, adverse event management, administration costs, etc.). Both cost and outcomes were discounted (3% annually). Sensitivity analyses (SA) were performed to test model robustness.
ResultsAdministration of aflibercept + FOLFIRI as second-line treatment provided 1.78 LYG (21 life-months gained). With FOLFIRI 1.43 LYG (17 months) were obtained. The cost of the clinical management of aflibercept + FOLFIRI implied an additional investment of € 13,564 compared with FOLFIRI for a lifetime horizon, being total costs for aflibercept + FOLFIRI of € 38,346, compared to € 24,782 with FOLFIRI. In the cost-effectiveness analysis € 38,931/LYG was obtained with aflibercept in combination with FOLFIRI versus FOLFIRI.
ConclusionAflibercept in combination with FOLFIRI increased overall survival versus FOLFIRI, so it is an effective strategy in the treatment of patients with mCRC. Aflibercept in combination with FOLFIRI is an efficient strategy for second-line mCRC treatment from the National Health System perspective.
El cáncer colorrectal (CCR) es el tercer cáncer más frecuentemente diagnosticado en el mundo, con una incidencia que aumenta con la edad1. En 2008, se diagnosticaron más de 1,2 millones de nuevos casos y aproximadamente un cuarto de los pacientes presentaba enfermedad metastásica en el momento del diagnóstico2. La tasa de supervivencia a 5 años en pacientes con cáncer colorrectal metastásico (CCRm) no supera el 10%3.
El tratamiento estándar del CCRm no resecable, consiste en una 1a línea de quimioterapia basada en un régimen de oxaliplatino o irinotecán en combinación con una fluoropirimidina. La actividad de estas combinaciones puede aumentar con la adición de un agente biológico. En España, las opciones más utilizadas en 1a línea, son los regímenes basados en oxaliplatino4. Los pacientes que no puedan ser sometidos a la resección del tumor primario y las metástasis, progresarán a la 1a línea, requiriendo una 2a línea de tratamiento4. Según las guías SEOM, en aquellos pacientes que han recibido un régimen basado en oxaliplatino como 1a línea, FOLFIRI (combinación de irinotecán, ácido folínico y 5-fluorouracilo) es el tratamiento de 2a línea recomendado4.
El factor de crecimiento vascular endotelial (Vascular Endothelial Growth Factor (VEGF)) interviene en la formación de la neovascularización tumoral. El uso de agentes anti-VEGF-A, como bevacizumab, para el tratamiento de CCRm, aumenta la actividad antitumoral cuando se asocia a la quimioterapia convencional5.
Aflibercept (Zaltrap®, Sanofi, Regeneron) es una proteína de fusión que se une a VEGF-A, a VEGF-B y al factor de crecimiento placentario (PIGF). Aflibercept se une a VEGF-A con una afinidad 100 veces mayor que bevacizumab6,7.
El estudio VELOUR8 demostró el beneficio de combinar aflibercept con FOLFIRI para el tratamiento del CCRm en pacientes que habían progresado tras quimioterapia previa basada en oxaliplatino. El objetivo de este trabajo fue estimar el coste incremental por año de vida ganado (AVG), de la utilización de aflibercept en combinación con FOLFIRI como tratamiento de 2a línea en pacientes con CCRm previamente tratados con un régimen con oxaliplatino. Para determinar si, como resultado de este análisis, aflibercept + FOLFIRI se puede considerar una estrategia eficiente (coste-efectiva) frente a FOLFIRI, se utilizó como rango de disponibilidad a pagar de un AVG entre 30.000 € y 45.000 €9.
Material y métodosModeloSe diseñó un modelo de Markov para simular la evolución de una cohorte de pacientes con CCRm en tratamiento con 2a línea de quimioterapia.
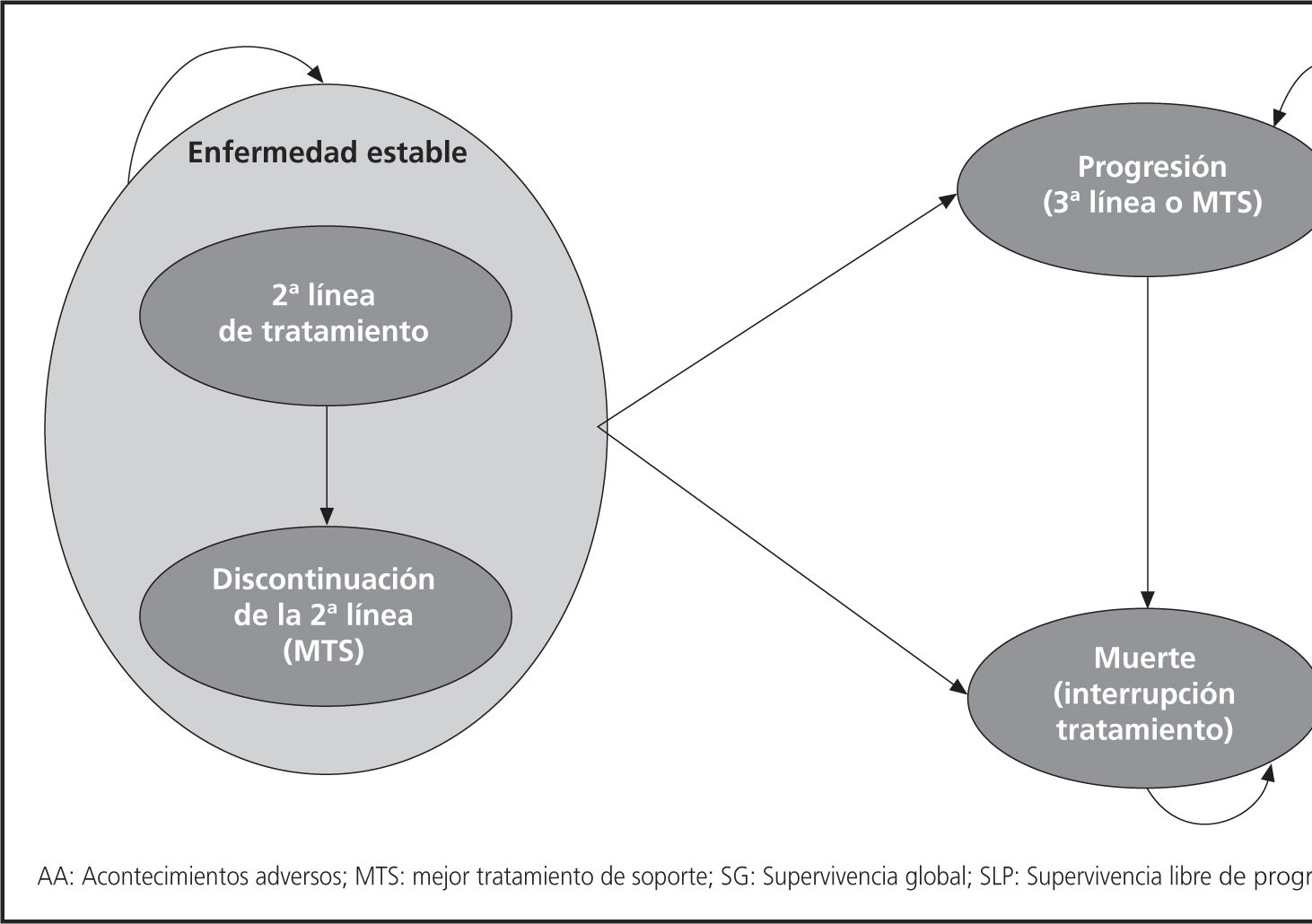
Los modelos de Markov se caracterizan por requerir la definición de estados de salud entre los cuáles los pacientes pueden evolucionar. El modelo utilizado consideró 3 estados de salud: Enfermedad estable (2a línea de tratamiento sin progresión de la enfermedad), progresión y muerte. El estado “enfermedad estable” se dividió en dos poblaciones de pacientes: pacientes en 2a línea de tratamiento y pacientes que habían discontinuado la 2a línea, sin progresión de la enfermedad, por acontecimientos adversos (AA), solicitud del paciente o decisión facultativa.
La duración de los ciclos de Markov se estableció en 2 semanas, es decir, cada paciente permanecía 2 semanas en cada estado de salud, coincidiendo con la frecuencia de administración de los ciclos de quimioterapia.
El modelo se iniciaba con la administración a toda la cohorte de pacientes de una 2a línea de quimioterapia, que se mantenía mientras el paciente permaneciera en el estado de salud “enfermedad estable, en tratamiento”.
La transición a “progresión” implicaba la interrupción del tratamiento activo pre-progresión y la administración de una línea subsiguiente.
La transición al estado “muerte” suponía la interrupción del tratamiento.
La figura 1 representa la estructura del modelo, con los estados de salud, las transiciones permitidas y las terapias recibidas en cada estado de salud.
Análisis económicoLos resultados proporcionados por el modelo se refieren a costes (€) totales y AVG de las alternativas evaluadas.
Los análisis coste-efectividad (ACE) pretenden estimar el coste por unidad de eficacia ganada, en este caso AVG adicional, que supone la administración de una estrategia frente a otra. El cálculo de coste/AVG adicional se realiza de manera incremental entre las estrategias evaluadas, mediante la diferencia de costes (Coste de aflibercept + FOLFIRI-Coste de FOLFIRI) dividido por la diferencia de eficacia (Eficacia de aflibercept + FOLFIRI-Eficacia de FOLFIRI).
PoblaciónLa población analizada en el modelo representa la población del ensayo clínico VELOUR8, pacientes con CCRm previamente tratados con un régimen basado en oxaliplatino.
Las características antropométricas para el cálculo de las dosis administradas, con un peso promedio de 70 kg y un área de superficie corporal media de 1,80 m2, son representativas de pacientes oncológicos españoles10.
Horizonte temporal, perspectiva y tasa de descuento
El horizonte temporal considerado fue toda la vida de los pacientes, que correspondió aproximadamente a 15 años de modelización.
La perspectiva considerada fue la del Sistema Nacional de Salud (SNS) español, considerándose sólo los costes directos sanitarios asociados al manejo de estos pacientes.
Siguiendo las recomendaciones de López-Bastida et al. sobre realización de evaluaciones económicas en España, se aplicó una tasa de descuento del 3% anual sobre costes y resultados en salud11.
Datos clínicosLa información clínica empleada en el caso base procede del estudio VELOUR8.
EfectividadLa efectividad se estimó mediante la supervivencia de los pacientes, considerándose tanto supervivencia global (SG) como supervivencia libre de progresión (SLP).
Un elevado número de pacientes continuaron con vida tras finalizar el estudio, y sus datos de supervivencia no quedaron recogidos en la diferencia de mediana de SG (1,4 meses) reportada en el ensayo VELOUR8. Asimismo, las recientes guías de evaluación económica del National Institute for Health and Care Excellence (NICE)12 recomiendan la utilización de la media en lugar de la mediana en las evaluaciones económicas. Con el objetivo de realizar la mejor aproximación del beneficio clínico de aflibercept, se realizó un análisis post-hoc para extrapolar la SG más allá del horizonte temporal del ensayo clínico y obtener la media de SG. Se analizaron diferentes distribuciones (exponencial, Weibull, lognormal y loglogistic), el criterio de información de Akaike (AIC), el criterio de información de Bayesiano (BIC) y métodos gráficos para evaluar la bondad del ajuste. Como resultado de este análisis, la distribución que mejor se ajustó para ambas ramas de tratamiento fue la loglogistic, obteniéndose una diferencia de 4,7 meses en la SG media entre las dos ramas de tratamiento. En esta proyección se consideró una ecuación diferenciada para cada brazo por separado y se estableció un límite para el horizonte temporal de 15 años13. Las guías del NICE recomiendan restringir el horizonte temporal cuando se consideran proyecciones de las curvas de SG con distribuciones loglogistic debido a la forma de la cola de su distribución13. Asimismo, siguiendo con la metodología utilizada en las evaluaciones económicas11, cabe mencionar que para la estimación del ratio coste-efectividad incremental (RCEI) tanto los resultados económicos como los resultados clínicos fueron descontados mediante una tasa de descuento anual del 3%, por lo que la SG media obtenida en el ACE fue de 4,2 meses.
Acontecimientos adversosEn base a la información recogida en el ensayo VELOUR8, el modelo consideraba la posible aparición de AA asociados a la administración de la quimioterapia. La tabla 1 detalla los AA considerados con su frecuencia de aparición por terapia evaluada (grados 3/4).
Acontecimientos adversos: tasa de aparición en función de la quimioterapia recibida y coste/ciclo del manejo (grados 3/4)
| Acontecimiento adverso | Distribución de AA en pacientes tratados con | Coste de manejo de AA por paciente grados 3/4 (€, 2013) | |
|---|---|---|---|
| Aflibercept + FOLFIRI | FOLFIRI | ||
| Neutropenia | 25,2% | 43,2% | 99,87 € |
| Hipertensión | 16,5% | 2,1% | 10,35 € |
| Diarrea | 15,6% | 10,6% | 247,65 € |
| Estomatitis | 9,4% | 6,1% | 1.517,50 € |
| Astenia | 3,4% | 4% | 107,85 € |
| Hemorragia | 2,2% | 2,1% | 4.187,59 € |
| Náuseas | 1,1% | 4,2% | 28,46 € |
| Neuropatía periférica | 0,7% | 0,6% | 0,52 € |
| Neutropenia febril | 3% | 2,1% | 4.740,07 € |
| Otros | 22,9% | 25,0% | |
| Total | 100% | 100% | - |
El consumo farmacológico de la quimioterapia se estableció a partir del número de miligramos necesarios para alcanzar las posologías administradas en el estudio VELOUR8. Las dosis de FOLFIRI para ambos grupos fue-ron: 180 mg/m2 de irinotecán, 400 mg/m2 de ácido folínico y 400 mg/m2 en bolus seguido de 2.400 mg/m2 de 5-fluorouracilo, todo administrado por vía intravenosa (iv) cada 2 semanas, y 3,87 mg/kg iv de aflibercept cada 2 semanas en combinación con FOLFIRI (aunque la ficha técnica establece 4 mg/kg, la cantidad administrada en el ensayo clínico fue de 3,87, debido a las reducciones de dosis observadas).
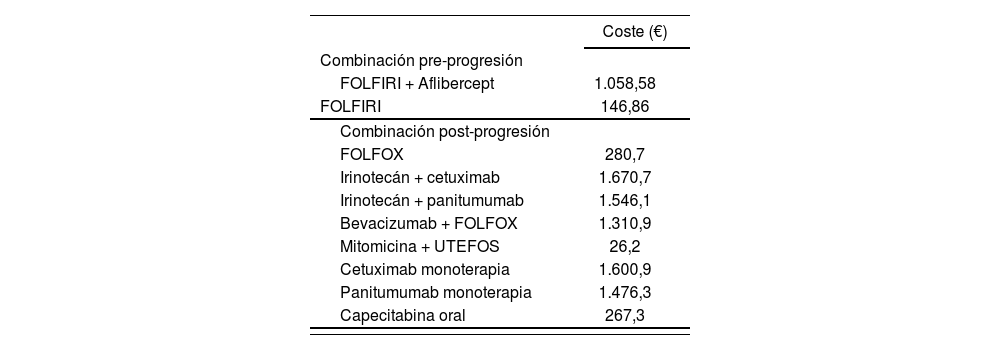
Para determinar la duración de tratamiento se consideró la media de ciclos del ensayo VELOUR14. De esta forma, el número medio de ciclos administrados en 2a línea fue de 10 ciclos en los pacientes que recibieron FOLFIRI solo y 9,2 ciclos de aflibercept y 10,1 de FOLFIRI para los pacientes que recibían la combinación14. El coste del tratamiento farmacológico completo con los dos tratamientos se muestra en la tabla 2.
Costes de tratamiento farmacológico por ciclo
| Coste (€) | |
|---|---|
| Combinación pre-progresión | |
| FOLFIRI + Aflibercept | 1.058,58 |
| FOLFIRI | 146,86 |
| Combinación post-progresión | |
| FOLFOX | 280,7 |
| Irinotecán + cetuximab | 1.670,7 |
| Irinotecán + panitumumab | 1.546,1 |
| Bevacizumab + FOLFOX | 1.310,9 |
| Mitomicina + UTEFOS | 26,2 |
| Cetuximab monoterapia | 1.600,9 |
| Panitumumab monoterapia | 1.476,3 |
| Capecitabina oral | 267,3 |
Adicionalmente, el modelo consideraba la administración de premedicación antes de la quimioterapia para prevenir o minimizar la aparición de posibles AA.
Se asumió que todos los pacientes recibían el primer día de cada ciclo: ondansetrón 24 mg/iv, dexametasona 8 mg/iv y atropina 0,25 mg/iv. Adicionalmente, se estimó que un 20% de los pacientes puede sufrir vómitos refractarios requiriendo dosis continuadas de ondansetrón oral 8 mg/iv durante 3-5 días.
Tratamientos post-2a línea de quimioterapiaLa evolución de los pacientes al estado de salud “progresión” implicaba la interrupción de la terapia en 2a línea (aflibercept con FOLFIRI o FOLFIRI) y la administración de una 3a línea (post-2a línea de quimioterapia) o Mejor Tratamiento de Soporte (MTS).
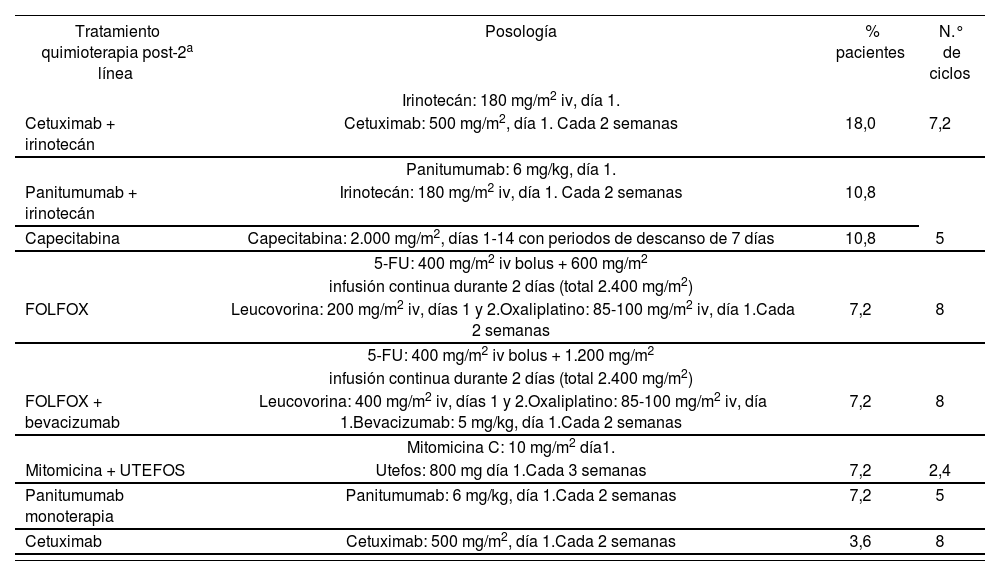
La posología y distribución de los tratamientos post-2a línea (Tabla 3) fueron proporcionadas por un panel de expertos en oncología y farmacia hospitalaria reflejando la práctica clínica habitual en España.
Posologías y distribución de tratamientos post-2a línea
| Tratamiento quimioterapia post-2a línea | Posología | % pacientes | N.° de ciclos |
|---|---|---|---|
| Irinotecán: 180 mg/m2 iv, día 1. | |||
| Cetuximab + irinotecán | Cetuximab: 500 mg/m2, día 1. Cada 2 semanas | 18,0 | 7,2 |
| Panitumumab: 6 mg/kg, día 1. | |||
| Panitumumab + irinotecán | Irinotecán: 180 mg/m2 iv, día 1. Cada 2 semanas | 10,8 | |
| Capecitabina | Capecitabina: 2.000 mg/m2, días 1-14 con periodos de descanso de 7 días | 10,8 | 5 |
| 5-FU: 400 mg/m2 iv bolus + 600 mg/m2 | |||
| infusión continua durante 2 días (total 2.400 mg/m2) | |||
| FOLFOX | Leucovorina: 200 mg/m2 iv, días 1 y 2.Oxaliplatino: 85-100 mg/m2 iv, día 1.Cada 2 semanas | 7,2 | 8 |
| 5-FU: 400 mg/m2 iv bolus + 1.200 mg/m2 | |||
| infusión continua durante 2 días (total 2.400 mg/m2) | |||
| FOLFOX + bevacizumab | Leucovorina: 400 mg/m2 iv, días 1 y 2.Oxaliplatino: 85-100 mg/m2 iv, día 1.Bevacizumab: 5 mg/kg, día 1.Cada 2 semanas | 7,2 | 8 |
| Mitomicina C: 10 mg/m2 día1. | |||
| Mitomicina + UTEFOS | Utefos: 800 mg día 1.Cada 3 semanas | 7,2 | 2,4 |
| Panitumumab monoterapia | Panitumumab: 6 mg/kg, día 1.Cada 2 semanas | 7,2 | 5 |
| Cetuximab | Cetuximab: 500 mg/m2, día 1.Cada 2 semanas | 3,6 | 8 |
*Total 72%, 28% adicional recibe mejor tratamiento de soporte (MTS).
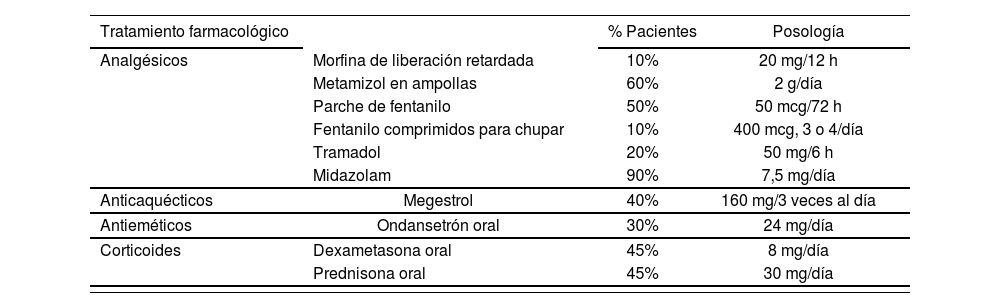
En el caso base el panel de expertos consideró que, tras progresar, el 72% de los pacientes recibiría una post-2a línea de quimioterapia, mientras que el 28% restante recibiría únicamente MTS. Asimismo se consideró que el 100% de los pacientes que discontinuaban la 2a línea permaneciendo en enfermedad estable recibiría MTS. El manejo clínico considerado como MTS fue estimado por el panel de expertos (Tabla 4).
Posologías y distribución del mejor tratamiento de soporte (MTS)
| Tratamiento farmacológico | % Pacientes | Posología | |
|---|---|---|---|
| Analgésicos | Morfina de liberación retardada | 10% | 20 mg/12 h |
| Metamizol en ampollas | 60% | 2 g/día | |
| Parche de fentanilo | 50% | 50 mcg/72 h | |
| Fentanilo comprimidos para chupar | 10% | 400 mcg, 3 o 4/día | |
| Tramadol | 20% | 50 mg/6 h | |
| Midazolam | 90% | 7,5 mg/día | |
| Anticaquécticos | Megestrol | 40% | 160 mg/3 veces al día |
| Antieméticos | Ondansetrón oral | 30% | 24 mg/día |
| Corticoides | Dexametasona oral | 45% | 8 mg/día |
| Prednisona oral | 45% | 30 mg/día |
El coste de los tratamientos farmacológicos completos por ciclo se recoge en la tabla 2.
AdministraciónComo reflejo de la práctica clínica en España, para la administración de la quimioterapia se consideró que el paciente realizaba una visita al hospital de día de oncología para cada sesión.
Ingresos hospitalariosEn el modelo se asumió que el 5% de los pacientes podía ser intervenido de una hemicolectomía, requiriendo ingreso hospitalario en cirugía general de 7 días.
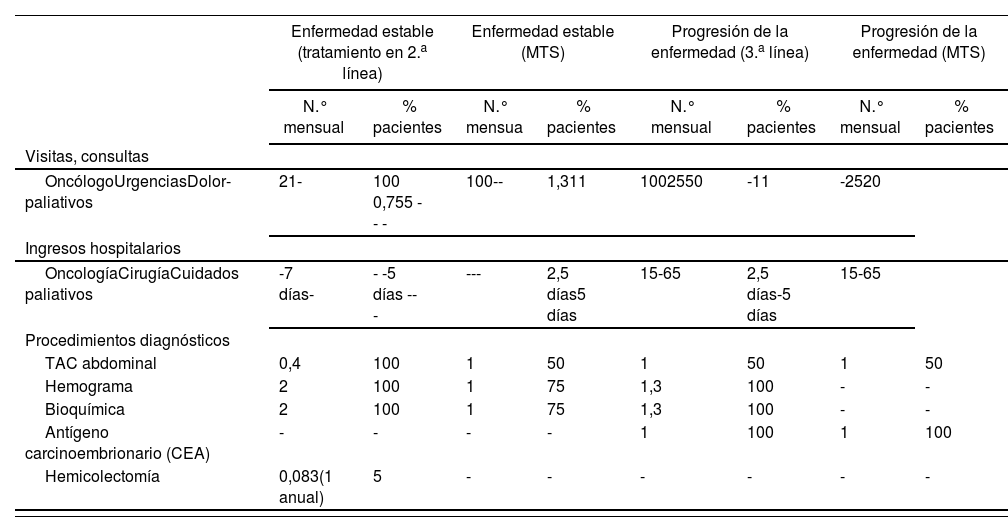
En pacientes en post-2a línea de quimioterapia, el panel de expertos estimó que se producían 2,5 ingresos en oncología y 5 en cuidados paliativos en cada periodo de 4 meses, con una duración media de 10 y 20 días por ingreso, respectivamente
Visitas médicas y pruebas de laboratorio y procedimientosLa Tabla 5 detalla el número mensual de visitas médicas, pruebas de laboratorio y procedimientos estimado por el panel de expertos en los pacientes tratados tanto con una 2a línea como con una post-2a línea de quimioterapia. Los costes unitarios asociados a estos conceptos se reflejan en la Tabla 6.
Consumo de recursos (visitas médicas, pruebas de laboratorio y procedimientos) por cada periodo de 1 mes
| Enfermedad estable (tratamiento en 2.a línea) | Enfermedad estable (MTS) | Progresión de la enfermedad (3.a línea) | Progresión de la enfermedad (MTS) | |||||
|---|---|---|---|---|---|---|---|---|
| N.° mensual | % pacientes | N.° mensua | % pacientes | N.° mensual | % pacientes | N.° mensual | % pacientes | |
| Visitas, consultas | ||||||||
| OncólogoUrgenciasDolor-paliativos | 21- | 100 0,755 -- - | 100-- | 1,311 | 1002550 | -11 | -2520 | |
| Ingresos hospitalarios | ||||||||
| OncologíaCirugíaCuidados paliativos | -7 días- | - -5 días -- - | --- | 2,5 días5 días | 15-65 | 2,5 días-5 días | 15-65 | |
| Procedimientos diagnósticos | ||||||||
| TAC abdominal | 0,4 | 100 | 1 | 50 | 1 | 50 | 1 | 50 |
| Hemograma | 2 | 100 | 1 | 75 | 1,3 | 100 | - | - |
| Bioquímica | 2 | 100 | 1 | 75 | 1,3 | 100 | - | - |
| Antígeno carcinoembrionario (CEA) | - | - | - | - | 1 | 100 | 1 | 100 |
| Hemicolectomía | 0,083(1 anual) | 5 | - | - | - | - | - | - |
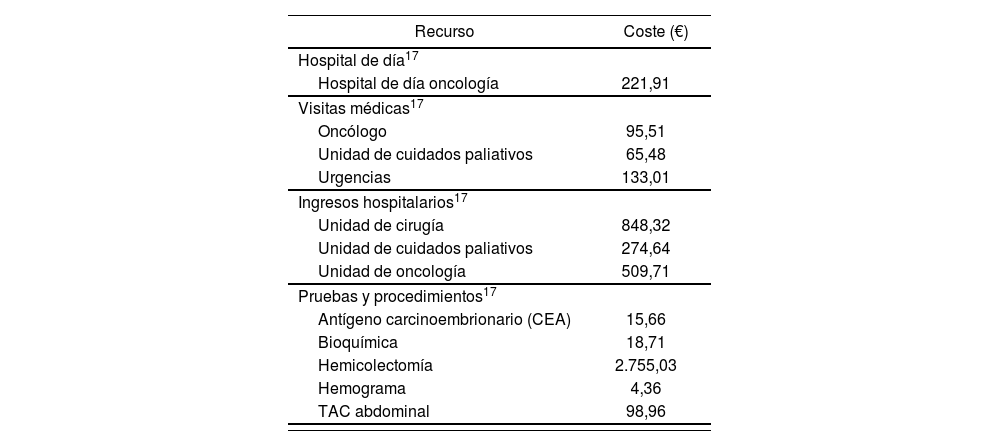
Costes unitarios (€, 2013)
| Recurso | Coste (€) |
|---|---|
| Hospital de día17 | |
| Hospital de día oncología | 221,91 |
| Visitas médicas17 | |
| Oncólogo | 95,51 |
| Unidad de cuidados paliativos | 65,48 |
| Urgencias | 133,01 |
| Ingresos hospitalarios17 | |
| Unidad de cirugía | 848,32 |
| Unidad de cuidados paliativos | 274,64 |
| Unidad de oncología | 509,71 |
| Pruebas y procedimientos17 | |
| Antígeno carcinoembrionario (CEA) | 15,66 |
| Bioquímica | 18,71 |
| Hemicolectomía | 2.755,03 |
| Hemograma | 4,36 |
| TAC abdominal | 98,96 |
El coste de manejo de cada AA evaluado fue estimado a partir de información desagregada de consumo de recursos proporcionada por el panel de expertos. La Tabla 1 incluye el coste total estimado.
Los costes farmacológicos se calcularon teniendo en cuenta el coste para el SNS, aplicando cuando correspondía la deducción establecida por el Real Decreto 8/201015 sobre el precio del fármaco para el sistema público de salud obtenidos en Octubre de 201316. Los costes unitarios de los recursos sanitarios no farmacológicos se obtuvieron de bases de datos de costes sanitarios17.
Todos los costes incluidos en el análisis se expresan en euros (€) del año 2013.
Análisis de sensibilidadPara comprobar la robustez del modelo se realizaron análisis de sensibilidad (AS) determinísticos y probabilísticos. Los AS implican la modificación de los valores de los parámetros usados en el caso base para determinar cuáles pueden tener influencia en el sentido de los resultados.
En los AS determinísticos se modificaron de forma univariante los valores de los siguientes parámetros:
- -
Horizonte temporal: 5 y 10 años.
- -
Tasa de descuento: Se utilizaron valores del 0% y 5%.
- -
Función para cálculo de SG: Se exploró la influencia de emplear una función Best fit log-logistic y una función Weibull.
- -
Número de ciclos de 2a línea: Se aplicaron las medianas de ciclos de SLP, 7 y 9 ciclos para aflibercept y FOLFIRI y 8 para FOLFIRI y un escenario en el que en ambas ramas de tratamiento se administraban 10 ciclos.
- -
Distribución de los tratamientos post-2a línea: Se analizó el impacto según el tratamiento administrado tras la progresión del paciente, considerando que el 100% de los pacientes recibiría una post-2a línea de quimioterapia.
- -
Coste farmacológico de aflibercept por miligramo: se evaluó un coste un 10% por superior e inferior al caso base.
- -
Coste del tratamiento post-2a línea: se evaluó un coste un 10% superior e inferior al caso base.
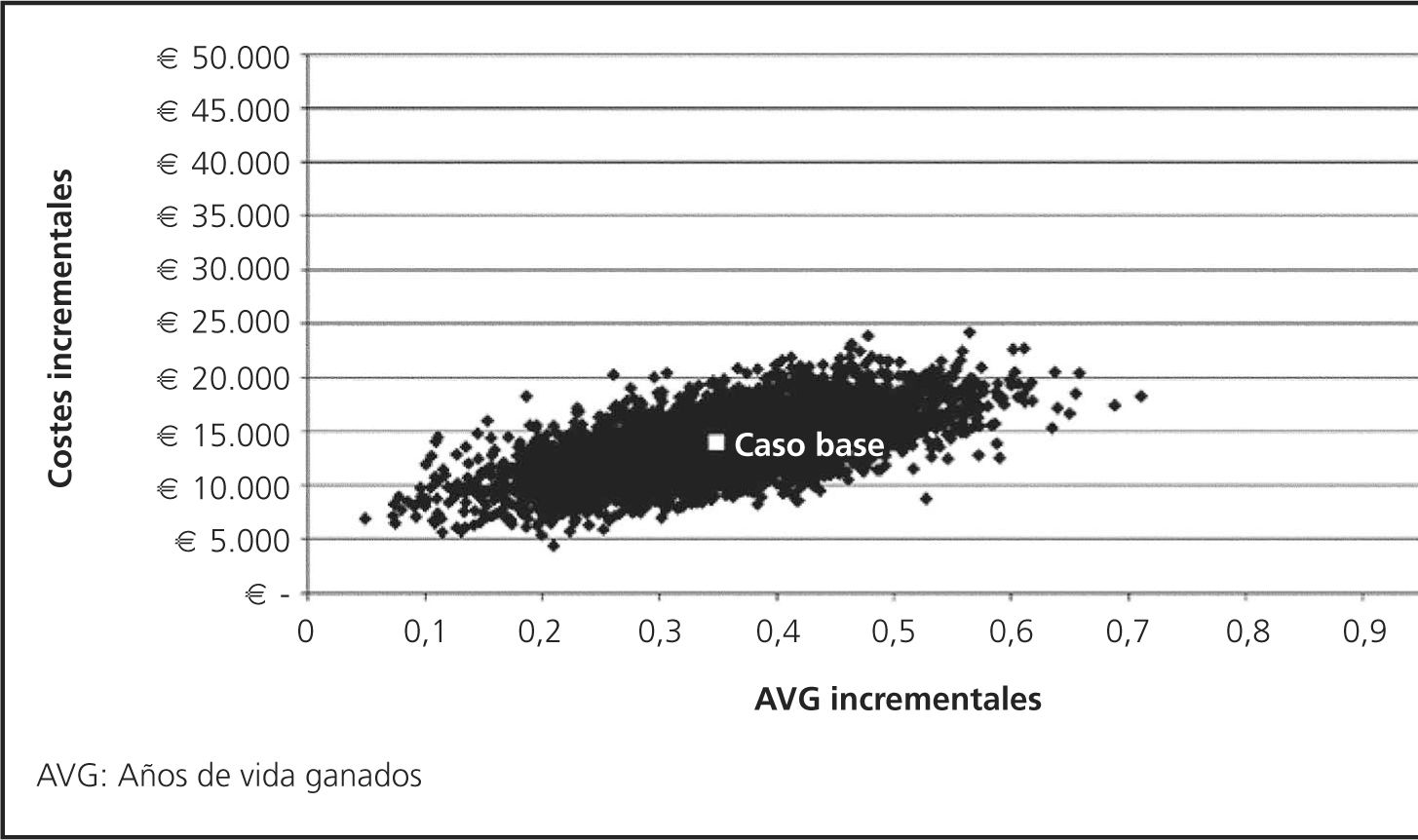
El AS probabilístico (ASP) se efectuó mediante 5.000 iteraciones de una simulación de Montecarlo. Las funciones aplicadas fueron distribución beta para tasas de AA, distribución normal para el peso y superficie corporal y gamma para los costes. En la distribución de los tratamientos tras discontinuación en enfermedad estable se aplicó una distribución Dirichlet para mantener la premisa de disponibilidad de tan solo un tratamiento subsecuente tras la discontinuación. La distribución asociada al análisis de los tratamientos post-progresión se realizó mediante una función beta. Los resultados del ASP se muestran gráficamente en un plano coste-efectividad18,19.
ResultadosLa administración de aflibercept en combinación con FOLFIRI como 2a línea de quimioterapia en pacientes con CCRm tras el fracaso con una 1a línea que contuviera oxaliplatino aporta 1,78 AVG descontados. Con FOLFIRI se consiguen 1,43 AVG (Tabla 7).
Resultados del caso base del modelo coste-efectividad incremental
| Aflibercept + FOLFIRI | FOLFIRI | Diferencia | |
|---|---|---|---|
| Años de vida ganados (AVG) descontados | 1,78 | 1,43 | 0,348(4,2 meses) |
| Años de vida ganados (AVG) no descontados | 1,91 | 1,51 | 0,40(4,8 meses) |
| Costes totales (€, 2013) descontados | 38.346 € | 24.782 € | 13.564 € |
| Costes totales (€, 2013) no descontados | 40.662 € | 26.118 € | 14.545 € |
| Enfermedad estableCostes farmacológicosManejo de la enfermedadCoste AA | 10.138 €4.545€653€ | 1,6 €4.231€257€ | 8.486€314€396€ |
| ProgresiónCostes farmacológicosManejo de la enfermedad | 2.854€22.472€ | 2.661€17.317€ | 193€5.156€ |
| RCEI; €/AVG de aflibercept + FOLFIRI vs. FOLFIRI | 38.931 €/AVG |
AA: Acontecimientos adversos; AVG: Años de vida ganados; RCEI: Ratio coste efectividad incremental.
El coste del manejo clínico de aflibercept en combinación con FOLFIRI supone una inversión adicional de 13.564 € frente a FOLFIRI a lo largo de toda la vida del paciente, siendo el coste total de 38.346 € para aflibercept + FOLFIRI y 24.782 € para FOLFIRI.
En el ACE se obtiene un RCEI de 38.931 € por AVG adicional obtenido con aflibercept en combinación con FOLFIRI frente a FOLFIRI.
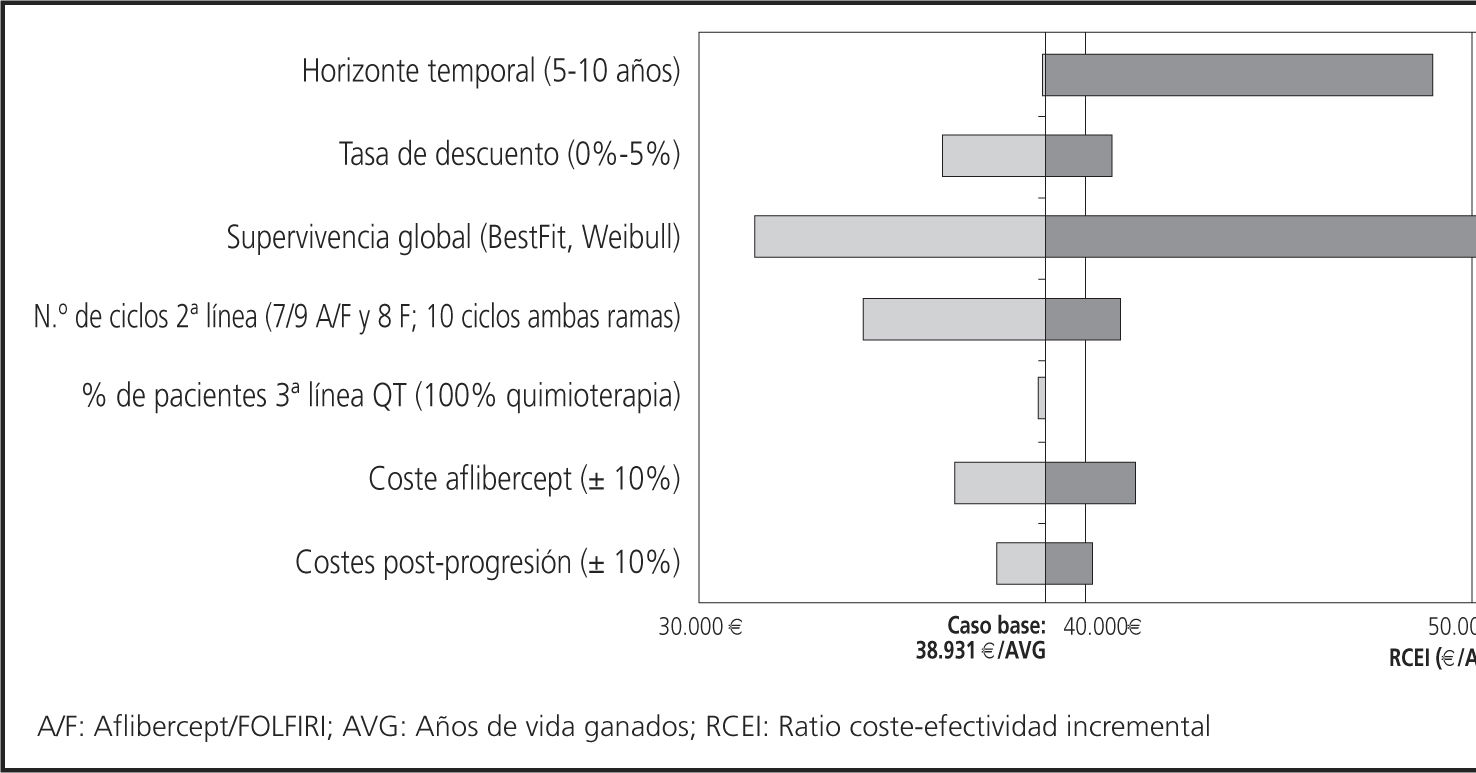
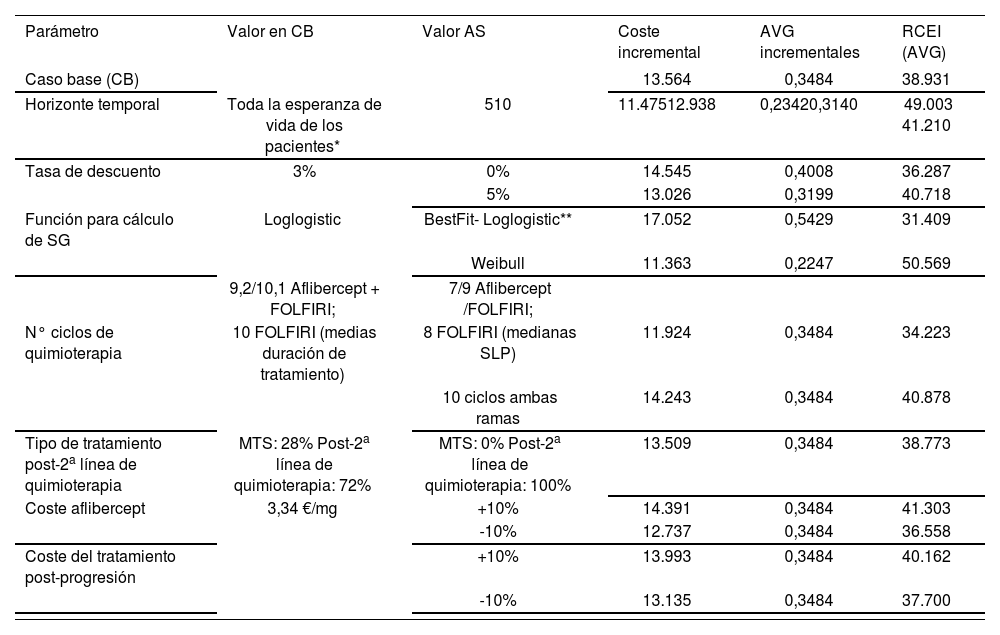
En los AS determinísticos realizados los parámetros con mayor influencia en los resultados fueron el horizonte temporal, la distribución que ajusta los datos de la SG y el número de ciclos administrados en 2a línea (Tabla 8, Figura 2).
Resultados del análisis de sensibilidad determinístico
| Parámetro | Valor en CB | Valor AS | Coste incremental | AVG incrementales | RCEI (AVG) |
|---|---|---|---|---|---|
| Caso base (CB) | 13.564 | 0,3484 | 38.931 | ||
| Horizonte temporal | Toda la esperanza de vida de los pacientes* | 510 | 11.47512.938 | 0,23420,3140 | 49.003 41.210 |
| Tasa de descuento | 3% | 0% | 14.545 | 0,4008 | 36.287 |
| 5% | 13.026 | 0,3199 | 40.718 | ||
| Función para cálculo de SG | Loglogistic | BestFit- Loglogistic** | 17.052 | 0,5429 | 31.409 |
| Weibull | 11.363 | 0,2247 | 50.569 | ||
| 9,2/10,1 Aflibercept + FOLFIRI; | 7/9 Aflibercept /FOLFIRI; | ||||
| N° ciclos de quimioterapia | 10 FOLFIRI (medias duración de tratamiento) | 8 FOLFIRI (medianas SLP) | 11.924 | 0,3484 | 34.223 |
| 10 ciclos ambas ramas | 14.243 | 0,3484 | 40.878 | ||
| Tipo de tratamiento post-2a línea de quimioterapia | MTS: 28% Post-2a línea de quimioterapia: 72% | MTS: 0% Post-2a línea de quimioterapia: 100% | 13.509 | 0,3484 | 38.773 |
| Coste aflibercept | 3,34 €/mg | +10% | 14.391 | 0,3484 | 41.303 |
| -10% | 12.737 | 0,3484 | 36.558 | ||
| Coste del tratamiento post-progresión | +10% | 13.993 | 0,3484 | 40.162 | |
| -10% | 13.135 | 0,3484 | 37.700 |
AS: Análisis de sensibilidad; AVG: Año de vida ganado; CB: Caso base; MTS: Mejor tratamiento de soporte; NA: No aplicable; RCEI: Ratio coste-efectividad incremental; SG: Supervivencia global; SLP: Supervivencia libre de progresión. *En la práctica es el momento en el que un 0,5% de los pacientes se mantienen en el modelo (alrededor de los 15 años). **2 segment piecewise fit.
Los resultados del resto de análisis realizados sobre las variables descritas supusieron modificaciones en márgenes inferiores a ± 7% sobre el resultado del caso base.
En la figura 3 se representan gráficamente los resultados del ASP mediante el plano coste efectividad.
DiscusiónLos resultados del presente análisis, concluyen que la administración de aflibercept en combinación con FOLFIRI como 2a línea de tratamiento en pacientes con CCRm, que progresaron tras una 1a línea de tratamiento con un régimen basado en oxaliplatino, es una estrategia más efectiva que la administración de FOLFIRI, aportando 1,78 AVG frente a 1,43 AVG. Estos resultados, que equivalen a un incremento en SG de 4,2 meses, corresponden a la utilización en el modelo de la curva de supervivencia con mejor ajuste estadístico a partir de los datos de SG del ensayo clínico13. Esta extrapolación se ha realizado de acuerdo con las recomendaciones del NICE sobre análisis de supervivencia para evaluaciones económicas12. En términos de costes, la terapia de aflibercept con FOLFIRI conlleva una inversión adicional de 13.564 €. En el presente modelo, la administración de aflibercept con FOLFIRI supone, por tanto, un coste de 38.931 € por AVG frente a la administración de FOLFIRI.
La teoría económica sugiere que, en la relación coste-efectividad, el valor umbral de disponibilidad a pagar debería reflejar el coste de oportunidad, aunque no es lo que realmente sucede en la práctica20. Asimismo, el NICE en el Reino Unido, admite que en la evaluación de fármacos dirigidos a un número reducido de pacientes en fase terminal, con una esperanza de vida inferior a los 24 meses y que hayan demostrado aportar beneficios en términos de supervivencia, los umbrales fijados deberían fle-xibilizarse21.
La creación de la Cancer Drugs Fund (Fundación de Fármacos para el Cáncer) en Inglaterra, pretendía facilitar el acceso de los pacientes a fármacos pendientes de evaluación por el NICE o que tras su evaluación hubieran sido rechazados en base a criterios de coste-efectividad22.
Estrategias similares que apliquen criterios más flexibles para el reembolso de algunas innovaciones terapéuticas, principalmente de medicaciones oncológicas, han sido también propuestas en otros entornos como Nueva Zelanda23.
Aunque la mayoría de las publicaciones utilizan como referencia un valor entre 30.000 y 45.000 €/AVG9, en España no existe consenso público oficial sobre la disponibilidad a pagar por cada AVG, y sería recomendable utilizar argumentos similares a los anteriormente expuestos a la hora de decidir la inclusión de nuevos fármacos, particularmente de medicamentos oncológicos, en el sistema público.
Como limitaciones y posibles sesgos del ACE, cabría comentar el carácter teórico inherente a cualquier modelización, que en ocasiones no refleja la práctica clínica.
La validez de los modelos económicos está condicionada por la calidad de los datos en los que se basa. En nuestro caso, la fuente principal de información fue el estudio pivotal VELOUR8, a través del que se obtuvo la indicación analizada en el modelo. La utilización en evaluaciones económicas de datos procedentes de ensayos clínicos, enmascarados y aleatorizados es discutible, debido a que la rigidez de los criterios de inclusión hace que no sean representativos de la práctica clínica habitual, principalmente cuando se emplean datos de estudios multinacionales en evaluaciones económicas a nivel local24. Sería ideal que en el proceso de inclusión de nuevas terapias, los decisores pudieran disponer de resultados obtenidos con datos prospectivos de los tratamientos a lo largo del tiempo. Sin embargo la imposibilidad de contar con esta información, hace que el empleo de datos procedentes de ensayos clínicos sea necesario a pesar de sus limitaciones25.
Otra limitación es el diseño basado en función de una cohorte poblacional que imposibilita tener en cuenta las características individuales de los pacientes, y las posibles variaciones entre sujetos.
A pesar de las limitaciones comentadas, las premisas adoptadas son razonables y conservadoras y los AS confirman la robustez del modelo y de los resultados obtenidos.
El horizonte temporal, la distribución para ajustar la SG y el número de ciclos administrados en 2a línea, parecen ser los parámetros asociados a mayor variación. En el caso base, se optó por el horizonte temporal de toda la vida del paciente para poder incluir todos los costes y efectos relevantes del tratamiento, pero dado que la perspectiva a largo plazo requiere extrapolación de los datos de supervivencia, el horizonte temporal fue uno de los parámetros modificados en el AS. Los resultados muestran que a partir de los 5 años sólo se obtienen mejoras marginales del RCEI. Respecto a la distribución utilizada en el modelo, aunque la que mejor se ajusta es la log-logistic, se analizaron otras distribuciones y el AS muestra que los resultados del RCEI se encuentran en un rango de 31.409 €/AVG y 50.569 €/AVG con las distribuciones best-fit log-logistic (sin límite temporal) y la distribución Weibull (15 años), respectivamente.
Otros estudios han estimado la eficiencia de tratamientos para el CCRm en España. La eficiencia de cetuximab con irinotecán en pacientes con CCRm refractarios al tratamiento previo con irinotecán se estimó en 49.118 €/AVG26. Por otro lado, la combinación de bevacizumab con FOLFIRI en 1a línea se asoció con un RCEI de 149.126 €/AVG27. Ambos RCEI son superiores al obtenido en el presente modelo, para aflibercept con FOLFIRI.
Las evaluaciones económicas de intervenciones oncológicas son cada vez más frecuentes en la literatura médica, debido probablemente al elevado coste que se suele asociar al tratamiento del cáncer28,29. Sin embargo, el debate no sólo se centra en los costes económicos, sino en las relativas mejoras a nivel de efectividad, ya que los fármacos orientados a población con enfermedades metastásicas aportan ganancias en supervivencia o calidad de vida, marginalmente superiores a otras alternativas existentes en el mercado30.
ConclusionesAflibercept en combinación con FOLFIRI incrementa la supervivencia global frente a FOLFIRI. Teniendo en cuenta un umbral aceptable en España de disponibilidad a pagar para un AVG adicional por debajo de 45.000€9, aflibercept en combinación con FOLFIRI, además de una estrategia efectiva, se puede considerar una estrategia eficiente en el tratamiento de pacientes con CCRm, siendo el RCEI de aflibercept con FOLFIRI frente a FOLFIRI de 38.931€ por AVG. Resultados de evaluaciones económicas como los del presente estudio deberían ayudar en la toma de decisiones en la práctica clínica, dado que la incorporación de aflibercept al tratamiento del CCRm supone la adopción de una tecnología innovadora que aumenta la supervivencia a un coste razonable para el SNS.
Fuente de financiaciónEste estudio ha sido financiado por Sanofi. Empleados de Sanofi han estado involucrados en el diseño del estudio, la edición, revisión del manuscrito y en la decisión de su publicación.
Conflicto de interesesEste estudio ha sido realizado por Pharmacoeconomics & Outcomes Research Iberia, una empresa consultora independiente que ha recibido financiación de Sanofi. Los miembros del panel de expertos recibieron financiación de Sanofi y han actuado como consultores para otras empresas farmacéuticas.
Cost-effectiveness analysis of aflibercept in combination with FOLFIRI in the treatment of patients with metastatic colorectal cancer